Introducción
La epilepsia postraumática se caracteriza por la recurrencia de crisis epilépticas espontáneas posteriores a un evento traumático. Estas representan el 6 % del total, y un 20 % del total de las epilepsias sintomáticas. Así mismo, se conoce que la epilepsia postraumática aparece en el 5 % de todos los traumas craneoencefálicos (TCE) y en el 15 %-20 % de los TCE clasificados como severos. Lo anterior convierte al TCE en una de las etiologías más comunes de epilepsia y a la epilepsia en una de sus secuelas más representativas (1).
La epilepsia postraumática se define como la presencia de mínimo dos episodios de crisis epilépticas en menos de un año y posteriores a un episodio traumático (1). Las crisis epilépticas postraumáticas pueden clasificarse en dos tipos, principalmente: crisis epilépticas tempranas, aquellas que se presentan en los primeros siete días postrauma, y crisis epilépticas tardías, que se presentan después de los primeros siete días postrauma (2). Dentro de los factores de riesgo para la aparición de la epilepsia postraumática se han descrito: el hematoma intracraneal agudo (en especial el de origen subdural), la pérdida de conocimiento o amnesia prolongada (más de 24 horas), la presencia y extensión de lesiones parenquimatosas y las presencias de fracturas de hundimiento (3).
Se han sugerido varios mecanismos que influyen en la ictiogénesis posterior a la lesión traumática. El mecanismo primario del daño posterior a un TCE involucra cambios mecánicos que se dan dentro de los primeros minutos después del trauma y se producen en los axones, las células gliales y los vasos sanguíneos, los cuales pueden resultar lacerados y causar extravasación de sangre y muerte celular (4,5). Así, dentro de las lesiones primarias, podemos tener lesión axonal difusa, contusiones cerebrales, hematoma (epidural, subdural e intraparenquimatoso) o hemorragia subaracnoidea traumática (3). Horas, minutos o días después del trauma se produce una lesión secundaria (4,5) que involucra, entre otros, la liberación de glutamato por parte de neuronas y células gliales afectadas por el trauma, lo que produce excitotoxicidad mediada por este neurotransmisor, al igual que inflamación, que afecta el espacio subdural por la migración de linfocitos activados y aumento de mediadores proinflamatorios (6). Según Medina Marín y Escobar Betancourth (7), la excitotoxicidad es resultado del aumento de las concentraciones de calcio en el interior de la célula, en respuesta a una sobreestimulación de los receptores para glutamato, lo que provoca daño neuronal. Además de aumentar las concentraciones de calcio en el interior de la célula, se incrementan los radicales libres, ya que al entrar el calcio por los receptores de N-metil-d-aspartato y también al liberarse desde el retículo endoplásmico, este activa enzimas como la calmodulina cinasa y disminuyen entonces las cantidades de arginina y se incrementa la producción de radicales libres de oxígeno, como el peroxinitrito y el anión superóxido (8, 9, 10, 11). Por último, los niveles en ascenso del glutamato en el espacio extracelular modifican la función del antiportador cisteína-glutamato, necesario para la creación del principal antioxidante de la célula que es el glutatión (12).
Adicionalmente, se han asociado otros mecanismos moleculares, como la peroxidación lipídica, trombosis de la microcirculación, la disfunción mitocondrial, la activación de genes que disparan apoptosis y el incremento de la permeabilidad de la barrera hematoencefálica (4,5). Posterior a esto, hay una reparación con neurogénesis, brote axonal, sinaptogénesis y cambios en la composición de los receptores para neurotransmisores (13,14). Todos estos efectos biológicos secundarios facilitan la aparición de las crisis, pues contribuyen al desbalance excitación/inhibición (figura 1).
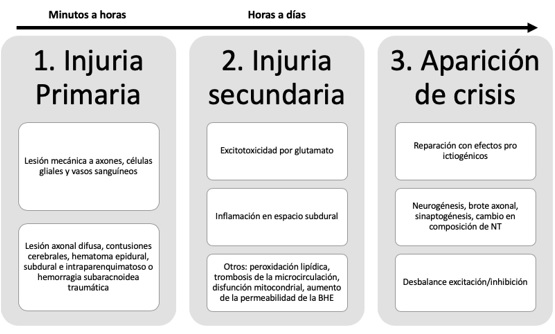
Figura 1 Mecanismos que influyen en la ictiogénesisBHE: barrera hematoencefálica; NT: neurotransmisores.
Algunos estudios han mostrado que la muerte celular en TCE afecta, principalmente, a las interneuronas gabaérgicas en diferentes sectores corticales, en el hipocampo, ya que esta estructura es vulnerable a las lesiones relacionadas con estados hipóxicos y oxidativos (14,15). Por lo tanto, las neuronas excitatorias, específicamente las células piramidales de la lámina V de la neocorteza y las células piramidales del sector CA1 del hipocampo, se disparan de manera descontrolada. Estudios de TCE en humanos han evidenciado alteraciones citomorfológicas en células piramidales de las láminas III y V de la neocorteza cerebral y pérdida de inmunorreactividad de subpoblaciones específicas de interneuronas gabaérgicas positivas para parvalbúmina, como lo son las células en cesta y las células en candelabro. Tanto la pérdida de interneuronas gabaérgicas como sus alteraciones citomorfológicas podrían relacionarse con las alteraciones funcionales observadas en las neuronas piramidales en los biomodelos, como la disminución del control de la actividad eléctrica (14,16,17).
En este contexto, se sugiere que el aumento de la excitabilidad neuronal, junto con un aumento en la sincronización de disparos, disminuiría el umbral para el desencadenamiento de crisis epilépticas (6). Hay mecanismos adicionales descritos en biomodelos, como la neurogénesis, capaces de resultar en nódulos ectópicos de neuronas con conexiones excitatorias aberrantes y circuitos hiperexcitables. Múltiples mecanismos y cascadas moleculares se han relacionado con estos eventos, como la activación del factor neurotrófico derivado del cerebro y su receptor de tirosina cinasa B para el brote axonal, la activación de la cascada mTOR (mammalian target of rapamycin) para el brote axonal y la neurogénesis, las alteraciones de las subunidades del receptor para GABA más ubicuo: GABA. y la activación de los receptores de trombospondina en el contexto de la sinaptogénesis (17, 18, 19, 20).
Tratamiento farmacológico profiláctico en crisis epilépticas postraumáticas
De acuerdo con el contexto celular como punto de partida, se hace notoria la importancia de la profilaxis para crisis epilépticas postraumáticas. En lo que respecta a la profilaxis, se ha mencionado que esta es inefectiva para prevenir las crisis epilépticas postraumáticas tardías; pero se recomienda para evitar crisis tempranas (3). Los fármacos que actualmente se recomiendan en el consenso colombiano de TCE son: 300 mg/día de fenitoína, 200-400 mg/día de ácido valproico o 1,5 g/día de levetiracetam durante una semana. Esta recomendación se hace siempre y cuando se cumplan situaciones de riesgo: un examen Glasgow menor o igual a 10, fractura con hundimiento craneal, trauma penetrante, contusiones cerebrales, hematomas intracraneanos, hematomas extradurales, hematomas subdurales y crisis en las 24 horas iniciales del trauma (3).
Ahora bien, si el paciente tiene crisis epilépticas y requiere un tratamiento, la terapéutica que se debe implementar sigue los mismos principios que aquellas epilepsias sintomáticas de otras etiologías (1). No obstante, en la literatura sobre el tema hacen hincapié en tener cuidado cuando de forma secundaria a la terapia farmacológica el paciente presenta deterioro neurológico, incremento en la presión intracraneal, hipoxia tisular cerebral o cuando no hay un despertar adecuado (1).
En esta revisión se priorizaron artículos científicos publicados en la última década que podían ser originales o de revisión, obtenidos de bases de datos como PubMed y SciELO, con entradas como Epilepsy ANDTraumatic Brain Injury AND Post-Exposure Prophylaxis. En la búsqueda bibliográfica se excluyeron artículos publicados en un idioma diferente al español o al inglés y reportes de caso.
Evidencia de los anticonvulsivantes
Como se mencionó, la prevención de crisis epilépticas tempranas posteriores a TCE, según la recomendación de la Neurociencias en Colombia, revista oficial de la Asociación Colombiana de Neurocirugía (2017), se debe realizar con fenitoína, ácido valproico o levetiracetam (3). A continuación se expone el mecanismo de acción de cada uno de ellos y luego su evidencia clínica, añadiendo alguna información sobre el fármaco carbamacepina, que también se ha usado en este contexto (3).
Por un lado, la fenitoína, dentro de sus múltiples mecanismos de acción descritos, interrumpe los mecanismos que intervienen en la generación experimental de potenciales de acción repetitiva, bloqueando los canales de sodio rápidos, dependientes de voltaje, y disminuyendo la entrada de este ion a las células (21). Tiene numerosos efectos adversos reportados y, con una frecuencia no definida, podemos encontrar, según el sistema, efectos cardiovasculares, como arritmias cardiacas, choque circulatorio, hipotensión, poliarteritis nodosa y fibrilación ventricular; neurológicos, como ataxia, atrofia cerebral, confusión, cefalea, insomnio, parestesias, neuropatía periférica, disartria y vértigo; dermatológicos, como dermatitis bullosa, dermatitis exfoliativa, hipertricosis, sarpullido morbiliforme, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica; gastrointestinales, como constipación, disgeusia, hiperplasia gingival y vómito; genitourinarios, como la enfermedad de Peyronie; hematoncológicos, como agranulocitosis, granulocitopenia, linfoma de Hodgkin, leucopenia, linfadenopatía, macrocitosis, linfoma maligno, anemia megaloblástica, pancitopenia y trombocitopenia; hepáticos, como falla hepática aguda, daño hepático y hepatitis; inmunológicos, como síndrome de DRESS, y neuromusculares, como osteomalacia y lupus eritematoso sistémico. Paradójicamente, la intoxicación por fenitoína puede empeorar las crisis (21,22).
Por otro lado, el ácido valproico tiene evidencia experimental de aumentar la concentración del GABA en el cerebro, potenciando así la respuesta de esta sustancia a nivel postsináptico. Además, bloquea los canales de sodio rápidos dependientes de voltaje, lo que resulta en la inhibición de descargas de alta frecuencia neuronal (21). Dentro de sus efectos adversos podemos encontrar, con una frecuencia mayor al 10 % y según el sistema: neurológicos, como cefalea, mareo e insomnio; dermatológicos, como alopecia; gastrointestinales, como náusea, vómito, dolor abdominal, diarrea, dispepsia y anorexia, y hematoncológicos, como trombocitopenia.
También podemos encontrar con una frecuencia de entre el 1 % y el 10 % y según el sistema efectos: cardiovasculares, como edema periférico, edema facial, hipertensión, hipotensión, hipotensión ortostática, palpitaciones, vasodilatación y dolor torácico; neurológicos, como ataxia, amnesia, parestesia, labilidad emocional, confusión, depresión, hipertonía, alteraciones en el lenguaje, discinesia tardía, agitación, escalofríos, hiperreflexia, vértigo, ansiedad, malestar y miastenia; dermatológicos, como sarpullido maculopapular, prurito, xeroderma, diaforesis, eritema nodoso y seborrea; endocrinológicos y metabólicos, como ganancia de peso, pérdida de peso, amenorrea y alteraciones en la menstruación; gastrointestinales, como hiperexia, constipación, flatulencia, incontinencia fecal, gastroenteritis, glositis, estomatitis, xerostomía, hematemesis, disgeusia, pancreatitis, disfagia, hemorragia gingival y úlcera de la mucosa oral; hematoncológicos, como equimosis y petequias, y hepáticos, como elevación de enzimas. Por último, con una frecuencia menor al 1 %, podemos encontrar comportamiento anormal, porfiria aguda, agranulocitosis, anafilaxia, anemia, depresión de la médula ósea, bradicardia, atrofia cerebral, síndrome de DRESS, parkinsonismo inducido por drogas y galactorrea, entre otros (21, 22, 23).
La carbamacepina, por su parte, disminuye la conductancia del sodio, y en menor grado, la del potasio, inhibiendo además la recaptura y liberación de noradrenalina de los sinaptosomas cerebrales (21). Dentro de sus efectos adversos se encuentran ataxia, náuseas, letargia, visión borrosa, nistagmo, cefalea, malestar, temblor, depresión de la médula ósea, entre otros (21, 22, 23, 24).
Por último, está el levetiracetam, que hace parte de los nuevos anticonvulsivantes y su mecanismo de acción aún no está dilucidado de manera clara (21). No obstante, cierta evidencia sugiere que el levetiracetam afecta únicamente a los receptores GABAa en el tejido epiléptico, modula la actividad neuronal inhibiendo el aumento de calcio intracelular y ralentiza las corrientes de los canales rectificadores de potasio y de los receptores AMPA para glutamato. También se ha observado que se une a la glucoproteína 2A de vesícula sináptica, disminuyendo la liberación de neurotransmisores en la hendidura sináptica, entre otros (25). Tiene pocos efectos colaterales reportados, como la somnolencia, la fatiga, el mareo e infecciones (sobre todo del tracto respiratorio superior). No obstante, la mayoría de estos son de leve a moderada intensidad y, generalmente, ocurren durante la fase de titulación (25). Los efectos adversos neuropsiquiátricos, como la sedación, pueden ocurrir incluso después de esta fase y ser causantes de la descontinuación de este medicamento (25). Cabe resaltar que solo el 24 % de la dosis es metabolizada por hidrólisis enzimática del grupo acetamida y ocurre principalmente en la sangre y no por el citocromo P450 (26).
En cuanto a los estudios que se han adelantado en el contexto de las crisis posteriores a TCE, solo se han evaluado clínicamente cinco fármacos anticonvulsivantes: fenobarbital, fenitoína, carbamacepina, valproato y magnesio, este último con muchos menos estudios y más antiguos que los demás, que no serán objeto de la presente revisión.
Schierhout et al. (citados en 1), en un metanálisis con una base de 2036 pacientes, definieron que tanto la fenitoína como la carbamacepina que se administraban tempranamente y de forma posterior al TCR lograban evitar crisis tempranas, pero no la aparición de crisis tardías, sin efectos en la mortalidad ni en la recuperación neurológica. Por su parte, Jedrzejczak et al. (27), en un estudio prospectivo, recolectaron datos para evaluar la efectividad y tolerabilidad del valproato de sodio como monoterapia de primera línea para pacientes diagnosticados recientemente con epilepsia focal. El 77 % de los pacientes evaluados no presentó crisis epilépticas, pero se presentaron efectos adversos por la medicación en el 10,2 % de los pacientes, lo que llevó a realizar cambios en el plan terapéutico. Los efectos adversos más comunes fueron ganancia de peso y trastornos digestivos, neurológicos y dermatológicos. Por lo tanto, aunque el valproato de sodio mostró un adecuado control de las crisis epilépticas, su perfil de efectos adversos lo hace un candidato menos atractivo.
Khan et al. (28), en una revisión sistemática de la literatura, compararon levetiracetam y fenitoína como tratamientos farmacológicos profilácticos. Incluyeron siete artículos con un total de 1186 pacientes que mostraron una tasa de crisis epilépticas del 5,4 % en la cohorte del levetiracetam versus una tasa del 3,4 % en la cohorte de la fenitoína. En el estudio no se encontraron diferencias en el riesgo de aparición de crisis tempranas según el tratamiento profiláctico escogido.
Jones et al. (29) recolectaron 32 casos en los cuales a los pacientes se les administró levetiracetam durante los primeros 7 días posteriores al TCE severo y los compararon con una cohorte de 41 casos en que los pacientes recibieron monoterapia con fenitoína. En el estudio evidenciaron una mayor actividad epileptiforme en los electroencefalogramas de los pacientes que tomaron levetiracetam en comparación con la fenitoína, pero no hubo diferencias significativas entre el hallazgo de manifestaciones clínicas de las crisis entre los pacientes tratados con fenitoína y los pacientes tratados con levetiracetam.
En un estudio retrospectivo observacional con un tamaño de muestra de 109 pacientes con daño cerebral traumático, el 65 % recibió terapia profiláctica antiepiléptica durante más de 7 días. De los pacientes admitidos entre el 2000 y el 2007, a 81 (98 %) se les suministró fenitoína; mientras que a 28 pacientes (64 %) admitidos entre el 2008 y el 2010, levetiracetam. Los autores encontraron que solamente dos pacientes experimentaron crisis postraumáticas después de que se les administrara la terapia profiláctica, lo cual indicó una baja incidencia. La mayoría de los pacientes admitidos recibió terapia profiláctica más de 7 días, a pesar de que los datos actuales no muestran beneficios de usarlos durante más de 7 días (30, 31, 32). Finalmente, el estudio concluyó que después de ser aceptada la administración de levetiracetam de manera intravenosa se está creando una tendencia en la que se prefiere prescribir esta terapia al uso de la fenitoína (33).
En un metanálisis realizado por Wilson et al. (34), en el cual se revisaron 120 artículos, los autores concluyeron que la fenitoína se asoció con una disminución en la probabilidad de presentar crisis tempranas con respecto al placebo (OR = 0,34, con un intervalo de confianza del 95 % [0,19-0,62]). También se demostró que no había diferencia en la incidencia de crisis tempranas entre levetiracetam y fenitoína (OR = 0,83, con un intervalo de confianza del 95 % [0,22-2,1]). Así mismo, se evidenció que ni la fenitoína ni el levetiracetam se asociaron con menos crisis tardías que el placebo. Este estudio, en particular, concluyó que la nueva literatura es consistente con las guías actuales que respaldan el uso de anticonvulsivantes como prevención para las crisis epilépticas tempranas, mas no para las tardías. También concluyó que, con respecto a la prevención de crisis tempranas, la fenitoína y el levetiracetam son prácticamente igual de efectivos en el ámbito clínico (34). Se considera que los hallazgos actuales son insuficientes para preferir levetiracetam sobre la fenitoína con respecto a su efecto antiepiléptico (35).
En relación con estudios realizados en modelos animales, la fenitoína y la carbamacepina no evidenciaron alguna actividad dentro de la profilaxis para crisis epilépticas postraumáticas en modelos animales. Por su parte, el fenobarbital y el valproato pueden tener efectos, según los estudios en biomodelos; pero solo si se utilizan en dosis dos veces más altas de lo recomendado (6). En el caso del levetiracetam, los estudios con modelos animales han evidenciado muchos mecanismos moleculares que contribuyen con el efecto anticonvulsivante del fármaco y que podrían estar también relacionados con un papel antiepileptogénico. Dentro de estos se destacan el efecto antioxidante por disminución de radicales libres, el efecto antinflamatorio por disminución de las concentraciones de la IL-1β (36,37) y el efecto antiexcitotóxico, que reduce la liberación del calcio intracelular y reduce la hiperactivación de los transportadores de glutamato y aspartato (36). Un blanco para destacar es la proteína vesicular sináptica 2A, que es ubicua presinápticamente. En un modelo murino deficiente de esta proteína se mostró una reducción marcada en la actividad anticonvulsivante del levetiracetam, lo que confirmó el rol de la proteína vesicular sináptica 2A en la protección contra las crisis (38). Así mismo, en un estudio con un modelo genético murino se demostraron las propiedades protectoras del fármaco cuando se administra antes del desarrollo de la expresión epiléptica. Esto se llevó a cabo en una cepa de ratas epilépticas de la Universidad de Kyoto que se trataron a largo plazo con levetiracetam, el cual inhibió la expresión de crisis epilépticas tónicas. (39). Así mismo, en un estudio con un modelo murino de estimulación eléctrica inducida por pilocarpina y ácido kaínico, las ratas que fueron tratadas de manera crónica con levetiracetam mostraron reducción del número y duración de las crisis motoras subsecuentes (40,41).
Aunque la literatura actual recomienda el uso de este tipo de fármacos como profilaxis en la aparición de crisis epilépticas postraumáticas tempranas, otros fármacos han sido y se están estudiando como posibles alternativas para este uso particular, que si bien no cuentan con suficientes estudios en humanos, ya comienzan a acumular evidencia experimental preclínica que los pone en la mirada para su uso futuro.
Evidencia de los fármacos antioxidantes y eliminadores de radicales libres
Entre los fármacos evaluados a través de estudios preclínicos en el contexto de las crisis epilépticas postraumáticas, están los que pueden agruparse bajo la categoría de antioxidantes y eliminadores de radicales libres. En el modelo de Wilmore se demostró que los animales manejados previamente con α-tocoferol, melatonina, taninos, adenosina y zonisamida mostraron una disminución importante en las descargas electroencefalográficas, en el número de crisis y un aumento en el tiempo en el cual se presenta la primera crisis posterior al trauma (1). Dentro de este grupo también se ubican la deferoxamina y la dehidroepiandrosterona (DHEA). Su mecanismo de acción radica en que disminuyen la cantidad de hierro que se acumula en las neuronas (42,43). Por su parte, la vitamina E o α-tocoferol actúa reduciendo la pérdida neuronal y la gliosis; mientras que los mecanismos de los otros fármacos no están bien dilucidados (42,43).
Evidencia de los medicamentos antiglutamatérgicos
Los medicamentos antiglutamatérgicos, como el antibiótico ceftriaxona, actúan reduciendo la expresión del transportador glutamato-aspartato, conocido transportador de localización glial, principalmente encontrado en el cerebelo (7), que participa en la homeostasis del glutamato en la hendidura sináptica, pues hace parte de la familia de proteínas de membrana encargadas de la recaptura del glutamato, conocida como transportadores de aminoácidos excitatorios (44). Como se mencionó, el trauma cerebral induce una alteración en el sistema glutamatérgico que induce una excitotoxicidad dependiente de glutamato. Así, entonces, el uso de estos medicamentos revierte esta alteración, al disminuir los daños ocasionados por el glutamato (45,46). Esto fue evidenciado en un modelo murino en el cual se estudió la ceftriaxona como mitigadora de la astrogliosis regional y como mitigadora de la severidad de un daño cerebral postraumática. En el estudio encontraron que 7 días después del trauma, las concentraciones del transportador de glutamato 1 disminuyeron en la corteza ipsilateral en un 29 %, revertidos con el manejo médico empleando ceftriaxona. Además, se encontró que disminuye la expresión de proteína acídica fibrilar glial en un 43 % en la corteza lesionada respecto al control. Estos datos sugieren un potencial efecto antiepiléptico de la ceftriaxona posterior a un traumatismo (46).
Evidencia de medicamentos antinflamatorios
Otro grupo de medicamentos estudiado preclínicamente en crisis epilépticas posteriores a TCE son los antinflamatorios, dentro de los cuales podemos mencionar: celecoxib, losartán y fingolimod. En un modelo murino donde se indujo el estado epiléptico después del uso de pilocarpina y litio se observó que el inhibidor de la ciclooxigenasa 2 (celecoxib) previene la activación de la microglía, la muerte neuronal, la neurogénesis y la generación de células granulares ectópicas, todos estos mecanismos pueden estar relacionados con disminución de la aparición de crisis (47).
Por otro lado, el losartán, que es un antagonista de receptores de angiotensina II, actúa al inhibir la acción inflamatoria de la albúmina, que induce la cascada de señalización del factor transformante del crecimiento β, que se produce en los astrocitos, mecanismos por los cuales se ha candidatizado como un posible fármaco en epilepsia (48). Fingolimod, utilizado en esclerosis múltiple, es un análogo de la esfingosina que modula los receptores 1 de esfingosina. Esto repercute en la inhibición de la migración de los linfocitos a la zona del daño y reduce la activación de la microglía y los astrocitos, la expresión de la interleucina-1β y del factor de necrosis tumoral α y, por lo tanto, la muerte neuronal (49). Esto fue evidenciado en un modelo murino al cual se le indujo epilepsia mediante el uso de litio y pilocarpina y donde se concluye que por las razones mencionadas el fingolimod ejerce una acción antinflamatoria y antiepiléptica que provee entonces una posible ruta de abordaje terapéutica (49).
Evidencia de medicamentos gabaérgicos
Se postula que los medicamentos como la gabapentina (de acción gabaérgica), la eritropoyetina (EPO) y la rapamicina tienen un efecto profiláctico para el desarrollo de crisis epilépticas, ya que afectan la regeneración y la plasticidad neuronal (6). En efecto, la gabapentina inhibe el brote de colaterales axonales y la formación de sinapsis excitatorias que se producen después del trauma cerebral, según se ha observado en algunos estudios (6). Por su lado, los receptores de la EPO, expresados en las neuronas del hipocampo, incrementan su número posterior al trauma cerebral, lo cual puede ser interesante para considerarlo en este contexto. En un modelo febril murino se sugiere que la acción profiláctica de la EPO radica en que reduce la fuga de la barrera hematoencefálica, la muerte neuronal y la activación de la microglía (50,51). Por último, después de un TCE, la vía mTOR se encuentra hiperactivada y se ha visto que promueve la supervivencia celular, la neurogénesis y la plasticidad neuronal (52). Por esta razón, se ha propuesto la rapamicina como una opción eventual dentro de la profilaxis. En el modelo murino de impacto cortical controlado se demostró que su mecanismo de acción es inhibir la degeneración neuronal y el brote axonal de las fibras musgosas (19,53).
Limitaciones a la hora de elegir la terapia profiláctica
Los mecanismos moleculares relacionados con la fisiopatología de la epilepsia postraumática no están claramente dilucidados; sin embargo, una cantidad muy significativa de evidencia en modelos animales y en estudios en humanos o con tejido proveniente de estos sugieren que los fenómenos de estrés oxidativo, inflamación, excitotoxicidad mediada por glutamato, muerte celular programada y plasticidad secundaria al daño (brotes de colaterales axonales, sinaptogénesis y quizás neurogénesis) están presentes como eventos secundarios desencadenantes o consecuentes (6). Por lo tanto, se han investigado muchos blancos farmacológicos que constituyen potenciales agentes para prevenir la epilepsia postraumática. No obstante, no se ha diseñado un medicamento capaz de intervenir todos los procesos que se ven alterados durante el desarrollo de la epileptogénesis, por lo cual se considera que hasta el momento no hay ningún fármaco antiepileptogénico.
Este amplio contexto fisiopatológico permite la aproximación a la terapia desde diferentes perspectivas funcionales, cascadas de señalización o procesos celulares. Por esto, hemos reunido la evidencia alrededor de fármacos diversos que podrían estar relacionados con el proceso o que se han considerado: los anticonvulsivantes, como la fenitoína, el ácido valproico, el levetiracetam y la carbamacepina; antioxidantes, como la vitamina E, la zonisamida, la deferoxamina y la DHEA; antiglutamatérgicos, como la ceftriaxona; antiinflamatorios, como el celecoxib, el losartán y el fingolimod, y fármacos con acción gabaérgica como la rapamicina, la EPO y la gabapentina (6).
Vale la pena resaltar que los medicamentos anticonvulsivantes clásicos, como la fenitoína, el fenobarbital, el sulfato de magnesio y la carbamacepina no han demostrado en los estudios realizados históricamente un efecto antiepileptogénico contundente como profilaxis para la epilepsia postraumática. No obstante, las Brain Trauma Foundation Guidelines continúan recomendando el uso de la profilaxis antiepiléptica para disminuir la incidencia de las crisis tempranas dentro de los primeros 7 días posterior a un TCE severo con base en estos medicamentos (33).
Según lo estudiado, ninguno de estos agentes puede intervenir todos los mecanismos moleculares en juego dentro de la génesis de las crisis epilépticas postraumáticas tempranas, la cual es multifactorial, y de hecho todos los estudios que se han realizado hasta el momento analizan un solo agente como monoterapia (54). Constituye un punto central de discusión el levetiracetam, dado que, a diferencia de los otros fármacos, presenta mecanismos de acción múltiples, muchos de ellos con hallazgos preclínicos en el contexto de las crisis postraumáticas. Sin embargo, a pesar de los datos novedosos moleculares y el potencial papel antiepileptogénico del levetiracetam, se considera que la evidencia actual es insuficiente para preferirlo sobre la fenitoína con respecto a su efecto antiepiléptico (35). Además, la Brain Trauma Foundation corrobora que el levetiracetam se está prescribiendo de manera creciente en comparación con la fenitoína, pero principalmente dada su fácil vía de administración y su perfil de efectos adversos más favorable (33).
Considerando la complejidad de este panorama, se plantea que la combinación de fármacos que intervengan diferentes procesos en los mecanismos de daño como una forma de tener una mejor probabilidad de prevención (55,56). No obstante, muchos aspectos podrían complicar el uso de una terapia combinada, principalmente su perfil de seguridad. Así, pues, este tipo de terapia debería ser analizada con drogas cuyo perfil de seguridad y efecto profiláctico se haya comprobado (6).
Conclusiones
La epilepsia postraumática representa un 20 % de las epilepsias sintomáticas. Según su cronología de aparición, se definen las crisis tempranas (menos de 7 días) o tardías (más de 7 días). La terapia profiláctica ha demostrado ser útil en la prevención de crisis epilépticas tempranas, mas no tardías. Actualmente, se utilizan los medicamentos anticonvulsivantes fenitoína, ácido valproico, carbamacepina o levetiracetam como primera línea. Otro tipo de fármacos no cuentan con estudios clínicos que permitan sustentar su uso clínico, aunque aquí se describen sus mecanismos de acción y potenciales usos.
De los fármacos anticonvulsivantes, por su perfil de efectos adversos más favorables, su fácil vía de administración y sus mecanismos de acción, el levetiracetam tiende a ser el fármaco de primera opción. Como los mecanismos implicados en la génesis de la epilepsia postraumática son muchos y no están totalmente dilucidados, hoy en día se considera que no existe ningún fármaco que actúe como antiepileptogénico, pero sí existen fármacos con algún grado mayor o menor de evidencia de prevención de crisis epilépticas tempranas postraumáticas.
Los fármacos anticonvulsivantes que están en experimentación y que han demostrado algún grado de elegibilidad o potencial antiepileptogénico en modelos animales, como el levetiracetam, deben contar en un futuro con un uso respaldado en estudios clínicos en humanos que verifiquen su utilidad. Esto mismo aplicaría para una posible terapia combinada y para fármacos de otras categorías; adicionalmente, se insiste en la importancia de desarrollar estudios que diluciden los mecanismos fisiopatológicos de las crisis epilépticas postraumáticas tempranas y tardías con mayor exactitud, con el fin de buscar nuevos blancos farmacológicos posibles.














