Introducción
La historia de la infección por SARS-CoV-2 inició en noviembre de 2019, cuando aparecieron los primeros casos de neumonía de origen desconocido en Wuhan (China). En enero de 2020, el Centro de Control de Enfermedades de China confirmó que el agente etiológico era un nuevo tipo de coronavirus. A finales de este mes, la Organización Mundial de la Salud (OMS) declaró la infección por SARS-CoV-2 como una emergencia de salud pública de interés internacional (1) y menos de dos meses después la OMS confirmó que la infección se había convertido en pandemia (2).
El primer caso en niños se reportó a mediados de enero de 2020 en Shenzhen (China). Para finales de ese mes, se habían descrito más de 20 casos pediátricos en ese país (1). El primero en neonatos se informó el 5 de febrero de 2020. Se trató de un recién nacido diagnosticado a las 36 horas de vida, hijo de una madre con neumonía por SARS-CoV-2 (3).
La reciente aparición de esta entidad y la escasa literatura disponible para el manejo y seguimiento específico del recién nacido generó nuestro interés por hacer una revisión acerca de la evidencia disponible sobre el tema y plantear una propuesta de atención para las unidades neonatales.
Características virales y transmisión
Los coronavirus humanos como 229E, OC43, NL63 y HKU1 se han asociado más frecuentemente con infecciones de las vías respiratorias superiores. El nuevo virus es un β coronavirus de la misma familia de los agentes del SARS-CoV (síndrome respiratorio agudo severo) y MERS-CoV (síndrome respiratorio del Este Medio), con un 70 % de similitud en la secuencia genética del SARS-CoV. Se ha denominado SARS-CoV-2 y se han establecido tres distintas cepas (4).
Corresponde a una zoonosis. Se cree que el reservorio pudieran ser los murciélagos, y su huésped intermediario, el pangolín. Pertenece a la familia Coronaviridae,subfamilia Orthocoronavirina (1). El SARS-CoV-2 ingresa a las células uniéndose al receptor de la enzima convertidora de angiotensina 2 (ACE-2), que tiene alta expresión en los neumocitos tipo 2 y en el tracto gastrointestinal en las células epiteliales esofágicas y los enterocitos ileales y colónicos (5, 6).
La transmisión de este virus se da, principalmente, de persona a persona, a partir de pacientes infectados sintomáticos; sin embargo, existe una frecuencia importante de infección y trasmisión por personas asintomáticas. El periodo de incubación es de 1 a 14 días, con una media estimada en 5,2 días (intervalo de confianza [IC] del 95 %: 4,4‐6,0); el 97,5 % de los que desarrollan síntomas, lo hacen en un promedio de 10,5 días a partir de la infección (IC 95 %: 7,3‐15,3) (1, 7, 8, 9, 10, 11, 12). Los datos actuales demuestran como principales rutas de transmisión las gotas, el contacto y los aerosoles. Se ha planteado la posibilidad de transmisión fecal-oral, dada la presencia de ARN del SARS-CoV-2 en muestras fecales de algunos pacientes en estudios de Estados Unidos y China (7, 11, 13, 14, 15, 16, 17, 18).
De acuerdo con los datos existentes, al igual que en las epidemias de SARS-CoV y MERS-CoV, hasta la fecha no se ha documentado transmisión vertical a recién nacidos, como lo indican estudios con análisis molecular negativo en muestras de placenta, líquido amniótico y sangre de cordón umbilical de madres infectadas por SARS-CoV2 en diferentes series de casos (2, 9, 17, 19, 20, 21, 22). Otro aspecto para resaltar es que tampoco se ha encontrado eliminación viral a través de leche materna (2, 15, 23); sin embargo, los estudios aún son escasos y con tamaños de muestra pequeños, por lo que no se pueden sacar conclusiones certeras (24).
Teniendo en cuenta lo anterior, la evidencia sobre la fuente de infección en la mayoría de los casos pediátricos es el contacto con algún familiar o conviviente infectado (1, 2, 14, 23, 25).
Epidemiología
Con relación a la población neonatal los datos son escasos; una revisión sistemática de la literatura que incluyó países como Estados Unidos, Italia y China reporta que, de un total de 7480 casos pediátricos, el 7 % corresponde a pacientes menores de un mes. En Colombia, hasta noviembre de 2020, el Instituto Nacional de Salud había documentado 632 casos, de los cuales 494 se recuperaron y uno falleció. Respecto a las manifestaciones clínicas de los pacientes identificados, el 72,47 % tuvo un curso leve; el 25,47 %, un curso moderado, y el 1,11 %, un curso grave de la enfermedad. Así mismo, 238 casos ocurrieron en la primera semana de vida y los restantes fueron de presentación tardía hasta los 28 días de vida. La mayor concentración de los casos está en Bogotá con 140; Antioquia, con 85 y Cesar, con 54. Los casos restantes están distribuidos en el resto del país, sin contar con reportes en los departamentos de Arauca, Guainía, Vaupés, Guaviare y Vichada (26, 27).
Manifestaciones clínicas
Teniendo en cuenta la localización del receptor de angiotensina 2 (ACE-2), se considera que los principales órganos blanco para la infección por SARS-CoV-2 son las vías respiratorias y el tracto digestivo. También se hallaron receptores ACE-2 a nivel renal, endotelial y cardiaco (9, 28).
Una vez el virus ingresa a la célula, inicia su replicación y traducción de proteínas estructurales virales, lo cual desencadena la liberación exagerada de citocinas proinflamatorias y quimiocinas. Ello ocasiona la llamada tormenta de citocinas, que media la respuesta inflamatoria sistémica y lleva al desarrollo de síndrome de dificultad respiratoria agudo del adulto y daño multiorgánico (1).
Aún no se conoce el mecanismo fisiopatológico exacto de la aparición de los síntomas digestivos; se presume que el virus produce diarrea al destruir enterocitos absorbentes y que ello da lugar a malabsorción, desequilibrio en la secreción intestinal y activación del sistema nervioso entérico (29).
No es clara la razón por la cual esta infección parece tener manifestaciones más leves en la población pediátrica al compararlas con la clínica que presentan los adultos. Dentro de las posibles explicaciones, se han propuesto varias hipótesis:
Un sistema inmune innato más fuerte en los niños, con un mayor número de células T, B y NK. Menor producción de citocinas proinflamatorias, que disminuyen la posibilidad de aparición de una tormenta de citocinas, tal como se produce en la patogenia de la COVID-19 en los adultos. Los niños tienen una menor presencia de comorbilidades como hipertensión y diabetes. En la población pediátrica se produce una mayor circulación de los coronavirus comunes y ello genera una inmunidad preexistente, anticuerpos y reacción cruzada contra el SARS-CoV-2, con disminución del total de anticuerpos hacia la adultez (3, 30, 31). Así mismo, la mayor colonización de la mucosa por virus y bacterias podría limitar la colonización y el crecimiento del SARS-CoV-2 a través de interacciones microbianas. Se presume que los niños tienen menos receptores ACE-2 con menor afinidad, en comparación con los adultos, lo que atenúa el ingreso del SARS-CoV-2 a la célula y, así, el daño celular asociado con la infección viral (23, 28, 30, 32, 33), lo que los hace menos susceptibles. Se cree que existe cierta protección fuera de los objetivos de la vacuna antituberculosa, presumiendo cierta correlación entre la vacuna y la severidad de la COVID-19; pero esto es aún objeto de estudios. Igualmente, hay una menor exposición al daño pulmonar secundario a contaminación ambiental y humo de cigarrillo (1, 23, 30, 32, 33, 34).
Las manifestaciones clínicas en los recién nacidos con infección por SARS-CoV2 suelen ser inespecíficas, incluso pueden estar asintomáticos o tener síntomas leves, como fiebre, tos seca, taquipnea, signos de dificultad respiratoria, apnea, taquicardia y letargia (6, 7, 19, 23, 25, 35). En algunas series de casos se describen síntomas digestivos iniciales o como manifestación aislada de COVID-19. Entre el 10 % y 40 % de los casos, los síntomas gastrointestinales se asocian con síntomas respiratorios con manifestaciones como vómito, diarrea, intolerancia alimentaria, regurgitación, distensión abdominal y hemorragia digestiva (9, 17, 29, 36, 37, 38, 39).
Es importante mencionar que en la infección por SARS-CoV del 2003 se encontró asociación con enterocolitis necrosante y perforación intestinal espontánea, tanto en prematuros como en neonatos a término. En un principio se pensó que estas complicaciones podrían haber sido fruto del azar; sin embargo, no se descarta que estén relacionadas con la importante afectación hemodinámica materna que, de manera indirecta, afecta el suministro de sangre y oxígeno en la placenta, lo cual produce isquemia intestinal y predispone a la presentación de estas dos entidades. Dado que el SARS-CoV del 2003 es de la familia del SARS-CoV-2 y podrían compartir ciertas características infecciosas y de presentación clínica, es importante que los signos y los síntomas gastrointestinales en recién nacidos se monitoricen rigurosamente, con el fin de realizar una intervención temprana (40).
Para realizar un enfoque práctico tanto del diagnóstico como del tratamiento, la Asociación Colombiana de Infectología (ACIN) recomienda diferenciar entre neonatos sintomáticos y neonatos asintomáticos según las siguientes definiciones (41):
Sintomático: neonato con dificultad respiratoria, intolerancia o rechazo a la vía enteral, distermia, taquicardia, apneas, hemorragia digestiva, síntomas de sepsis severa, como coagulación intravascular diseminada y choque.
Asintomático: neonato sin dificultad respiratoria, intolerancia o rechazo a la vía enteral, distermia, taquicardia, apneas, hemorragia digestiva, síntomas de sepsis severa como coagulación intravascular diseminada y choque.
A su vez, se recomienda la clasificación de los casos de SARS-CoV-2/COVID-19 de la siguiente manera:
Caso sospechoso: neonato de una madre con infección confirmada por SARS-CoV-2, 14 días antes o 28 días después del parto, y neonato con historia de contacto estrecho con un caso confirmado o probable.
Caso probable: caso sospechoso sintomático con reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) no concluyente o prueba rápida positiva.
Caso confirmado: caso que cumple criterio de laboratorio de RT-PCR positiva en muestra respiratoria.
La Sociedad Española de Neonatología (42) considera caso descartado en las siguientes situaciones.
En caso de madre con infección confirmada o alta sospecha y recién nacido sintomático que precisa hospitalización, se deben tener dos pruebas de RT-PCR SARS-CoV-2 negativas (la primera dentro de las primeras 24 horas y la segunda después o a las 48 horas).
En los otros casos, una sola prueba puede ser suficiente; sin embargo, si está disponible, se recomienda repetir la prueba en la primera o segunda semana de vida.
De igual manera, la ACIN y la Asociación Colombiana de Neumología Pediátrica sugieren que los pacientes pediátricos se clasifiquen de acuerdo con la gravedad de los síntomas para orientar su tratamiento. Dicha estratificación de riesgo no aplica para la población neonatal, por lo cual nuestro grupo desarrollador, basado en dichos criterios, propone la siguiente clasificación en recién nacidos, según su sintomatología (41, 43):
Infección leve: neonato con distermia, tos, congestión nasal, hipoxemia leve, hiporexia, diarrea o vómito sin deshidratación.
Infección grave: neonato con taquipnea (frecuencia respiratoria mayor de 70), hipoxemia, dificultad respiratoria, apneas, intolerancia a la vía oral, deshidratación o deposiciones con sangre.
Infección crítica: neonato con alteración del estado de conciencia, insuficiencia respiratoria, requerimiento de ventilación mecánica, choque séptico o disfunción multiorgánica.
Pruebas diagnósticas
A la fecha, el criterio de referencia (gold standard) para el diagnóstico de COVID-19, incluso en pacientes que cursan asintomáticos, es la realización de estudios moleculares para SARS-CoV-2 (42, 44, 45, 46).
Actualmente, en Colombia se recomienda el diagnóstico molecular tanto por medio de la amplificación de ácido nucleico (NAAT) como RT-PCR. Esta prueba detecta secuencias únicas de ARN por NAAT (genes virales N, E, S, RdRP) para SARS-CoV-2 y se puede tomar en muestras de lavado broncoalveolar, aspirado bronquial o hisopado naso y orofaríngeo. La sensibilidad es del 93 %, del 72 % y del 63 %, respectivamente (41).
Los Centros para el Control y Prevención de Enfermedades recomiendan el uso de hisopado naso u orofaríngeo en neonatos; debe realizarse a todo recién nacido de madre sospechosa o confirmada de COVID-19. No está claramente definido el momento oportuno para realizar la prueba, dado que realizarla tempranamente puede relacionarse con mayor frecuencia de falsos positivos, por contaminación de secreciones respiratorias altas del recién nacido con fluidos maternos, así como pueden presentarse falsos negativos, por el corto tiempo entre la exposición y la realización de la prueba.
A pesar de esto, se recomienda tomar la muestra dentro de las primeras 24 horas de vida y si el resultado es negativo o no fue posible recolectar la muestra, se debe tomar nuevamente a las 48 horas de vida. Adicionalmente, se recomienda la realización de RT-PCR SARS-CoV-2 a todos los neonatos que tengan manifestaciones clínicas sugestivas de COVID-19 (46). En la actualidad, no se recomienda el uso de pruebas serológicas para el diagnóstico de infección aguda por SARS-CoV2/COVID-19 en neonatos (41, 46).
Con relación a pruebas diagnósticas complementarias, se sugiere descartar coinfección por otros gérmenes como virus sincitial respiratorio y virus de influenza cepa H1N1 con estudios moleculares de detección múltiple o, en caso de no disponibilidad, con estudio antigénico (7, 41). Teniendo en cuenta los hallazgos descritos en las diferentes series de casos, se recomienda ampliar los estudios con hemograma, pruebas de función renal, hepática, cardiaca y electrolitos séricos, proteína C reactiva (PCR), procalcitonina, tiempos de coagulación y gases arteriales, según la condición clínica del recién nacido (7, 19, 20, 22, 41, 47).
Respecto al estudio imagenológico, se sugiere la toma de una radiografía de tórax en todos los casos; sin embargo, los hallazgos pueden no tener buena correlación con la clínica y variar de acuerdo con el estadio de evolución. Por esta razón, en los casos de evolución tórpida o progresión a estado clínico grave, se recomienda la toma de una tomografía axial computarizada de tórax, dada su mayor sensibilidad (41, 43, 48).
Manejo del recién nacido (49, 50, 51)
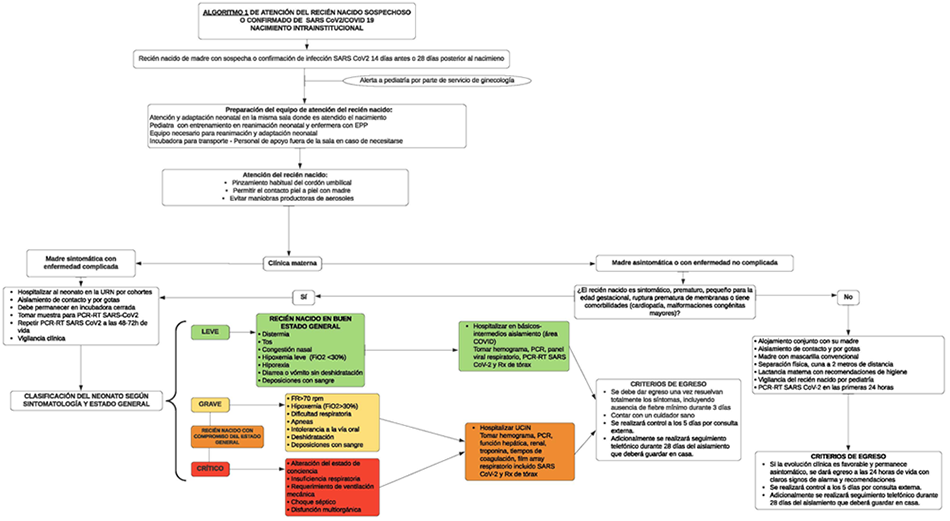
Recién nacido de madre con sospecha o confirmación de infección por SARS-CoV 2/COVID 19 (52, 53, 54, 55)
La adaptación neonatal debe realizarse por parte de un pediatra con experiencia, siguiendo las recomendaciones del Neonatal Advanced Life Support en su edición número 7 y las recomendaciones de la Academia Americana de Corazón (56). Se recomienda que la atención del recién nacido se realice en la misma sala de parto o cirugía donde se atiende el nacimiento y que el personal encargado tenga todos los elementos de protección personal completos, ya que el parto es considerado un procedimiento generador de aerosoles (57).
Si la estabilidad clínica materna y del neonato lo permiten, se recomienda el pinzamiento habitual del cordón umbilical (41, 55, 57).
El Ministerio de Salud de Colombia y la OMS recomiendan permitir el contacto piel a piel con la madre en la transición inmediata a la vida extrauterina, siguiendo las recomendaciones de higiene respiratoria y de contacto para disminuir el riesgo de contagio del recién nacido, decisión que será consensuada con los padres, explicándose los riesgos de infección (55, 58).
Una vez superado el periodo inmediato de transición neonatal, se definirá la estancia del recién nacido teniendo en cuenta su condición clínica y la de su madre (42, 50, 52, 54, 59, 60, 61) (algoritmo 1).
Recién nacido asintomático y madre asintomática o con enfermedad no complicada
Según la definición de la ACIN, corresponde a síntomas locales en las vías respiratorias altas o síntomas inespecíficos como fiebre y dolor muscular (50):
Puede continuar su transición en alojamiento conjunto con su madre, manteniendo las medidas de aislamiento de contacto y gotas, cumpliendo las indicaciones de higiene respiratoria y de manos, que son distanciamiento de la cuna del recién nacido a 2 metros de la cama materna, uso permanente de mascarilla convencional y lavado de manos y senos cada vez que el recién nacido va a ser alimentado por la madre o cuando va a ser atendido por ella (52, 53, 54).
Se debe hacer seguimiento a sus constantes vitales y vigilancia clínica. Se realizará RT-PCR para SARS-CoV-2 en las primeras 24 horas de vida y se repetirá entre el tercer y el quinto día de vida (55).
La estancia en alojamiento conjunto debe ser de 24 horas como mínimo para vigilancia (41, 42, 57, 62).
En caso de recién nacido prematuro tardío o de bajo peso al nacer, pero estable, se recomienda decidir de forma consensuada con los padres el inicio de la adaptación canguro, explicando los beneficios de esta práctica y los claros riesgos de transmisión horizontal de la infección y siguiendo estrictas medidas de bioseguridad para protección del recién nacido (59, 60, 63).
Recién nacido sintomático o madre con sintomatología
Según la clasificación de la ACIN, corresponde a neumonía leve o grave, síndrome de dificultad respiratoria agudo del adulto, sepsis o choque séptico (53, 64):
Se debe trasladar en incubadora cerrada a un área de aislamiento definida, dependiendo de la condición clínica del neonato (unidad de cuidado básico, intermedio o intensivo neonatal), con precauciones de aislamiento por contacto y gotas, así separación por cohortes en caso de no poder garantizarse hospitalización en cubículo individual. Ante procedimientos de riesgo de generación de aerosoles, se ajustarán las medidas de aislamiento pertinentes.
Para su cuidado, el personal de salud debe utilizar elementos de protección personal.
Se debe contar con un cuidador sano, que no cumpla criterios de contacto con casos sospechosos o confirmados de infección por COVID-19; edad entre 18 y 59 años y no tener comorbilidades de riesgo para infección por COVID-19.
El tiempo que debe estar el recién nacido separado de su madre se definirá de manera individual y consensuada con los padres según la evolución clínica de los dos. Se solicitará valoración por trabajo social con el objetivo de definir la red de apoyo (2, 41, 57, 62).
Debe tenerse en cuenta que el recién nacido asintomático con factores de riesgo adicionales como prematuridad, pequeño para la edad gestacional, ruptura prematura de membranas o con comorbilidades (cardiopatía o malformaciones congénitas mayores) que lo predispongan a enfermedad más grave requiere vigilancia intrahospitalaria hasta que su condición clínica permita el egreso (41, 59).
Se debe realizar estratificación de riesgo según la descripción previa, en infección leve, grave o crítica, en aislamiento de contacto y gotas, aerosoles según necesidad (área COVID-19) y solicitar los estudios diagnósticos acorde con su condición (50, 60):
Recién nacido asintomático hospitalizado por factores de riesgo o con infección leve: hospitalizar en cuidado básico o intermedio neonatal. Tomar hemograma, PCR, panel viral respiratorio, RT-PCR SARS-CoV-2 y radiografía de tórax o radiografía de abdomen según sea el caso.
Recién nacido con infección grave: hospitalizar en la unidad de cuidado intensivo neonatal (UCIN). Tomar hemograma, PCR, función hepática, renal, troponina, tiempos de coagulación, dímero D, CPK, pruebas moleculares múltiples para virus respiratorios, si están disponibles, RT-PCR SARS-CoV-2, radiografía de tórax o radiografía de abdomen según sea el caso (64).
Recién nacido con infección crítica: hospitalizar en la UCIN. Tomar hemograma, PCR, función hepática, renal, troponina, tiempos de coagulación, dímero D, CPK, pruebas moleculares múltiple para virus respiratorios, si están disponibles, RT-PCR SARS-CoV-2 y radiografía de tórax o radiografía de abdomen según sea el caso (64).
En caso del recién nacido prematuro que requiere hospitalización, una vez su condición clínica lo permita y cuente con un cuidador sano disponible, se puede iniciar la adaptación canguro intrahospitalaria (63).
Recién nacido sospechoso o confirmado de infección por SARS-CoV-2/COVID-19 proveniente de la comunidad
Se considera que cumple con esta definición el neonato que ingresa proveniente del servicio de urgencias, programa madre canguro o remitido de otra institución con sintomatología respiratoria o digestiva (algoritmo 2).
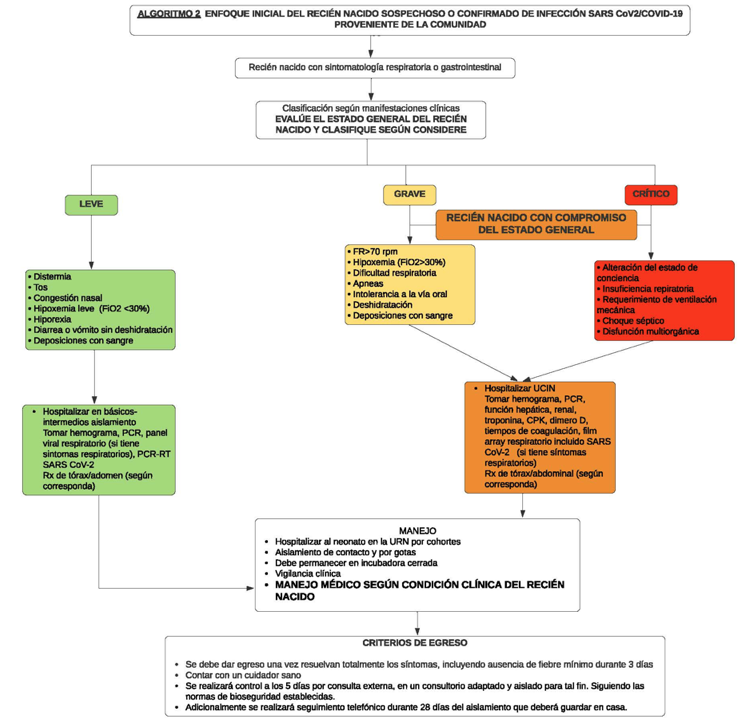
Algoritmo 2. Enfoque inicial del recién nacido sospechoso o confirmado de infección SARS CoV2/COVID-19
A su ingreso, se debe realizar estratificación de riesgo, y según su condición, se ubicará por cohortes, con aislamiento de contacto y gotas en área COVID-19, aerosoles según necesidad. Debe permanecer en incubadora cerrada (será la misma para el transporte), su alimentación será con leche materna o fórmula según la condición clínica del neonato y su madre, se definirá el manejo médico según condición clínica y se evaluará la pertinencia de estudios diagnósticos de extensión como se describió (7, 9, 19, 23, 25, 29, 36, 37, 38, 59, 60).
Vigilancia y control de infecciones
Como parte de la estrategia de vigilancia y control de infecciones, decidimos qué pacientes que ingresan remitidos de otra institución o programa madre canguro se ubican por cohortes en precauciones de aislamiento de contacto y gotas y se indica estudio de RT-PCR SARS-CoV-2 para definir la pertinencia de manejo adicional. En caso de pacientes provenientes de la comunidad que resulten positivos, se realiza la búsqueda activa de sus contactos mediante RT-PCR SARS-CoV-2 o títulos de anticuerpos IgG/IgM según corresponda.
Tratamiento farmacológico (41, 42, 43, 50)
En caso de recién nacidos sintomáticos con infección por COVID-19, se recomienda que se dé manejo de soporte según su condición clínica, como líquidos endovenosos, soporte inotrópico o vasopresor, oxígeno suplementario con dispositivos de bajo o alto flujo según el requerimiento, teniendo en cuenta la precaución de evitar maniobras productoras de aerosoles y el uso adecuado del equipo de protección personal.
La indicación de antibióticos deberá ser considerada cuando el paciente presente deterioro clínico, asociado a hallazgos clínicos y paraclínicos de coinfección bacteriana.
Con relación al manejo farmacológico específico, hemos encontrado en el ámbito mundial el uso empírico de diferentes medicamentos, como lopinavir/ritonavir, ribavirina, glucocorticoides, inmunoglobulina, hidroxicloroquina, cloroquina y algunos antibióticos de amplio espectro para pacientes con infección crítica; sin embargo, la evidencia disponible a la fecha para su uso en neonatos es insuficiente; por lo tanto, no recomendamos su administración (27, 55). La Sociedad Americana de Enfermedades Infecciosas en su actualización más reciente informa que se está adelantando un estudio con remdesivir en población pediátrica con edad mayor a 14 días, nacimiento a término y peso superior a 2,5 kg, sin que se cuente con datos publicados al respecto, por lo cual su uso no es recomendado a la fecha (65, 66).
Lactancia materna
Para iniciar la lactancia materna se deben seguir las directrices de la OMS. Dado que la es el principal factor protector de diversas enfermedades infecciosas en la infancia y debido a que hasta el momento no hay evidencia de excreción viral a través de la leche materna, se debe seguir aconsejando siempre y cuando el estado de la madre y el recién nacido lo permitan. Idealmente, se recomienda su inicio dentro de la primera hora de vida (62, 67, 68, 69, 70, 71).
En caso de que la madre se encuentre con sospecha o confirmación de COVID-19, se deben tener en cuenta las siguientes medidas estrictas de aislamiento:
Distanciamiento de la cuna del bebe a 2 metros de la cama de la madre, lavado de manos y senos antes del contacto con el neonato y después de este (también, antes y después de la extracción de leche materna), uso permanente de tapabocas, evitar hablar durante la lactancia y la extracción de la leche, así como limpiar y desinfectar rutinariamente las superficies con las que ha estado en contacto.
Si la madre cursa con enfermedad grave o crítica que impida la lactancia materna, se podría hacer extracción de leche por parte de un cuidador sano; sin embargo, esto implica garantizar las medidas de aislamiento en la recolección de la leche materna.
En los casos en que se cuenten con banco de leche, esta podría ser una opción.
Se debe considerar, de igual forma, ofrecer apoyo en lactancia para superar las dificultades que se le presenten a la madre con el fin de iniciar, instaurar y mantener la lactancia materna (18, 51, 59, 71, 72, 73).
Inmunizaciones (74)
Según el lineamiento del Programa Ampliado de Inmunizaciones, en el contexto de la pandemia por COVID-19 en Bogotá, la Secretaría Distrital de Salud recomienda:
En caso de madre sospechosa o confirmada de COVID-19 y recién nacido confirmado de COVID-19, se debe diferir la vacuna antituberculosa hasta que la condición clínica lo permita o hasta los 14-28 días de vida posnatal; diferir hepatitis B hasta antes del alta. En caso de madre con estado serológico desconocido para hepatitis B, se debe administrar la inmunización al recién nacido en las primeras 12 horas de vida, y en caso de madre confirmada para infección por virus de hepatitis B, también se debe administrar inmunoglobulina.
Madre sospechosa o confirmada de COVID-19 con recién nacido sin prueba confirmatoria y asintomático se debe administrar vacuna de hepatitis B en las primeras 12 horas de vida y administrar la vacuna antituberculosa lo más pronto posible posterior al nacimiento.
Madre sospechosa o confirmada de COVID-19 con recién nacido sin prueba confirmatoria y sintomático, se debe administrar vacuna de hepatitis B en las primeras 12 horas de vida y diferir la vacuna antituberculosa hasta los 14-28 días de vida, según la condición clínica.
En los neonatos que requieran manejo hospitalario se dará egreso una vez resuelvan totalmente los síntomas, incluyendo ausencia de fiebre mínimo durante 3 días, adecuada tolerancia a la vía oral, además de contar con un cuidador sano, teniendo en cuenta los criterios previamente definidos y se deben indicar signos de alarma claros y recomendaciones.
Se realizará control a los 5 días por consulta externa, en un consultorio adaptado y aislado para tal fin, siguiendo las normas de bioseguridad establecidas.
Adicionalmente, se realizará seguimiento telefónico durante los 28 días del aislamiento que deberá guardar en casa,
En el recién nacido asintomático que continúa transición neonatal en alojamiento conjunto con su madre, si la evolución clínica es favorable y permanece asintomático, se dará egreso a las 24 horas de vida, siguiendo la ruta de atención materno-perinatal con signos claros de alarma y recomendaciones. Se realizará control ambulatorio a los 5 días por la consulta externa, en un consultorio adaptado y aislado para tal fin, siguiendo las normas de bioseguridad establecidas. Adicionalmente, se realizará seguimiento telefónico durante los 28 días del aislamiento que deberá guardar en casa. Se tomará RT-PCR SARS-CoV-2 de control el día del control ambulatorio (5 día de vida), para lo cual se dejará la orden diligenciada en el momento del egreso (51).
En un estudio retrospectivo realizado en Francia, se demostró el pronóstico favorable de no separar a los recién nacidos de sus madres, a pesar de que ellas sean sintomáticas para infección por SARS-CoV-2. Ello sugiere que se debe considerar la combinación de atención médica domiciliaria neonatal y teleconsulta si la condición clínica madre-hijo lo permite, a fin de que haya: un seguimiento seguro, un mantenimiento de las barreras higiénicas en casa, una reducción de la transmisión horizontal posnatal que favorezca el vínculo madre-hijo y se reciba una atención no solo en el recién nacido, sino centrada también en la familia (76).
Conclusiones
En el mundo todavía se desconocen las estadísticas certeras sobre la mortalidad y morbilidad de la infección por SARS-CoV-2/COVID-19 en recién nacidos.
Las manifestaciones clínicas en esta población, como en muchas otras entidades, suelen ser inespecíficas, ya que pueden cursar cuadros desde asintomáticos, pasando por síntomas leves, hasta infección grave o crítica, con requerimiento de manejo en una UCIN.
Hasta la fecha no existe evidencia que respalde un tratamiento específico para la infección por SARS-CoV2/COVID-19 en los recién nacidos, por lo que el tratamiento es de soporte e individualizado según las condiciones de cada paciente y con seguimiento estricto en cada uno de ellos.
Dada la información limitada disponible y los pocos casos reportados en población neonatal, por la aparición tan reciente del virus, se desconoce cuáles puedan ser las secuelas a mediano y largo plazo en este grupo etario.
Este protocolo, basado en la mejor evidencia disponible, pretende ser una herramienta para el manejo de los recién nacidos sospechosos o con infección instaurada por SARS- CoV-2/COVID-19 en las unidades de recién nacidos de Colombia.