Introducción
La resistencia antimicrobiana es un proceso natural que ocurre como respuesta adaptativa de las bacterias a condiciones adversas del ambiente; por lo tanto, era de esperarse que en su material genético —miles de millones de años más antiguo que el humano— tuviera las herramientas necesarias para evolucionar y volverse resistentes a los antibióticos. Así es como, en la actualidad, no es inusual encontrar aislamientos clínicos resistentes a todos los antibióticos disponibles para uso clínico. Por lo anterior, la resistencia a los antimicrobianos se considera uno de los problemas de salud pública más importantes del mundo, que no solo aumenta la morbimortalidad de los pacientes, sino que representa un aumento de gastos para el sistema de salud, dado que se requieren mayores recursos para tratar las enfermedades y se prolongan las estancias hospitalarias de los pacientes.
Por desgracia, la propagación exitosa de bacterias gramnegativas productoras de carbapenemasas en América Latina y el Caribe ha hecho que países como Colombia se consideren endémicos para algunas carbapenemasas como las KPC (1, 2). Los pacientes infectados por estas bacterias requieren tratamientos con mayores efectos adversos, como nefrotoxicidad, debido al uso de colistina y aminoglucósidos (2). Por lo anterior, las bacterias productoras de carbapenemasas se han convertido en un desafío terapéutico, ya que han aumentado la mortalidad, han generado estancias hospitalarias más prolongadas y se han convertido en una mayor carga económica para los sistemas de salud (3).
Dada su baja toxicidad, alta eficacia y tolerancia, aproximadamente el 60 % de todos los antibióticos prescritos en el mundo son β-lactámicos (4). La producción de β-lactamasas es el mecanismo más importante de resistencia a β-lactámicos en bacterias gramnegativas. De estas, las carbapenemasas, β-lactamasas con la capacidad de hidrolizar o inactivar los carbapenémicos, se han convertido en una seria preocupación, ya que tienen el mayor espectro hidrolítico y, por lo tanto, limitan la utilidad de la mayoría de los antibióticos β-lactámicos (3).
La crisis de los antibióticos ha impulsado a entidades no gubernamentales, como la Organización Mundial de la Salud, y a gobiernos de varios países a destinar recursos para estimular la investigación de nuevas moléculas activas contra las llamadas superbacterias. Una de estas nuevas moléculas es la ceftazidima-avibactam (CAZ-AVI), compuesta por una cefalosporina de tercera generación, que tiene acción bactericida, pues inhibe la síntesis de la pared celular de peptidoglucanos mediante su unión a las proteínas de penicilinas (PBP), y el avibactam, un inhibidor no β-lactámico que inhibe las β-lactamasas de clase A de Ambler, como las β-lactamasas de espectro extendido (BLEE) y carbapenemasas como KPC; las de clase C (AmpC), y algunas β-lactamasas de clase D, como la carbapenemasa de tipo OXA-48. Sin embargo, este compuesto no tiene actividad frente a las enzimas de clase B (metalo-β-lactamasas) (5).
En el 2015, la Food and Drug Administration (FDA) de Estados Unidos probó la CAZ-AVI para el tratamiento de infecciones intrabdominales complicadas, infecciones de las vías urinarias complicadas y neumonía asociada a ventilación mecánica. Este nuevo agente ofrece, por tanto, una opción terapéutica efectiva, cuyo uso prudente y racional ayudará a prolongar su vida útil en la clínica.
En este artículo se presenta evidencia de la actividad microbiológica y clínica de la CAZ-AVI, y al examinar la epidemiología molecular de la resistencia antimicrobiana colombiana, se pretende determinar el nicho terapéutico de esta nueva opción antibiótica en el país.
Metodología
Se llevó a cabo una búsqueda estructurada de la literatura de forma independiente por parte de los investigadores NMA, DMA y DAC utilizando los términos DeCS y MeSH (en inglés y español): resistencia a antibióticos, farmacorresistencia microbiana, antibacterianos, bacterias gramnegativas, bacterias aerobias gramnegativas, antibióticos y ceftazidime, avibactam ceftazidime, drug combination, drug resistente, multiple, gram-negative aerobic bacteria, betalactámico, bacterial infection, gram-negative, beta-lactamases, multidrug resistant, respectivamente.
Se incluyeron artículos publicados en inglés y español desde el 2009 al 2019, sin discriminar por grupo etario, ni tipo de artículo. Excluimos aquellos publicados antes del 2009. Los criterios de inclusión fueron los siguientes:
Estudios de susceptibilidad in vitro de aislamientos clínicos provenientes de Latinoamérica frente a CAZ-AVI, publicados entre el 2009 y el 2019.
Estudios clínicos sobre la aplicación clínica de CAZ-AVI publicados entre el 2009 y el 2019.
Estudios epidemiológicos y revisiones sistemáticas sobre la resistencia antimicrobiana en bacterias gramnegativas en Colombia.
Se utilizaron las bases de datos Embase, Pubmed, LILACS, SciELO y Google Académico, con las siguientes estrategias de búsqueda: [Drug resistance multiple] and [ceftazidime avibactam], [ceftazidime avibactam], [bacterias aerobias gramnegativas] and [resistencia a medicamentos], [beta lactams] AND [classification], (‘ceftazidime’/exp OR ceftazidime) AND (‘avibactam’/exp OR avibactam) AND (‘Colombia’/exp OR Colombia), (((ceftazidime) AND avibactam) AND resistance) AND Colombia.
Resultados
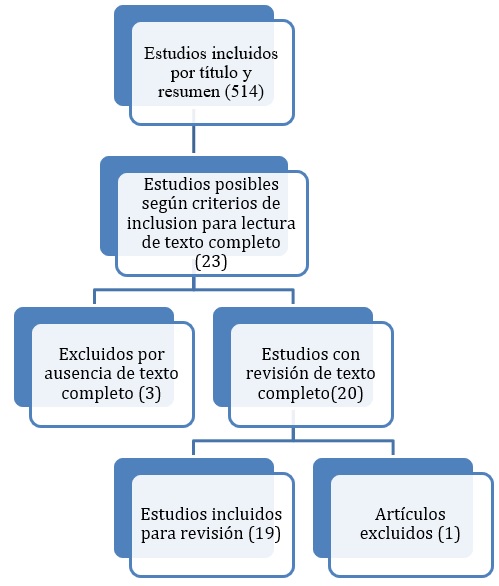
Los resultados obtenidos se basaron en las herramientas de búsqueda de la literatura acerca de CAZ-AVI y su nicho terapéutico frente a la multidrogorresistencia para gramnegativos en Colombia y América Latina. De esta manera, se obtuvo material de estudio con presentaciones de casos, ensayos clínicos, revisiones narrativas y revisiones sistemáticas, en los cuales se tuvieron en cuenta las variables tanto de criterios de inclusión como de exclusión, y así se recopilaron los mejores artículos de la literatura relacionados con la temática tratada (figura 1).
Resistencia antimicrobiana en bacilos gramnegativos en Colombia
La resistencia antimicrobiana en Colombia ha venido en aumento con el paso de los años. Según la Organización Mundial de la Salud, en la última década años se ha evidenciado un incremento significativo de las carbapenemasas, principalmente de KPC, VIM, IMP y OXA (6, 7). Tal es el caso de la diseminación de KPC, que Colombia se considera endémica para esta carbapenemasa (8).
Desde que se presentaron los primeros casos de infecciones por enterobacterias productoras de BLEE en hospitales de Latinoamérica, se ha registrado un aumento en la prevalencia y número de estas enzimas, hasta el punto de que la producción de BLEE en Klebsiella spp. se ha considerado endémica en Latinoamérica (9), con tasas elevadas de infecciones asociadas a la atención en salud en comparación con otras regiones del mundo. La expansión de las BLEE ha sido rápida, en especial las del tipo CTX-M. En Colombia, el panorama no es diferente al mundial y en diversos estudios se ha evidenciado la tendencia al incremento de la circulación de CTX-M, con la presencia simultánea de enzimas de tipo SHV y TEM (10).
A partir de aislamientos de K. pneumoniae se han caracterizado las enzimas TEM y SHV, de las cuales la SHV-5 es la más prevalente hasta el momento, junto con SHV-12 y SHV-2a. Entre las carbapenemasas de clase A tenemos las NmcA, que son un mecanismo de resistencia a carbapenémicos, y las KPC, halladas en Colombia en aislados de K. pneumoniae y P. aeruginosa, y que es la variante más prevalente en estos la KPC-2; sin embargo, en nuestro país también ha habido brotes con KPC-3. Como se mencionó y según el Instituto Nacional de Salud, en la actualidad Colombia es considerada un país endémico para enzimas KPC halladas en un 70,3 % en enterobacterias resistentes a carbapenémicos. De las carbapenemasas de clase B, VIM-2 se ha reportado en varias ciudades de Colombia en P. aeruginosa, y su variante, VIM-24 en aislamientos de K. pneumoniae. En el 2013, se detectó la presencia simultánea de VIM-24 y la KPC-2 en un aislamiento de K. pneumoniae, y su codificación en dos plásmidos diferentes, lo cual desde ese momento significó una limitación más para las opciones terapéuticas existentes.
También en Colombia se describió la presencia de las enzimas VIM-2 y KPC-2 en un mismo aislamiento de P. aeruginosa, el cual pertenecía al clon ST111, considerado un clon exitoso responsable de epidemias en todo el mundo. La diseminación de este clon de alto riesgo se reportó en un estudio del 2014, en el que se incluyeron aislamientos de 16 hospitales de tercer nivel en siete ciudades de Colombia, donde casi todos los aislamientos que portaban el gen bla VIM-2 y pertenecían al clon ST111 de P. aeruginosa y solo un tipo de secuencia ST235 se asociaron con la enzima KPC-2. Las enzimas NDM se han convertido, así mismo, en agentes importantes, dada su capacidad de diseminación y las pocas opciones terapéuticas que hay para ellas. Afortunadamente, la carbapenemasa de clase D OXA-48 aún no es de gran importancia epidemiológica en nuestro país, dada su baja prevalencia en enterobacterias (10). Algunas investigaciones han identificado a K. pneumoniae ST258 y ST51233 y P. aeruginosa ST308, ST235, ST1006 y ST1060 como los principales tipos de secuencia que alojan las enzimas KPC en Colombia (1).
Durante el 2009 y el 2012 se analizaron aislamientos de K. pneumoniae, E. coli, P. aeruginosa . A. baumannii obtenidos en las unidades de cuidados intensivos médico-quirúrgicas de adultos, pediátricas y neonatales de hospitales de alta complejidad en 10 ciudades colombianas, 6 de ellos localizados en Bogotá, 4 en Cali, 3 en Medellín, 3 en Bucaramanga y 2 en Pasto. Los resultados mostraron que de 38.048 microrganismos aislados en esos cuatro años, 24.203 (63 %) correspondieron a bacilos gramnegativos; de ellos, se identificaron 5637 de E. coli, 5302 de K. pneumoniae, 3647 de P. aeruginosa y 1525 de A. baumannii. En general, E. coli fue el microrganismo más frecuentemente aislado, con un promedio anual del 14,8 %. Sin embargo, el número de aislamientos de K. pneumoniae aumentó significativamente hasta ser el microrganismo más frecuente para el 2012 con un 15 % de los casos. P. aeruginosapresentó un comportamiento anual estable con un 9,7 % de los casos. Así mismo, se observó una tendencia al incremento de bacilos gramnegativos multirresistentes y una amplia distribución de las carbapenemasas en Colombia, especialmente KPC, VIM y OXA-23 (8).
En cuanto a las NDM, a partir de la información proporcionada por el Sistema Nacional de Vigilancia Epidemiológica de las Infecciones Asociadas a la Atención en Salud y Resistencia Bacteriana, desde el 2012 hasta septiembre del 2014 se reportaron 58 aislamientos productores de carbapenemasa tipo NDM, de los cuales 3 presentaron coproducción de NDM con otra carbapenemasa. De los 31 aislamientos productores de NDM notificados de enero a septiembre del 2014, 20 fueron en Bogotá, de los cuales 18 fueron P. rettgerri, uno Morganella morgannii y uni K. pneumoniae; 5 en el departamento de Antioquia, de los cuales 2 correspondieron a E. coli, uno A. haemolitycus, uno a Serratia fonticola y uno a K. pneumoniae; 2 en el Valle del Cauca que correspondieron a aislamientos de K. pneumoniae; uno en Santander de P. rettgeri; uno en Cundinamarca, y uno en Nariño, ambos aislamientos de K. pneumoniae, motivo por el cual estas han venido adquiriendo mayor importancia clínica en la actualidad (11).
Según un estudio realizado en Colombia, con 233.120 aislamientos bacterianos y 415.551 registros de fenotipos de resistencia bacteriana, se concluyó que en los servicios que no requieren unidades de cuidado intensivo (UCI) el microrganismo más comúnmente aislado es E. coli, seguido de S. aureus. En las UCI, el microrganismo más frecuentemente aislado es E. coli, igualmente seguido de Staphyococcus aureus y Klebsiella pneumoniae. En cuanto a los fenotipos, se observó que los aislamientos de S. epidermidis resistente a oxacilina, S. aureus resistente a oxacilina, Enterobacter cloacae resistente a cefotaxima y Acinetobacter baumannii resistente a imipenem fueron los fenotipos hallados principalmente en servicios de hospitalización generales; en las UCI, los resultados fueron muy similares (12).
En Medellín y municipios del área metropolitana, los más comúnmente aislados y que presentan mayor resistencia son S. marcescens, E. cloacae y enterobacterias resistentes a carbapenémicos. Otros microrganismos que presentan aumento de la resistencia a cefalosporinas de tercera generación son E. coli (BLEE: 8,4 %) y K. pneumonie (BLEE: 32,6 %), que se encontraron en el 40 % de los aislamientos (13).
Evidencia de actividad microbiológica de ceftazidima-avibactam y experiencia clínica mundial
A continuación, se presenta una serie de estudios que han evaluado la actividad microbiológica de la CAZ-AVI, así como sus resultados en la práctica clínica:
El programa de vigilancia global de la Red Internacional para el Monitoreo de la Resistencia Óptima recolectó aislamientos clínicos de enterobacterias (n = 7665) y P. aeruginosa (n = 1794) de 26 centros médicos en seis países latinoamericanos del 2012 al 2015. Las enterobacterias fueron altamente susceptibles (99,7 %) a la CAZ-AVI, incluido el 99,9 % de los aislamientos negativos a metalobetalactamasa (MBL). El 87,4 % de todos los aislamientos de P. aeruginosa y el 92,8 % de los aislados MBL negativos fueron susceptibles a la CAZ-AVI. La susceptibilidad a la CAZ-AVI varió del 99,4 % al 100 % para enterobacterias, y del 79,1 % al 94,7 % para P. aeruginosa cuando se analizaron los aislamientos por país de origen. La CAZ-AVI inhibió del 99,6 % al 100 % de los aislados de enterobacterias que portaban β-lactamasas, incluidas las BLEE, las AmpC y las carbapenemasas (similares a KPC y OXA-48), así como el 99,7 %, el 99,6 %, el 99,5 % y el 99,2 % de los aislados MBL negativos que muestran fenotipos no susceptibles a ceftazidima, multirresistentes (MDR), meropenem-no susceptibles y resistentes a colistina, respectivamente. Entre los aislados no susceptibles a carbapenémicos de P. aeruginosa (n = 750), el 14,7 % portaba MBL con o sin β-lactamasas adquiridas adicionales; mientras que en la mayoría de los aislamientos (70,0 %) no se identificó ninguna β-lactamasa adquirida. La CAZ-AVI inhibió el 89,5 % de los aislados de P. aeruginosa no susceptibles a carbapenémicos en los que no se detectó β-lactamasa adquirida. En general, los aislamientos clínicos de enterobacterias recolectados en América Latina desde el 2012 hasta el 2015 fueron altamente susceptibles a la CAZ-AVI, incluidos los aislamientos que mostraron resistencia a la ceftazidima, meropenem, colistina o un fenotipo MDR. Se observaron variaciones específicas del país en la susceptibilidad de los aislados de P. aeruginosa a CAZ-AVI (14).
Según otro estudio llevado a cabo en países latinoamericanos, entre ellos Colombia, se evaluaron 2252 aislamientos de enterobacterias, donde se observó que la susceptibilidad a la CAZ-AVI fue del 95,8 %: en primer lugar, E. coli, con un 97,9 %; seguida de S. marcescens, con un 94,5 %; K. aerogenes, con un 93,3 %, y K. pneumoniae, con un 92,1 %. Adicionalmente, para enterobacterias no susceptibles a carbapenémicos, la CAZ-AVI estuvo activa en un 77,5 % (9).
En un estudio in vitro que incluyó 276 aislamientos de K. pneumoniae de pacientes de Europa, Australia y España, no susceptibles a meropenem, el 98,9 % fueron susceptibles a la CAZ-AVI (3). En un segundo estudio, el 67,4 % de los 396 aislamientos de P. aeruginosa no susceptibles a meropenem eran susceptibles a CAZ-AVI (3). Un tercer estudio informó una susceptibilidad del 100 % a la CAZ-AVI entre 133 aislados de enterobacterias no productores de carbapenemasas en los que el mecanismo de resistencia a carbapenémicos fue la producción de BLEE o AmpC junto con alteraciones de porinas (15).
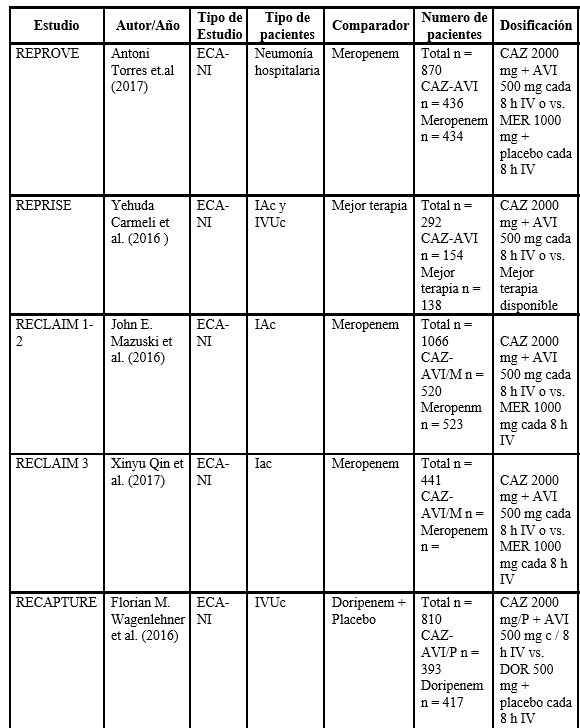
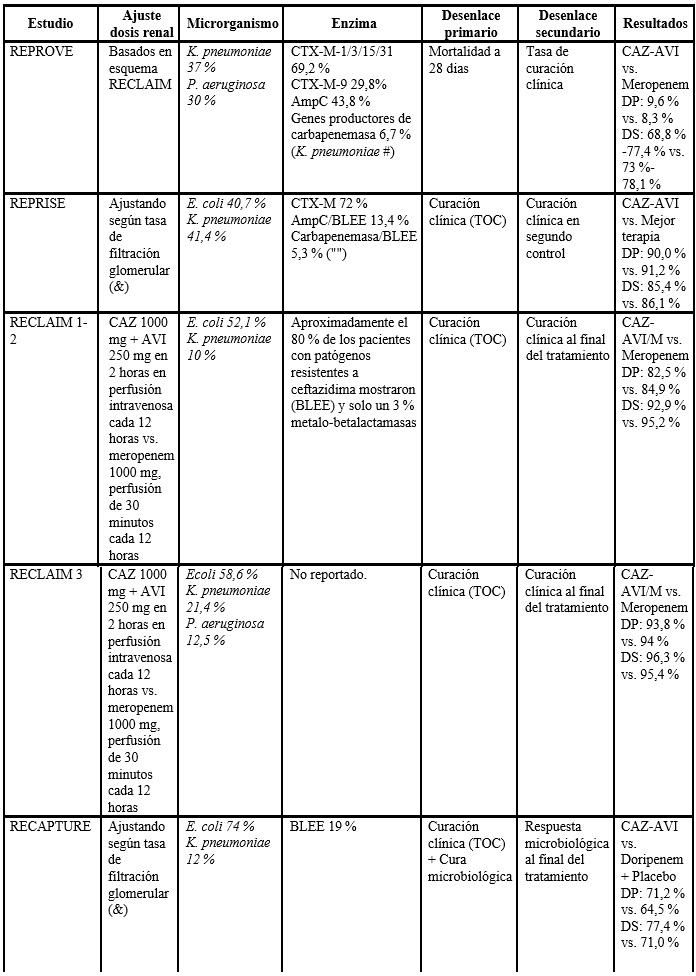
El estudio REPROVE, de fase 3, prospectivo, multicéntrico, con asignación aleatoria y de no inferioridad, evaluó la eficacia, la seguridad y la tolerabilidad de la CAZ-AVI en infusión intravenosa de 2 h (2000 mg/500 mg cada 8 h) comparado con meropenem en infusión intravenosa de 30 min (1000 mg cada 8 h) en pacientes adultos con neumonía adquirida intrahospitalariamente diagnosticada clínicamente o neumonía asociada a la ventilación. Los resultados fueron similares para los dos grupos, con tasas de curación del 68,8 % al 77,4 % para CAZ-AVI frente al 73,0 %-78,1 % de meropenem. Se mostró no inferioridad a meropenem y, por tanto, es una alternativa para uso en estos pacientes (16).
El estudio REPRISE, llevado a cabo entre enero del 2013 y agosto del 2014, comparó la eficacia de la CAZ-AVI con la mejor terapia disponible en pacientes con infecciones abdominales complicadas e infecciones urinarias complicadas por P. aeruginosa. Un grupo de 333 pacientes fueron asignados al azar: 165 al grupo de CAZ-AVI y 168 a la mejor terapia disponible. En 163 (97 %) de 168 pacientes en el grupo de mejor terapia disponible se les administró un carbapenémico, 161 (96 %) como monoterapia. De los pacientes analizados (no todos los asignados en forma aleatoria), la cura clínica se observó en una proporción similar en el grupo de CAZ-AVI (91 % = 140 de 154 pacientes) versus aquel con la mejor terapia disponible (91 % = 135 de 148 pacientes). Los eventos adversos fueron observados en 51 de los 164 pacientes (31 %) del grupo de la CAZ-AVI y 66 de 168 (39 %) del grupo de mejor terapia disponible, la mayoría de los cuales fueron de intensidad leve o moderada. Las alteraciones gastrointestinales fueron los eventos adversos más notificados para ambos grupos (13 % y 18 %, respectivamente) para los pacientes que recibieron CAZ-AVI versus la mejor terapia disponible (16).
En el estudio RECLAIM (17) se comparó el uso de CAZ-AVI más metronidazol versus meropenem más placebo en pacientes con infección intrabdominal complicada confirmada que requerían intervención quirúrgica y antimicrobianos. Fueron asignados en forma aleatoria (en una relación 1:1) para recibir 2000 mg de ceftazidima más 500 mg de avibactam más una infusión de 500 mg de metronidazol versus 1000 mg de meropenem más placebo cada 8 h por un mínimo de cinco días y máximo de 14 días. Aquí se mostró que la CAZ-AVI más metronidazol no fue inferior con respecto a meropenem en la tasa de curación clínica (81,6 % vs. 85,1 %, respectivamente; −3,5 y IC95 % = −8,6-1,6) (18), y en cuanto a los efectos adversos se evidenció que los más frecuentes fueron los trastornos gastrointestinales sin diferencias porcentuales en los demás eventos reportados. No se informaron casos de enterocolitis por Clostridium difficile.
El programa RECAPTURE de fase 3 comparó la eficacia y la seguridad de CAZ-AVI y doripenem en pacientes con infección urinaria complicada, incluida la pielonefritis aguda confirmada microbiológicamente. Fueron aleatorizados 1:1 a ceftazidima-avibactam 2000 mg/500 mg cada 8 h o doripenem 500 mg cada 8 horas (dosis ajustadas para la función renal), con posible cambio de antibiótico oral después de ≥5 días (duración total del tratamiento de hasta 10 días o 14 días para pacientes con bacteriemia). De 1033 pacientes aleatorizados, 393 y 417 tratados con CAZ-AVI y doripenem, respectivamente, fueron elegibles para los análisis de eficacia primarios. El 19,6 % tenía patógenos no susceptibles a ceftazidima. La no inferioridad de la CAZ-AVI frente a doripenem se demostró para los criterios de valoración de la FDA. De resolución sintomática informada por el paciente al día 5: 276 de 393 (70,2 %) frente a 276 de 417 (66,2 %) pacientes (diferencia = 4,0 %), y resolución sintomática combinada/erradicación microbiológica en la prueba de curación: 280 de 393 (71,2 %) versus 269 de 417 (64,5 %) pacientes (diferencia = 6,7 %). La erradicación microbiológica en la prueba de curación se produjo en 304 de 393 (77,4 %) con CAZ-AVI frente a 296 de 417 (71,0 %) pacientes con doripenem (diferencia = 6,4 %; IC95 % = 0,33 %-12,36 %), lo que demostró superioridad a un nivel de significancia del 5 %. Ambos tratamientos mostraron una eficacia similar contra los patógenos ceftazidimas no susceptibles. La CAZ-AVI tenía un perfil de seguridad consistente con el de la ceftazidima sola y fue muy efectiva para el tratamiento empírico de infección urinaria complicada (incluida la pielonefritis aguda), y puede ofrecer una alternativa a los carbapenémicos (19).
Otro estudio retrospectivo de pacientes fue el llevado a cabo en el Centro Médico de la Universidad de Pittsburgh, con bacteriemia por K. pneumoniae resistente a carbapenémicos entre enero del 2009 y febrero del 2017 que recibieron ≥3 días de tratamiento. El K. pneumoniae resistente a carbapenémicos se definió por la resistencia a cualquier carbapenémico, y solo se incluyó el primer episodio de bacteriemia por K. pneumoniae resistente a carbapenémicos. El éxito clínico se definió a los 30 días como supervivencia, resolución de signos y síntomas de infección, esterilización de hemocultivos dentro de los 7 días posteriores al inicio del tratamiento y ausencia de infecciones recurrentes. Se incluyeron 109 pacientes y los regímenes de tratamiento incluyeron CAZ-AVI (n = 13), CB + AG (carbapenémico más aminoglucósido; n = 25), CB + COL (carbapenémico más colistina; n = 30) y otros (n = 41). Las tasas de éxito clínico correspondientes por régimen fueron 85 % (11/13), 48 % (12/25), 40 % (12/30) y 37 % (15/41), respectivamente. CAZ-AVI se administró en monoterapia (n = 8) o en combinación con gentamicina. Las tasas de éxito correspondientes fueron del 75 % (6/8) y del 100 % (5/5), respectivamente. El éxito clínico se logró con mayor frecuencia entre los pacientes tratados con un régimen que incluye CAZ-AVI que con otros regímenes (p = 0,006), incluidos aquellos compuestos por ≥2 agentes activos in vitro (44 % [12/27]; p = 0,02). Las tasas de supervivencia a los 30 y 90 días fueron del 92 % (12/13) entre los pacientes que recibieron regímenes de CAZ-AVI frente al 69 % (66/96) de CB + AG, y el 55 % (53/96) de CB+COL, respectivamente, entre los pacientes que recibieron cualquier otro régimen (p = 0,10 y 0,01, respectivamente). Las tasas de supervivencia fueron del 87,5 % (7/8) y del 100 % (5/5) entre los pacientes que recibieron CAZ-AVI solo o en combinación con gentamicina, respectivamente. El 22 % (24/109) de los pacientes requirió terapia de remplazo renal al inicio del estudio. Entre los pacientes restantes, el 21 % (18/85) y el 34 % (29/85) desarrollaron lesión renal aguda a los 7 días y al final del tratamiento, respectivamente. Al final del tratamiento, las tasas de lesión renal aguda fueron: 18 % (2/11), 44 % (8/18), 57 % (13/23) y 18 % (6/33) para CAZ-AVI, CB + AG, CB + COL y otros regímenes, respectivamente. Las tasas de lesión renal aguda al final del tratamiento fueron del 25 % (1/4) y del 14 % (1/7) para los pacientes que recibieron CAZ-AVI con AG y sin esta, respectivamente. En todos los grupos, las tasas de lesión renal aguda al final del tratamiento fueron significativamente más altas entre los pacientes que recibieron AG o COL (42 % [28/66]) que entre los pacientes que no recibieron estos agentes (5 % [1/19]; p = 0,002) (20).
Otro estudio presentó una serie de casos de pacientes con infecciones causadas por enterobacterias resistentes a carbapenémicos o P. aeruginosa resistente a carbapenémicos, respectivamente, se trataron con terapia de rescate CAZ-AVI. Se incluyeron 36 pacientes tratados en Europa y Australia entre el 2013 y el 2016 infectados con enterobacterias resistentes a carbapenémicos y dos con P. aeruginosa resistente a carbapenémicos. Las infecciones más comunes fueron las intrabdominales. Todos, menos dos pacientes, recibieron otros regímenes terapéuticos antes de iniciar CAZ-AVI, en promedio durante 13 días. El promedio de duración del tratamiento con CAZ-AVI fue de 16 días y la duración mínima del tratamiento fue de 3 días. A 24 pacientes (63,2 %) se les administró la dosis estándar de CAZ-AVI durante todo el tiempo del tratamiento (2 g de ceftazidima-0,5 g de avibactam cada 8 h). Veintiocho pacientes (73,7 %; IC95 % = 56,9-86,6 %) experimentaron curación microbiológica clínica o documentada al final del tratamiento. Nueve de los 13 pacientes (69,2 %) que recibieron CAZ-AVI en monoterapia lograron curación clínica o microbiológica, en comparación con 19 de 25 pacientes (76,0 %) que recibieron un antibiótico concurrente con actividad in vitro contra su patógeno (p = 0,71). Seis pacientes (15,8 %) desarrollaron eventos adversos que se atribuyeron a CAZ-AVI. La fosfatasa alcalina en la sangre aumentó en dos pacientes; náuseas/vómitos, diarrea asociada a Clostridium difficile, convulsiones y desorientación que progresó a estupor ocurrieron en un paciente cada uno. Entre los pacientes infectados con miembros de la familia Enterobacteriaceae, la supervivencia fue mayor en pacientes afectados por productores de carbapenemasa tipo KPC que en aquellos con productores tipo OXA-48: 17 de 23 pacientes (73,9 %) con organismos productores de KPC sobrevivieron hasta el alta, en comparación con 5 de 13 pacientes (38,5 %) con productores de OXA-48 (p = 0,07). Entre los curados se encontraban pacientes con infecciones que no se han incluido en estudios clínicos de CAZ-AVI, como endocarditis y osteomielitis (15).
En otro estudio, 38 pacientes fueron tratados primero con CAZ-AVI y 99 con colistina. La mayoría de los pacientes recibieron agentes efectivos contra K. pneumoniae productora de carbapenemasas adicionales como parte de su tratamiento. Las infecciones del torrente sanguíneo (n = 63; 46 %) y respiratorias (n = 30; 22 %) fueron las más comunes. En pacientes tratados con CAZ-AVI versus colistina, la mortalidad hospitalaria por todas las causas 30 días después de comenzar el tratamiento fue del 9 % frente al 32 %, respectivamente. En un análisis de disposición a los 30 días, los pacientes tratados con CAZ-AVI, en comparación con los tratados con colistina, tuvieron un mejor resultado del 64 % (IC95 % = 57 %-71 %). Los análisis indicaron una superioridad uniforme de CAZ-AVI a colistina (21).
Adicionalmente, un estudio evaluó la actividad clínica de CAZ-AVI contra enterobacterias MDR y P. aeruginosa aislados de los ensayos clínicos de fase III para adultos en pacientes con infección intrabdominal complicada, infección complicada de las vías urinarias o neumonía hospitalaria, incluyendo neumonía asociada al ventilador. En la población agrupada se identificaron 1051 pacientes con enterobacterias MDR y 95 pacientes con aislados de P. aeruginosa MDR. Las tasas de respuesta microbiológica favorables en prueba de curación para todas las enterobacterias MDR y P. aeruginosa MDR fueron del 78,4 % y del 57,1 %, respectivamente, para CAZ-AVI, y del 71,6 % y del 53,8 %, respectivamente, para comparadores. Las proporciones de pacientes con ≥1 aislado de MDR que se curaron clínicamente con prueba de curación fueron similares en CAZ-AVI (85,4 %) y de comparación (87,9 %). Los autores llegaron a la conclusión que CAZ-AVI demostró una eficacia clínica similar a los comparadores predominantemente de carbapenémicos contra enterobacterias MDR y P. aeruginosa, y puede ser una alternativa adecuada a las terapias basadas en carbapenémicos causadas por patógenos gramnegativos MDR (22).
La FDA advirtió que hay muchas confusiones en cuanto a la dosificación de CAZ-AVI, motivo por el cual los pacientes están sobredosificados. Existen ya tres casos de reportes de la literatura de sobredosificación, lo cual aumenta el porcentaje y la incidencia de resistencia, por lo que al formular este medicamento, es necesario un correcto entendimiento de su dosificación. Inicialmente, la CAZ-AVI se aprobó con etiquetas en el frasco y la caja de cartón que muestran las potencias individuales de los dos ingredientes activos (es decir, 2 g/0,5 g); sin embargo, el producto se dosifica según la suma de los ingredientes activos (es decir, 2,5 g) (23).
Ceftazidima-avibactam en niños
Desafortunadamente, la resistencia a los antibióticos β-lactámicos en infecciones pediátricas es un problema de salud pública. Las opciones para el tratamiento por bacterias gramnegativas MDR son generalmente limitadas, dado que se han aprobado menos antibióticos para su uso en niños y hay escasez de los ensayos clínicos con medicamentos pediátricos. Por lo anterior, son un problema sumamente importante de abordar (24).
Los niños son muy vulnerables en la pandemia de enterobacterias MDR, debido a la falta de antibióticos de amplio espectro aprobados para su uso. Una revisión del 2014 sobre el tratamiento de infecciones gramnegativas MDR en niños describió que, en la actualidad, de los 7 fármacos en desarrollo para su empleo en la infección por gramnegativos MDR, solo uno (CAZ-AVI) se probó en niños (24, 25). La evidencia que se presenta a continuación podría ocasionar un cambio en el tratamiento de infecciones pediátricas graves, cuyo tratamiento de referencia es, hasta el momento, un carbapenémico, debido a que es controvertido el uso de fármacos inhibidores de β-lactamasas en el tratamiento de infecciones por bacterias productoras de BLEE (24).
La CAZ-AVI está aprobada por la FDA para el tratamiento de infecciones intrabdominales e infecciones urinarias complicadas en la población pediátrica (niños mayores de 3 años a 18 años). En un estudio publicado en septiembre del 2019 por The Pediatric Infectious Disease Journal, 95 niños con infección urinaria recibieron una o más dosis de CAZ-AVI intravenosa, el patógeno causal más común fue E. coli (92,2 %), con una aparición de efectos adversos en un 53,7 %, siendo graves el 11,9 % de todos ellos; pero solo uno se consideró relacionado con el fármaco. Hubo una tasa de respuesta clínica favorable en un 95 % y permanecieron en un 88,9 % en la prueba de cura. En este estudio se llegó a la conclusión que la CAZ-AVI fue bien tolerada en niños con infección urinaria, con un perfil de seguridad consistente con el de adultos con infección urinaria, y parecía efectivo en niños con infección debido a gramnegativos (26).
Por otro lado, un estudio para evaluar la eficacia de la CAZ-AVI más metronidazol en el tratamiento de infección intrabdominal complicada tomó a niños hospitalizados (≥3 meses a <18 años) con dicha infección, que recibieron CAZ-AVI más metronidazol o meropenem intravenosos durante, al menos, 72 h (9 dosis). Del grupo evaluado, 83 niños fueron asignados al azar y recibieron el fármaco del estudio (61 CAZ-AVI más metronidazol y 22 meropenem). La mayoría (90,4 %) tenía un diagnóstico de apendicitis. Los patógenos gramnegativos predominantes fueron E. coli (79,7 %) y P. aeruginosa (33,3 %). Dos aislamientos de E. coli fueron no susceptibles a ceftazidima. Los eventos adversos ocurrieron en el 52,5 % y el 59,1 % de los pacientes en los grupos de CAZ-AVI más metronidazol y meropenem, respectivamente. Se produjeron efectos adversos graves en el 8,2 % y en el 4,5 % de los pacientes, respectivamente; ninguno se consideró relacionado con los antibióticos. No ocurrieron muertes. Se observaron respuestas clínicas/microbiológicas favorables en el ≥90 % de los pacientes en ambos grupos de tratamiento al final de este. Como conclusión, la CAZ-AVI más metronidazol fue bien tolerada, con un perfil de seguridad similar a la ceftazidima sola, y pareció ser efectiva en pacientes pediátricos con infección por gramnegativos, incluidas cepas no susceptibles a ceftazidima (27).
Discusión
La proporción de infecciones por bacterias gramnegativas MDR aumenta cada día; pero, además, hay unas opciones de tratamiento muy limitadas que hacen necesario emplear otras, como colistina, fosfomicina, tigeciclina y aminoglucósidos, con gran cantidad de efectos adversos y aumento en sus tasas de resistencia, dado su uso irracional. En esta revisión se presentó evidencia que sustenta la premisa con la cual fue introducida la CAZ-AVI en la práctica clínica: ser una elección menos tóxica para el tratamiento de infecciones graves por gramnegativos MDR, incluidos los resistentes a carbapenémicos.
Numerosos estudios han demostrado que la CAZ-AVI tiene una actividad potente contra diferentes especies de gramnegativos, entre estas no fermentadores como P. aeruginosa. En un estudio se evaluó la actividad de la CAZ-AVI y otros agentes comparadores frente un panel de organismos resistentes seleccionados que comprendían 36.380 de la familia Enterobacteriaceae y 7868 aislados de P. aeruginosa. Los aislamientos fueron recolectados en 94 hospitales de Estados Unidos y se caracterizaron en términos de determinantes genéticos de resistencia a cefalosporinas de tercera generación (por ejemplo, presencia de genes codificantes para BLEE) y resistencia a carbapenémicos (por ejemplo, presencia de genes codificantes para carbapenemasas). De acuerdo con el punto de corte establecido por la Instituto de Estándares Clínicos y de Laboratorio, de ≤8 μg/ml, el 99,9 % de todos los aislamientos pertenecientes a la familia Enterobacteriaceae fueron susceptibles a la CAZ-AVI y, así mismo, fue muy activo contra bacterias MDR (n = 2953). Solo 23 de las 36.380 cepas de enterobacterias (0,06 %) no fueron susceptibles a la CAZ-AVI, entre ellas 9 productoras de MBL y 2 cepas productoras de KPC con alteración de la porina. Las 12 cepas restantes mostraron resultados negativos para todas las β-lactamasas analizadas. Igualmente, la CAZ-AVI mostró una potente actividad contra P. aeruginosa, incluidos los aislados MDR, e inhibió el 71,8 % de aislamientos no susceptibles a meropenem, piperacilina-tazobactam y ceftazidima (n = 628). Este estudio, por tanto, demostró que la CAZ-AVI tiene una actividad potente contra una gran acumulación (n = 44.248) de bacilos gramnegativos contemporáneos aislados de pacientes de Estados Unidos (28).
En un estudio realizado en el 2012, en Estados Unidos, acerca de la actividad antimicrobiana de la CAZ-AVI, se demostró que fue el agente más activo probado contra enterobacterias con una MIC 50/90 de 0,12/0,25 µg/ml. Entre las especies bacterianas estudiadas se incluyeron K. pneumoniae, K. oxytoca, P. mirabilis, M. morganii, C. koseri, C. freundii, S. marcescens . Providencia spp. Como era de esperarse, las cepas de fenotipo BLEE fueron susceptibles a la CAZ-AVI, en la cuales se encontró que CTX-M 15 fue la BLEE más comúnmente hallada, seguida de SHV y KPC (29).
Otros estudios han documentado el impacto de microrganismos productores de carbapenemasas tipo MBL en la susceptibilidad global de los gramnegativos a la CAZ-AVI. Tal es el caso de un estudio realizado en países europeos desde el 2012 hasta el 2015, en el cual se observó que la susceptibilidad a la CAZ-AVI oscila entre el 74,6 % y el 99,6 %, siendo menor en países donde las MBL se encontraban con mayor frecuencia, como República Checa, Grecia, Rumania y Rusia (14, 30). La circulación de gramnegativos productores de MBL es, por tanto, una limitación importante para el uso de CAZ-AVI y constituye un problema en Colombia, debido a que, como se mencionó, en nuestro país, además de una alta prevalencia de enzimas tipo KPC, hay una circulación importante de MBL. Por lo anterior, los estudios de epidemiología molecular son necesarios para conocer la frecuencia con la que se están presentando infecciones por productores de MBL, y ante la sospecha, y dada la falta de acción de AVI para inhibir las carbapenemasas tipo MBL, es absolutamente imperativo detectar este mecanismo de resistencia antes de suministrar la CAZ-AVI como terapia. Lo anterior limitaría el uso de la CAZ-AVI como tratamiento empírico.
Por otro lado, numerosos estudios han evaluado la eficacia clínica de la CAZ-AVI tanto para el tratamiento de diferentes tipos de infecciones —entre ellas las complicadas de las vías urinarias, intrabdominales, neumonías asociadas al ventilador—, así como las dirigidas a diferentes agentes etiológicos como enterobacterias y P. aeruginosa resistentes a carbapenémicos. Los estudios presentados en este trabajo demuestran que en el caso de infecciones intrabdominales complicadas la CAZ-AVI no es inferior a la mejor terapia disponible en la actualidad y que, además, la incidencia de efectos adversos con este fármaco es mucho menor que con otros, como los aminoglucósidos, la fosfomicina y la colistina.
Dentro de las limitaciones de la CAZ-AVI se encuentra su escaso empleo en diferentes tipos de focos infecciosos. La evidencia es más robusta en infecciones complicadas de vías urinarias o intrabdominales, con un menor número de estudios en otros escenarios, como infecciones del torrente sanguíneo, del sistema nervioso central o neumonía asociada al ventilador (31), que en ocasiones se limita a presentaciones de casos. En algunos tejidos, como el pulmonar, la penetración de la CAZ-AVI es cercana al 30 %, por lo que no es claro si en estos casos es necesario un ajuste de la dosis (32).
Otra limitación importante es la resistencia antimicrobiana, como la descrita en carbapenemasas tipo NDM. Se ha planteado su asociación con aztreonam; sin embargo, mutaciones en PBP3 pueden conferir resistencia a este esquema; además, su asociación con carbapenémicos no ha demostrado actividad sinérgica (33, 34). La actividad hidrolítica de la ceftazidima puede limitar el uso de la CAZ-AVI en infecciones por microrganismos con blaCTX-M-14 y blaOXA-48. En el caso de enzimas KPC-2, pueden llegar a hidrolizar el avibactam y favorecer la resistencia bacteriana (35).
Una limitación más se trata de la resistencia emergente durante el tratamiento con CAZ-AVI, descrito por blaKPC-3, gracias a plásmidos (36), o cambios en la secuencia de aminoácidos (37), y por OXA-539, producto de la duplicación de residuos de aminoácidos en aislamientos iniciales de blaOXA-2, que le otorgan un espectro de resistencia extendido (38). Su acción limitada contra anaerobios y la frecuente prevalencia de cepas productoras de β-lactamasas en estos microrganismos (80 %-100 %) hace necesario asociarlo a otros antimicrobianos en contextos específicos como infecciones intrabdominales (39).
Por último, se han descrito eventos adversos (infrecuentes y de baja severidad), como náuseas, diarrea y hallazgo de Coombs directo positivo, con seroconversión en el 3,2 %-20 % y sin documentar hemólisis. Existe riesgo de colitis por Clostridium difficile, aun cuando en una proporción baja de pacientes (40). Se debe ajustar su dosis a la función renal, ya que puede llevar a un aumento en la exposición al medicamento e incrementar el riesgo de neurotoxicidad (tremor, mioclonía, estatus epiléptico no convulsivo, convulsión, encefalopatía y coma). Algunos efectos adversos (como la insuficiencia renal aguda) están relacionados con la dosis administrada de CAZ-AVI. Sin embargo, la proporción en que estos eventos adversos aparecen durante tratamientos con CAZ-AVI es mucho menor que la observada en otros regímenes. Adicionalmente, las tasas de mortalidad asociada con los regímenes de tratamiento para microrganismos resistentes a carbapenémicos son considerablemente altas, hasta un 57 % para colistina en monoterapia, hasta un 80 % para tigeciclina en monoterapia, hasta un 64 % para la combinación colistina-tigeciclina, hasta un 50 % para la combinación gentamicina-tigeciclina y hasta un 67 % para la terapia combinada de colistina y un carbapenémico (16). Lo anterior demuestra la necesidad de implementar nuevas terapias eficaces y seguras como la CAZ-AVI.
Adicionalmente, se mostró que solo la CAZ-AVI se ha evaluado para el tratamiento de infecciones por gramnegativos en niños. Hasta el momento, en esta población, la CAZ-AVI presenta tasas similares de éxito clínico y microbiológico en comparación con las terapias estándar, como imipenem (18).
Los datos recopilados en las publicaciones incluidas en este artículo demuestran, por tanto, la eficacia de la CAZ-AVI para el tratamiento de infecciones causadas por enterobacterias y P. aeruginosa resistentes a carbapenémicos, tanto en población adulta como en población pediátrica. No obstante, y tal y como lo señalan una serie de estudios, el mecanismo molecular responsable de la resistencia a carbapenémicos sí influye en la eficacia de la CAZ-AVI. Por ejemplo, se ha documentado que la supervivencia es mayor en pacientes infectados por enterobacterias productoras de KPC que en aquellos con infecciones por productores de OXA-48 (31). Afortunadamente, la circulación de enterobacterias productoras de OXA-48 es baja en Colombia.
Además, es importante el seguimiento de la epidemiología molecular, debido a que ya hay evidencia de un cambio en la población tras la introducción de la CAZ-AVI en la práctica clínica. En un estudio realizado en Grecia se observó una disminución de enterobacterias productoras de KPC y un aumento de las productoras de MBL (4). Dado que la presencia de MBL imposibilita el uso de casi todos los β-lactámicos y que, por tanto, las opciones de tratamiento efectivas restantes son altamente tóxicas (e. g. colistina), este estudio es una alerta sobre las consecuencias que puede traer el uso indiscriminado de la CAZ-AVI.
Entre las limitaciones de nuestro estudio se destaca que es escasa la información en Colombia acerca de resistencia antimicrobiana y sobre el uso de la CAZ-AVI, lo cual limita la profundización sobre el comportamiento de este medicamento en nuestra población.
Conclusiones
La CAZ-AVI se ha convertido en una excelente estrategia terapéutica para el tratamiento de infecciones por enterobacterias resistentes. Si bien es limitada la experiencia con el fármaco y es bajo el número de ensayos clínicos con un número importante de pacientes, la evidencia actual sugiere que este brinda mayor seguridad y eficacia similar, comparado con los antiguos regímenes de combinaciones, que condicionan un alto riesgo de eventos adversos. Se debe profundizar en la caracterización de la resistencia bacteriana por medio de métodos moleculares, con el fin de establecer la mejor estrategia antibiótica y, por tanto, el uso correcto de este nuevo antibiótico. Finalmente, hay que tener cautela con infecciones en pacientes hematológicos e inmunosuprimidos, así como en infecciones óseas y del sistema nervioso central, dado que es más escasa la experiencia en estos contextos.