Introducción
La estimulación cordonal posterior (SCS, por sus siglas en inglés) es un procedimiento neuroquirúrgico llevado a cabo, por primera vez en, 1967, por los doctores Norman Shealy y Thomas Mortimer en la Clínica Gundersen, adscrita a la Universidad de Wisconsin (Estados Unidos). Ellos implantaron un sistema de estimulación eléctrica continua poniendo un electrodo en contacto de los cordones posteriores de la médula y conectándolo a un generador de pulso que enviaba ondas eléctricas directamente a las neuronas medulares para controlar los estímulos que generan dolor crónico. En ese momento se consideraba que los estímulos eléctricos en las neuronas de los cordones posteriores (sustancia blanca) de la médula ejercía un efecto inhibidor sobre la vía nociceptiva en los cuernos posteriores (sustancia gris). Actualmente, sabemos que el estímulo eléctrico tiene la capacidad de modular toda la respuesta nociceptiva y no está limitada al cordón posterior (1, 2, 3, 4, 5).
Evolución histórica
La evolución histórica del uso de la electricidad para el control del dolor se remonta a las civilizaciones antiguas que ya utilizaban las descargas eléctricas de algunos animales acuáticos. Colocaban el animal sobre el área del dolor de los pacientes y estos presentaban una mejoría clínica de sus síntomas (1, 5, 6):
En las tumbas egipcias de la quinta dinastía (2750 a. C.) se encuentran grabados que ilustran el uso del Malapteruselectricus (pez gato), el cual abundaba en las riveras del río Nilo, para el tratamiento del dolor. Incluso, la palabra usada para identificar ese grupo de peces era Vagk, cuya traducción podría corresponder actualmente con el término disestesia, que se asocia con la sensación producida por el contacto de la electricidad.
En la civilización griega, Marcellus de Sida (siglo II a. C.) escribió en el tomo 12 de un compendio de 42 volúmenes relacionados con la medicina las características curativas de los peces y su capacidad para controlar el dolor después de las descargas eléctricas. Estas descripciones estaban relacionadas específicamente con el Torpedo marmorata (pez torpedo), el cual se encontraba en las costas griegas.
En el gran Imperio romano también era bien conocido el uso de las descargas eléctricas para el control del dolor. En el año 46 a. C., en Roma, se publicó la primera descripción clínica de un paciente tratado con esta técnica. Scribonius Largus se refirió a un ciudadano de Nerón, llamado Antheros, quien sufría de dolores intensos en una extremidad (lo que podía corresponder a una artritis gotosa). Él señaló que, al introducir la extremidad en un balde con anguilas, la descarga eléctrica permitía un control de los síntomas. En esta se plantea ya un fenómeno clínico ampliamente estudiado en la actualidad, el denominado postefecto. Scribonius Largus narró cómo la mejoría del dolor era inmediata y, además, se extendía en el tiempo, incluso después de haber retirado la extremidad del contacto con los animales.
Actualmente, este efecto se describe como la capacidad que tiene la SCS de permitir una mejoría clínica, incluso después de apagar el estimulador, lo que permite recomendar al paciente una estimulación intermitente. Sin embargo, tal descripción ha generado controversia respecto a su autoría y hay quienes señalan que fue realmente Dioscórides, cirujano de la armada de Nerón, quien desarrolló estos conceptos. El uso de la electricidad en medicina fue señalada por grandes autores, como Cayo Plinio Segundo, también conocido como “Plinio el Viejo”, quien en su libro Historia natural hizo referencia a estos tratamientos. Plinio es considerado, igualmente, el pionero de la “salud ocupacional”, al describir ampliamente las enfermedades ocupacionales en los esclavos de la época. Igualmente, Plutarco de Queronea, en su libro Moralia, señaló la utilidad de la raya en el tratamiento del dolor (1, 6, 7, 8).
La Edad Media estuvo marcada por un oscurantismo místico, donde fue muy limitado el papel de la electricidad. Hago referencia solamente a la interpretación mágica-religiosa que se le daba a la polaridad eléctrica encontrada en algunos metales y minerales, utilizada solo por embaucadores que buscaban engañar a pacientes y poblaciones ingenuas y reprimidas. Fue solo hasta el Renacimiento y el Romanticismo cuando la ciencia médica evolucionó con el desarrollo de la anatomía y la fisiología. Igualmente, avanzaron la ciencia y la tecnología de la mano del descubrimiento de la electricidad estática y dinámica. Son muchos los científicos que permitieron el desarrollo de la electricidad, pero menciono solo algunos (6, 7, 9, 10, 11, 12):
William Gilbert (1600): fue el médico de la reina Elizabeth II y de Jorge I de Inglaterra. Desarrolló el término electricidad y describió las capacidades eléctricas de la tierra y su polaridad. Identificó la electricidad estática que se producía al frotar algunos objetos, entre otras cosas (6, 13).
Otto de Guericke: en 1650 desarrolló un equipo que era capaz de reproducir electricidad estática.
Johann Gottlob Kruger (1715-1759) y Christian Gottlieb Kratzenstein (1723-1795): fueron los primeros, en 1744, en darle un uso terapéutico al aparato de Guericke para el tratamiento de algunas formas de dolor.
Von Kleist (1745) desarrolló un condensador eléctrico que producía electricidad dinámica.
Jacob Hermann Klyn (1746): utilizó el condensador en pacientes con parálisis.
John Wesley: fue el fundador del metodismo y era un fanático de la electroterapia. Escribió varios libros relacionados con el tema.
Alexander Volta (1800): desarrolló la pila eléctrica (6,14).
Duchenne de Boulogne: fue un neurólogo francés quien dedicó gran parte de su vida no solo a la electroanestesia (término que él desarrolló), sino a la integración de las imágenes en la historia clínica y en la medicina. Existen descripciones e ilustraciones clásicas del estudio de la expresión facial humana y fotos de muestras histológicas y patológicas de pacientes diagnosticados y tratados. Utilizó la estimulación eléctrica para el tratamiento del dolor facial y para la rehabilitación de la parálisis. Publicó cuatro obras ilustradas con fotografías y grabados, entre las cuales se destacan: Album de photographies pathologiques y De l’electrisation localisee et de son application á la physiologie, a la pathologie et a la therapeutique. En 1999, sus imágenes fueron objeto de una exposición en la Escuela de Bellas Artes de Paris (6,15).
Tanto en Estados Unidos como en Europa, el siglo XIX vio la utilización de la electricidad para realizar extracciones dentales y para la estimulación de nervios periféricos en pacientes con parálisis. Menciono a Goldin Bird y a Althaus, en Inglaterra; a Francis, en Filadelfia; a Oliver en Búfalo, y Gomart, en Boston (6, 16).
A comienzos del siglo XX, Nagelschmidt desarrolló el término diatermia quirúrgica (1909), como la aplicación de la electricidad para coagular y tratar los tejidos durante procedimientos quirúrgicos.
Bases fisiológicas
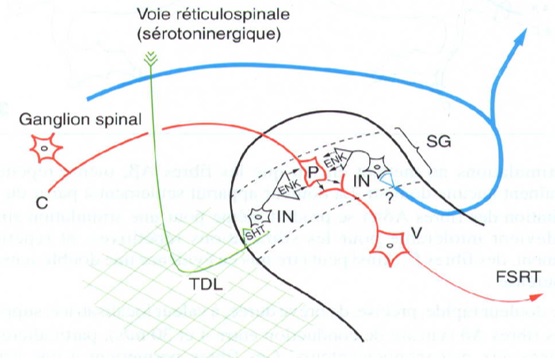
Las bases fisiológicas para entender el funcionamiento de la estimulación eléctrica continua de la médula como tratamiento del dolor las estableció Santiago Ramón y Caja a comienzos del siglo XX. En 1906, él describió la rama colateral recurrente (RCR) como una fibra que se desprende de las vías propioceptivas de conducción de los estímulos de la sensibilidad profunda en los cordones posteriores de la médula y que penetra por el aspecto medial del cuerno posterior de la médula, para entrar en contacto con la vía nociceptiva y generar un efecto inhibidor. Esta RCR es la explicación anatómica del efecto analgésico de la aplicación de presión sobre el área dolorosa, sobre todo en situaciones cotidianas de dolor agudo.
Cuando una parte del cuerpo sufre un dolor agudo por un trauma contundente, el organismo responde con un acto casi que involuntario de masaje profundo y presión, que permite aliviar el dolor. Esta situación habitual se explica por el efecto inhibidor de la vía propioceptiva, a través de la RCR sobre la vía nociceptiva. Igualmente, esta descripción clásica tuvo la gran dimensión de proyectarse en el futuro para seleccionar como blanco de acción la electricidad de los cordones posteriores, entendidos como el sitio anatómico de concentración de fibras de conducción de estímulos de la sensibilidad profunda y que pueden ejercer un efecto directo de equilibrio y de compensación sobre la vía nocicpetiva hiperexcitada por estímulos dolorosos (1, 2, 6, 16, 17, 18) (figura 1).
Fuente: esta figura fue obsequiada personalmente por el Dr. Marc Sindou, neurocirujano francés con reconocimiento mundial, especialista en Neurocirugía Funcional, con quien yo tuve la oportunidad de trabajar durante dos años de mi posgrado en neurocirugía y dos años de subespecialización.
Figura 1. Ilustración que muestra de una manera esquemática la localización y la función de la rama colateral recurrente de Ramón y Cajal. En la imagen observamos en línea negra el cuerno posterior de la médula; en líneas azules, las fibras propioceptivas de la sensibilidad profunda, y en líneas rojas, las fibras de la sensibilidad superficial, especialmente nociceptivas. Ramón y Cajal describió, a comienzos del siglo XX, la presencia de una rama (inhibitoria-azul) que se desprende de las fibras de la sensibilidad profunda (penetran por el cordón posterior a la médula), que entra en contacto con las capas más superficiales del cuerno posterior (nociceptivas-rojo), que penetran por su aspecto medial. Esa rama activa interneuronas inhibitorias que modulan la respuesta nociceptiva.
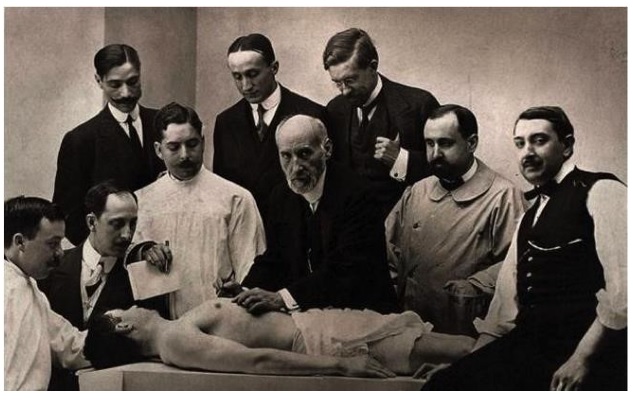
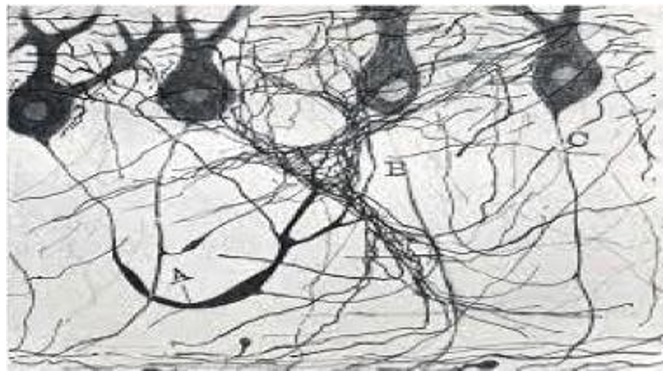
Ramón y Cajal fue un neurocientífico brillante, premio Nobel de Medicina y artista. Desde sus inicios se vio atraído por el arte y el desarrollo de la fotografía. Ilustró su biografía con imágenes clásicas, entre las cuales resalto la fotografía denominada “Disección de anatomía”, y las extensas ilustraciones sobre la descripción de la anatomía del sistema nervioso. Dichas imágenes observadas simplemente como una mezcla de colores y de trazos son obras de arte dignas de los más grandes museos; además de ser grandes avances en el conocimiento del funcionamiento del sistema nervioso. En el siglo XXI, una galería de arte de Manhattan (Nueva York) recogió sus obras en una exposición titulada The Beautiful Brain. Su interés por la fotografía hizo que sea reconocido como uno de los pioneros de la fotografía a color en Europa (figuras 2A y 2B).
Fuente: esta foto fue sacada de la publicación libre en internet sobre la vida de Ramón y Cajal, que realizó el periódico El País de España.
Figura 2A. Ramón y Cajal fue pionero de las neurociencias y también permitió el desarrollo de la fotografía. Esta imagen, muy conocida y denominada “Disección de anatomía”, ilustra una de las sesiones del científico junto con sus colegas. En ella ilustró no solo su capacidad científica-médica, sino la importancia que le daba al registro gráfico de su vida y de su actividad científica.
Fuente: tomada de la página en internet libre www.sid.cu
Figura 2B. Esta imagen busca resaltar la calidad de los dibujos realizados por Ramón y Cajal, quien no solo era un neurocientífico, sino también un artista. No busco que el lector conozca la histología del sistema nervioso al incluir esta imagen; al contrario, que aprecie sus capacidades artísticas. Las ilustraciones de Ramón y Cajal fueron no solamente avances histológicos.
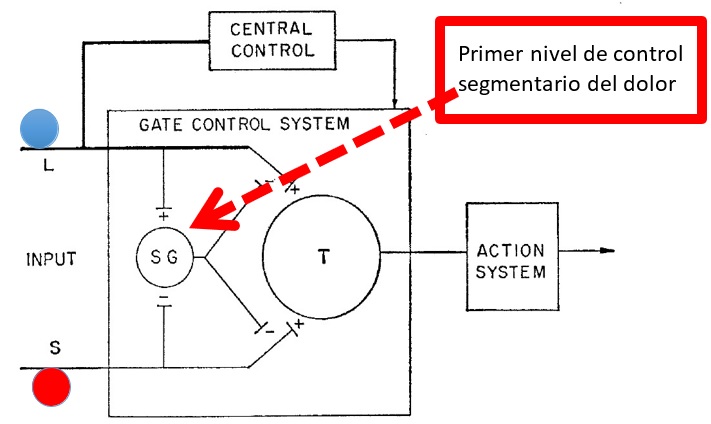
Después de Ramón y Cajal, la historia del desarrollo del concepto básico para el planteamiento de la SCS como tratamiento del dolor hace que mencione a Ronald Melzack y a Patrick Wall. El primero fue es un neuropsicólogo canadiense y Wall era un neurólogo inglés. Ambos coincidieron en el Instituto Tecnológico de Massachussets, donde plasmaron años de estudio del dolor en el planteamiento de su teoría de la compuerta. Este artículo relacionado fue publicado en la revista Science de 1965, en el volumen 150 y el número 3699. Ha sido muy importante en la historia de la medicina moderna, al ser el trabajo más referenciado por otros autores. En este plantearon que en el cuerno posterior de la médula existe una zona de control segmentario del dolor, a nivel de las capas más superficiales de Rexed, donde entran en contacto competitivo las fibras de la sensibilidad profunda (inhibitorias) y las fibras de la sensibilidad superficial (excitatorias y nociceptivas). En este sitio, la intensidad del estímulo de las fibras propioceptivas va a determinar la severidad (intensidad) del dolor que va a ser conducido a través de las vías ascendentes en el tracto espinotalámico lateral y medial. Este concepto se apoya inevitablemente en la descripción anatómica de Ramón y Cajal, a partir de ese contacto estrecho entre fibras propioceptivas (inhibitorias) y fibras nociceptivas, todo ello en la sustancia gelatinosa de Rolando. Esta teoría, junto con las descripciones clásicas de Ramón y Cajal, resalta la importancia de los cordones posteriores y sus fibras en el mecanismo de control inhibitorio del dolor (1 ,6, 19, 20, 21, 22) (figuras 3A, 3B y 3C).

Fuente: esta fotografía fue tomada directamente por el autor del artículo (JCA).
Figura 3A. El artículo publicado por Melzack y Wall, relacionado con los principios básicos del entendimiento del dolor fue tan importante que me parece relevante, como evidencia histórica, incluir en este trabajo. La foto tomada por el autor (JCA) de la portada de la revista en que dicho artículo fue publicado. No busco con dicha imagen ampliar el conocimiento del lector respecto al manejo del dolor, sino permitir asociar una imagen con el evento histórico de la descripción de la teoría de la compuerta. Hay que recordar que es el artículo más referenciado en la historia de la medicina.

Fuente: esta fotografía fue tomada directamente por el autor del artículo (JCA).
Figura 3B. De la misma forma que la figura anterior, esta imagen se incluye en este trabajo como documento histórico del importante desarrollo del conocimiento hecho por Melzack y Wall. No pretendo en ningún momento utilizarla como respaldo de un principio fisiopatológico, sino solo resaltar un documento histórico-neuropático.
Fuente: esquema tomado del artículo original de Melzach y Wall, modificado por el autor.
Figura 3C. Esquema original de la teoría de la compuerta, modificado por el autor para ilustrar uno de los principios del entendimiento del dolor. La teoría de la compuerta se trata de un balance competitivo inhibitorio (azul; modificado por el autor) y excitatorio (rojo; modificado por el autor), localizado en las capas mas superficiales del cuerno posterior de la médula. Es el primer nivel de control segmentario del dolor. SG: sustancias gelatinosas de Rolando: T: células Y.
Esta primera corriente del análisis del desarrollo de la estimulación medular se apoya en el concepto básico y fisiopatológico del dolor. Una segunda vía de análisis se respalda en el desarrollo técnico y en el uso de los estímulos eléctricos sobre el sistema nervioso. Así, de acuerdo con Thompson, en la Universidad de California, al aplicar corriente alterna sobre el tronco de un nervio periférico, se produce hipoestesia y pérdida de la sensibilidad mientras el estímulo eléctrico está en contacto de las fibras. Incluso indicó que el incremento en el voltaje produce anestesia. En 1940, Paraf publicó una serie de 127 pacientes con dolor, tratados con estimulación eléctrica aplicada sobre el nervio periférico (1, 6, 23, 24).
En 1965, E. A. Spiegel y H. T. Wice, quienes son ampliamente conocidos por sus técnicas de estereotaxia y de estimulación cerebral profunda para el tratamiento de los movimientos anormales, desarrollaron en su laboratorio un sistema de estimulación eléctrica que se podía aplicar a los nervios y era muy parecido al Electretreat, que se usó ampliamente más adelante. Ellos nunca usaron este aparato en humanos; pero W. H. Sweet y J. G. Wepsic sí los utilizaron para ser implantado sobre los nervios periféricos de pacientes con dolor para su tratamiento. Este trabajo salió publicado en 1968, en la revista Transactions of the American Neurological Association (revista americana que fue publicada entre 1875 y 1981) con el título “Treatment of Chronic Pain by Stimulation of Fibers of Primary Afference Neuron”.
Sin embargo, solo hasta el 24 de marzo de 1967 Clyde Norman Shealy y Thomas Mortimer implantaron el primer sistema de estimulación medular (cordones posteriores) para el tratamiento del dolor crónico en una mujer de 70 años de edad, quien se encontraba en el hospital luterano con diagnóstico de un carcinoma broncogénico, el cual ya le había producido lesiones metastásicas en la pleura y en el hígado. La paciente sufría de un dolor mixto, con componente somático en la reja costal y visceral en la parte baja del tórax y superior del abdomen. Ellos realizaron una laminectomía extendida que incluía T2 y T3 y colocaron un electrodo de estimulación medular que fue suturado sobre la duramadre a nivel del surco medio posterior y los cordones posteriores (en la médula). Ese mismo día, a las 6:00 p. m., el electrodo fue conectado a un generador eléctrico externo y se inició el proceso de fase de prueba de estimulación medular. Usaron como parámetros una frecuencia de 10-50 pulsos por segundo; 0,8 a 1,2 voltios; y 0,36 a 0,52 miliamperios. Esta estimulación le producía a la paciente parestesias sobre el hemitórax afectado y una mejoría superior al 50 % del dolor. Estos resultados le permitieron a Shealy convencer al director de la empresa de tecnología médica Medtronic de desarrollar un sistema completamente implantable de estimulación medular (1, 6, 20, 21, 24, 25, 26, 27).
El concepto de inhibición/excitación
De manera general, el sistema nervioso funciona a partir de un equilibrio entre el mecanismo de excitación y los mecanismos de inhibición, es decir, para que exista un funcionamiento normal de un individuo con un desempeño neurológico normal se requiere dicho equilibrio (inhibición/excitación). Cuando dicho balance se pierde o se altera y comienza a predominar uno sobre otro, aparecen las patologías neurológicas. Es la explicación más simple de la epilepsia, de los movimientos anormales, la espasticidad y, sobre todo, del dolor crónico. Este balance inhibición/excitación es el reflejo de un equilibrio eléctrico con potenciales de acción de fibras excitatorias y potenciales de acción de fibras inhibitorias; pero igualmente existe un concepto húmedo, expresado a partir de sustancias y neurotransmisores, inhibidores y excitadores. Es el desequilibrio en neurotransmisores excitatorios y neurotransmisores inhibitorios que van finalmente a expresarse como la aparición de un síntomas, un signo y una patología.
De forma simplista, podemos considerar que los pacientes con dolor crónico tienen un desequilibrio en la concentración de GABA (inhibidor) y glutamato (excitador) como el causante de la expresión clínica. Sabemos que dicho desequilibrio no se limita a un solo neurotransmisor, sino que muchas sustancias van a participar y cada una con sus respectivos receptores y sus interacciones. En este contexto, podemos integrar el sistema de estimulación medular como un tratamiento que va a permitir restablecer el equilibrio inhibición/excitación. Estimula de manera activa las fibras y los neurotransmisores inhibitorios, restableciendo el equilibrio y permitiendo una mejoría clínica de los síntomas de dolor (28, 29, 30, 31, 32, 33, 34) (figura 4).

Fuente: fotografia original tomada por el autor JCA.
Figura 4. Esta fotografia fue tomada por el autor e incluida en este trabajo para ilustrar de manera agradable un concepto desarrollado por JCA para entender no solo la aparición de dolor crónico, sino otras patologías del sistema nervioso. Así como en la imagen vemos el equilibrio fotográfico de la imagen de la “garza de cuello blanco”, su imagen real y su reflejo, así debe ser el equilibrio entre los mecanismo de inhibición y el de excitación para mantener el sistema nervioso sano. Cuando se pierde el equilibrio entre los mecanismos de inhibición y de excitación en el sistema nervioso, aparecen ciertas patologías, entre las cuales me permito mencionar: epilepsia, movimientos anormales, parkinson, distonías, espasticidad, dolor, entre otras El tratamiento de estas debe ir dirigido a restablecer el equilibrio.
Electricidad
La electricidad es una forma de energía que se manifiesta por el desplazamiento de electrones en la capa externa de los átomos que hay en la superficie de un material conductor. Esta electricidad se puede graficar como una onda que se desplaza sobre un material conductor. Esa onda y sus componentes nos permiten entender los parámetros modificables cuando implantamos un sistema de estimulación medular. En la onda podemos describir una amplitud, un ancho de pulso y una frecuencia. La amplitud está relacionada con la altura de la onda y corresponde a su intensidad (se expresa en voltios). A mayor voltaje, mayor estímulo eléctrico y mayor sensación de parestesias, producidas por el sistema de estimulación medular. Voltajes muy altos producen estimulación motora y pueden llegar a ser muy molestos. El ancho del pulso corresponde al tiempo de exposición de la onda y se expresa en microsegundos. A mayor ancho de pulso, mayor área de cobertura del estímulo eléctrico. La frecuencia es el número de ondas en el tiempo. Se mide en hertz y corresponde a la suavidad con la cual se percibe el estímulo. De manera general, la estimulación eléctrica aplicada sobre una fibra nerviosa va a producir un potencial de acción, interpretado como una señal neural de estimulación que de manera directa va a producir la liberación de neurotransmisores (2, 7, 8, 10, 12, 16, 19, 20, 32, 35, 36, 37) (figura 5).
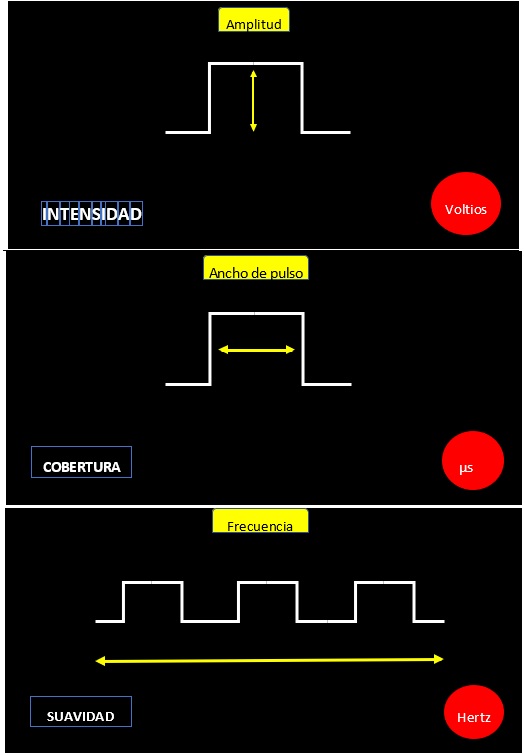
Fuente: esta imagen fue en su totalidad desarrollada por el autor JCA.
Figura 5. Onda eléctrica y las variaciones en evaluación (figura superior). La amplitud de la onda eléctrica se mide en voltios y se ve reflejada en la estimulación medular, en la intensidad del estímulo. A mayor amplitud, es decir, mayor voltaje, mayor intensidad de la sensación producida por la estimulación medular (figura intermedia). El ancho de pulso de la onda eléctrica se mide en microsegundos y se ve reflejada en la estimulación medular, en la cobertura del estímulo, es decir, qué parte del cuerpo va a sentir la estimulación medular. A mayor ancho de pulso, es decir, más microsegundos, mayor área corporal de la sensación producida por la estimulación medular (figura inferior). La frecuencia de la onda eléctrica se mide en hertz y se ve reflejada en la estimulación medular, en la suavidad del estímulo. A mayor frecuencia, es decir, mayor cantidad de hertz, mayor suavidad de la sensación producida por la estimulación medular.
Mecanismo de acción
El mecanismo de acción de la SCS es complejo. El sistema nervioso funciona como una estructura dinámica en un contexto funcional y no anatómico, es decir, lo que suceda en los receptores se va a ver reflejado en la corteza cerebral y, por supuesto, a todo lo largo de los nervios periféricos, plejos, raíces, tractos y estructuras cerebrales. Por eso, no se puede entender el mecanismo de acción de la SCS como un evento aislado y limitado a los cordones posteriores de la médula en un concepto exclusivamente anatómico. El hecho de aplicar electricidad sobre una fibra y producir un potencial de acción, implica que se está activando de manera fisiológica todo el sistema somatosensorial. Al poner en contacto un electrodo de estimulación medular con los cordones posteriores y conectarlo a un sistema implantado de generación de electricidad, va a producirse una acción directa sobre las neuronas intramedulares. Este efecto va a depender de las características del axón y de su integridad. Influye en la respuesta el diámetro del axón, su estructura, el tipo de mielina y el umbral de activación, que se puede ver modificado en una neurona afectada por dolor crónico.
Esta estimulación tiene como características que se desplaza de forma ortodrómica (hacia el cerebro) y antidrómica (hacia los receptores periféricos), es decir, es aún más complejo y completo, porque su efecto se desplaza en una doble vía: hacia la corteza cerebral y hacia las terminaciones libres en la piel y los tejidos. De igual forma, estos electrodos van a producir cambios en varios niveles del sistema nervioso: en el segmento medular en el que se realizó el implante; pero, igualmente, en los niveles suprasegmentarios (superiores) y supraespinales (cerebrales). Además, de forma directa, dicho estímulo eléctrico libera neurotransmisores y activa las vías descendentes corticoespinales de predominio inhibitorio.
Existen diferentes hallazgos y evidencias experimentales, clínicas y radiológicas que confirman ese efecto terapéutico dinámico de la SCS (1, 4, 6, 9, 23, 31, 32, 33, 36, 38, 39, 40):
Estudios funcionales del sistema nervioso han demostrado que la SCS tiene la capacidad de modificar de manera directa el metabolismo cerebral (1, 2).
La SCS aumenta la concentración de GABA B, de opioides endógenos (por activación de las vías inhibitorias corticoespinales), de acetilcolina y de adenosina; así como activa el sistema colinérgico, noradrenérgico y serotoninérgico (1, 2, 38, 39).
La SCS disminuye las concentraciones de glutamato y la expresión de los receptores NMDA específicos para glutamato y asociados a sensibilización periférica (1, 2, 39, 40).
La SCS incrementa las citocinas y de las interleucinas 10 (IL10) en el líquido cefalorraquídeo y los receptores muscarínicos M4.
Los estudios de resonancia funcional han mostrado cómo la SCS activa directamente la corteza somatosensorial, la corteza cingular anterior y la ínsula posterior.
Los estudios de resonancia funcional han evidenciado cómo la SCS inhibe la conectividad neuronal tálamo-cíngulo.
Los estudios de electrofisiología han demostrado cómo la SCS disminuye el reflejo RIII nociceptivo, modifica los potenciales somatosensoriales y reduce los potenciales evocados láser.
Aunque es un tema todavía en desarrollo, se considera que la SCS tiene la capacidad de modificar la expresión de las células gliales y modificar su capacidad de modular la respuesta nociceptiva.
Neuronas de amplio rango
Las neuronas de amplio rango o wide dynamic range neurons fueron descritas por Mendell, en 1966, en la lámina V de Rexed, en el cuerno posterior de la médula. Estas neuronas participan de manera activa en el proceso de amplificación medular del estímulo doloroso nociceptivo, ejerciendo un papel fundamental en la interpretación cortical del dolor. Favorecen el proceso de interpretación del dolor en la médula y permiten la discriminación sensorial del dolor, la ubicación del estímulo doloroso y la intensidad. Son estructuras que buscan magnificar el potencial de acción mediante un mecanismo de amplificación. Estudios recientes han asociado el mecanismo de acción del SCS con las neuronas de amplio rango considerando que el estímulo eléctrico tiene la capacidad de disminuir su actividad en el cuerno posterior de la médula, todo esto a través de la estimulación de las cells islet, localizadas en el cuerno posterior de la médula (1, 23, 41, 42, 43, 44).
En los primeros treinta años, la evolución tecnológica de la SCS se centró en la manera de mejorar los equipos de estimulación, hacerlos más confiables, funcionales y pequeños. En el siglo XXI, la evolución de la SCS se ha dirigido a la forma de estimulación, al tipo de onda eléctrica y al efecto de la variedad de onda en las estructuras nerviosas. Así es como han surgido otras formas de estimulación que deben integrarse a las opciones de tratamiento del dolor crónico, junto con la estimulación convencional. Entre ellas menciono (34, 38, 45, 46, 47):
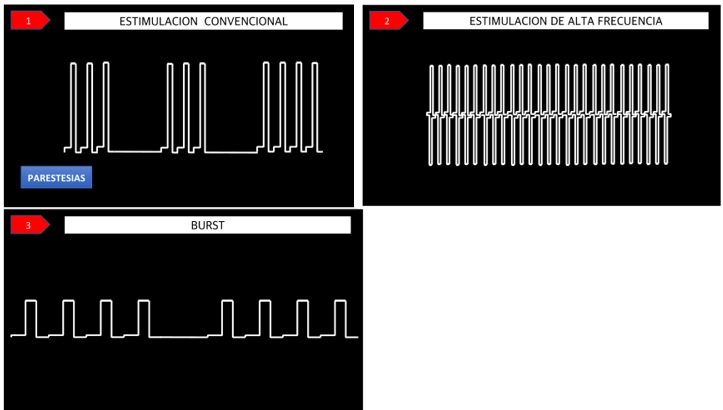
Fuente: esta imagen fue en su totalidad desarrollada por el autor JCA.
Figura 6. Ilustración de la variación en los sistemas de estimulación. Forma de las ondas eléctricas y del patrón de estimulación: 1) estimulación convencional (produce parestesias); 2) estimulación de alta frecuencia (no produce parestesias); 3) estimulación Burst (no produce parestesias).
La estimulación Burst. Su mecanismo de acción va dirigido de una forma más específica al cuerno posterior de la médula y al tracto espinotalámico lateral y medial. Su acción es directa sobre la corteza somatosensorial y la corteza anterior del cíngulo, lo que permite controlar el componente afectivo y emocional del dolor. Se sabe que no estimula los cordones posteriores, ni las fibras Aβ y su acción no depende de la liberación de los neurotransmisores gabaérgicos (1, 2, 4, 6, 18, 22, 51).
La estimulación del ganglio de la raíz dorsal. Una variedad para la colocación del electrodo de estimulación es ponerlo en contacto del ganglio de la raíz dorsal, a través de la columna, pero saliendo por el foramen de la raíz espinal que se desea estimular. Surge esta variante de estimulación a partir de la importancia que tiene el ganglio de la raíz dorsal en el proceso de modulación del dolor neuropático. Es considerado el ganglio de la raíz dorsal el sitio de almacenamiento de neurotrasmisores “durmientes”, que se activan en condiciones patológicas, tanto para generar mecanismos inhibitorios como para desarrollar procesos de hiperexcitabilidad. Esto hace considerar que el estímulo eléctrico aplicado directamente sobre el ganglio permite un mejor control de los síntomas. Su acción está aislada a la raíz estimulada, lo que se convierte en una limitante cuando el mecanismo del dolor es producido por lesiones de la cola de caballo o en los que participan más de un segmento medular. Se indica sobre todo en el síndrome doloroso regional complejo, en los cuales el origen de los síntomas es periférico y cumple con la limitación estructural relacionada con su origen (22, 25, 27, 52, 53, 54).
Técnica de implantación
La técnica de implantación de un estimulador medular es sencilla, por lo que es más riesgosa su utilización. Entre más simple es el procedimiento, más estricto hay que ser en su indicación y en su proceso de análisis previo a la cirugía. El proceso de selección del paciente debe ser estricto e incluir una completa objetividad para ofrecer otros tratamientos percutáneos (previos) para el tratamiento del dolor crónico. En promedio, se calcula que un paciente llega a ser candidato para la implantación de un sistema de estimulación medular solo cuatro años después de su diagnóstico inicial del dolor crónico. Esto implica que previo al procedimiento tendría que haber pasado por un proceso diagnóstico en el cual se confirmó mediante el análisis estricto de los aspectos clínicos, radiológicos y electrofisiológicos la presencia de un dolor de característica neuropáticas, que es el que más se ve beneficiado de esta técnica. En el concepto de dolor neuropático se incluye el síndrome doloroso regional complejo (sistema autonómico), la angina crónica (sistema autonómico) y el dolor por patologías vasculares periféricas (sistema autonómico).
Una vez hecho el diagnóstico, debe conducirse al tratamiento analgésico más conveniente. Esto incluye la combinación multimodal de fármacos de diferente familia analgésica y de mecanismos de acción complementarias. Las combinaciones más usadas son las de analgésicos opioides + antineuropáticos + coadyuvantes + tratamiento tópico (si hay alodinia o puntos gatillo). El tratamiento analgésico adecuado debe incluir la posibilidad de ir aumentando progresivamente los medicamentos, comenzando incluso con dosis muy bajas, pero bien toleradas, e ir titulando hasta obtener las dosis terapéuticas tolerables. Es frecuente que sea necesario modificar el esquema terapéutico inicial, permitiendo a cada medicamento el tiempo necesario para evaluar adecuadamente su capacidad terapéutica en el paciente específico (2, 6, 18, 55, 56, 57, 58).
De forma paralela al tratamiento analgésico, se debe iniciar el tratamiento con procedimientos percutáneos. No se debe hacer de forma escalonada, sino de forma paralela, ya que muchas veces la realización de un procedimiento simple como un bloqueo puede permitir que las dosis necesarias de medicamento para controlar el dolor residual sean mucho menores. Deben utilizarse inicialmente bloqueos de estructuras nerviosas o autonómicas específicas, sabiendo que entre más preciso el bloqueo, mayores resultados podrá tener. Cuando el número de estructuras nerviosas que se van a bloquear es mayor, menores son las posibilidades de eficacia. No es prudente bloquear al mismo tiempo estructuras nerviosas y autonómicas, ya que no se podrá determinar el verdadero origen del dolor, en caso que la sintomatología vuelva. Siempre el procedimiento de bloqueo tendrá una utilidad diagnóstica y una terapéutica. Si el procedimiento de bloqueo permite un alivio del dolor significativo, pero transitorio, será necesario realizar procedimientos de lisis, idealmente con la utilización de ondas de radiofrecuencia. El ganglio de la raíz dorsal cumple un papel modulador del dolor que hace que la aplicación de radiofrecuencia pulsada sobre este permita una modificación favorable en las características del dolor (59, 60, 61, 62, 63, 64, 65).
Solo después de haber realizado el proceso previo es posible pensar en implantar un sistema de estimulación medular. Debe reevaluarse nuevamente el diagnóstico y confirmar que se trata de un dolor neuropático que no se ha modificado a través del tiempo y que no ha mutado a otra forma de dolor, posiblemente no favorable para indicar este tratamiento.
Implantación
La gran ventaja de implantar un sistema de estimulación medular es que no tiene casi ningún otro procedimiento quirúrgico y es la posibilidad de realizar una fase de prueba, es decir, se va a poder implantar el electrodo en contacto de los cordones posteriores en el espacio epidural de forma percutánea; pero va a ir conectado a un sistema externo generador de estímulos eléctricos que el paciente podrá llevar fácilmente durante un periodo variable que puede estar entre dos y tres semanas, dependiendo de la respuesta clínica. Durante ese periodo se harán modificaciones al tipo de estimulación e, idealmente, se evaluará la respuesta clínica cada 72 horas.
Al finalizar la fase de prueba, se escuchará la opinión del paciente respecto a la utilidad del procedimiento, la de los familiares del paciente, los de los técnicos especialistas en estimulación y la del neurocirujano tratante. Las conclusiones determinarán si la prueba fue positiva (mejoría superior al 75 % del dolor) o negativa (inferior al 75 % del dolor) (66, 67, 68, 69).
Fase definitiva
La fase definitiva es el proceso de implantación del sistema de estimulación medular completamente interno. Es indispensable para ambas fases conocer la ley de Chipault (neurólogo francés), que determina la relación existente entre los segmentos vertebrales y los segmentos medulares, pues es necesario —previo al procedimiento— determinar cuál es el segmento medular relacionado y comprometido en el proceso de generación del dolor. Dicho segmento se extrapola al segmento vertebral asociado, el cual se podrá verificar durante el procedimiento con la utilización de ayuda fluoroscópica (rayos X).
Recomiendo hacer de este proceso un punto indispensable en el momento de la implantación, ya que va a permitir utilizar el menor número de electrodos, con el menor número de contacto; pero de una forma muchos más específica y precisa. Aquella tendencia ilógica de colocar cada vez más electrodos y con una mayor cantidad de contactos para que cubran una extensión amplia de estimulación solo es el reflejo de una falta de precisión terapéutica y una ineficacia en el procedimiento. Sugiero el uso de un solo electrodo, máximo con ocho contactos, pero colocado con precisión en los segmentos medulares indicados. Durante el procedimiento, con el paciente bajo sedación, podremos llevar a cabo una estimulación perioperatoria que permitirá verificar que la posición del electrodo estimula adecuadamente la zona del dolor. El paciente sentirá parestesias en dicha zona. Una vez colocado el electrodo, debe ser fijado sobre la fascia lumbar con cualquiera de los sistemas comercializados.
Más allá de recomendar alguno de ellos, se debe verificar que los puntos de anclaje del electrodo estén firmes y que el electrodo no se deslice sobre el fijador. Igualmente, evitar que quede acodado. Realizo un bolsillo único a través del cual se realiza la punción epidural y donde queda adecuadamente fijo el generador de pulso (68, 69, 70, 71, 72).
Relacionado con la técnica, proponemos cinco rigurosos pasos para una implantación perfecta, rápida (en promedio 30 minutos) y, sobre todo, eficaz:
Paso 1. Planeación. Una vez el paciente se encuentra bajo anestesia local asistida o general y en posición de decúbito prono, se verifica que no haya zonas de presión y se colocan soportes que permitan dejar libre el tórax y el abdomen, para no aumentar la presión intratorácica o intrabdominal. La planeación se hace antes de la asepsia y la antisepsia, utilizando visión de fluoroscopia (rayos X) y se debe identificar en la piel el punto de entrada sobre el borde inferior del pedículo opuesto al lado que se desea estimular. Si la estimulación es bilateral, se escogerá el lado que se facilite, de acuerdo con la mano dominante del cirujano (cirujano diestro: pedículo izquierdo; cirujano zurdo: pedículo derecho). Se selecciona el punto de entrada de la aguja en el espacio epidural, lo que permite determinar la dirección de la punción y el ángulo con respecto a la piel, que debe corresponder con el borde inferior de la apófisis espinosa. Igualmente, se selecciona la posición del bolsillo en el que va alojado el generador de pulso y a través del cual se va a realizar la punción. Este bolsillo no debe ir en contacto estrecho con superficies óseas. Esta planeación es muy importante, sobre todo, en aquellos pacientes ya operados de la columna o con material de instrumentación que limita y hace más compleja la implantación (figura 7).
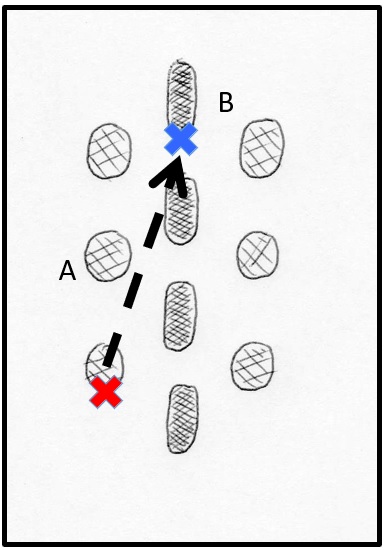
Fuente: este esquema fue desarrollado y es original del autor JCA.
Figura 7. Técnica. Paso 1. Planeación. Con el paciente en una posición de decúbito prono y bajo visión fluoroscópica (rayos X) se identifican el borde inferior del pedículo seleccionado y se identifica el borde inferior de la apófisis espinosa dos vértebras superior. Estos dos puntos permiten direccionar la aguja. X roja: borde inferior de pedículo. X azul: borde inferior de la apófisis espinosa. A: pedículos. B: apófisis espinosa.
Paso 2. Abordaje percutáneo del espacio epidural. Es preciso realizar la incisión del tamaño del bolsillo para el generador, lo que implica prepararla con una disección roma digital, una punción con aguja de Tuohy en la dirección y ángulo seleccionados y bajo visión fluroscópica. Se verifica el ingreso al espacio epidural con la técnica de pérdida de resistencia. Se pasa una guía de verificación de ingreso al espacio epidural. La adecuada planeación permite que esta punción sea rápida (figura 8).
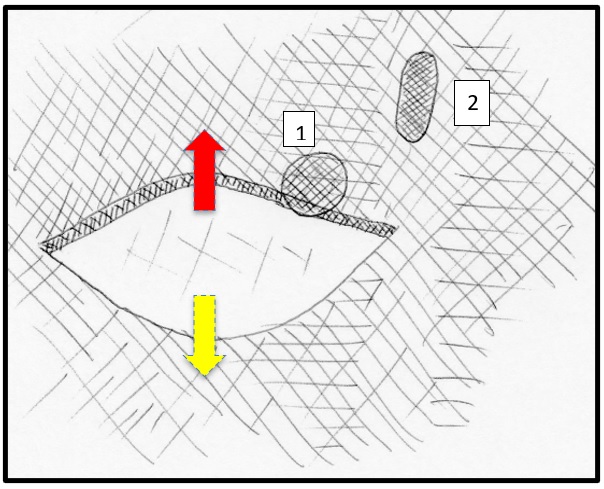
Fuente: este esquema fue desarrollado y es original del autor JCA.
Figura 8. Técnica. Paso 2. Realización de la única (una sola) incisión que incluye: bolsillo generador de pulso + sitio de punción en el borde inferior del pedículo. Flecha roja: disección superior para realizar el bolsillo generador. Flecha amarilla: disección inferior para realizar el bolsillo generador. La incisión debe quedar sobre la línea correspondiente con los 2/3 del generador.
Paso 3. Implantación del electrodo y navegación del espacio epidural. Se introduce el electrodo a través de la aguja y se navega por el espacio epidural hasta colocarlo en el sitio determinado durante la planeación. Se debe verificar la posición del electrodo con proyecciones anteroposteriores y laterales del arco en C mediante fluoroscopia (rayos X). Si se está en la fase de prueba, la posición del electrodo será determinada por la presencia de parestesias que el paciente despierto va a ubicar en la zona del dolor. Si se está en la fase definitiva, la posición del electrodo será determinada por el análisis de la posición del electrodo en la fase de prueba y de los contactos que permitieron una mejoría del dolor (figura 9).
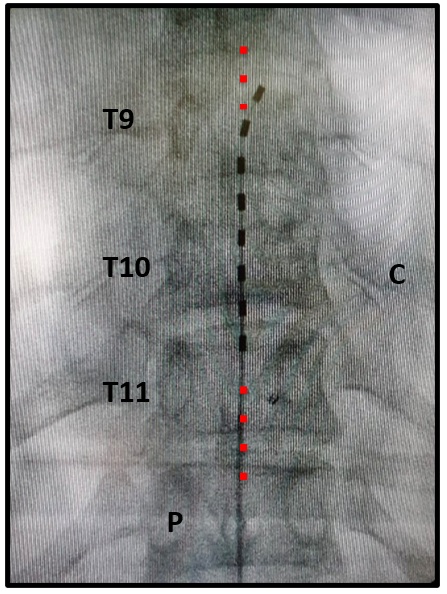
Fuente: fotografía original tomada y modificada por el autor.
Figura 9. Técnica. Paso 3. Navegación epidural con el electrodo de estimulación. Radiografía AP (anteriposterior) donde se observa sobre la línea media un electrodo de estimulación de 8 contactos. Se observa un contacto inferior en el borde superior de T11 y un contacto superior en el borde superior de T9. C: costilla. P: pedículos. La línea roja ilustra la línea media.
Paso 4. Fijación del electrodo. Este momento del procedimiento quirúrgico es crucial y requiere una mayor atención. Se debe vigilar mediante fluoroscopia (rayos X) que el electrodo no se desplace. De manera general, los sistemas de fijación son poco prácticos e incómodos en un campo quirúrgico ya estrecho. El más sofisticado no necesariamente es el mejor, porque no puede remplazar una adecuada técnica. Casi siempre, el sistema más simple, acompañado de una técnica adecuada, es el mejor. Se debe verificar que el electrodo quede fijo al sistema de fijación y que no deslice. El sistema de fijación debe anclarse en la fascia y nunca en el tejido graso. Puntos adicionales pueden ser necesarios para evitar que al acomodar el electrodo quede acodado (figura 10).
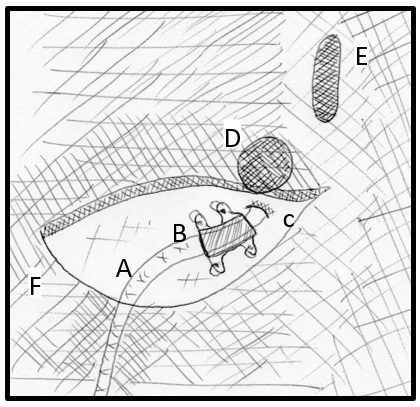
Fuente: este esquema fue desarrollado y es original del autor JCA.
Figura 10. Técnica. Paso 4. Fijación del electrodo. Se observa el electrodo saliendo de su punto de entrada (punción) y el sistema plástico que permite fijar el electrodo en la fascia. Debe verificarse que el electrodo no se deslice en el fijador. A: electrodo B: Fijador de plástico. C: punto de entrada (de punción) del electrodo. D: pedículo. E: apófisis espinosa.
Paso 5. Implantación del generador de pulso. Se verifica el adecuado tamaño del bolsillo para el generador, se fija al electrodo y se introduce y fija a la fascia. Cierre de la única incisión en dos planos (figura 11).
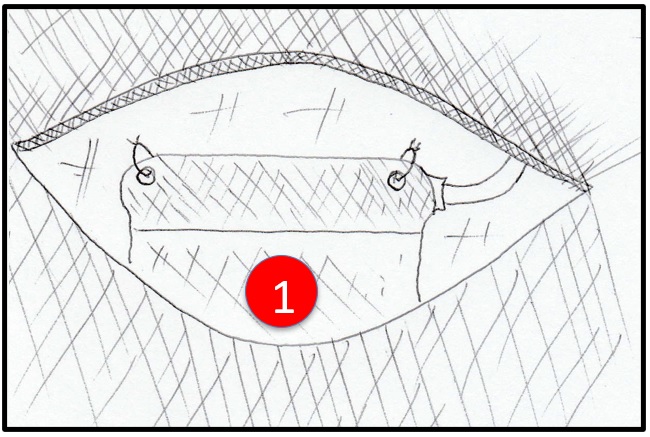
Fuente: este esquema fue desarrollado y es original del autor JCA.
Figura 11. Técnica. Paso 5. Implantación del generador. Se observa incisión (única) y en su interior el generador de pulsos eléctricos. Se debe fijar en sus tres puntos específicos y verificar que el trayecto del electrodo no presentó acodaduras. 1 rojo: generador de pulso.
Las indicaciones y los resultados de esta técnica van de la mano. Se obtienen mejores resultados cuando se mantienen y se respetan buenas indicaciones. Realizar una fase de prueba objetiva aumenta la posibilidad de que sean mejores los resultados a corto y mediano plazo. Los diferentes estudios llevados a cabo en Europa, Estados Unidos y Australia han confirmado que las mejores indicaciones son: dolor neuropático periférico, síndrome doloroso regional complejo (en fase caliente), angina de pecho crónica y patologías dolorosas vasculares de miembros inferiores.
Es importante mencionar respecto al diagnóstico de síndrome de espalda fallida que es solo una incapacidad académica, esto es, no ahondar en la determinación de un diagnóstico en un paciente con dolor después de uno o varios procedimientos quirúrgicos. Un paciente ya operado de la columna y que persiste o volvió a tener dolor debe seguir el mismo procedimiento diagnóstico que cualquier otro paciente con dolor crónico. Es preciso determinar si se trata de un dolor somático (originado en todos los tejidos excepto en el sistema nervioso y las vísceras) o de un dolor neuropático (dolor originado en el sistema nervioso) (71, 72).
La causa más frecuente de dolor persistente, de tipo somático, después de haber sido operado es enfermedad sacroiliaca, enfermedad facetaria, dolor discogénico, inestabilidad por segmento adyacente o por falla en montaje de instrumentación. La causa más frecuente de dolor persistente, de tipo neuropático, después de haber sido operado, es de tipo radicular, por nueva inflación, nueva compresión o daño irreversible de tipo iatrogénico o simplemente explicado por una lesión crónica. Debe tenerse igualmente en cuenta que se puede tratar de una nueva lesión (71, 72) (figura 12).
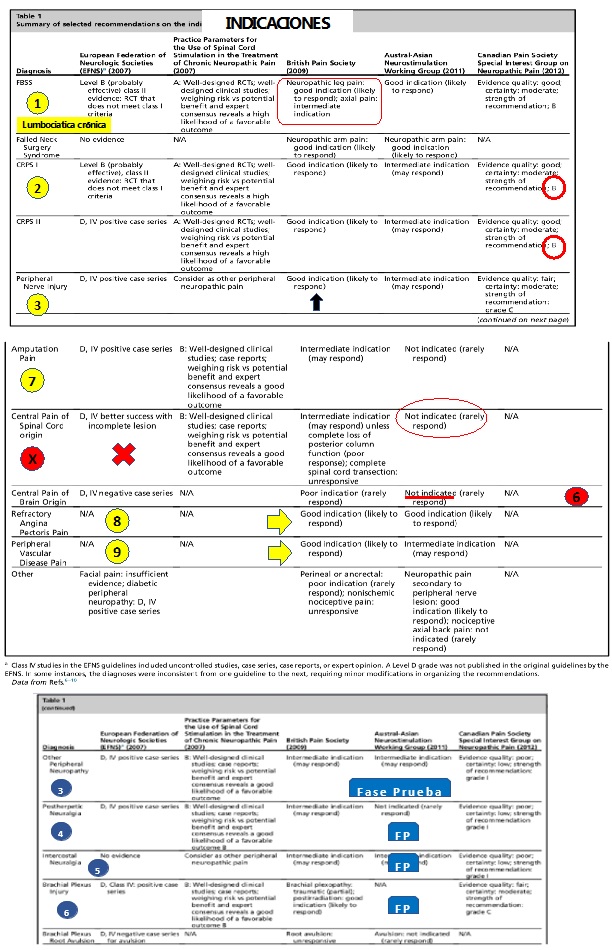
Fuente: tablas tomadas de las referencias (2) y (3) y modificado por el autor de este trabajo (JCA).
Figura 12. Figura tomada de los artículos más relevantes relacionados con el tema y modificada por el autor de este trabajo JCA. Se ilustran el análisis de los resultados de acuerdo con las diferentes patologías. En amarillo, las indicaciones absolutas para la realización del procedimiento. En azul, las indicaciones relativas para la realización del procedimiento. En rojo, las indicaciones no recomendadas para el procedimiento.
Conclusión
El sistema de estimulación medular es un tratamiento eficaz para el control del dolor crónico. Debe realizarse bajo unos parámetros técnicos estrictos para poder obtener mejores resultados y ser costo-efectiva. El seguimiento del paciente es esencial y la participación interdisciplinaria es obligatoria.















