Introducción
El propofol es un medicamento de uso frecuente desde hace más de 20 años que se prefiere sobre otros fármacos sedantes, por su rápido inicio de acción y recuperación de la sedación, reducción de náuseas y vómitos en el postoperatorio, además de proveer numerosos efectos fisiológicos benéficos, incluidos la reducción de la demanda metabólica cerebral, sus propiedades anticonvulsivantes y sus efectos neuroprotectores; sin embargo, requiere vigilancia estricta, dados los casos relacionados con la presentación del síndrome por infusión de propofol (SIP) (1, 2).
En la literatura sobre el tema se han encontrado datos correspondientes al SIP que provienen de presentaciones de casos y estudios retrospectivos que, en un principio, evidenciaron este síndrome en la población pediátrica que era expuesta a altas dosis y por largos periodos; sin embargo, más recientemente se han reportado casos de pacientes, en su mayoría adultos, que desarrollan el SIP con dosis más bajas y durante cortos intervalos de tiempo.
Definición
El SIP alude a la presencia de acidosis metabólica, alteraciones tanto cardiovasculares como renales, rabdomiólisis y cambios electrocardiográficos (3, 4). El término fue introducido en la práctica clínica por R. J. Bray, en 1998, como un conjunto de síntomas caracterizados por: bradicardia marcada de inicio súbito resistente al tratamiento y que puede progresar a asistolia como hallazgo obligatorio, más la presencia de, al menos, uno de los siguientes: suero lipémico, hepatomegalia clínica o evidencia de infiltración grasa del hígado, acidosis metabólica con, al menos, una medición de gases arteriales con evidencia de déficit de base ≥10 mmol/l y rabdomiólisis o mioglobinuria, en relación con pacientes que se han expuesto a altas dosis de propofol (>4-5 mg/kg/h o >83 µg/kg/min) durante largos periodos (>48 h) (2, 5, 6, 7, 8, 9). En la literatura documentada varían los hallazgos diagnósticos del SIP: se han encontrado características comunes, como compromiso cardiovascular, arritmias cardiacas y acidosis metabólica; mientras que la rabdomiólisis, el suero lipémico y la hipertrigliceridemia no son hallazgos consistentes en los diferentes reportes (10,11).
Epidemiología
La mayoría de los datos clínicos respecto al SIP se han originado a partir de informes y series de casos descritos por anestesiólogos y provenientes de pacientes de unidades de cuidado intensivo (12, 13). Probablemente, uno de los principales problemas corresponde a las diferencias en los criterios diagnósticos para el SIP, los factores de riesgo y las patologías asociadas con este síndrome (14). Hasta el momento no hay estudios prospectivos sobre la incidencia del SIP (15); pero sí hay evidencia de una alta tasa de mortalidad, pese a la disparidad existente respecto al uso de propofol en la unidad de cuidado intensivo y el bajo número de casos reportados (16).
Fong et al. (17), en el 2008, propusieron un puntaje para identificar a los pacientes con sospecha de SIP con mayor riesgo de mortalidad e identificaron factores como edad <18 años, uso de vasopresores o presencia de alguna de las siguientes manifestaciones clínicas: alteraciones cardiacas, acidosis metabólica, insuficiencia renal, hipotensión, rabdomiólisis o dislipidemia, hallazgos compatibles con reportes de Roberts et al. (9). En la literatura, los casos de SIP están relacionados con uso de dosis de propofol >83 µg/kg/min en el 88 % de los casos; pero hay que aclarar que puede ocurrir incluso a bajas dosis del medicamento o en menos de 24 h de haber iniciado la infusión (9).
Varios estudios retrospectivos evidenciaron una incidencia que va desde el 1,1 % al 4,1 %, con tasas de mortalidad que en los años noventa llegaban al 80 %; pero que, gracias a la identificación temprana del SIP, se ha logrado una reducir hasta en un 64 %, cifra que aún continúa siendo elevada aunque con mayores tasas de sobrevida (18,19).
Krajčová et al. (3), en el 2015, identificaron una correlación significativa entre anormalidades electrocardiográficas y la tasa promedio de infusión; además, identificaron factores asociados con una mayor mortalidad, como dosis más elevadas, una mayor duración de la infusión, el desarrollo de fiebre y la presencia de trauma craneoencefálico (TCE).
Mecanismo de acción
El propofol es un compuesto químico (2,6 diisopropilfenol) derivado del fenol, con un peso molecular de 178,27 g/mmol que se comercializa al 1 % o al 2 % en emulsión de color blanco lechoso que contiene un 10 % de aceite de soya, un 2,25 % de glicerol y un 1,2 % de fosfato de huevo purificado (18, 20).
Es altamente lipofílico con un expedito inicio de acción (9-51 s), lo que le permite cruzar la barrera hematoencefálica con rapidez. Posee un efecto hipnótico relacionado con la dosis y una vida de eliminación corta (30 a 60 min). Se distribuye velozmente en el cuerpo con una vida media bifásica inicial de 40 min y una terminal de 7 h. Más del 95 % al 99 % de la molécula se une a las proteínas plasmáticas (1, 5, 21, 22). El metabolismo ocurre, sobre todo, por la conjugación en el hígado a metabolitos inactivos a través de la CYP2B6-CYP2C9. La vía de eliminación principal del propofol es por glucoronidación; solo el 0,3 % de la dosis administrada se excreta sin cambios por la orina y, aproximadamente, un 53 %, en forma de glucurónido. Sus propiedades sedantes e hipnóticas se presentan a bajas dosis, y, además de amnesia, como las benzodiacepinas, se prefiere en pacientes en quienes se requiere un efecto sedante, pero con un despertar rápido (16).
El propofol ejerce su acción activando el neurotransmisor central inhibitorio, el ácido gamma-aminobutírico (GABA). Los receptores GABA A son canales iónicos dependientes del ligando conformado por varias subunidades que forman una estructura pentamérica que contiene un canal central de cloro (1-6, β1-4, γ1-3, δ, ε y ρ1-3). La unión de la molécula de propofol al receptor GABA A aumenta el influjo del cloro en el interior de la célula, lo que ocasiona hiperpolarización de la neurona, con la consecuente ausencia de respuesta a los estímulos externos. El propofol influye, además, en los mecanismos presinápticos de la transmisión gabaérgica, como en la recaptación y liberación de GABA. Así mismo, bloquea selectivamente la liberación de acetilcolina en las vías basocorticales y septohipocampales que se encuentran bajo inervación tónica del influjo gabaérgico (1, 18, 20).
En el sistema respiratorio, con la dosis usual del propofol (1-3 mg/kg), disminuye el volumen corriente y la ventilación por minuto y aumenta la presión parcial arterial de oxígeno. Los pacientes con enfermedad pulmonar obstructiva crónica pueden tener una respuesta exagerada a los efectos depresores ventilatorios del propofol. A dosis de 50 a 120 µg/kg/min deprime la respuesta ventilatoria a la hipoxia, disminuye los reflejos de protección de la vía aérea y potencia la vasoconstricción pulmonar hipóxica (18).
En el sistema nervioso central, el propofol causa vasoconstricción cerebral significativa, que es directamente proporcional a la dosis administrada, lo que ocasiona una disminución del flujo sanguíneo cerebral, de la demanda metabólica para el oxígeno y cualquier edema cerebral preexistente; mientras que la autorregulación cerebral y la reactividad cerebrovascular al consumo de oxígeno no se ven afectadas. Causa una caída en la presión intracraneal normal o elevada, junto con una disminución en la presión de perfusión cerebral, por lo que se ha usado para la sedación en pacientes con TCE. El propofol en la actividad cerebral epileptogénica es poco conocido; pero parece que tiene un efecto anticonvulsivo dependiente de la dosis, puede actuar mejorando el efecto del GABA, inhibir los receptores de N-metil-D-aspartato y modular canales de iones de calcio lentos (18).
En el sistema cardiovascular, poco después de que aparece la hipnosis, se evidencia el efecto hemodinámicamente más significativo: una disminución de la tensión arterial, que llega a producir una reducción del 25 %-40 % de la tensión arterial sistólica, con una dosis de inducción de 2-2,5 mg/kg, así como una caída de la media y de la tensión arterial diastólica. Este efecto es ocasionado, sobre todo, por una vasodilatación arterial y por una reducción del tono simpático vascular; pero también puede afectar la contractilidad miocárdica y el control autónomo del gasto cardiaco, así como disminuir la precarga y la poscarga, al causar una caída de la resistencia vascular sistémica arterial y venosa. Todos estos efectos dependen de la concentración plasmática de propofol, por lo que son más pronunciados durante la inducción, en comparación con el mantenimiento de la anestesia. Esta es la razón por la que se debe tener precaución en pacientes con hipovolemia, edad avanzada o cardiopatía preexistente, ya que estos efectos pueden ser exagerados o potenciados por el uso concomitante de otros fármacos de uso crónico por los pacientes o durante la realización de procedimientos (18).
La evidencia de una elevación significativa del segmento ST en V1 como patrón similar al observado en el síndrome de Brugada se reconoce en la actualidad como un posible indicador de inestabilidad eléctrica maligna o previo a la progresión a falla cardiaca durante la infusión prolongada de propofol en adultos (2, 5, 7, 23). Se cree que la elevación del segmento ST resulta de un desplazamiento hacia afuera en el equilibrio de las corrientes iónicas al final de la fase I del potencial de acción ventricular epicárdico, especialmente en el tracto de salida del ventrículo derecho, lo que conduce al predominio del patrón electrocardiográfico anterior en las derivaciones precordiales derechas (24). La degeneración miofibrilar focal explicaría la rápida implicación del sistema de conducción cardiaca, porque causa un cambio no homogéneo en la velocidad de conducción local (25). Las arritmias se pueden presentar en ausencia de acidosis profunda o disfunción miocárdica, secundarias a daños celulares directos o por otras alteraciones metabólicas, y aun cuando el mecanismo se desconoce, están relacionadas con el aumento del tono vagal, la alteración de la respuesta de los barorreceptores y la disminución de la respuesta simpática o cambios en las propiedades de la membrana de las células miocárdicas.
El propofol tiene un efecto inotrópico negativo, secundario a la disminución del tono simpático y al antagonismo de los receptores β-adrenérgicos y los canales de calcio. Este efecto inotrópico resulta en un incremento de la liberación de catecolaminas requerida para mantener la estabilidad hemodinámica; por este efecto, a medida que las catecolaminas aumentan, la infusión de propofol también lo debe hacer para mantener el mismo efecto sedante, y ello crea un círculo vicioso que da como resultado un estado hipercatabólico con rabdomiólisis, acidosis metabólica, insuficiencia renal aguda y cardiaca (8, 26).
Fisiopatología y manifestaciones clínicas
Las manifestaciones clínicas principales del SIP incluyen: insuficiencia miocárdica con arritmias progresivas, acidosis metabólica, falla renal, fiebre y trastornos metabólicos adicionales, que incluyen hiperlipidemia e hiperpotasemia.
La fisiopatología del SIP no se encuentra totalmente dilucidada. Los estudios han encontrado una relación entre el uso del propofol y una alteración del empleo de los ácidos grasos libres en la actividad mitocondrial y un desequilibrio entre la demanda y la utilización de energía, con efectos deletéreos en la célula que principalmente llevan a necrosis muscular cardiaca y periférica, por lo que los análisis de las biopsias musculares y del metabolismo de la grasa de los pacientes con SIP se asemejan a los encontrados en citopatías mitocondriales y en deficiencias adquiridas del metabolismo de la acilcarnitina, mediante la inhibición de la β-oxidación (acumulación de gotas de grasa, degeneración vacuolar aguda y micitólisis del músculo esquelético y cardiaco, sin evidencia de un infiltrado inflamatorio significativo que ilustra la agudeza del proceso) (5, 19, 25, 27).
La hipótesis es que los individuos que desarrollan este síndrome sufren una alteración en las enzimas de la cadena respiratoria, porque se suprime la oxidación de los ácidos grasos y ello genera la fabricación de intermediarios tóxicos de los ácidos grasos; la disminución de la producción de ATP (que, asociada con la hipoxia celular y la acidosis metabólica formada en situaciones de estrés, lleva a un cambio en el metabolismo hacia un aumento de la lipólisis) y la oxidación de las grasas, incluso en presencia de reservas adecuadas de carbohidratos. Así, aumenta la cantidad de ácidos grasos no esterificados, que posteriormente en el hígado se convierten en cuerpos cetónicos, que si bien son fuente de energía su acumulación pueden contribuir a la acidosis y ocasionar mayor toxicidad (28, 29).
El inicio del SIP puede estar relacionado con la inhibición intracelular de la producción de la energía en la mitocondria por uno de dos siguientes mecanismos: 1) inhibición del transporte de las cadenas largas de ácidos grasos en las células durante estados de deficiencia nutricional en la enfermedad crítica o 2) efecto inhibitorio en la cadena respiratoria de la mitocondria (11).
Para comprender mejor cómo se desarrolla el SIP es indispensable entender cómo funciona a nivel mitocondrial la cadena respiratoria y la β-oxidación de los ácidos grasos. En circunstancias fisiológicas, la glucosa es una fuente importante de energía para el cerebro, el sistema cardiovascular y el sistema musculoesquelético. Sin embargo, durante las condiciones de estrés (trauma e infección), para la gran mayoría de los tejidos hay un cambio hacia la utilización de ácidos grasos libres como fuente principal de energía. Dicho cambio se logra mediante la activación de las hormonas del estrés (como la adrenalina y el cortisol=, que modulan la actividad de la lipasa sensible a las hormonas en el tejido adiposo. Esta lipasa sensible a hormonas, a su vez, promueve la degradación de los triglicéridos en el glicerol y los ácidos grasos libres. Ambos constituyentes de los triglicéridos son tomados por las células del hígado, donde el glicerol se puede utilizar como fuente de síntesis de glucosa de novo, y los ácidos grasos libres se usan en la β-oxidación mitocondrial, con el objetivo de proporcionar más glucosa al sistema nervioso central y a los glóbulos rojos. La β-oxidación de ácidos grasos genera productos intermedios bioquímicos que se emplean en el ciclo del ácido cítrico (o de Krebs), que proporcionan electrones a la cadena transportadora de electrones y que sirven en la síntesis de cuerpos cetónicos, que también pueden ser fuente de energía (30).
El propofol aumenta la actividad del malonil coenzima A, que a su vez inhibe la carnitina palmitoil transferasa I, de modo que los ácidos grasos libres de la cadena larga no pueden entrar en la mitocondria. El propofol también desacopla la β-oxidación y la cadena respiratoria en el complejo II; por lo tanto, no se pueden utilizar los ácidos grasos libres de cadena media o corta que cruzan libremente las membranas mitocondriales. Tales factores llevan a una producción baja de energía que puede conducir a necrosis muscular cardíaca y periférica si la demanda de energía es alta (27).
El daño muscular se asocia con cantidades elevadas de creatina fosfocinasa (CPK), liberación de contenido intracelular tóxico, mioglobinuria e insuficiencia renal; sin embargo, las concentraciones elevadas de CPK y la rabdomiólisis tienen múltiples causas en pacientes críticamente enfermos (3, 8, 12, 23, 30, 31).
Laboratorio
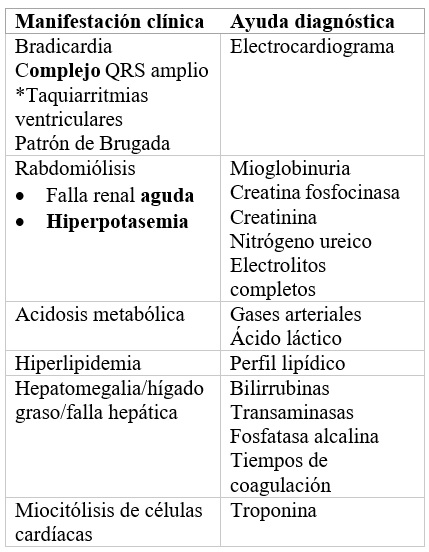
Hasta el momento no existe una prueba diagnóstica específica para el SIP, por lo que se debe realizar monitoreo continuo de exámenes paraclínicos (tabla 1) orientados a las alteraciones fisiopatológicas de este síndrome, así como a la condición clínica del paciente (12).
La identificación sistemática diaria es una estrategia utilizada desde el 2006 y hasta la fecha que le hace seguimiento a los valores del ácido láctico y de la CPK mientras el paciente reciba manejo con propofol (32):
Factores de riesgo
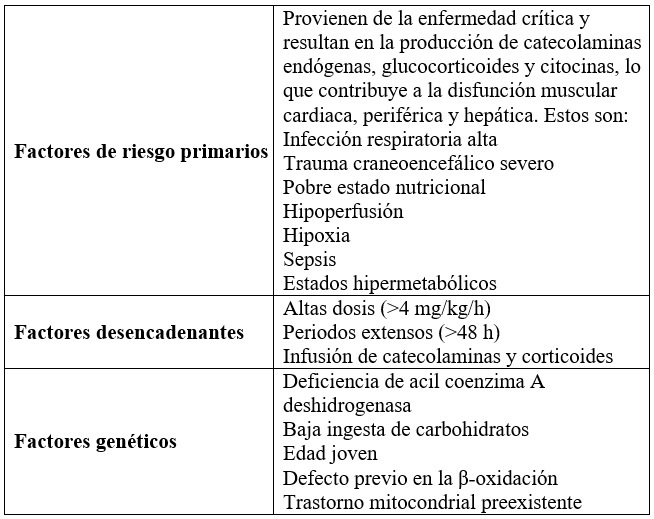
De acuerdo con la fisiopatología del SIP, es indispensable tener en cuenta ciertos factores de riesgo que van a favorecer el desarrollo del síndrome (tabla 2). Vasile et al. (27) los describen en varios grupos (7, 9, 11,16, 18).
Tratamiento
No existe una guía con la cual se pueda dirigir el tratamiento del SIP. El éxito del tratamiento depende de un alto índice de sospecha, así como de la realización de un diagnóstico temprano (33).
El principal tratamiento consiste en la prevención. Esta se logra al administrar el medicamento al paciente correcto, bajo las indicaciones correctas, según la dosis y el tiempo recomendado, limitando la infusión a dosis de 4-5 mg/kg/h por no más de 48 h, así como llevando un estricto control y seguimiento de las variables fisiológicas, al igual que de los parámetros de laboratorio (gases arteriales, concentraciones de lactato sérico, CPK, electrolitos, función hepática y renal) que nos pueden indicar el desarrollo temprano del SIP (18, 30).
Como ya se indicó, en el caso de los pacientes pediátricos y adultos en estado crítico, las reservas de carbohidratos se depletan más rápido, por lo que un aporte inadecuado de estos nutrientes promueve la movilización de depósitos de grasa (lo que aumenta su metabolismo) y la carga de ácidos grasos libres circulantes, lo cual predispone al SIP. Entonces, uno de los objetivos de tratamiento es mantener una ingesta de 6 a 8 mg/kg/min de carbohidratos al día para prevenir la aparición del SIP tanto en niños como en adultos (7). Hasta el momento no existe un antídoto o un agente que revierta el efecto del propofol, por lo que si se presentan dos o más síntomas, se debe sospechar el desarrollo del SIP y la infusión se debe suspender inmediatamente y usar una sedación alternativa (3, 30, 34).
Varios estudios han demostrado que la hemodiálisis y la hemodiafiltración, si son requeridas con el fin de disminuir las concentraciones de lípidos y ácidos metabólicos, resultan ser muy efectivas para el manejo de los casos del SIP severo; no obstante, también se ha documentado que estas intervenciones han sido ineficaces en el tratamiento de los casos fatales (20). Al evidenciar colapso cardiovascular, la primera medida debe ser la estabilización hemodinámica del paciente, y en caso de evolución a parada cardiaca, la recomendación es el manejo, según las guías de reanimación cardiopulmonar de la American Heart Association. En algunas circunstancias, el compromiso cardiovascular es resistente al efecto de las catecolaminas, como se mencionó, por lo que en algunos pacientes se debe considerar soporte circulatorio mecánico durante cortos periodos o, incluso, el uso de oxigenación con membrana extracorpórea (3,12, 18, 35).
Dentro de las medidas generales se encuentran mantener una adecuada volemia y oxigenación, para mantener la perfusión a los tejidos y evitar así la producción de lactato. La hiperpotasemia y la rabdomiólisis son indicaciones sólidas para considerar la terapia de remplazo renal en pacientes con acidosis metabólica por SIP; empero el uso de gluconato de calcio, insulina, β2-agonistas, bicarbonato y resinas de intercambio iónico deben instaurarse como parte del manejo inicial de la hiperpotasemia. Las alteraciones electrocardiográficas, como las bradiarritmias, pueden manejarse farmacológicamente o con marcapasos transvenosos, pero la aparición de un patrón electrocardiográfico similar al Brugada se debe considerar un signo precoz de desarrollo de taquiarritmias ventriculares.
Como se mencionó, no existe antídoto para el SIP; pero teniendo en cuenta la posible etiología mitocondrial, podría haber beneficio en la administración de soluciones dextrozadas, realizando un seguimiento con glucómetro o incluso con el uso concomitante de insulina (33).
Conclusiones
El SIP es una complicación rara pero potencialmente fatal del uso de infusiones de propofol a altas dosis (>4-5 mg/kg/h) o durante periodos prolongados (>48 h); sin embargo, se debe tener presente que se han reportado casos en los cuales infusiones cortas y con dosis medias (<4 mg/kg/h) han generado SIP, por lo que en estos casos la sospecha diagnóstica y la vigilancia estricta desempeñan un papel importante en la prevención.
La acidosis metabólica y la insuficiencia cardiaca ocurren temprano y de una manera dependiente de la dosis; mientras que la rabdomiólisis, las arritmias y otros cambios en el electrocardiograma son más dependientes de la duración de la infusión de propofol.
Los datos experimentales sugieren que los signos clínicos tempranos son dependientes de la dosis y pueden ser causados por la inhibición de la cadena de respiratoria; mientras que los signos clínicos tardíos son dependientes del tiempo de infusión y son secundarios a la inhibición de la oxidación de ácidos grasos (8,13).
El SIP tiene una mayor incidencia en pacientes críticamente enfermos, en comparación con pacientes sanos que recibieron propofol para la anestesia de rutina; por lo tanto, la enfermedad crítica actúa como un factor de riesgo para que el propofol desencadene el síndrome.
El tratamiento consiste en la prevención; no obstante, para los casos ya establecidos, además de las medidas de soporte, la terapia de remplazo renal, el soporte cardiovascular, la oxigenación con membrana extracorpórea y la terapia de intercambio plasmático terapéutico, en los casos severos con colapso cardiovascular, son una alternativa terapéutica que se debe considerar.
Así es como recomendamos evitar infusiones mayores 4 mg/kg/h e infusiones de más de 48 h; sin embargo, en casos específicos de requerimiento de sedación prolongada, como lo es la infección respiratoria aguda por SARS-CoV-2, debería realizarse un seguimiento estricto de las concentraciones de CPK y de lactato, para definir de manera temprana la posibilidad de suspender el fármaco y así evitar el desarrollo del síndrome.