Introducción
Es ampliamente conocida la aparición de náuseas y vómitos (NyV), secundaria a la administración de fármacos, en particular aquellos pertenecientes a la familia de los citostáticos. Y esto es una de las principales causas que han motivado la suspensión o, en otros casos, el abandono definitivo del tratamiento. Específicamente en el campo de la hematología, el uso extensivo de estos y otros medicamentos, por ejemplo, los anticuerpos monoclonales, se encuentran altamente asociados con la presencia de NyV (1).
Como consecuencia del mal control de estos síntomas, se pueden desencadenar deshidratación, alteraciones electrolíticas, desnutrición a mediano y largo plazo e insuficiencia renal (2). En vista lo anterior, tanto la prevención como el tratamiento adecuado de los episodios de NyV constituyen grandes determinantes en el momento de definir la continuidad y el adecuado cumplimiento del régimen terapéutico propuesto a nuestros pacientes.
Materiales y métodos
Para la elaboración de este artículo se revisó la literatura sobre el tema publicada entre 2014 y 2020. Las preguntas orientadoras durante esta revisión fueron: ¿cuáles son los factores relacionados con la presencia de NyV en los pacientes oncológicos? ¿Cuáles son los algoritmos vigentes para el tratamiento de NyV relacionados con quimioterapia? Para ello se consultaron las siguientes bases de datos: PubMed (United States National Library of Medicine), SciELO (Biblioteca Científica Electrónica en Línea), LILACS (Literatura Latinoamericana y del Caribe en Ciencias de la Salud) y Google Académico. Como estrategia de búsqueda, se recurrió al uso de términos clave como: náuseas y vómito, quimioterapia y hematología. Además, se incluyeron búsquedas con los términos antes descritos, traducidos al inglés. Se tomaron en cuenta: metanálisis, guías de práctica clínica y ensayos clínicos aleatorizados en idioma castellano o en inglés. Posteriormente, se usó una segunda estrategia, basada en la revisión manual de cada uno de los artículos preseleccionados, luego de lo cual se escogieron solo aquellos cuyo tema principal fuera: NyV inducido por quimioterapia en pacientes con enfermedad hematológica. Así mismo, se tomaron como referencia las guías de Sociedad Norteamericana de Oncología Clínica (ASCO) y la Sociedad Europea de Oncología Médica. Luego de seleccionar las referencias bibliográficas, que requirió la aprobación del 80 % del panel de autores, se elaboró el contenido de este artículo, inicialmente bajo la forma narrativa y, posteriormente, analizando las estrategias para el manejo de NyV según la evidencia disponible.
Resultados
Se analizaron un total de 100 artículos, de los cuales se eligieron 40 para una segunda etapa de revisión. Al final se seleccionaron 30 que cumplieron con los criterios de inclusión para formar parte de la revisión. En función de la base de datos empleada, 14 de los artículos escogidos fueron de PubMed; 8, de SciELO; 6, de LILACS, y 2, de Google Académico.
Cada una de las referencias citadas para el manejo de NyV se clasificaron según el nivel de evidencia planteado por Sackett en los siguientes grados de recomendación: grado A (niveles 1a y 1b): evidencia fuerte (revisión sistemática o metanálisis y ensayos clínicos aleatorizados); grado B ( niveles 2a, 2b, 3a, 3b): evidencia fuerte/moderada (estudios de cohortes y casos y controles con buena calidad metodológica); grado C (nivel 4): evidencia baja (estudios de cohortes y casos y controles con baja calidad metodológica); grado D (nivel 5): evidencia débil (opinión de expertos) (3).
Mecanismo fisiopatológico del desarrollo de náuseas y vómito
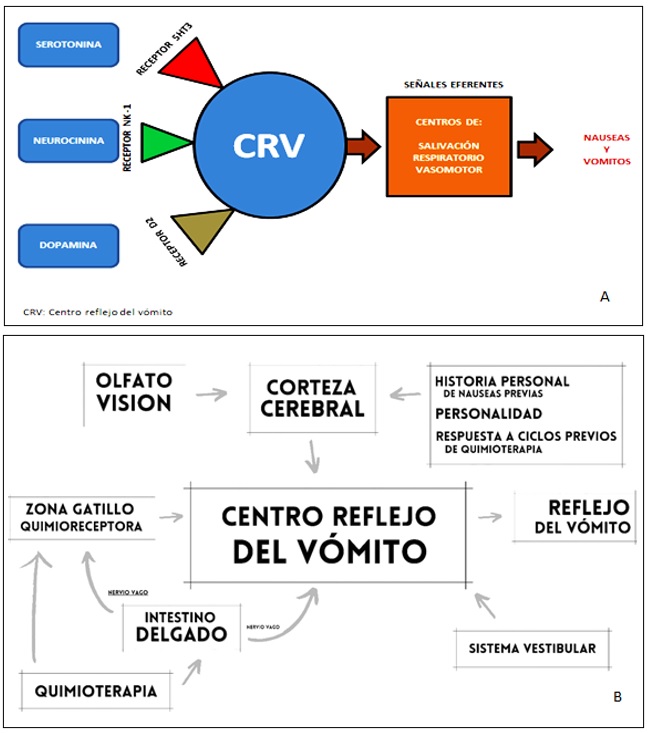
El origen de las NyV resulta de la interacción entre múltiples estructuras, a saber: el centro reflejo del vómito (CRV), la zona quimiorreceptora gatillo (ZQG) y las aferencias centrales y periféricas de estas dos.
Respecto a la ZQG, se encuentra en el área postrema localizada en el piso del cuarto ventrículo, lugar donde la barrera hematoencefálica no está lo suficientemente desarrollada y la lleva a ser susceptible de recibir estímulos emetogénicos, entre los cuales se incluyen las drogas usadas para el tratamiento con quimioterapia, así como los trastornos metabólicos (por ejemplo, los asociados a elevación de la urea e hipercalcemia). Una vez que se estimula la ZQG, transmite señales de activación al centro reflejo del vómito, que consiste en una amplia red neuronal que integra los estímulos emetogénicos de la ZQC y otras aferencias provenientes del nervio vago y nervios esplácnicos, glosofaríngeo y aferencias provenientes de la corteza y el sistema vestibular, que se localizan en la formación reticular del tronco encefálico.
En el contexto de las NyV por quimioterapia, el CRV lo activan receptores serotoninérgicos (5HT), dopaminérgicos (D2) y de neurocinina (NK-1), a través de mediadores humorales, donde la estimulación de receptores 5HT3, 5HT2 y D2 está asociada al desarrollo de eventos de NyV agudos y a la estimulación de receptores NK-1, relacionada con episodios tardíos (4, 5).
Una vez estimulado el CRV, será el encargado de trasmitir señales eferentes a través de los nervios vago y frénico hacia el centro de salivación, estómago, diafragma y músculos abdominales, con la finalidad de lograr el aumento de la presión dentro de la cámara gástrica y posterior expulsión del contenido intracavitario al exterior (5, 6). Si bien en términos generales los mecanismos generadores de NyV se corresponden de forma total o parcial con lo descrito, en la actualidad se tiene poca información acerca de la fisiología del vómito inducido por quimioterapia, aunque se conoce que a través de la estimulación de vías periféricas mediadas principalmente por serotonina y las vías centrales mediadas por neurocinina logran activar el CRV con la consecuente aparición de síntomas (figura 1).
Clasificación de las náuseas y vómito inducidos por quimioterapia
Agudos: aparecen durante las primeras 24 horas luego de la administración del esquema de quimioterapia (7).
Tardíos: aparecen luego de las 24 horas de administración y, habitualmente, persisten hasta los 5 días posteriores a la infusión (7).
NyV anticipatorios: obedecen a una respuesta condicionada del individuo luego de haber presentado un episodio de NyV en ciclos anteriores. Dado que su fisiopatología y tratamiento son distintos, tendrán un apartado específico (8).
NyV irruptivos: aquellos cuya manifestación se lleva a cabo durante la quimioterapia, a pesar de la instauración de un esquema adecuado de profilaxis antiemética (8).
NyV refractarios: aquellos cuya aparición persiste en ciclos sucesivos de quimioterapia, a pesar de la administración del esquema de profilaxis antiemética acorde (8).
Factores de riesgo para el desarrollo de las náuseas y los vómitos inducidos por quimioterapia
Existen distintos factores que pueden aumentar la probabilidad de ocurrencia de las NyV en los pacientes sometidos a tratamiento con quimioterapia. Estos deben evaluarse de forma sistemática para cada paciente en particular y no solamente a la luz del fármaco que se va a utilizar. Con base en lo antedicho, podemos clasificar los factores de riesgo como aquellos dependientes del paciente y aquellos dependientes del esquema de quimioterapia.
Factores de riesgo dependientes del paciente
Sexo femenino. Es uno de los factores de riesgo con mayor aceptación, dado que ha sido encontrado como un factor de riesgo independiente en múltiples estudios (8, 9,10). El más relevante es el trabajo de Suji et al. (10), en el cual se llevó a cabo una regresión logística multivariada para identificar los factores de riesgo independientes sobre 825 pacientes bajo tratamiento con cisplatino y triple esquema antiemético, incluidos granisetrón o palonosetrón (10).
Edad. Si bien el límite de edad varía entre 55 y 60 años, según los estudios evaluados, existe evidencia de que en pacientes menores de 60 años existe un aumento del riesgo de NyV.
Estatus performance medido por la escala ECOG. El ECOG mayor o igual a 1 se asocia con mayor riesgo de NyV, aunque este hallazgo fue demostrado solo para las náuseas de inicio tardío (11).
Consumo de alcohol. El consumo de alcohol de forma crónica fue encontrado como factor protector para la aparición de NyV de inicio tardío en hombres. Este hallazgo no presenta explicación por el momento, aunque podría deberse al daño crónico sobre la ZQG inducida por el alcohol.
Historia de cinetosis. Este antecedente fue encontrado en múltiples estudios como un factor de riesgo independiente (11).
Factores de riesgo relacionados con los medicamentos usados en hematooncología
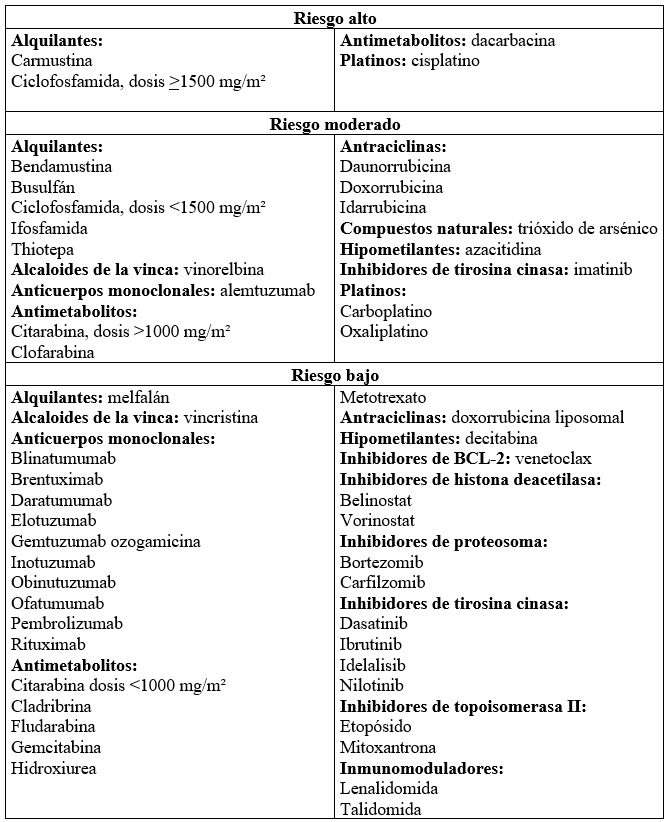
Existen diferentes subgrupos de medicamentos dentro de la familia de los citostáticos frecuentemente usados en el tratamiento de enfermedades hematológicas. En 2019, la ASCO reunió un grupo de expertos que, a partir de la revisión de la literatura sumada a su experticia clínica, se dieron a la tarea de clasificar los diferentes fármacos empleados en tratamientos oncológicos en función de su potencial emetogénico. Este se dividió en tres categorías (tabla 1): riesgo alto (episodios de NyV reportados entre el 30 % y el 90 % de los pacientes tratados), riesgo moderado (entre el 10 % y el 30 %) y riesgo bajo (menos del 10 % de episodios de NyV). Una vez realizado el consenso, se redactó un documento con recomendaciones para el tratamiento de NyV (12,13).
Medicamentos empleados con frecuencia para el manejo de náuseas y vómito
Si bien en la actualidad se tiene conocimiento y disponibilidad de acceso a una variedad de fármacos identificados como antieméticos, la finalidad del presente artículo es mencionar aquellos sobre los cuales se tenga mayor experiencia de uso en pacientes oncohematológicos. Así es como tales medicamentos, en función de su mecanismo de acción, se identifican dentro de los siguientes grupos:
Antagonistas del receptor de serotonina 3
El mecanismo de acción en este grupo de fármacos se da mediante el bloqueo de receptores tipo 5HT3 localizados a nivel central, además de aquellos ubicados en otras zonas como las fibras vagales aferentes del tracto gastrointestinal (14,15). Pertenecen a este grupo el ondansetrón, el granisetrón, el dolasetrón y el palonosetrón, actualmente disponibles en el país. Su principal efecto es en las náuseas de inicio agudo. Los efectos adversos principales para tener en cuenta de este grupo de drogas son la cefalea, la constipación y la prolongación del intervalo QT corregido (QTc) (16).
Algunas guías de manejo internacional ubican al palonosetrón como el antagonista del receptor 5HT3 de elección, principalmente por su vida media prolongada, por la menor tasa de prolongación del intervalo QTc y por estudios que justifican una mayor tasa de respuesta completa de las náuseas de inicio agudo (17,18). Sin embargo, algunos estudios han demostrado que el ondansetrón no es inferior al palonosetrón, motivo por el que puede utilizarse el primero como primera línea, dado que se encuentra más disponible en nuestro medio(18).
Antagonistas del receptor de neurocinina
Estos medicamentos inhiben selectivamente los receptores de la sustancia P (neurocinina 1 o NK-1), localizados en el tronco encefálico y relacionados con los eventos de emesis tardía, por lo que su principal virtud reside en su capacidad de bloquear episodios de NyV que puedan aparecer tras 24 horas o más de administrada la quimioterapia (19). Dentro de este grupo están incluidos: aprepitant, fosaprepitant, netupitant y rolapitant. En nuestro medio, el más utilizado es el aprepitant (20).
El aprepitant, en combinación con dexametasona y granisetrón, demostró ser superior al esquema sin aprepitant para lograr la respuesta completa en el caso de las NyV tardíos en pacientes que recibieron quimioterapia con alto riesgo de emetogenicidad, aunque no mostró diferencias en las NyV agudas (20, 21). Otro trabajo demostró hallazgos similares para el fosaprepitant en dosis única de 150 mg por vía endovenosa en combinación con ondansetrón y dexametasona para pacientes con quimioterapia con moderada emetogenicidad (22).
Por último, merece la pena mencionar el trabajo realizado por Hesketh et al. (21), en 2014, que evaluó la combinación de netupitant en dosis de 100, 200 o 300 mg más 0,5 mg de palonosetrón frente a 0,5 mg orales de palonosetrón en pacientes que recibieron quimioterapia con alto riesgo de emetogenicidad. El netupitant fue superior al palonosetrón en las tres dosis para prevenir las náuseas tardías, aunque el mayor beneficio se vio en los 300 mg. Respecto a la seguridad, los efectos adversos de los antagonistas del receptor de neurocinina 1 han demostrado ser seguros en todos los trabajos antedichos, y los efectos adversos más frecuentes son la fatiga, la constipación y, en algunos casos, diarrea como efecto paradójico (23).
En resumen, los antagonistas del receptor de neurocinina demostraron ser más efectivos que la terapia doble (dexametasona y antagonistas del receptor de serotonina) e igualmente seguros para la profilaxis de las NyV tardíos en esquemas de moderada y alta emetogenicidad. La respuesta preferencial sobre las NyV tardíos es consistente con el mecanismo fisiopatológico de los mismos (24).
Dexametasona
La dexametasona demostró aumentar el efecto de los antagonistas del receptor de serotonina 3 tanto en las NyV agudas como en las tardías. La inhibición del CYP3A4, producida por aprepitant y netupitant, debe tenerse en cuenta, porque aumenta las concentraciones de la dexametasona (20). La principal limitante de este fármaco se debe a los efectos adversos, principalmente al insomnio que produce en las dosis que suelen utilizarse para el tratamiento de las NyV (tabla 2).
Antagonistas de la dopamina
Su efecto es mediado por el bloqueo de los receptores de dopamina, particularmente los D2 de estimulación quimioceptora, así como los localizados en el CRV. La metoclopramida pertenece a esta familia de medicamentos (25). Es importante mencionar que la metoclopramida no suele recomendarse en la profilaxis, dado que las dosis que han demostrado efecto favorable son de 20 mg cada 6 horas, y estas presentan riesgo de efectos extrapiramidales.
Otros fármacos
Dentro de este grupo podemos clasificar a los benzodiacepinas y a los antipsicóticos, como la olanzapina y el haloperidol, cuyo efecto sobre los episodios de NyV es de leve a moderado, si se usan de forma individual; sin embargo, se ha demostrado que su asociación con regímenes terapéuticos en los que se incluyan antagonistas de 5HT3 o NK-1 contribuyen a potenciar de modo global el efecto antiemético (26, 27).
Esquemas para la prevención y manejo de náuseas y vómito asociado a quimioterapia
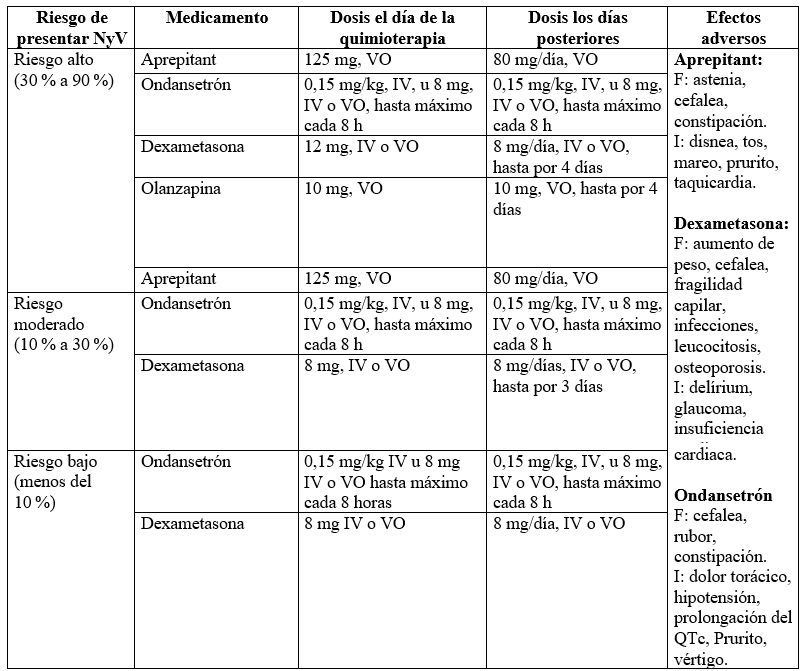
Para la edición de este apartado se tomó en cuenta nuevamente la clasificación de medicamentos según su grado de asociación con NyV emitidas por la ASCO y la revisión de la literatura realizada, y a partir de ello se definió el manejo más apropiado según cada caso. Respecto de los esquemas terapéuticos empleados, se evidenció en toda la literatura consultada que estos guardaban un alto grado de similaridad; por otra parte, se incluyeron solo medicamentos disponibles en el país. Por ello, en función del riesgo de desarrollar NyV se describen a continuación los siguientes esquemas (13, 28, 29):
Riesgo alto:
Esquema de manejo propuesto: uso combinado de cuatro fármacos (nivel 2 grado de recomendación B):
Antagonista de receptor de neurocinina (NK1)A
Antagonista del receptor de serotonina (5HT3)A
DexametasonaA
OlanzapinaA, B
Riesgo moderado:
Esquema de manejo propuesto: uso combinado de tres fármacos (nivel 2 grado de recomendación B):
Antagonista de receptor de neurocinina (NK1)A
Antagonista del receptor de serotonina (5HT3)A
DexametasonaA
Riesgo bajo:
Esquema de manejo propuesto: uso de un fármaco entre dos opciones disponibles (nivel 2 grado de recomendación B):
La letra A en superíndice indica que se pueden ver las opciones de medicación disponible y dosis en la tabla 2, que se pueden remplazar por lorazepam o alprazolam, según el criterio médico.
En el caso de tratamientos con quimioterapia de dos o más días de duración, es recomendable la continuación del esquema para la prevención de las NyV hasta dos días luego de finalizado el tratamiento oncológico.
Náuseas y vómitos anticipatorios
Pueden afectar entre el 8 % y el 14 % de los pacientes según el número de ciclo de quimioterapia evaluado. Los factores de riesgo más relevantes para el desarrollo de este tipo de náuseas son la aparición de NyV en el ciclo anterior y la presencia de ansiedad (28).
Dado su mecanismo fisiopatológico, suelen ser resistentes al tratamiento con antieméticos, por lo que el mejor método profiláctico es el adecuado manejo de las NyV durante cada ciclo.
El tratamiento farmacológico con mayor evidencia para este tipo de NyV consiste en el uso de benzodiacepinas, principalmente con el uso de lorazepam o alprazolam (30).
Náuseas y vómitos refractarios
En estos pacientes es principal determinar aquellos factores de riesgo dependientes de ellos que puedan desempeñar algún rol en la refractariedad, a pesar del tratamiento indicado. Dentro de estos factores de riesgo, debe considerarse la posibilidad de un componente de ansiedad en relación con la refractariedad. Si ese es el caso, los pacientes pueden beneficiarse del agregado de lorazepam o alprazolam.
Además de lo antedicho, si el paciente no estaba bajo un régimen de cuatro drogas, debe considerarse el agregado de olanzapina al esquema de profilaxis, dado que se ha demostrado que el agregado de esta última a un régimen de triple terapia puede lograr una eficacia de hasta el 70 % en el contexto de las NyV refractarias.
En caso de no lograr el control de los síntomas con el agregado de olanzapina o si el paciente ya presentaba un esquema con cuatro drogas, se puede rotar el antagonista de receptores de serotonina y el de neurocinina. Una buena opción es la combinación de 0,5 mg de palonosetrón con 300 mg de netupitant, aunque existe escasa evidencia de que esta rotación presente mayor efectividad (28, 29, 30).
Conclusión
Las NyV inducidas por quimioterapia representan un síntoma altamente incómodo para los pacientes y, además, se asocian con la posibilidad de complicaciones clínicas producto de la deshidratación o a la aparición de NyV anticipatorios, que pueden ser de difícil manejo. Desde esta perspectiva, se han desarrollado diferentes guías de manejo evocadas al abordaje de pacientes oncológicos en general; sin embargo, desde el punto de vista de la hematología, el desarrollo durante los últimos 10 años de un número considerable de nuevos fármacos para el tratamiento de enfermedades oncohematológicas hace necesario el desarrollo de trabajos enfocados en el abordaje de NyV relacionados con fármacos de uso común para esta especialidad. La creación de un algoritmo acorde para la prevención o tratamiento requiere una estrategia basada en la fisiopatología de las náuseas y vómitos. Igualmente, es importante la consideración de planes de tratamiento adaptados al riesgo de desarrollo de NyV según el agente específico.