Introducción
La infección por el virus SARS-CoV-2 y la enfermedad generada por este, la COVID-19, han tenido un gran impacto en la morbimortalidad mundial. A pesar de los esfuerzos para mitigar la pandemia, esta situación ha generado un gran número de decesos, sobre todo en Brasil y México, que han sido dos los países más afectados, al ocupar el segundo y tercer lugar en mortalidad por la COVID-19, respectivamente. El objetivo de este artículo es comprender y conocer de manera concisa y clara la información publicada hasta la fecha para el conocimiento del personal de salud sobre los conceptos básicos, datos estadísticos, clínicos, diagnósticos, terapéuticos, secuelas y complicaciones, así como algunos aspectos relacionados a la vacunación, en relación con la infección por el virus SARS-CoV-2.
Aspectos microbiológicos de los coronavirus
Los coronavirus son una familia muy diversa de virus de ARN monocatenario de sentido positivo con envoltura, cuyo diámetro aproximado es de 125 nm, y denominados de esta manera, debido a la apariencia similar a una corona, al ser vistos a través del microscopio electrónico. Se considera que tienen el genoma más grande de los virus ARN con un tamaño de 26-32 kilobases, el cual codifica cuatro proteínas estructurales que incluyen: glicoproteína espiga (S), envoltura (E), membrana (M) y nucleocápside (N), así como la hemaglutinina esterasa (HE) y otras 16 proteínas no estructurales que participan en la transcripción y replicación viral, como la helicasa y la ARN polimerasa dependiente de ARN (1) (figura 1).
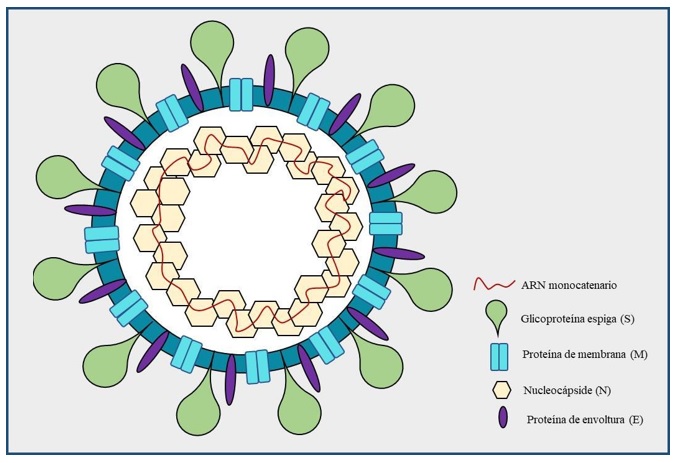
Figura 1 Estructura del virión de los coronavirus se observa cada una de las proteínas y distribución que conforman a los coronavirus
De acuerdo con el Comité Internacional de Taxonomía del Virus, pertenecen al orden Nidovirales, suborden Cornidovirinae, familia Coronaviridae, subfamilia Orthocoronavirinae, que consta de cuatro géneros: alfacoronavirus, betacoronavirus, gammacoronavirus y deltacoronavirus (2). Mientras los dos primeros infectan exclusivamente al ser humano y mamíferos, los últimos dos abarcan una gama de hospederos más amplia, incluyendo algunas especies de aves. Las infecciones por coronavirus humanos y animales resultan principalmente en enfermedades respiratorias.
Desde hace años, se conoce que los coronavirus humanos, como el HCoV-229E y el HCoV-OC43, circulan en la población; además, los más recientemente identificados, HCoV-NL63 y HCoV-HKU1, causan infecciones respiratorias estacionales, generalmente leves, asociadas con síntomas del resfriado común. En contraste, el coronavirus del síndrome respiratorio agudo severo (SARS-CoV), el coronavirus del síndrome respiratorio de Medio Oriente (MERS-CoV) y el SARS-CoV-2, que han surgido en la población humana durante los últimos años, son altamente patógenos, dado que al infectar las células del tracto respiratorio superior, del epitelio bronquial y los neumocitos en humanos, las infecciones por SARS-CoV, MERS-CoV y SARS-CoV-2 pueden convertirse en patologías respiratorias graves potencialmente mortales y originar lesiones pulmonares para las que no existe un tratamiento profiláctico o terapéutico específico hasta la fecha (1,3).
El virus del síndrome respiratorio agudo severo por coronavirus 2 (SARS-CoV-2) es un betacoronavirus que produce la enfermedad conocida como COVID-19 (coronavirus disease 2019).
Antecedentes históricos
31 diciembre del 2019: se reporta al mundo, por primera vez, el nuevo coronavirus identificado en personas que desarrollaron neumonía severa de causa desconocida en Wuhan (China) (4).
3 de enero del 2020: la Organización Mundial de la Salud (OMS) recibe información de funcionarios chinos sobre el conglomerado de casos de “neumonía vírica de origen desconocido” (4).
9 de enero del 2020: las autoridades chinas informan del nuevo coronavirus ante la OMS, conocida inicialmente como 2019-nCoV (4).
12 de enero del 2020: China hace pública la secuencia genética del virus (4).
30 de enero del 2020: la OMS declara el brote de la infección como una emergencia de salud pública de importancia internacional (4).
11 de febrero del 2020: la OMS declara el nombre oficial de la enfermedad producida por SARS-CoV-2 como COVID-19 (4).
28 de febrero del 2020: se reporta el primer caso de COVID-19 en México.
2 de marzo del 2020: se obtiene la secuencia genética del virus SARS-CoV-2 del caso reportado en México.
11 de marzo del 2020: la OMS declara la situación de la infección como pandemia (4).
11 de abril del 2020: la OMS publica un borrador del panorama de las vacunas candidatas contra el virus que causa la COVID-19 (4).
15 de mayo del 2020: la OMS publica el informe del síndrome inflamatorio multisistémico en niños y adolescentes, relacionado con la COVID-19 (4).
16 de junio del 2020: se recomienda como estándar de tratamiento el uso de dexametasona en pacientes con COVID-19 en estado crítico (4).
4 de julio del 2020: la OMS anuncia la interrupción del uso de la hidroxicloroquina y del lopinavir/ritonavir de los estudios Recovery y Solidaridad, debido a la falta de efectividad como tratamiento contra la COVID-19 (4).
22 de septiembre del 2020: la OMS publica la autorización para el uso de emergencia de una prueba de diagnóstico rápido basada en antígenos para detectar el virus del SARS-CoV-2 (4).
15 de octubre del 2020: la OMS anuncia que los regímenes terapéuticos con hidroxicloroquina, lopinavir/ritonavir e interferón parecen tener poco o ningún efecto en la mortalidad a los 28 días o en la evolución hospitalaria de los pacientes con COVID-19 (4).
5 de noviembre del 2020: Dinamarca informa de una variante del virus SARS-CoV-2 asociada a visones, denominada cluster 5, que es altamente mortal (4).
20 de noviembre del 2020: la OMS publica al personal médico una orientación sobre opciones terapéuticas y COVID-19, en la cual no se recomienda el uso de remdesivir en pacientes hospitalizados, independientemente de la gravedad (4).
14 de diciembre del 2020: el Reino Unido e Irlanda del Norte reportan ante la OMS la identificación de una nueva variante del virus llamada B.1.1.7, también conocida como SARS-CoV-2 VOC 202012/01 (variante preocupante, año 2020, mes 12, variante 01) o 20I/501Y.V1, que se define por la presencia de un rango de 14 mutaciones en cambios de aminoácidos y tres deleciones; así como una propagación más fácil y rápida, entre un 40-70 % de mayor transmisibilidad (4, 5, 6, 7).
18 de diciembre del 2020: Sudáfrica anuncia la detección de una nueva variante del virus, conocida como B.1.351 o 20H/501Y.V2, debido a una mutación N501Y. Esta variante comparte algunas mutaciones con B.1.1.7 (4).
31 de diciembre del 2020: la vacuna Pfizer/BioNTech (BNT162b1) es la primera en recibir validación por parte de la OMS para su uso de emergencia por su eficacia contra la COVID-19 (4).
12 de enero del 2021: Japón notifica a la OMS la existencia de una variante del SARS-CoV-2 conocida como P.1 o 20J/501Y.V3, que se identificó tras la secuenciación genética de virus aislados de viajeros procedentes de Brasil (4, 6, 7). Por otra parte, un estudio que monitorizó los cambios genéticos de aminoácidos en la proteína S del SARS-CoV-2 identificó una sustitución de D614G (glicina por ácido aspártico) que con el tiempo se convirtió en el polimorfismo dominante en el mundo: polimorfismo G614 (7, 8).
15 de febrero del 2021: la OMS incluye la vacuna de Oxford-AstraZeneca (ChAdOx1-S) en su lista de uso de emergencia contra la COVID-19 (4).
12 de marzo del 2021: la OMS añade la vacuna de Janssen (Ad26.COV2.S) como la tercera en su lista de uso de emergencia contra la COVID-19, que es de una sola dosis para facilitar la distribución logística en todos los países (4).
Aspectos epidemiológicos
Desde el inicio de la pandemia y hasta el 6 de abril del 2021 se calculan 132.293.566 casos confirmados de COVID-19; 2.871.642 defunciones y 75.121.408 personas recuperadas de la enfermedad (9).
Estados Unidos, India y Brasil representan los primeros tres países con mayor número de casos con la enfermedad COVID-19; sin embargo, México ocupa el tercer lugar mundial con mayor número de decesos, precedido por Estados Unidos y Brasil (9).
En Latinoamérica, los datos obtenidos al momento de escribir este artículo posicionan entre los países con mayor número de casos confirmados, en orden descendente, a Brasil (13.100.580), Colombia (2.468.236), Argentina (2.428.029), México (2.256.509) y Perú (1.590.209); en cambio, los decesos son mayores en Brasil (336.947), México (204.985), Colombia (64.524), Argentina (56.634) y Perú (53.138). Por otro lado, el índice de letalidad de los países latinoamericanos es mayor en México (9 %), Ecuador (5 %) y Bolivia (4 %) (9) (figura 2).
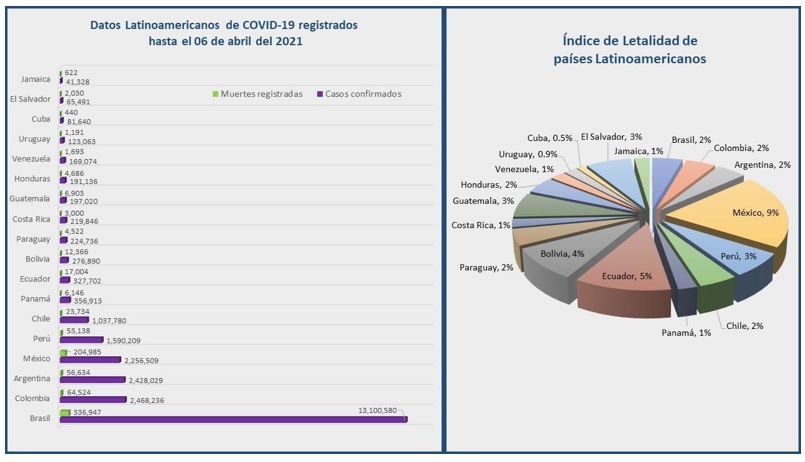
Figura 2. Del lado izquierdo se observan los datos reportados de los países latinoamericanos con mayor número de casos confirmados de COVID-19, así como el número de decesos de cada uno. Del lado derecho se presenta el índice de letalidad de los datos presentados del lado izquierdo de los distintos países latinoamericanos hasta el 6 de abril del 2021 (9)
En México se han registrado 2.256.380 casos confirmados; 441.464 casos sospechosos; 205.002 defunciones y 1.795.213 casos recuperados, desde el inicio de la pandemia hasta el 6 de abril del 2021, con una tasa de letalidad del 9 %. Se ha observado que los estados con mayor afectación, de mayor a menor prevalencia, son la Ciudad de México (614.446 casos), Estado de México (235.312 casos), Guanajuato (128.241 casos) y Nuevo León (120.335 casos). En cambio, los estados que han reportado una menor prevalencia son Campeche (9049 casos), Chiapas (10.527 casos), Colima (10.869 casos) y Nayarit (11.381 casos) (10).
La mayor prevalencia de la infección por el virus SARS-CoV-2 ocurre en el género masculino (50,1 %), comparada con el género femenino (49,9 %). En la población masculina prevalece entre los 0 y los 14 años de edad, y en los mayores de 55 años; mientras que en la población femenina prevalece entre los 15 y los 54 años. De estas cifras, la población en mayor riesgo es aquella que se encuentra entre los 20 y los 64 años, con un pico máximo entre los 25 y los 55 años, que es la población económicamente activa (10) (figura 3).
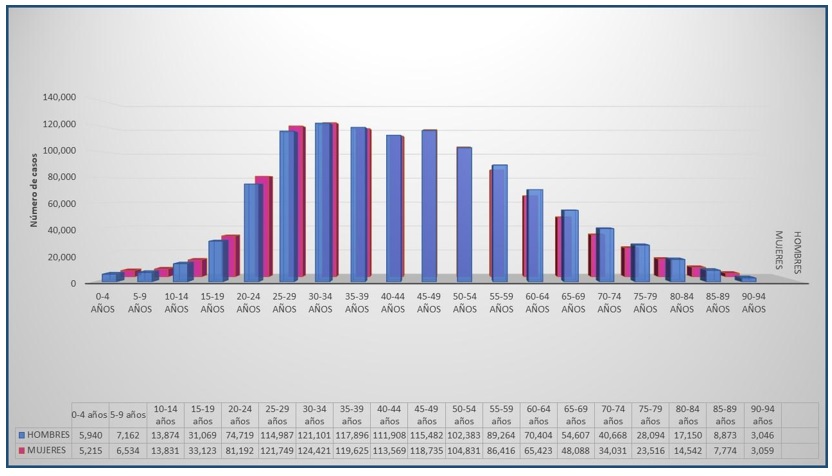
Figura 3 Número de casos de COVID-19 según el rango de edad y género en México hasta el 6 de abril del 2021 (10)
Factores de riesgo
La presencia de comorbilidades en la población ocasiona que la COVID-19 pueda dar manifestaciones clínicas que lleven al desarrollo de una enfermedad severa y la muerte del paciente. Se han detectado entre los principales factores de riesgo los siguientes (11):
Hipertensión arterial sistémica.
Obesidad.
Diabetes mellitus.
Tabaquismo.
Género masculino.
Personas mayores de 60 años.
Cáncer.
Enfermedad pulmonar obstructiva crónica, asma o neumopatías.
Nefropatías.
Cardiopatías (insuficiencia cardiaca, enfermedad coronaria, cardiomiopatías o hipertensión pulmonar).
Hepatopatías (cirrosis hepática, hígado graso, etc.).
Neuropatías (demencia, eventos vasculares cerebrales, epilepsia).
Inmunocompromiso, VIH, uso de corticoesteroides, uso de inmunomodulares, trasplantes.
Síndrome de Down.
Embarazo.
Alteraciones hematológicas (anemia drepanocítica o talasemia).
Patogenia
La infección por el virus SARS-CoV-2 se adquiere a través de la vía aérea, al estar expuesto a las partículas virales emitidas de persona a persona a través de gotas de Flügge, ya sea al toser, hablar o estornudar; así también por medio de aerosoles o por contacto (12).
El receptor de la enzima convertidora de angiotensina 2 (ACE2) permite la entrada del virión del SARS-CoV-2 a las células del hospedero a través de su fijación con la proteína S, además de la proteasa celular, TMPRSS (7). El receptor ACE2 se localiza en distintos tejidos corporales que incluyen pulmones, corazón, endotelio vascular, hígado, intestino, riñones y testículo; de ahí la generación de diversas manifestaciones clínicas. Posteriormente, tiene lugar la fusión de las membranas que permiten la liberación del ARN viral dentro de la célula. El ARN viral inicia la traducción de proteínas virales y la replicación del genoma en el citosol (el ARN viral no interactúa con el genoma de la célula del hospedero) para así formar nuevos viriones completos del SARS-CoV-2 que se diseminan para infectar otras células del organismo. La presencia de viriones en la circulación permite el reconocimiento de su proteína S y la nucleocápside por el receptor de células linfocíticas B, el cual se encargará de producir anticuerpos de unión a la glucoproteína espiga y anticuerpos neutralizantes hacia la misma proteína estructural. Los viriones posteriormente serán reconocidos por las células presentadoras de antígenos, que presentarán los epítopos de las proteínas estructurales y no estructurales a las células linfocíticas T (13).
Las proteínas virales pueden ser reconocidas por receptores de reconocimiento de patrones TLR3, TLR4 y TLR7 (TLR, por sus siglas en inglés) que conducen a la liberación de patrones moleculares asociados al daño y patrones moleculares asociados a patógenos (DAMP y PAMP, respectivamente, por sus siglas en inglés), la respuesta inflamatoria y la activación de vías antivirales innatas. La activación de células Th1, junto con los macrófagos y células dendríticas, desencadena una respuesta inmune inicial, que incluye una linfocitosis y producción de citocinas proinflamatorias, principalmente IL-1, IL-2, IL-6, IFN-γ y TNF-α; mientras que el reconocimiento de las células citotóxicas provocará la destrucción de las células infectadas. Sin embargo, la respuesta inflamatoria da como resultado la destrucción de los linfocitos que intentan detener la infección por SARS-CoV-2, que originan un estado de linfopenia, especialmente en pacientes gravemente afectados. La producción de citocinas se desregula rápidamente, con la llamada hipercitocinemia, que daña las células sanas y da como resultado un daño a la barrera epitelial de los pulmones, pero que potencialmente se extiende a otros órganos como son los riñones, el corazón, los vasos sanguíneos y el cerebro. Esta ruptura de la barrera epitelial expone a los pulmones y demás tejidos a una infección bacteriana. La respuesta inflamatoria sistémica incrementada puede ocasionar una falla orgánica múltiple (14) (figura 4).
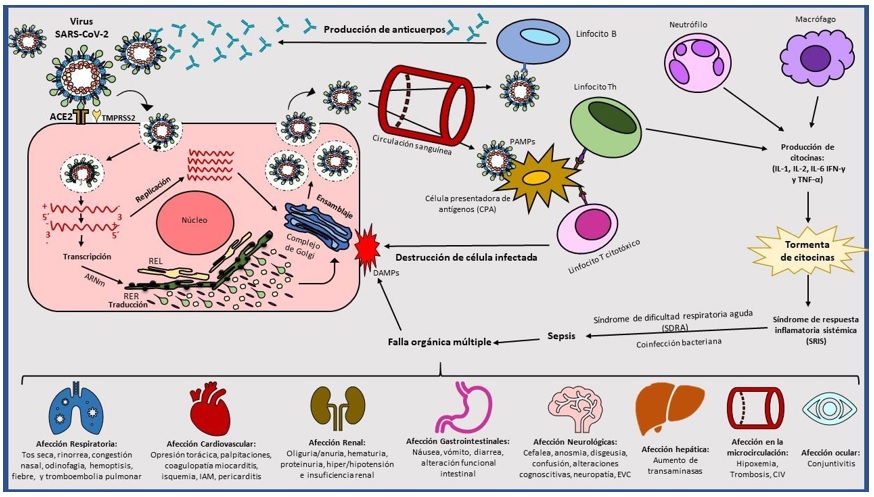
Figura 4 Eventos patogénicos desencadenados por la infección por el virus SARSCoV2SARS-CoV-2: síndrome respiratorio agudo severo por coronavirus 2; ACE2: receptor de la enzima convertidora de angiotensina 2; REL: retículo endoplásmico liso; RER: retículo endoplásmico rugoso; PAMP: patrones moleculares asociados a patógenos; DAMP: patrones moleculares asociados a daño; CPA: célula presentadora de antígenos; IL: interleucina; TNF: factor de necrosis tumoral; IFN: interferón; SRIS: síndrome de respuesta inflamatoria sistémica; SDRA: síndrome de dificultad respiratoria aguada; IAM: infarto agudo de miocardio; EVC: evento vascular cerebral; CIV: coagulación intravascular.
Manifestaciones clínicas
El periodo de incubación de la COVID-19 puede ser de hasta 14 días (media de 5-7 días) desde la exposición hasta la aparición de los síntomas. Se estima que el 95 % de las personas con COVID-19 que tienen síntomas lo harán dentro de los 11,5 días de la infección por SARS-CoV-2 (15,16).
La infección por SARS-CoV-2 puede dar una amplia gama de manifestaciones clínicas que varía de persona a persona; por ello, se deberá descartar, en primer lugar, la enfermedad por COVID-19 y establecer diagnósticos diferenciales con otras enfermedades infecciosas. De ahí que se hayan creado algoritmos diagnósticos y terapéuticos, con la información hasta ahora conocida, para el manejo de los pacientes enfermos por COVID-19.
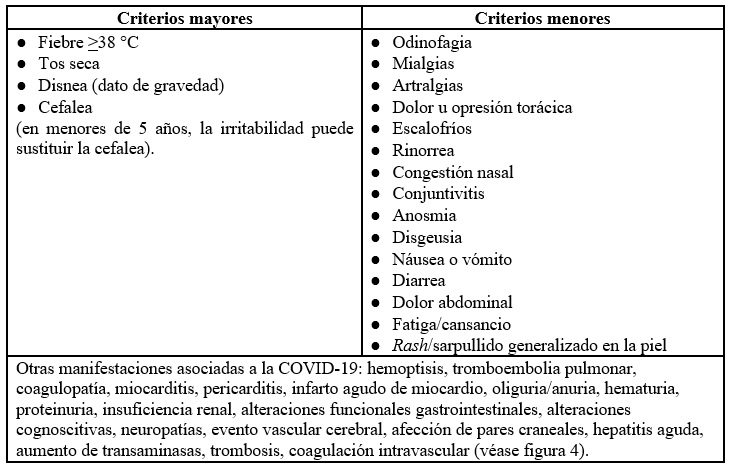
Una gran parte de la población cursará de manera asintomática (30-40 %), mientras que otras desarrollarán algún signo o síntoma. Se determinará como “caso sospechoso” al paciente que presente, al menos, un signo o síntoma mayor más uno menor en los últimos 7 días (17) (tabla 1).
Tabla 1 Principales manifestaciones clínicas asociadas a la COVID19Otras manifestaciones asociadas a la COVID-19: hemoptisis, tromboembolia pulmonar, coagulopatía, miocarditis, pericarditis, infarto agudo de miocardio, oliguria/anuria, hematuria, proteinuria, insuficiencia renal, alteraciones funcionales gastrointestinales, alteraciones cognoscitivas, neuropatías, evento vascular cerebral, afección de pares craneales, hepatitis aguda, aumento de transaminasas, trombosis, coagulación intravascular (véase figura 4).
En caso de cumplir con los criterios de caso sospechoso se evaluarán condiciones de gravedad como:
Frecuencia respiratoria (FR) >30 rpm.
Saturación de oxígeno (SpO₂) <90 %.
Hipotensión.
Hiporreactividad en niños.
Hipotermia en adultos mayores.
Otros datos francos de dificultad respiratoria.
También se deberán investigar condiciones médicas especiales por la gravedad de la enfermedad, como son embarazo, estado de inmunosupresión, enfermedad pulmonar previa, diabetes mellitus o hipertensión arterial sistémica, niños <5 años, adultos >65 años, o la presencia de obesidad (17). Los datos de alarma en todo paciente con COVID-19 son (17):
Disnea.
Exacerbación de síntomas cardiovasculares o respiratorios en enfermos crónicos.
Oximetría de pulso <90 % al aire ambiente.
Abundantes secreciones.
Trastorno del estado de conciencia.
Taquipnea.
Vómito o diarrea persistente.
Hipotensión arterial (PAS: <90 mmHg; PAM <60 mmHg; disminución de la PAS habitual).
Descontrol glucémico.
Síndromes pleuropulmonares.
Clasificación de gravedad de la infección por la COVID-19
La cohorte más significativa reportada hasta la fecha, que incluye 72.000 personas con COVID-19, mostró que la gravedad de la enfermedad puede variar de leve a crítica (16,18):
Enfermedad leve: la enfermedad leve y moderada representan el 81 %. En la primera se incluyen pacientes sintomáticos que cumplen criterios confirmatorios de COVID-19, con ausencia de signos de neumonía viral o hipoxia (19).
-
Enfermedad moderada-neumonía leve:
-
Enfermedad grave-neumonía grave (14 %):
Pacientes adolescentes o adultos con datos clínicos de neumonía (fiebre, tos, disnea y taquipnea) más uno de los siguientes: FR > 30 rpm, dificultad respiratoria grave o SpO₂ < 90 % al aire ambiental (19).
-
Pacientes pediátricos con datos de neumonía (tos o disnea) más uno de los siguientes:
-
Enfermedad crítica (5 %) (13): se refiere al paciente que evoluciona de una enfermedad grave con alguna de las siguientes (19):
En este estudio, las muertes ocasionadas por el virus ocurrieron en pacientes con enfermedad severa y la tasa de letalidad general fue del 2,3 %; en cambio, con enfermedad crítica fue del 49 %. Entre los niños de China, la gravedad de la enfermedad fue menor que en los adultos, con un 94 % de niños con enfermedad asintomática, leve o moderada; un 5 % con enfermedad severa, y menos del 1 % con enfermedad crítica (15,18). En el caso del paciente pediátrico, la definición de caso del síndrome inflamatorio multisistémico incluye seis criterios (20):
Enfermedad grave por COVID-19.
Menores de 21 años.
Fiebre (>38 °C) o informe de fiebre subjetiva con duración >24 horas.
Datos inflamatorios por estudios de laboratorio.
Daño de órganos multisistémicos (al menos dos sistemas afectados).
Infección por SARS-CoV-2 confirmada por laboratorio (RT-PCR o prueba de anticuerpos durante hospitalización) o haber presentado algún vínculo epidemiológico con una persona con COVID-19.
Métodos diagnósticos
Existe una gran variedad de pruebas para el diagnóstico de la COVID-19. El diagnóstico de certeza requiere la detección del ARN del SARS-CoV-2 mediante RT-PCR. Su detección es mejor en las muestras de nasofaringe en comparación con las muestras de garganta (16). El porcentaje de detección del SARS-CoV-2 mediante RT-PCR es mayor si se toman 2 días antes de los síntomas o hasta 7 días después del inicio de la sintomatología.
Las pruebas de antígeno del SARS-CoV-2 se pueden utilizar en una gran variedad de estrategias; sin embargo, un resultado negativo no excluye la enfermedad (21). El porcentaje de positividad es mayor en pacientes sintomáticos dentro de los primeros 6 días o en personas presintomáticas o asintomáticas con alta carga viral en la nasofaringe. También se ha detectado ARN del SARS-CoV-2 en las muestras de heces y sanguíneas; siendo la detección en esta última un marcador de enfermedad grave (21).
Las pruebas serológicas detectan anticuerpos contra el SARS-CoV-2 en la sangre, y las que se han validado adecuadamente pueden ayudar a identificar a los pacientes que tuvieron una infección por el SARS-CoV-2, así como a los pacientes con infección actual que han tenido síntomas durante tres o cuatro semanas. Dado que es menos probable que las pruebas serológicas sean reactivas durante los primeros días o semanas de la infección, tienen una utilidad muy limitada para el diagnóstico en situaciones agudas (figura 5) (21). La comprobación de la serología tres o cuatro semanas después de la aparición de los síntomas optimiza la precisión de la prueba, ya que la sensibilidad de la prueba más allá de las cinco semanas es incierta. Se sugiere utilizar pruebas de anticuerpos IgG o anticuerpos totales en lugar de pruebas de diferenciación de anticuerpos IgM, anticuerpos IgA o IgM/IgG, debido a su mayor precisión. Esto concuerda con las recomendaciones de la Sociedad Estadounidense de Enfermedades Infecciosas (22).
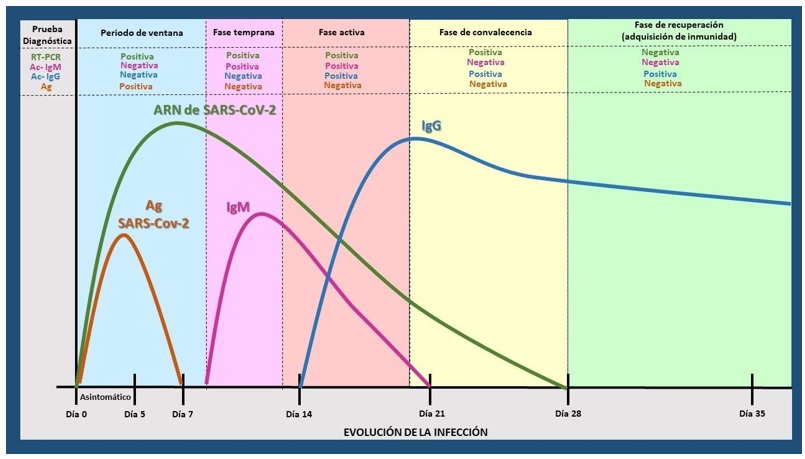
Figura 5 Evolutivo de la infección por SARSCoV2 con asociación a las distintas pruebas diagnósticas de RTPCR serológicas y anticuerposRT-PCR: reacción en cadena de la polimerasa con transcriptasa reversa; Ac: anticuerpos; Ag: antígenos; IgM: inmunoglobulina M; IgG: inmunoglobulina G; SARS-CoV-2: síndrome respiratorio agudo severo por coronavirus 2.
En pacientes con resultado positivo confirmado por RT-PCR y que cuenten con un dato de alarma, se procederá a solicitar urea y creatina para evaluar CURB-65 (creatina, urea, FR, PA y edad >65 años). Si el paciente obtiene dos o más puntos de CURB-65, se solicitarán los siguientes laboratorios (17):
Biometría hemática completa.
Perfil hepático.
Procalcitonina.
Proteína C reactiva.
CPK y mioglobina.
Gasometría arterial.
Dímero D y fibrinógeno.
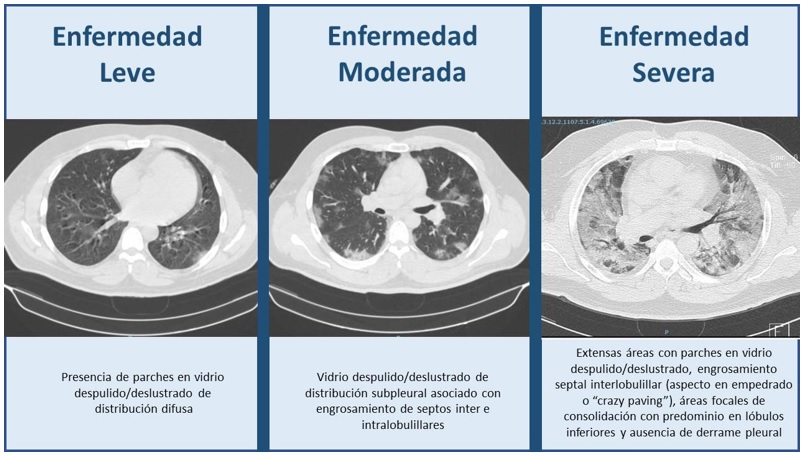
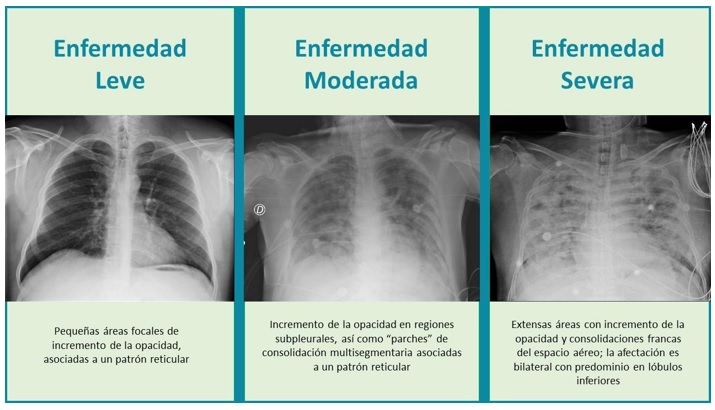
Estudios de imagen: tomografía axial computarizada de tórax en primera instancia en caso de disponibilidad o rayos X simples de tórax, en los que se puede observar imágenes de vidrio esmerilado (figuras 6 y 7).
Otros estudios según comorbilidades y estado del paciente.
Se deberán evaluar los estudios y ajustar tratamiento según el estado de gravedad.
Tratamiento médico
No existe tratamiento específico para la COVID-19. Este se llevará a cabo de acuerdo con la sintomatología y con el estado de gravedad de la enfermedad: puede ser domiciliario o intrahospitalario. Al ser una infección viral, no están recomendados el uso de antibióticos como preventivo o tratamiento.
En pacientes asintomáticos, se recomienda aislamiento domiciliario por 10 días después de obtener resultado positivo en la prueba del SARS-CoV-2 con vigilancia de sintomatología y datos de alarma (23).
En los casos de pacientes con sintomatología, se dará aislamiento domiciliario por 10 días de la aparición de los síntomas, más por lo menos 3 días sin síntomas y con uso de medicamentos sintomáticos, vigilancia de molestias y datos de alarma (23).
En pacientes que presenten una saturación de oxígeno <90 % por oximetría de pulso, se iniciará el uso de oxígeno suplementario y se recomienda la posición prona al menos por una hora, tan frecuente como sea tolerada (23).
Para los pacientes no hospitalizados con COVID-19, los anticoagulantes y la terapia antiplaquetaria no deben utilizarse para la prevención de tromboembolismo venoso o trombosis arterial, a menos que el paciente tenga otras indicaciones para la terapia (24).
Se deberá clasificar la gravedad del paciente en etapa moderada o severa según los resultados imagenológicos (figuras 6 y 7) y los marcadores inflamatorios para proceder con el tratamiento subsecuente (17):
Enfermedad moderada: en caso de presentar en los estudios de tomografía computada o rayos X de tórax incremento de infiltrados, proteína C reactiva de 100 mg/L y cuenta de linfocitos <0,8, se iniciará el uso de 6 mg de dexametasona por día (en ningún caso debe extenderse durante más de 10 días y se deberán vigilar efectos secundarios: miopatía, infecciones agregadas, hiperglucemia e hipertensión arterial) (17).
Enfermedad grave con hipercitocinemia (dímero D > 1000 mg/mL, CPK por encima de 2 veces valores de referencia; proteína C reactiva > 100 mg/L; DHL > 245 UI y cuenta de linfocitos < 0,8): se realizará tromboprofilaxis o anticoagulación, si hay incremento progresivo del dímero D > 2000 o datos sugestivos de tromboembolia pulmonar o trombosis venosa profunda con heparina de bajo peso molecular 1 mg/kg cada 12 h SC o 1000 UI/h de heparina no fraccionada en infusión intravenosa para 24 h (con control de TTPa cada 8 h), junto con el uso de dexametasona 6 mg/día (en ningún caso debe extenderse por más de 10 días y deberá vigilar efectos secundarios) (17). En caso de sospecha de coinfección bacteriana en pacientes con un cuadro clínico de COVID-19 grave, se recomienda el uso empírico temprano de antimicrobianos para los probables patógenos según las condiciones acompañantes. Su uso se limita a casos moderados en los que exista sospecha de coinfección bacteriana; en caso contrario, no está recomendado como tratamiento ni profilaxis (24).
En ambos escenarios, se continuará el manejo establecido hasta el egreso del paciente, por mejoría.
En los casos graves en los cuales el paciente no mejore y presente un índice PaO₂/FiO₂ < 150 mmHg, se procederá a la intubación orotraqueal para su manejo con ventilación mecánica invasiva. Luego se continuará con el tratamiento hospitalario según la evolución clínica y las complicaciones, evaluando la presencia de SDRA, síndrome de respuesta inflamatoria sistémica, neumonía grave, sepsis y falla orgánica múltiple/choque (17).
En caso de que el paciente continúe en estado crítico con hipercitocinemia, se mantendrá el manejo y se valorarán terapias alternativas (17). El paciente se considerará recuperado cuando cumpla con al menos 6 semanas posteriores al inicio de la sintomatología y presente las siguientes características (17):
Tomografía axial computarizada o rayos X de tórax normales.
Laboratorios con marcadores inflamatorios normales: proteína C reactiva, DHL y linfocitos totales (ferritina y dímero D, si están disponibles).
FR < 20 rpm, con clasificación de la Escala Modificada de Disnea = 0, sin antecedente de cardioneumopatía.
Saturación de oxígeno > 90 % con FIO2 al 21 % al aire ambiente.
En pacientes con enfermedad pulmonar obstructiva crónica o neumopatías crónicas, es necesario considerar la saturación de oxígeno entre 88 % y 92 %, o >93 % con asistencia de oxígeno suplementario por catéter nasal que previamente utilizaban.
Los regímenes hidroxicloroquina, lopinavir/ritonavir e interferón alfa/beta parecen tener poco o ningún efecto sobre la COVID-19 en pacientes hospitalizados, como lo indica la mortalidad general, el inicio de la ventilación mecánica y la duración de la estancia hospitalaria; por lo que no son medicamentos aprobados como tratamiento de la enfermedad (25).
Por otra parte, estudios han mostrado que el uso de remdesivir con baricitinib es superior al uso único de remdesivir para reducir el tiempo de recuperación y mejoramiento del estado clínico de los pacientes con oxigenación a alto flujo o ventilación no invasiva (26). Para estos casos, el uso de remdesivir deberá realizarse por al menos 5 días sin superar los 10 días de tratamiento. Así mismo, no se recomienda la utilización de inhibidores de la cinasa Janus, distintos de baricitinib, para el tratamiento de la COVID-19, excepto en ensayos clínicos (24).
De igual modo, se ha visto que en los pacientes hospitalizados con neumonía por COVID-19 que no estaban recibiendo ventilación mecánica, el uso de tocilizumab (anticuerpo antirreceptor de IL-6) en dosis única intravenosa de 8 mg/kg de peso corporal real, hasta 800 mg, redujo la probabilidad de progresión hacia el uso de ventilación mecánica o muerte, pero sin mejorar la supervivencia (27). Por el momento no se recomienda la utilización de anticuerpos monoclonales contra el receptor de IL-6 (p. ej., sarilumab) o el anticuerpo monoclonal anti-IL-6 (siltuximab) para el tratamiento de COVID-19, excepto en ensayos clínicos (24).
El bamlanivimab, la combinación de casirivimab más imdevimab y la combinación bamlanivimab (700 mg) más etesevimab (1400 mg), mediante infusión única intravenosa, son anticuerpos monoclonales contra el SARS-CoV-2, disponibles a través de la Food and Drug Admistration de Estados Unidos, para el tratamiento de pacientes con COVID-19, de leve a moderado, que disminuyen el riesgo de progresión de la enfermedad a grave u hospitalización (24). Actualmente, no se cuenta con estudios suficientes a favor o en contra del uso de ivermectina, vitamina D y zinc en pacientes con COVID-19 (24).
Complicaciones de la COVID-19
Se han documentado diferentes complicaciones en diferentes sistemas, como (17):
Secuelas y síntomas a largo plazo de la COVID-19
En algunos pacientes se han observado secuelas tras la enfermedad, como son (28):
Respiratorias: disnea, hipoxia, disminución en la capacidad de difusión, restricción y fibrosis pulmonares.
Hematológicas: eventos tromboembólicos y estado inflamatorio persistente.
Cardiovasculares: palpitaciones, disnea, dolor torácico, fibrosis miocárdica, arritmias, taquicardia, disfunción autonómica, cardiopatía isquémica crónica, insuficiencia cardiaca crónica e hipertensión pulmonar.
Neuropsiquiátricas: fatiga, mialgias, cefalea, disautonomía, alteraciones cognoscitivas, disfunción neuromuscular, procesos desmielinizantes, epilepsia y neuropatías craneales, depresión, ansiedad, insomnio y estrés postraumático.
Renales: reducción de la tasa de filtración glomerular.
Endocrinas: descompensación de enfermedades coexistentes. como diabetes mellitus, tiroiditis subaguda y desmineralización ósea.
Gastrointestinales: trastornos de la función gastrointestinal. como diarrea, estreñimiento y alteraciones de la microbiota intestinal.
Dermatológicas: caída del cabello.
Los siguientes síntomas se han identificado con mayor frecuencia después de la recuperación de la COVID-19: fatiga (58 %), cefalea (44 %), trastorno de atención (27 %), caída del cabello (25 %) y disnea (24 %); sin embargo, se han documentado una gran variedad de molestias adicionales, por ejemplo: ageusia (23 %), anosmia (21 %), polipnea (21 %), tos (19 %), artralgias (19 %), sudoración (17 %), dolor torácico (16 %), náusea (16 %), pérdida de la memoria (16 %), alteraciones auditivas (15 %), entre otras (29).
Prevención
En la actualidad, no existe tratamiento preventivo para la COVID-19. Las actuales recomendaciones, establecidas por la OMS (30) para evitar el contagio por el virus SARS-CoV-2 son:
Usar cubrebocas o mascarilla facial.
Mantener una distancia con otras personas de al menos 1,5 a 2 metros.
Lavarse frecuente las manos con agua y jabón o usar alcohol gel al 70 %.
Evitar tocarse ojos, nariz y boca.
Evitar la realización de actividades no esenciales.
Alejarse de lugares cerrados y preferir espacios abiertos.
Evitar lugares conglomerados, así como reuniones sociales.
Al estornudar o toser, taparse la cara con el codo flexionado o con algún pañuelo.
Limpieza y desinfección frecuente de superficies, en especial de aquellas de contacto frecuente.
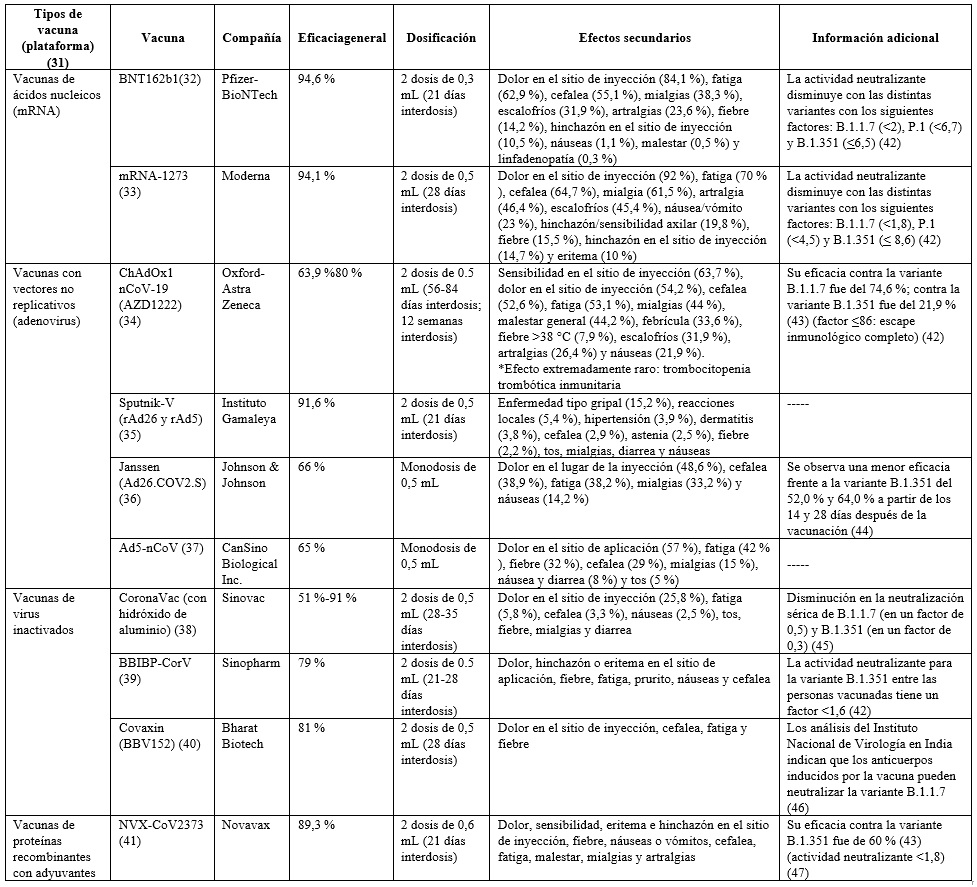
La vacunación, como medida preventiva, aún se encuentra en desarrollo alrededor del mundo. Actualmente, hay una gran variedad de vacunas candidatas en fase 3 de investigación y varias de ellas han sido aprobadas por la OMS para su uso de emergencia (Pfizer-BioNTech, Oxford-AztraZeneca y Johnson & Johnson), así como algunas otras por las agencias regulatorias de cada país (tabla 2). Están indicadas para mayores de 16 años en el caso de Pfizer y para mayores de 18 años en el caso de las otras vacunas. En todas ellas, la contraindicación es alergia/anafilaxia hacia algunos de sus componentes.
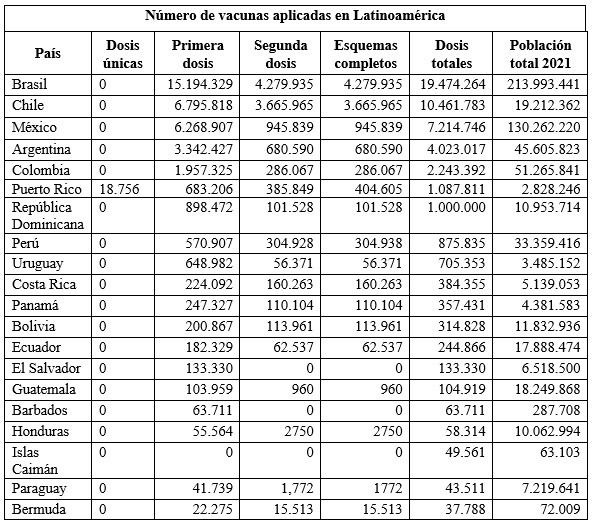
La Organización Panamericana de la Salud ha registrado, hasta el 1.º de abril del 2021, 49 países de las Américas que han iniciado el proceso de vacunación. Se han administrado 210.225.738 de dosis, de las cuales 68.453.728 han registrado esquemas completos; 141.712.827 con las primeras dosis aplicadas; 65.070.752 con las segundas dosis aplicadas y 3.382.976 de dosis únicas aplicadas. Entre los países latinoamericanos que han realizado mayor número de dosis aplicadas destacan Brasil, Chile, México, Argentina y Colombia (tabla 3) (48).
Tabla 3 Países latinoamericanos con mayor número de esquemas de vacunación aplicado hasta el 1º de abril del 2021 (48)
Debido a la alta morbimortalidad, México inició el proceso de vacunación en el personal de salud de primera línea contra la COVID-19 el 24 de diciembre de 2020 con la vacuna de Pfizer-BioNTech (49). Al mismo tiempo, el Gobierno mexicano ha propuesto un calendario escalonado para la vacunación poblacional, que inició el 2 de febrero de 2021 con el registro para la vacunación de adultos mayores de 60 años y la aplicación de la primera dosis en tres alcaldías de la Ciudad de México, el 15 de febrero del 2021 con la vacuna de Oxford-AstraZeneca y Sputnik V. Para los meses de abril se precisa continuar el proceso de vacunación con las personas comprendidas entre los 50 y los 59 años; en mayo, aquellos entre 40 y 49 años, y en junio el resto de la población (50). Para cumplir con la vacunación poblacional en México, el Gobierno ha aprobado y adquirido el uso de emergencia de algunas otras, como CanSino, CoronaVac de Sinovac y Covaxin de Barhat Biotech.
A pesar de la información obtenida a la fecha, aún queda mucho por saber sobre las investigaciones en relación con las vacunas, su capacidad de inmunización contra las variantes genéticas, su duración a lo largo del tiempo y su aplicación en menores de edad.
Reinfección por COVID-19
Hasta la fecha, existen datos limitados sobre la reinfección con SARS-CoV-2 después de la recuperación de COVID-19. Los informes de casos publicados han demostrado que la reinfección es posible, pero aún no está claro durante cuánto tiempo las personas que se han recuperado de COVID-19 están protegidas contra la reinfección con SARS-CoV-2, ni qué concentración de anticuerpos se necesita para conferir protección o con qué frecuencia puede ocurrir una reinfección (15). Si bien se ha observado que la liberación del ARN viral disminuye con la resolución de la sintomatología, la liberación de ARN del SARS-CoV-2 puede continuar durante días o semanas. Por lo tanto, la detección de ARN viral durante la convalecencia no necesariamente indica la presencia de virus con capacidad replicativa (infecciosidad) o la presencia de nuevos virus infecciosos. La infección clínica se ha correlacionado con la detección de anticuerpos IgM e IgG.
Las personas que se han recuperado pueden continuar eliminando ARN detectable del SARS-CoV-2 en muestras de las vías respiratorias superiores hasta 3 meses después del inicio de la enfermedad, aunque en concentraciones considerablemente menores que durante la enfermedad, en rangos donde el virus competente para la replicación no se ha recuperado de manera confiable y es poco probable que sea infeccioso (15). Por otro lado, hay que tener en cuenta las variantes genéticas que han surgido, tanto aquellas de preocupación como de interés, siendo las primeras las que han mostrado diferentes grados en la evasión de la neutralización por anticuerpos preexistentes y de algunas vacunas (tabla 2).
Conclusiones
La infección por SARS-CoV-2 y la enfermedad que ocasiona, denominada COVID-19, es una situación de preocupación de salud pública mundial que ha traído un gran número de decesos y secuelas a largo plazo por la enfermedad. En Brasil y México ha traído graves consecuencias, al punto que son el segundo y el tercer país, respectivamente, con mayor mortalidad registrada a la fecha. La COVID-19 es una enfermedad respiratoria de origen viral catalogada según sus estadios de gravedad y daño asociado a múltiples órganos y sistemas. Las manifestaciones clínicas son variables dependiendo de persona a persona; sin embargo, es importante la vigilancia de datos de alarma para el manejo oportuno de las complicaciones asociadas. Actualmente, no hay un tratamiento definitivo para el control de la pandemia; este se realiza en función de la sintomatología y los estados patológicos subsecuentes. La vacunación como medio preventivo ya se está realizando alrededor del mundo; sin embargo, queda mucho por determinar. Su implementación actual prevé la necesidad de disminuir la mortalidad y el número de contagios. Tras la recuperación por COVID-19 se han demostrado una gran variedad de molestias a largo plazo, y la fatiga es la más frecuente de estas. A pesar de haber adquirido previamente la infección por SARS-CoV-2, la probabilidad de reinfección es posible en un tiempo determinado; por ello, surge la necesidad de continuar con las medidas preventivas para su mitigación.