Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Universitas Medica
versión impresa ISSN 0041-9095versión On-line ISSN 2011-0839
Univ. Med. vol.62 no.4 Bogotá jul./dic. 2021 Epub 30-Sep-2021
https://doi.org/10.11144/javeriana.umed62-4.tibo
Original
Efectividad de la tibolona e incidencia de efectos adversos en mujeres posmenopáusicas. Estudio cuasiexperimental en Armenia (Colombia), 2012-2015
1Medical Doctor specialist in Gynecology and Obstetrics, Universidad Militar Nueva Granada, Colombia. Master in Sexology: Education and Sexual Counseling, Universidad Alcalá de Henares, Spain. Urogynecology/Pelvic Floor Reconstructive Surgery, FUCS-Unicamp, Brazil. Scientific Director of Hathor, Clínica Sexológica
Objetivo:
Establecer la efectividad de la tibolona en la sintomatología menopáusica y la función sexual, así como la incidencia de efectos adversos en mujeres posmenopáusicas.
Material y métodos:
Estudio cuasiexperimental, antes-después, en una clínica privada de carácter universitario en Armenia (Quindío, Colombia), entre 2012 y 2015, en 127 mujeres posmenopáusicas mayores de 40 años, con síntomas climatéricos y último periodo menstrual al menos 2 años antes de ingresar al estudio, con pareja estable. Se utilizaron como instrumentos la escala de calidad de vida Menopause Rating Scale .MRS) y el Índice de Función Sexual Femenino (IFSF). Se hizo un muestreo aleatorio simple. Se utilizó el programa Stata. 16.1.
Resultados:
La edad promedio fue de 56,91 ± 7,34 años. Al final del estudio se alcanzó una mejoría de la sintomatología menopáusica del 94,48 % (. < 0,05), con una disminución en la puntuación de la escala MRS de 15,91 ± 3,21 a 6,18 ± 3,75 puntos (. < 0,05). Las disfunciones sexuales reportaron una mejoría del 86,56 %; el IFSF pasó de 23,19 ± 6,41 puntos a 28,02 ± 6,63 (. < 0,05). Los efectos adversos se hicieron presentes desde los primeros 3 meses de inicio de la terapia, entre ellos amenorrea (85,82 %), mastalgia (18,89 %) y edema (17,32 %).
Conclusiones:
La tibolona tiene una positiva efectividad en el tratamiento de la sintomatología de la menopausia, al reducir tanto la cantidad como su severidad; además, se asocia a una franca mejoría de la función sexual, con efectos adversos leves, tolerables y transitorios.
Palabras clave mujeres; posmenopausia; signos y síntomas; terapia de remplazo de hormonas; efectos adversos; incidencia
Objective:
To establish the effectiveness of tibolone in menopausal symptoms and sexual function, as well as the incidence of adverse effects, in postmenopausal women.
Material and methods:
Quasi-experimental study, before-after; in 127 postmenopausal women older than 40 years, with climacteric symptoms and last menstrual period at least 2 years before entering the study, with a stable partner. In a private university clinic in Armenia (Quindío), Colombia, between 2012 and 2015. The Quality of Life Scale Menopause Rating Scale (MRS) and the Female Sexual Function Index (IFSF) were used as instruments. Simple random sampling was done. The Stata® 16.1 program was used.
Results:
The average age was 56.91 ± 7.34 years. At the end of the study, an improvement in menopausal symptoms of 94.48% (. < 0.05) was achieved, with a decrease in the MRS score from 15.91 ± 3.21 to 6.18 ± 3, 75 points (. < 0.05). Sexual dysfunctions reported an improvement of 86.56%; the IFSF went from 23.19 ± 6.41 points to 28.02 ± 6.63 (. < 0.05). Adverse effects were present from the first 3 months of initiation of therapy, the most frequent being: amenorrhea (85.82%), mastalgia (18.89%), and edema (17.32%).
Conclusions:
Tibolone has a positive effectiveness in the treatment of the symptoms of menopause, reducing both the amount and the severity of the same; associated with a clear improvement in sexual function, with mild, tolerable and transitory adverse effects.
Keywords women; postmenopause; signs and symptoms; hormone replacement therapy; adverse effects; incidence
Introducción
En promedio, la menopausia ocurre a los 51 años (con variaciones étnicas y regionales) (1). En Colombia, la edad de inicio está alrededor de los 48,1 ± 5,39 años (2). El cese de la función ovárica conduce a la aparición de síntomas vasomotores, psicológicos, somáticos y atróficos en los tejidos dependientes de estrógenos. Dichos cambios fisiológicos y patológicos pueden ejercer un efecto negativo en la calidad de vida de las mujeres posmenopáusicas e, incluso, provocar graves enfermedades físicas y mentales (3).
Los síntomas de la menopausia son variados, dependiendo de las características físicas, mentales, sociales, culturales y raciales de cada mujer (2,4). Se estima que el 85 % de ellas informan, al menos, un síntoma de la menopausia; pero solo el 10 % busca atención médica (5). En la menopausia se destacan los síntomas vasomotores (sofocos o sudoración nocturna), alteraciones del sueño y sequedad vaginal (6).
La terapia de remplazo hormonal (TRH) es la principal indicación para el tratamiento de la deficiencia de estrógenos (síntomas vasomotores, síntomas de la atrofia urogenital, osteopenia posmenopáusica y osteoporosis), con el propósito de mejorar la calidad de vida de las mujeres (7). El tratamiento debe ser individualizado de acuerdo con las condiciones clínicas de cada paciente, y se puede ofrecer tratamiento hormonal y no hormonal (7,8).
Antes del inicio de la TRH, en la consulta se recomienda llevar a cabo un exhaustivo examen físico, a fin de considerar tanto las indicaciones como las contraindicaciones; por lo tanto, precisa el registro de antecedentes, examen físico y otras pruebas complementarias (9,10).
La tibolona es un esteroide sintético, regulador selectivo de la actividad estrogénica tisular, que controla los síntomas de la menopausia (11), inhibe la pérdida ósea (12) y aumenta el flujo sanguíneo vaginal (13). Después de ingerirse, se convierte en tres metabolitos activos: 3α– y 3β–OH tibolona, que actúan sobre los receptores de estrógenos en la vagina, los huesos, el cerebro y la pared vascular, y el isómero ∆4 tibolona, que se une a los receptores de andrógenos y progesterona, cuya acción androgénica se ejerce primariamente en el hígado y el cerebro (14).
La Menopause Rating Scale (MRS) es un instrumento útil para medir la severidad de los síntomas relacionados con la menopausia y así evaluar la calidad de vida (15). La integran tres dimensiones: a) somático-vegetativa, b) psicológica y c) urogenital, en donde se agrupan once síntomas (15,16).
El Índice de Función Sexual Femenino (IFSF) es instrumento confiable para evaluar la función sexual de las mujeres en un amplio rango de edad, con adecuada confiabilidad y propiedades psicométricas (17).
En presencia de las escasas investigaciones en la población colombiana, acerca de la efectividad de la tibolona en el tratamiento del síndrome climatérico y la función sexual de la mujer en posmenopausia (etapa que inicia a partir del año de la última menstruación hasta el final de la vida) (2,6,9), y dado que no se han publicado estudios al respecto en el ámbito regional, esta investigación tuvo como objetivo establecer la efectividad de la tibolona y la incidencia de efectos adversos en mujeres posmenopáusicas.
Materiales y métodos
Diseño y población
Se realizó un estudio cuasiexperimental, antes-después, en el que se incluyeron mujeres posmenopáusicas (menopausia natural) mayores de 40 años sexualmente activas, con síntomas climatéricos y último periodo menstrual al menos 2 años antes, con pareja estable y hormona folículo estimulante (FSH) sérica ≥40 IU/L y estradiol ≤25 pg/ml. Ello, en el periodo comprendido entre el 1.º de enero de 2012 y el 31 de diciembre de 2015, en una clínica privada de Armenia (Quindío), centro de alta complejidad, de referencia, que atiende población afiliada al régimen subsidiado por el Estado y al régimen contributivo, en el Sistema General de Seguridad Social en Colombia. Se excluyeron mujeres con cualquier antecedente de cáncer, historia personal de trombosis venosa profunda, antecedentes de histerectomía o salpingooforectomía, enfermedad hepática (aguda o crónica), enfermedad mental, función renal alterada, hemorragia uterina anormal de etiología desconocida, situación psicopatológica o social que dificultara la comprensión del instrumento, cambio de departamento de residencia, posible retiro del estudio antes de seis meses de seguimiento o dificultades para el seguimiento, haber recibido TRH en los últimos seis meses y presentar alteraciones en la ultrasonografía transvaginal o con una línea endometrial ≥4,5 mm.
La muestra se calculó a partir de la fórmula del muestreo aleatorio simple para una proporción esperada del 50 %, con un nivel de confianza del 95 % (α = 0,05) y riesgo β del 0,2 para una precisión de ±0,15. De acuerdo con estos criterios, el tamaño muestral fue de 85 mujeres, pero se decidió incluir al mayor número de participantes del programa de “Climaterio y menopausia”. Se hizo muestreo aleatorio simple mediante una tabla de números aleatorios.
Procedimiento
A partir de la base de datos de la consulta del programa de “Climaterio y menopausia” de la clínica, se reconocieron las mujeres candidatas a participar. La selección se hizo identificando el código N95.1 de la Clasificación Internacional de Enfermedades: estados menopáusicos y climatéricos femeninos. Las contactó el equipo de investigación conformado por el investigador principal, un médico general y una enfermera profesional, quienes verificaron que cumplieran los criterios de inclusión y exclusión. A las mujeres seleccionadas se les explicó el objetivo del estudio y se les solicitó la firma del consentimiento informado, que autorizaba su inclusión en la investigación. A las que aceptaron ser parte de la investigación, se les aplicó un cuestionario para establecer las características sociodemográficas y clínicas, con el fin de aplicar posteriormente el instrumento IFSF y la escala MRS.
El IFSF es un cuestionario que consta de 19 preguntas que evalúan la función sexual femenina en las últimas cuatro semanas. Agrupa seis dominios: Deseo (ítems 1-2), Excitación (ítems 3-6), Lubricación (ítems 7-10), Orgasmo (ítems 11-13), Satisfacción (ítems 14-16) y Dolor (ítems 17-19). Cada pregunta tiene entre 5 y 6 opciones, cuya asignación de puntos va de 0 a 5. El puntaje de cada dominio se multiplica por un factor. El resultado es la suma aritmética de los dominios: a mayor puntaje, mejor sexualidad. El rango total de la puntuación va desde 2 hasta 36; un puntaje ≤26,55, o cuando algún dominio es menor a 3,6 puntos, se considera como criterio de riesgo de disfunción sexual (17-19).
La escala MRS autoevalúa los síntomas menopáusicos. La integran tres dimensiones o dominios: a) somático, b) psicológico y c) urogenital. El somático evalúa cuatro síntomas (bochornos, molestias cardiacas, trastornos del sueño y molestias osteomusculares); el psicológico, cuatro (estado depresivo, irritabilidad, ansiedad y cansancio), y el urogenital, tres (problemas sexuales, problemas de vejiga y sequedad vaginal), para un total de once ítems. A cada ítem la mujer le otorga un valor de 0 a 4 (0 = ausente; 1 = leve; 2 = moderado; 3 = severo; 4 = muy severo). El puntaje de un dominio corresponde a la sumatoria de cada ítem de esa subescala; de esta forma, el puntaje MRS total será la suma de los puntajes obtenidos de cada dominio. Cuanto mayor sea la puntuación obtenida, mayor es el deterioro de la calidad de vida (15,16,20). Es una escala confiable con coeficiente α de Cronbach de 0,80. La consistencia interna de cada dimensión varía entre 0,60 y 0,87 (15,21).
Todas las pacientes fueron examinadas por el investigador principal, quien evaluaba la presencia de la sintomatología (síntomas y signos) menopaúsicos, referidos por las participantes. El diagnóstico de menopausia se hizo con el hallazgo de la ausencia de menstruación por 12 meses o más.
A todas las participantes se les solicitaron exámenes complementarios: hemograma, glucemia, hemoglobina glucosilada (HbA1c), perfil lipídico (colesterol total, HDL-colesterol, LDL-colesterol, triglicéridos), hormona estimulante de la tiroides (TSH), uroanálisis, creatinina y perfil hepático (aspartato aminotransferasa o transaminasa glutámico-oxalacética y alanina aminotransferasa o glutamato piruvato transaminasa, bilirrubinas y fosfatasa alcalina). Estos se solicitaron anualmente hasta el final del estudio; así como en aquellas con hiperlipidemia, cada 6 meses. Se tomaron muestras de antitrombina III, plasminógeno, inhibidor del activador tisular del plasminógeno e inhibidor del activador del plasminógeno-1. Igualmente, ultrasonografía transvaginal (para evaluar pólipos endometriales, masas pélvicas e hiperplasias endometriales; se tuvo en cuenta el grosor endometrial ≥4,5 mm para establecer el diagnóstico presuntivo de anomalías endometriales), citología cérvico-vaginal y mamografía.
A cada paciente se le explicó la naturaleza de su condición clínica y se le ofreció como alternativa terapéutica la tibolona, a una dosis de 2,5 mg vía oral (todas las noches a la hora de acostarse a dormir). Se realizaron cinco seguimientos: al año, a los dos, a los tres, a los cuatro y a los cinco años de iniciada la terapia. En cada control se evaluaba la presencia y la severidad de la sintomatología mediante la escala MRS, y la función sexual, a través del IFSF; además, se indagaba la aparición y naturaleza de los efectos adversos. En el seguimiento se tuvo en consideración, para evaluar la efectividad terapéutica, la ausencia o la disminución de la severidad de la sintomatología. Los hallazgos de cada mujer y los resultados de la escala MRS e IFSF se registraron en cada control, tanto en la historia clínica como en el formulario diseñado por los investigadores.
Dos auxiliares de enfermería se encargaron de revisar y tomar los datos de la historia clínica, verificados por una enfermera profesional (especialista en Auditoría en Salud). La información de cada participante fue consignada en un formulario específicamente diseñado, que posteriormente se digitó en una base de datos en Excel 14.0 Office® 2011, y se envió al equipo epidemiológico principal del estudio.
Variables medidas
Edad, raza, nivel de estudios, estrato socioeconómico, estado civil, ocupación, condición religiosa, origen, afiliación al Sistema General de Seguridad Social en Salud; talla, peso, Índice de Masa Corporal (IMC); hábitos (ingesta de alcohol, tabaquismo, consumo de café, adicción a sustancias psicoactivas, sedentarismo); variables de salud sexual y reproductiva (edad de la menarquia, edad de la menopausia, evolución del tiempo de la menopausia, antecedentes de abuso sexual o violencia sexual en el matrimonio, tiempo de convivencia en pareja y disfunción sexual en la pareja); antecedentes patológicos, comportamiento sexual: edad de inicio de la actividad sexual coital, actividad sexual (masturbación, sexo oral, coito vaginal o anal, frecuencia de relaciones sexuales coitales mensuales, número de parejas sexuales y tiempo de convivencia en pareja). Así mismo, presencia y severidad de la sintomatología (síntomas y signos) de la menopausia; efectos adversos de la tibolona y los dominios del instrumento IFSF y la escala MRS. Se midieron el endometrio por ultrasonografía, la tensión arterial y los laboratorios en cada control.
Análisis estadístico
Las variables de naturaleza cualitativa se describen en frecuencias absolutas y proporciones; las cuantitativas, en medidas de tendencia central (media o mediana) y dispersión (desviación estándar o rango), según aplicara. Se estableció la incidencia acumulada de efectos adversos al final del estudio. Para comparar los resultados antes-después, en las variables cualitativas se utilizó la prueba de χ², y en las cuantitativas, la prueba t de Student (para variables normales) o la U de Man-Whitney en las variables de distribución no normal o de varianzas no homogéneas. El análisis se realizó con el programa Epi Info® 7.2. La validación de datos fue realizada en el programa Stata® 16.1. Se considera un valor de p < 0,05 como estadísticamente significativo.
Aspectos éticos
El estudio recibió la aprobación del Comité de Ética e Investigaciones de la Clínica (Acta 102 de 2011) y cumplió con los requerimientos para investigaciones médicas en seres humanos establecidos en la Declaración de Helsinki y con la Resolución 8430 de 1993, por la cual se establecen las normas científicas, técnicas y administrativas para investigación en salud. Todas las participantes firmaron el consentimiento informado para ingresar al estudio y se les garantizó la confidencialidad de la información.
Resultados
De una población de 325 mujeres elegibles, 103 no cumplieron con los criterios de inclusión, y quedaron 222 como población para la aleatorización, por lo que el estudio se hizo con 127 (57,2 %) mujeres para el análisis final.
La edad promedio de las participantes fue de 56,91 ± 7,34 años (mínimo 42 y máximo 72 años). El 71,65 % estaban casadas o vivían en unión libre. El 84,25 % eran de origen urbano y el 77,95 % pertenecían al régimen de aseguramiento contributivo. El 89,76 % profesaba la fe cristiana. En la tabla 1 se describen las características sociodemográficas de la población.
Tabla 1 Características sociodemográficas en mujeres usuarias de tibolona en Armenia (Colombia), 2012-2015 (n = 127)
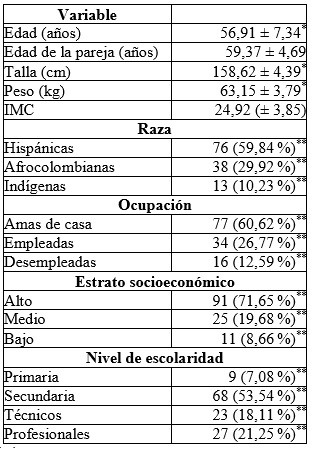
*Media y desviación estándar.
**Frecuencia absoluta y relativa.
Respecto a los hábitos, el 18,11 % fumaba, con una mediana de consumo de 3 cigarrillos diarios (rango entre 3 y 9). El 92,91 % tomaba café; el 74,8 % manifestó consumo de alcohol, y el 6,29 % reportó el uso de sustancias psicoactivas. El sedentarismo se detectó en el 69,29 %.
La edad promedio de la menarquía fue de 11,79 ± 2,83 años. La edad media de la menopausia fue de 47,85 ± 3,98 años, con una duración media de la menopausia de 9,52 ± 6,71 años. El 4,72 % había recibido TRH en los últimos 3 años, previos al estudio.
En los antecedentes patológicos se encontró que el 36,22 % padecía artrosis; el 33,07 %, hipertensión arterial; el 41,73 %, dislipidemias (56,6 % triglicéridos elevados y 43,39 % colesterol total elevado, con un 47,16 % de HDL-colesterol bajas); el 14,96 %, hipotiroidismo; el 8,66 %, diabetes tipo 2, y el 3,14 %, artritis reumatoide. El 5,51 % tenía obesidad mórbida.
Respecto a las variables de comportamiento sexual, la edad media de inicio de la actividad sexual fue de 15,28 ± 4,37 años. El coito vaginal lo practicaba el 100 %; mientras el anal lo reportaron el 11,81 %. La masturbación apareció como una experiencia poco común (14,17 %). El sexo oral era la práctica sexual preferida por el 86,61 %. La frecuencia de relaciones sexuales mensuales (últimos 30 días previos a la entrevista) arrojó una mediana de 2 (rango entre 1 y 4). El tiempo de convivencia en pareja fue de 13,98 ± 7,52 años. La mediana del número de parejas sexuales reportó 3 (rango entre 1 y ≥9).
El antecedente de abuso sexual lo refirió el 18,89 % de las participantes; mientras que la violencia sexual en el matrimonio la indicó el 9,44 %. El 56,69 % de las participantes afirmó que sus parejas presentaba alguna disfunción sexual.
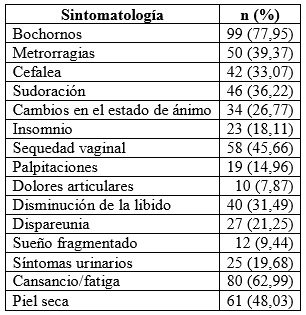
Los síntomas menopáusicos mencionados por las pacientes, en orden de frecuencia, se detallan en la tabla 2, y entre ellos los más frecuentes fueron: bochornos (77,95 %), seguido por cansancio/fatiga (62,99 %) y sequedad vaginal (48,03 %). El 75,59 % presentó 3 o menos síntomas; el 15,74 %, 4, y el 8,66 %, 5 o más síntomas, con una mediana de 3 (rango entre 1 y ≥6).
Tabla 2 Manifestaciones clínicas de la menopausia en mujeres de Armenia (Colombia), 2012-2015 (n = 127)
El puntaje de la MRS se presenta en la tabla 3. Los síntomas que muestran mayor severidad son los del dominio somático, que reportan un promedio de 5,98 ± 1,08 puntos. El de menos impacto sintomático fue el dominio urogenital, con 4,62 ± 1,06 puntos. Según la severidad de los síntomas, se encontró que el 18,11 % (n = 23/127) de las mujeres tuvo síntomas “leves”; el 22,83 % (n = 29/127), “moderados”; el 27,55 % (n = 35/127), “severos”, y el 31,49 % (n = 40/127), “muy severos”. De acuerdo con la sintomatología severa, se observó que el 52,5 % era del tipo somático; el 27,5 %, psicológico, y el 20 %, urogenital. Al inicio del estudio (basal), el valor de la puntuación del MRS fue 15,91 ± 3,21 y al final fue inferior, con un valor de 6,18 ± 3,75; diferencia estadísticamente significativa (p = 0,001). Al inicio del estudio (basal) en el dominio somático el valor del MRS fue de 5,98 ± 1,08 y al final fue inferior, con un valor de 1,98 ± 1,02; diferencia estadísticamente significativa (p = 0,001).
A partir del primer mes de tratamiento se empezó a notar la efectividad de la tibolona: el 57,48 % (n = 73/4127) de las pacientes comunicó mejoría de la sintomatología, la cual fue progresiva a lo largo del primer año y se mantuvo constante el incremento hasta finalizar el estudio (tabla 3). La sequedad vaginal persistió en el 7,07 % (n = 9/127), y la dispareunia, en el 6,29 % (n = 8/127). Al final del estudio, ninguna de las mujeres calificó la gravedad de la sintomatología como “severa” ni “leve”, para una mejoría de la sintomatología menopáusica del 94,48 % (p< 0,05); mientras que el 5,51 % persistieron con síntomas “moderados” (p > 0,05).
Tabla 3 Puntaje del Menopause Rating Scale (MRS) en mujeres posmenopáusicas de Armenia (Colombia), 2012-2015 (n = 127)
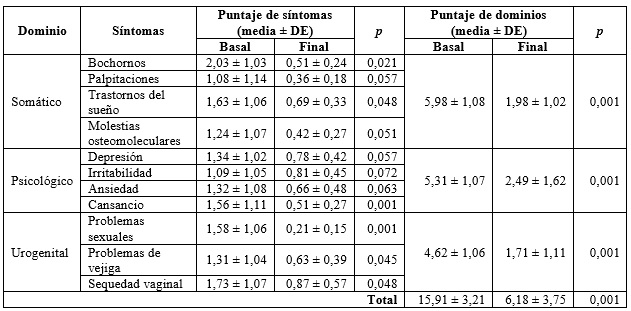
DE:desviación estándar.
Al inicio del estudio, la puntuación media del IFSF fue de 23,19 ± 6,41 puntos (límite inferior = 8,57 y superior = 29,38). Al final, la puntuación promedio alcanzó 28,02 ± 6,63 puntos (límite inferior = 10,52 y superior = 32,75), con diferencia estadísticamente significativa (p = 0,001). Se reportaron un 52,75 % de disfunciones sexuales. Se encontró que el 45,66 % presentó 2, y el 23,62 %, 3 o más disfunciones sexuales concomitantes, con una mediana de 2 disfunciones sexuales por mujer (rango entre 1 y ≥4). El deseo sexual hipoactivo se hizo presente en el 31,49 % de las participantes. Al contrastar los dominios del IFSF entre la medición antes de la terapia y al final, se observó en el dominio deseo un puntaje de 3,47 ± 1,06 vs. 4,62 ± 1,17 (p< 0,05). Respecto a la lubricación, la puntuación fue de 3,52 ± 1,07 vs. 4,74 ± 1,05 (p< 0,05) (tabla 4).
Tabla 4 Índice de función sexual femenina en mujeres posmenopáusicas de Armenia (Colombia), 2012-2015 (n = 127)
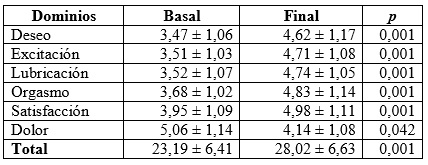
Al finalizar la investigación se descubrió que las disfunciones sexuales disminuyeron al 7,08 %, con lo que hubo una mejoría del 86,56 %. Por otro lado, los encuentros sexuales satisfactorios fueron indicados por el 21,25 %, frente al 82,67 %, al final (p< 0,05). El 92,91 % (n = 118/127), a los 5 años de seguimiento, declaró un incremento en la frecuencia coital vaginal, con una mediana de 4 encuentros mensuales (rango entre 3 y 9).
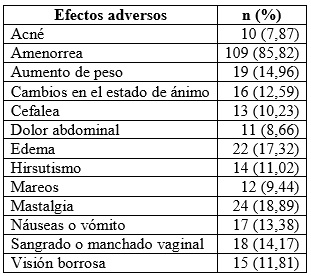
Los efectos adversos (EA) se hicieron presentes desde los primeros 3 meses de iniciada la terapia. Los más frecuentes fueron amenorrea (85,82 %), mastalgia (18,89 %) y edema (17,32 %). El total de los EA reportados y su frecuencia se describen en la tabla 5. En la mayoría de las mujeres, los EA se presentaron con más frecuencia entre el primer y tercer mes de la terapia, para disminuir de manera espontánea y progresivamente al término de un año; la mayoría fueron leves, tolerables y transitorios.
Tabla 5 Efectos adversos de la tibolona en mujeres posmenopáusicas de Armenia (Colombia), 2012-2015 (n = 127)
En el perfil metabólico al inicio, se encontró una media en la glucemia en ayunas de 109,58 ± 37,62 mg/dl y HbA1c: 7,13 ± 1,48 con una leve reducción del 6 % al final del estudio (97,16 ± 35,29 mg/dl y HbA1c: 6,78 ± 1,39; p > 0,05). No hubo cambios significativos en las transaminasas, bilirrubinas, fosfatasa alcalina, creatinina, hemograma ni TSH (p > 0,05).
En relación con el perfil lipídico, al final, se observó un resultado favorable al detectarse la reducción del 15 % en los triglicéridos (235,67 ± 61,8 vs. 201,95 ± 69,7 mg/dl; p < 0,001), un 20 % en el colesterol total (239,67 ± 58,62 vs. 192,78 ± 46,53 mg/dl; p< 0,001), un 20 % en el LDL (145,37 ± 38,62 vs. 116,87 ± 32,43 mg/dl; p< 0,001), un 12 % en el VLDL (32,87 ± 12,56 vs. 29,14 ± 10,25 mg/dl; p > 0,001), y un 9 % en el HDL (59,26 ± 13,81 vs. 54,31 ± 12,75; p > 0,001).
En el análisis de la fibrinólisis y coagulación, se descubrió que la tibolona reduce el inhibidor del activador tisular del plasminógeno y el inhibidor del activador del plasminógeno-1 entre un 15 % y un 20 % (1,83 ± 1,02 vs. 1,05 ± 0,96 ng/ml; p< 0,001, y 45,87 ± 16,23 vs. 37,95 ± 10,98 ng/ml; p< 0,001, respectivamente). El fibrinógeno disminuyó el 30 % (285,72 ± 59,37 vs. 201,48 ± 41,52 mg/dl; p > 0,001), y el plasminógeno, un 15 % (19,32 ± 4,71 vs. 15,78 ± 3,57 mg/dl; p< 0,001). La antitrombina III reportó un incremento del 20 % (87 % vs. 105 %; p< 0,001). Los cambios se hicieron presentes desde el primer año de seguimiento y se mantuvieron hasta el final del estudio.
En las cifras de la tensión arterial se observó una disminución del 7 %, en la media de la sistólica (128,57 ± 14,39 vs. 120,9 ± 13,58 mmHg; p > 0,05) y en la diastólica (87,51 ± 10,57 vs. 81,39 mmHg; p > 0,05).
La línea endometrial pasó de 4,13 ± 0,52 mm al inicio a 4,06 ± 0,47 mm al final del estudio, diferencia que no resultó estadísticamente significativa (p = 0,372). La citología cérvico-vaginal y mamografía no presentaron alteraciones a lo largo del estudio.
El aumento promedio de peso fue de 1,52 kg/año, presente en el 74,01 % (n = 94/127) del total de las participantes; mientras que el 12,59 % (n = 16/127) registraron una disminución de 0,76 kg/año.
No se reportó ningún EA grave (infartos, trombosis venosa o embolia pulmonar, cáncer endometrial o de mama, fracturas, enfermedades cardiovasculares ni muertes a lo largo del seguimiento).
Al finalizar el estudio, el 95,27 % del total de las mujeres participantes consideró estar satisfecha con la efectividad de la tibolona.
Discusión
En la presente investigación se observó una mejoría de la sintomatología menopáusica del 94,48 % (p< 0,05); mientras que las disfunciones sexuales reportaron una mejoría del 86,56 %. Se observó un impacto positivo sobre el deseo, la frecuencia y la satisfacción sexual. Si bien los efectos adversos fueron frecuentes, resultaron leves, tolerables y transitorios, aparte de que se resolvieron de forma espontánea. Los resultados son similares a los informados en el estudio TOTAL (TOlerabilit Trial Comparing Activelle with Livial), de Hammar et al. (22), de tipo multicéntrico (realizado en 32 centros de 7 países europeos, en 572 mujeres), que demostró que la tibolona reduce los síntomas de la menopausia en un grado similar a la TRH combinada continua, pero produce menos sangrados y tensión mamaria. De igual modo que el estudio LISA (Livial International Study in Sexual Arousal Disorders), un ensayo clínico multicéntrico, doble ciego, aleatorizado (con 403 mujeres), el cual demostró que tanto la tibolona como E2/NETA resultaron en una mejora de la función sexual en general, con aumento en la frecuencia de eventos sexuales y reducción de la angustia personal relacionada con la sexualidad; pero las puntuaciones fueron más altas en los dominios del IFSF en el grupo de la tibolona (p< 0,05) (23).
El aumento del deseo sexual inducido por la tibolona puede deberse a las acciones de los estrógenos y andrógenos asociados a sus metabolitos, así como a la baja actividad de la globulina transportadora de hormonas sexuales (24), que se correlacionan tanto con el aumento de las concentraciones séricas de estradiol como de la testosterona libre (25).
En los resultados de un estudio aleatorizado y controlado (LIBERATE), donde se incluyeron 3148 mujeres con síntomas climatéricos, cuyo objetivo era demostrar la no inferioridad de la tibolona frente al placebo con respecto al riesgo de recurrencia en pacientes con cáncer de mama, luego de 3,1 años de seguimiento, no se encontraron diferencias entre ambos grupos con respecto a mortalidad, eventos cardiovasculares y aparición de otros cánceres ginecológicos. Los síntomas vasomotores y la densidad mineral ósea mejoraron significativamente con la tibolona; sin embargo, la recurrencia de cáncer de mama fue mayor que en el grupo placebo (15,2 % vs. 10,7 %; HR: 1,40; IC95 %: 1,14-1,70; p = 0,001). La interpretación del estudio es que la tibolona aumenta el riesgo de recurrencia en pacientes con cáncer de mama, al tiempo que alivia los síntomas vasomotores y previene la pérdida ósea (26).
Respecto al perfil lipídico, nuestros datos son similares a los presentados por Bjarnason et al. (27), en un estudio doble ciego, aleatorizado, controlado con placebo (de 2 años, realizado en 91 mujeres sanas posmenopáusicas), el cual señala reducción en el colesterol total y los triglicéridos.
En THEBES (Tibolone Histology of Endometrium and Breast Endpoints Study), un estudio multicéntrico, aleatorizado y doble ciego en 3240 mujeres, diseñado para abordar los informes contradictorios de la literatura sobre la seguridad endometrial de la tibolona, se confirmaron hallazgos previos de que no induce hiperplasia o carcinoma endometrial en mujeres posmenopáusicas, y se asocia con un mejor perfil de sangrado vaginal que la TRH convencional (28). Sin embargo, en un estudio aleatorizado, donde se asignaron 4538 mujeres, con edades entre 60 y 85 años de edad, durante una mediana de 34 meses de tratamiento, en el grupo de tibolona se redujo el riesgo de fractura, de cáncer de mama y posiblemente el cáncer de colon; pero aumentó el riesgo de accidente cerebrovascular en mujeres mayores con osteoporosis (29). De aquí se desprende la idea de que la tibolona es la TRH en mujeres menores de 60 años, en las cuales el riesgo de trombosis es bajo.
Es importante aclarar que la tibolona no es antiestrogénica ni inhibe la aromatasa; por lo tanto, su mecanismo de protección mamario se explica por las acciones enzimáticas al inhibir la sulfatasa y 17ß-hidroxiesteroide deshidrogenasa y estimular la sulfotransferasa para aumentar la producción de sulfatos inactivos (30). A su vez, los metabolitos no tienen la misma acción sobre la actividad de la sulfatasa en todos los tejidos, ya que solo inhiben moderadamente la sulfatasa en el endometrio y no proporcionan inhibición en el hueso (lo que permite un mayor impacto estrogénico) (31). La influencia estrogénica en la vagina alivia la sequedad vaginal y la dispareunia, que se asocia con una mejor respuesta sexual e incremento de la libido (14,32,33).
La principal fortaleza de esta investigación es que establece resultados de una de las TRH más prescritas, pero poco evaluadas en la población colombiana. Ello facilita conocer su impacto en el síndrome climatérico y la función sexual en mujeres que se hayan en el periodo de la “ventana de oportunidad” (9,14). Otra fortaleza es el uso de instrumentos validados y el periodo del estudio. Adicionalmente, es el primero en su tipo que se realiza en Colombia. Entre las limitaciones se encuentra el disminuido tamaño de la muestra, debido a las características de la población participante, pues tiene un alto nivel de selección, razón por la que solo se logró el análisis de 127 mujeres, aunque alcanzó para completar el número esperado durante el periodo de estudio. Por otro lado, al ser una investigación cuasiexperimental, se entiende su menor precisión y validez, en comparación con los diseños experimentales. Se abre la necesidad de estudios de mayor calidad metodológica que evalúen la efectividad de la tibolona sobre la sintomatología menopaúsica y la función sexual, así como el impacto (seguridad y tolerabilidad) en mujeres mayores de 60 años.
Conclusiones
La administración de tibolona tiene una positiva influencia en el tratamiento de la sintomatología climatérica, ya que reduce tanto su cantidad como su severidad, con franca mejoría de la función sexual, con efectos adversos leves, tolerables y transitorios. Se requieren ensayos clínicos controlados aleatorizados, doble ciego, sobre su eficacia y seguridad en poblaciones de mayor edad y más numerosas. Las futuras investigaciones deben confirmar los hallazgos descritos.
Agradecimientos
Agradecemos de forma especial a las mujeres participantes, así como al grupo de investigación de Hathor, Clínica Sexológica, por participar de forma activa en la elaboración y desarrollo de esta investigación.
REFERENCIAS
1. Baber RJ, Panay N, Fenton A; IMS Writing Group. 2016 IMS Recommendations on women's midlife health and menopause hormone therapy. Climacteric. 2016; 19(2):109-50. https://doi.org/10.3109/13697137.2015.1129166 [ Links ]
2. Espitia De La Hoz FJ. Prevalence of genitourinary syndrome of menopause and impact on sexuality of women in Quindío (Colombia), 2013-2016. Rev Colomb Obstet Ginecol. 2018;69(4):249-59. https://doi.org/10.18597/rcog.3111 [ Links ]
3. Avis NE, Colvin A, Bromberger JT, Hess R, Matthews KA, Ory M, et al. Change in health-related quality of life over the menopausal transition in a multiethnic cohort of middle-aged women: Study of Women's Health Across the Nation. Menopause. 2009;16(5):860-9. https://doi.org/10.1097/gme.0b013e3181a3cdaf [ Links ]
4. Jane FM, Davis SR. A practitioner's toolkit for managing the menopause. Climacteric. 2014;17(5):564-79. https://doi.org/10.3109/13697137.2014.929651 [ Links ]
5. McKinlay SM, Brambilla DJ, Posner JG. The normal menopause transition. Maturitas. 1992;14(2):103-15. https://doi.org/10.1016/0378-5122(92)90003-m [ Links ]
6. Lewis V. Undertreatment of menopausal symptoms and novel options for comprehensive management. Curr Med Res Opin. 2009;25(11):2689-98. https://doi.org/10.1185/03007990903240519 [ Links ]
7. Kaunitz AM, Manson JE. Management of menopausal symptoms. Obstet Gynecol. 2015;126(4):859-76. https://doi.org/10.1097/AOG.0000000000001058. [ Links ]
8. The 2017 hormone therapy position statement of The North American Menopause Society. Menopause. 2018;25(11):1362-87. https://doi.org/10.1097/GME.0000000000001241 [ Links ]
9. Panay N, Hamoda H, Arya R, Savvas M; British Menopause Society and Women's Health Concern. The 2013 British Menopause Society & Women's Health Concern recommendations on hormone replacement therapy. Menopause Int. 2013;19(2):59-68. https://doi.org/10.1177/1754045313489645 [ Links ]
10. Rossouw JE, Manson JE, Kaunitz AM, Anderson GL. Lessons learned from the Women's Health Initiative trials of menopausal hormone therapy. Obstet Gynecol. 2013;121(1):172-6. https://doi.org/10.1097/aog.0b013e31827a08c8 [ Links ]
11. Ross LA, Alder EM. Tibolone and climacteric symptoms. Maturitas. 1995;21(2):127-36. https://doi.org/10.1016/0378-5122(94)00888-e [ Links ]
12. Hardiman P, Nihoyannopoulos P, Kicovic P, Ginsburg J. Cardiovascular effects of Org OD 14--a new steroidal therapy for climacteric symptoms. Maturitas. 1991;13(3):235-42. https://doi.org/10.1016/0378-5122(91)90198-y [ Links ]
13. Lindsay R, Hart DM, Kraszewski A. Prospective double-blind trial of synthetic steroid (Org OD 14) for preventing postmenopausal osteoporosis. Br Med J. 1980;280(6225):1207-9. https://doi.org/10.1136/bmj.280.6225.1207 [ Links ]
14. Espitia De La Hoz FJ. Terapia de reemplazo hormonal combinada con testosterona para el tratamiento del trastorno del deseo sexual hipoactivo en mujeres en climaterio. Arch Med (Manizales). 2020;20(1):71-85. https://doi.org/10.30554/archmed.20.1.3388.2020 [ Links ]
15. Heinemann K, Ruebig A, Potthoff P, Schneider HP, Strelow F, Heinemann LA, et al. The Menopause Rating Scale (MRS) scale: a methodological review. Health Qual Life Outcomes. 2004;2:45. https://doi.org/10.1186/1477-7525-2-45 [ Links ]
16. Sadiq U, Baig KB, Mustafa N. Translation and reliability analysis of menopause rating scale (MRS) in Urdu language. J Pak Med Assoc. 2019;69(2):224-9. [ Links ]
17. Rosen R, Brown C, Heiman J, Leiblum S, Meston C, Shabsigh R, et al. The Female Sexual Function Index (FSFI): a multidimensional self-report instrument for the assessment of female sexual function. J Sex Marital Ther. 2000;26(2):191-208. https://doi.org/10.1080/009262300278597 [ Links ]
18. Sánchez-Sánchez B, Navarro-Brazález B, Arranz-Martín B, Sánchez-Méndez Ó, de la Rosa-Díaz I, Torres-Lacomba M. The Female Sexual Function Index: transculturally adaptation and psychometric validation in Spanish women. Int J Environ Res Public Health. 2020;17(3):994. https://doi.org/10.3390/ijerph17030994 [ Links ]
19. Espitia De La Hoz FJ. Prevalence and characterization of sexual dysfunctions in women, in 12 Colombian cities, 2009-2016. Rev Colomb Obstet Ginecol. 2018;69(1):9-21. https://doi.org/10.18597/rcog.3035 [ Links ]
20. Potthoff P, Heinemann LA, Schneider HP, Rosemeier HP, Hauser GA. Menopause-Rating-Skala (MRS II): Methodische Standardisierung in der deutschen Bevölkerung [The Menopause Rating Scale (MRS II): methodological standardization in the German population]. Zentralbl Gynakol. 2000;122(5):280-6. [ Links ]
21. Schneider HP, Rosemeier HP, Schnitker J, Gerbsch S, Turck R. Application and factor analysis of the menopause rating scale [MRS] in a post-marketing surveillance study of Climen. Maturitas. 2000;37(2):113-24. https://doi.org/10.1016/s0378-5122(00)00177-8 [ Links ]
22. Hammar ML, van de Weijer P, Franke HR, Pornel B, von Mauw EM, Nijland EA; TOTAL Study Investigators Group. Tibolone and low-dose continuous combined hormone treatment: vaginal bleeding pattern, efficacy and tolerability. BJOG. 2007;114(12):1522-9. https://doi.org/10.1111/j.1471-0528.2007.01537.x [ Links ]
23. Nijland EA, Weijmar Schultz WC, Nathorst-Boös J, Helmond FA, Van Lunsen RH, Palacios S, et al. Tibolone and transdermal E2/NETA for the treatment of female sexual dysfunction in naturally menopausal women: results of a randomized active-controlled trial. J Sex Med. 2008;5(3):646-56. https://doi.org/10.1111/j.1743-6109.2007.00726.x [ Links ]
24. Laan E, van Lunsen RH, Everaerd W. The effects of tibolone on vaginal blood flow, sexual desire and arousability in postmenopausal women. Climacteric. 2001;4(1):28-41. [ Links ]
25. Nathorst-Böös J, Hammar M. Effect on sexual life--a comparison between tibolone and a continuous estradiol-norethisterone acetate regimen. Maturitas. 1997;26(1):15-20. https://doi.org/10.1016/s0378-5122(96)01069-9 [ Links ]
26. Kenemans P, Bundred NJ, Foidart JM, Kubista E, von Schoultz B, Sismondi P, et al. Safety and efficacy of tibolone in breast-cancer patients with vasomotor symptoms: a double-blind, randomised, non-inferiority trial. Lancet Oncol. 2009;10(2):135-46. https://doi.org/10.1016/S1470-2045(08)70341-3 [ Links ]
27. Bjarnason NH, Bjarnason K, Haarbo J, Bennink HJ, Christiansen C. Tibolone: influence on markers of cardiovascular disease. J Clin Endocrinol Metab. 1997;82(6):1752-6. https://doi.org/10.1210/jcem.82.6.3995 [ Links ]
28. Archer DF, Hendrix S, Gallagher JC, Rymer J, Skouby S, Ferenczy A, den Hollander W, Stathopoulos V, Helmond FA. Endometrial effects of tibolone. J Clin Endocrinol Metab. 2007;92(3):911-8. https://doi.org/10.1210/jc.2006-2207 [ Links ]
29. Cummings SR, Ettinger B, Delmas PD, Kenemans P, Stathopoulos V, Verweij P, et al. The effects of tibolone in older postmenopausal women. N Engl J Med. 2008;359(7):697-708. https://doi.org/10.1056/NEJMoa0800743 [ Links ]
30. Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52,705 women with breast cancer and 108,411 women without breast cancer. Collaborative Group on Hormonal Factors in Breast Cancer. Lancet. 1997;350(9084):1047-59. Erratum in: Lancet 1997;350(9089):1484. [ Links ]
31. De Gooyer ME, Kleyn GT, Smits KC, Ederveen AG, Verheul HA, Kloosterboer HJ. Tibolone: a compound with tissue specific inhibitory effects on sulfatase. Mol Cell Endocrinol. 2001;183(1-2):55-62. https://doi.org/10.1016/s0303-7207(01)00606-2 [ Links ]
32. Formoso G, Perrone E, Maltoni S, Balduzzi S, Wilkinson J, Basevi V, et al. Short-term and long-term effects of tibolone in postmenopausal women. Cochrane Database Syst Rev. 2016;10(10):CD008536. https://doi.org/10.1002/14651858.CD008536.pub3 [ Links ]
33. Modelska K, Cummings S. Tibolone for postmenopausal women: systematic review of randomized trials. J Clin Endocrinol Metab. 2002;87(1):16-23. https://doi.org/10.1210/jcem.87.1.8141 [ Links ]
Recibido: 17 de Junio de 2021; Aprobado: 27 de Julio de 2021











 texto en
texto en 



