Introducción
La pasta de cocaína, también conocida como paco, bicha, basuco/bazuco o susto, es una droga ilícita consumida en muchos países del mundo. Las muertes relacionadas por el consumo de drogas se ha incrementado en un 60 % en los últimos 15 años (1). El consumo de la pasta de cocaína es frecuente en países como Colombia, Argentina y Perú; sin embargo, en los últimos años se ha extendido por casi toda América Latina (2).
La elaboración de la pasta de coca es un proceso complejo que involucra varios pasos y agentes químicos. Las hojas de coca (Erythroxylum coca) se someten a un proceso de secado y machado, luego adición de permanganato de potasio (queroseno) y ácido sulfúrico, para posteriormente ser sometidas a un proceso de filtrado. Finalmente, la pasta de cocaína es una mezcla con características semisólidas de color amarillo o grisáceo, una forma fumable de cocaína (3).
La pasta de cocaína comercializada no es pura y contiene otras sustancias e impurezas que tienen una concentración variable. Se ha determinado que el basuco puede contener entre un 20 % y un 70 % de base de coca y otros componentes como cafeína, fenacetina e, incluso, otros componentes químicos derivados de agentes utilizados para su producción (4). La mayoría de los consumidores de basuco tiene una edad entre los 25 y los 34 años y son principalmente hombres, con mayor frecuencia de estrato socioeconómico 1 y 2 y edad de inicio promedio de consumo es entre los 18 y los 19 años (5).
En el país, según el Observatorio de Drogas de Colombia, la prevalencia anual del consumo de basuco en el 2013 fue del 0,21 % en la población entre 12 y 65 años. De unas 49.000 personas consumidoras, 45.000 son varones. Además, representa la cuarta droga ilícita de mayor consumo (5). Durante el 2016, se llevó a cabo en Colombia el Estudio Nacional de Consumo de Sustancias Psicoactivas en Escolares, es decir, población entre 12 y 18 años, y se encontró una prevalencia aproximada del 1 % (6). El fenómeno de transición entre drogas ilícitas ha sido poco estudiado en Colombia. No obstante, es claro que en buena medida muchos adictos hacen la transición hacia el consumo de basuco (7).
Los efectos negativos del consumo de drogas ilícitas se producen sobre la sociedad, el medioambiente, la economía y la salud del consumidor, lo cual ha motivado la búsqueda de acciones dirigidas a entender el problema y a mitigar en los consumidores los efectos de la intoxicación a corto y largo plazo (8). En este artículo se abordan los aspectos relacionados con el consumo de basuco sobre la salud humana.
Aspectos farmacológicos
Los psicoestimulantes son una clase amplia de drogas simpatomiméticas. Son sustancias que actúan de forma muy general, estimulando los nervios simpáticos adrenérgicos, siendo agonistas directos e indirectos de los receptores adrenérgicos (NE y DA) y aumentando la liberación de ambos neurotransmisores en el espacio intersináptico extraneuronal (9).
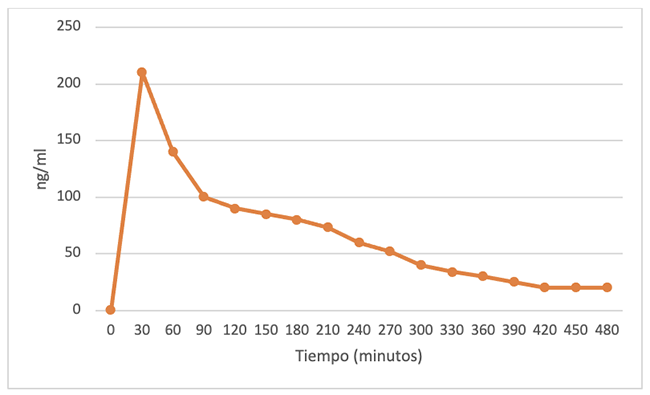
En el caso de la cocaína fumada, conocida como basuco, la absorción es muy rápida y en pocos minutos alcanza concentraciones plasmáticas entre el 70 % y el 80 %. Atraviesa rápidamente la barrera hematoencefálica y produce efectos centrales de forma rápida, con un efecto que es también de corta duración (8-12 segundos) (10). En la figura 1 se muestra la evolución de las concentraciones plasmáticas en la sangre de voluntarios sanos.
Su metabolismo se realiza por diferentes vías enzimáticas: en un 45 %, el metabolismo se produce por la acción de las colinesterasas séricas; otro 45 % se da por la acción de carboxilesterasas hepáticas específicas, y otro 5 %, por carboxilesterasas hepáticas inespecíficas (12). La excreción en la orina puede detectarse hasta 55 horas después y hasta en un 5 % sin metabolizarse (13).
Como la pasta base de cocaína es un derivado de la cocaína, podemos suponer que esta se comporta de forma similar, como una amina simpaticomimética de acción indirecta, es decir, incrementa la disponibilidad del neurotransmisor en la unión sináptica. Los efectos centrales de la cocaína combinan la acción de los neurotransmisores dopamina, noradrenalina, serotonina, acetilcolina y ácido γ-aminobutírico (14). En buena medida, el efecto inhibidor sobre la recaptación de la dopamina está implicado en la generación del efecto reforzador y la subsecuente adicción. Por otra parte, los efectos sobre la concentración de noradrenalina en la unión sináptica explican la mayoría de los síntomas y complicaciones derivadas con la cocaína, como hipertensión arterial, sudoración, temblor y modificaciones de la conducta que se presenta de forma aguda (15).
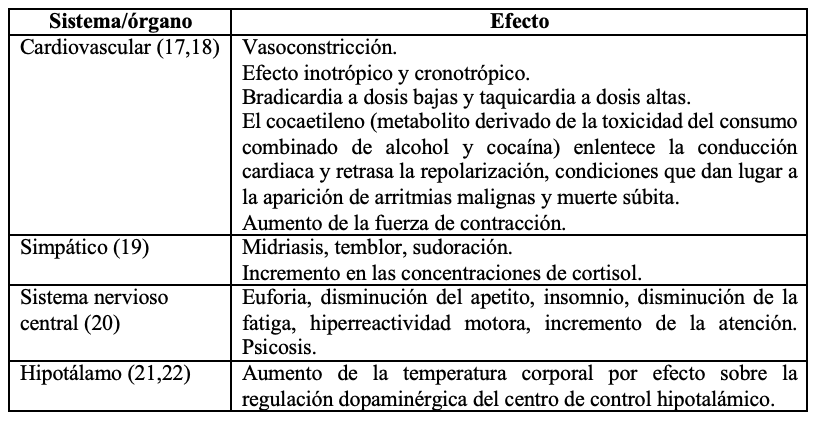
Por medio de la inhibición de la bomba de recaptación de dopamina se incrementa la biodisponibilidad de dicho neurotransmisor; asimismo, se activan directamente los receptores de dopamina postsinápticos que conducen a una hipersensibilidad en los receptores D1 y D2 postsinápticos. Esta sustancia también altera otros sistemas cerebrales y actúa sobre otros neurotransmisores, como la noradrenalina y la serotonina, a través de la inhibición de las bombas de recaptación respectivas. La neurotransmisión dopaminérgica-glutamatérgica-gabaérgica entre el núcleo accumbens, el área tegmental ventral y la corteza prefrontal resulta fundamental para comprender los mecanismos cerebrales de la recompensa y el placer (16). Los efectos farmacológicos sobre los distintos sistemas del cuerpo se presentan en la tabla 1.
El aclaramiento de la cocaína es rápido y varía entre 20 y 30 ml/min por cada kilogramo de peso. Se identifican como metabolitos la ecgonina metilester, la benzoilecgonina y la ecgonina. Las semividas de estos metabolitos pueden varían (23). El consumo, junto con el alcohol, así como variaciones genéticas en las vías metabólicas, que apenas comienzan a estudiarse, explican en buena medida las diferencias que ocurren en la farmacocinética luego de su consumo (24).
Es importante anotar que las alteraciones farmacológicas de la cocaína en el caso del basuco se ven modificadas como consecuencia de los agentes extraños que se usan en su proceso de producción y que pueden llevar a expresiones fisiológicas, incluso potenciadas de sus efectos (25). Este tipo de aspectos requieren mayor investigación y deberán abordarse en futuras investigaciones.
La adicción: aspectos neurobiológicos
El basuco es una sustancia con gran capacidad de inducir la adicción. La rápida velocidad de absorción y su capacidad para atravesar la barrera hematoencefálica facilitan su desarrollo. Las acciones de esta droga sobre el sistema nervioso central y sobre distintos procesos de la respuesta metabólica son complejas y explican la dificultad para la generación de abordajes terapéuticos para su tratamiento (10).
El núcleo accumbens es la región anatómica que con mayor probabilidad explica el inicio de la adicción a la cocaína (26). Otras regiones como el putamen y el núcleo caudado parecen estar relacionados con la respuesta a largo plazo. Adicionalmente, el circuito orexina/hipocretina está también implicado en el mantenimiento y potenciación de la adicción (27). Modelos en animales han mostrado que el efecto agudo del basuco y la cocaína se traduce en picos frecuentes de liberación de dopamina en los sistemas mesocorticolímbico y nigroestriado (28). De forma endógena, este circuito dopaminérgico es regulado por la acción del sistema opiáceo (29). La exposición prolongada a la cocaína incrementa las concentraciones de los receptores de opioides en diferentes regiones cerebrales relacionadas con la respuesta dopaminérgica (30).
Estos resultados también se han descrito mediante la realización de la tomografía por emisión de positrones (31). Es importante tener en cuenta que estos circuitos se modifican de acuerdo con el sexo (32), probablemente relacionados con las hormonas sexuales y la respuesta del eje hipotálamo-pituitario-adrenal (33). Incluso, aunque en la actualidad se comprende poco, estas modificaciones y la exposición a la cocaína durante el embarazo producen modificaciones en el funcionamiento del cerebro del feto, que incluso pueden expresarse durante la adolescencia y la vida adulta (34).
En general, estos sistemas del sistema nervioso central, con la exposición repetida a las drogas, entre ellas la cocaína, inducen la sensibilización neuronal y la generación de tolerancia a su acción, razón por la cual, con el tiempo, es necesario un estímulo mayor para lograr el efecto deseado (35). Es también reconocido que la exposición a la cocaína altera los circuitos de memoria y comportamiento, que refuerzan la necesidad de su consumo (36).
En un estudio de 2018 se entendió que, ante predisposiciones genéticas, la exposición a un medio ambiente proclive dispara la adicción. Un medio ambiente altamente estresante ha mostrado incrementar el riesgo de desencadenar la adicción (37). En el plano molecular, la cocaína modifica la expresión de proteínas que conducen a comportamientos de compulsión relacionados con el consumo de la droga (38). Estas modificaciones en la expresión de las proteínas buscan lograr la adaptación a la droga que se introduce en el cuerpo; sin embargo, estas suelen ser complejas e implicar diferentes circuitos neuronales. Ello explica parcialmente los motivos por los cuales una única intervención farmacológica parece no mostrar beneficios significativos en el control de la adicción (39).
Una de las combinaciones más frecuentes es el consumo del basuco con tabaco. Se ha sugerido que este tipo de casos requieren un enfoque combinado para su tratamiento, dado que se trata de dos adicciones con mecanismos diferentes, que incluso pueden potenciarse (40).
Desde el punto de vista nosológico, el cambio más relevante en la quinta edición del Manual diagnóstico y estadístico para la clasificación de los trastornos mentales (DSM-5) corresponde a la desaparición de las categorías de abuso y dependencia, para pasar a una conceptualización donde existe una dimensión estructurada como trastorno por consumo de sustancias. Para establecer este diagnóstico es necesario, como mínimo, cumplir dos ítems de los once propuestos para cualquier sustancia. En relación con la severidad del cuadro, se establece si es leve (dos o más síntomas), moderado (cuatro o cinco síntomas) y grave (más de seis síntomas).
Resumen de los criterios del DSM 5 para el trastorno por consumo de estimulantes (41)
Un patrón de consumo de estimulantes (cocaína o derivados, anfetamina u otra sustancia relacionada) que causa un malestar significativo que se manifiesta por, al menos, dos de los siguientes criterios durante un periodo de doce meses:
El estimulante es, a menudo, consumido en mayores cantidades o por periodos de tiempo más amplios de lo habitual.
Existen esfuerzos infructuosos para la disminución o la suspensión del consumo de la sustancia.
Se invierte una gran cantidad de tiempo en actividades necesarias para obtener el estimulante, usar el estimulante o recuperarse de los efectos.
Presencia de craving o un fuerte deseo o urgencia por el estimulante.
Existe un incumplimiento de los principales roles sociales por el consumo (trabajo, estudio u hogar).
Uso continuo del estimulante, a pesar de tener dificultades persistentes de tipo social o interpersonal exacerbadas por el uso del estimulante.
Problemas sociales o interpersonales importantes relacionados con el consumo.
Uso peligroso de la sustancia.
El uso de la sustancia se continúa a pesar del conocimiento de tener consecuencias físicas o psicológicas que han sido causadas o exacerbadas por el uso de estimulantes.
Tolerancia definida por uso de mayor cantidad de la sustancia para encontrar el efecto deseado.
Presencia de abstinencia.
Especificar si: remisión temprana, remisión sostenida o uso en entorno controlado.
Factores de riesgo
Son varios los factores de riesgo identificados con el consumo del basuco. Dentro de ellos se encuentran:
Abuso infantil (42).
Uso previo de otras drogas, incluso aquellas que son consideradas legales, como el alcohol (43).
Concepto negativo de familia (44).
Estrato socioeconómico bajo (45).
Rasgos de la personalidad narcisista (46).
Ausentismo escolar (47).
Edad menor a 30 años (48).
Hiperreactividad al estrés e impulsividad (49).
Como consecuencia del consumo de basuco aparecen también otros efectos negativos, es decir, su adicción es un factor de riesgo para problemas laborales, económicos y familiares (3). El consumo de basuco se ha relacionado también con un incremento en el riesgo de transmisión del virus de inmunodeficiencia humana (VIH); incluso presentan mayor riesgo aquellos quienes son usuarios de drogas intravenosas (50). Se ha documentado que los consumidores de cocaína tienen diferentes comportamientos de riesgo que facilitan la transmisión de infecciones de transmisión sexual (51). Estos aspectos siempre deben ser tenidos en cuenta por el médico tratante, para lograr el mejor enfoque del paciente.
Aspectos clínicos
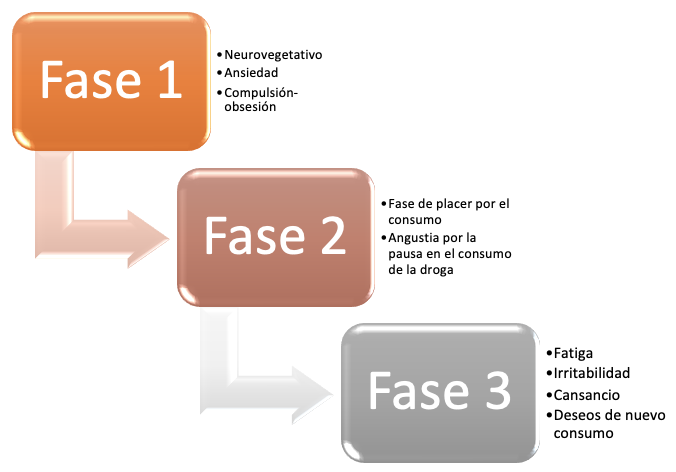
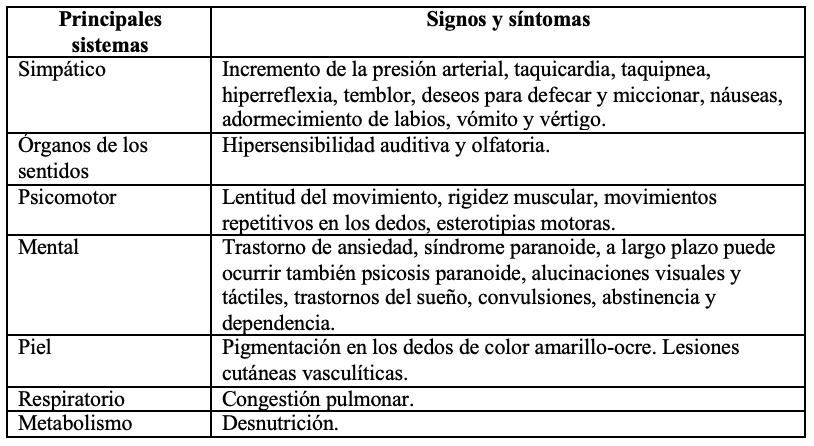
Los signos y síntomas (tabla 2) de la intoxicación aguda por consumo de basuco tienen una expresión sintomática variable, que se presenta en tres etapas (figura 2):
Fase 1. Fase de preconsumo. Se caracteriza por la presentación de taquicardia, sudoración y síntomas de malestar abdominal. Son habituales también los síntomas de ansiedad (52).
Fase 2. Fase de consumo. Se trata de una fase que tiene manifestaciones variadas en diferentes sistemas del cuerpo. En la figura 2 se describen estos signos y síntomas.
Fase 3. Fase de postefecto. Se caracteriza por la presentación de sudoración, fatiga e irritabilidad. Al inicio del consumo aparecen sentimientos de culpa. También aparece la boca seca y enrojecimiento de los labios. Al terminar da inicio a un nuevo consumo (2).
El consumo crónico genera también diferentes manifestaciones:
Efectos neuropsiquiátricos. El consumo crónico puede llegar a producir psicosis florida, especialmente en personas que tuvieron psicosis previa o aquellas con antecedentes de trastorno mental. A largo plazo se ha descrito también la alteración en la función cognitiva, particularmente en la función de la memoria verbal y la atención (55).
Efectos sobre el sistema cardiovascular. En el corazón se ha identificado el desarrollo de hipertensión arterial e hipertrofia ventricular concéntrica (56). También se ha documentado el desarrollo de vasoespasmo, que en casos extremos genera una cardiopatía isquémica (57). El incremento crónico de las catecolaminas en la sangre, producto del consumo, puede también generar una miocarditis (58). El consumo crónico está relacionado con la muerte súbita, probablemente debida a espasmos coronarios intensos o bien al desarrollo de arritmias ventriculares (59). Es claro que el consumo crónico también altera la elasticidad y función de las arterias en todo el cuerpo, lo cual favorece el desarrollo de aneurismas aórticos y la enfermedad cerebrovascular (60,61). El cocaetileno (metabolito derivado de la toxicidad del consumo combinado de alcohol y cocaína) enlentece la conducción cardiaca y retrasa la repolarización, condiciones que dan lugar a la aparición de arritmias malignas y muerte súbita (56).
Efectos sobre el sistema respiratorio. La exposición crónica conduce al desarrollo de vasoespasmo en las arteriolas pulmonares y procesos inflamatorios crónicos que deterioran de forma progresiva el parénquima pulmonar (62). En estos pacientes se presentan signos y síntomas de enfermedad pulmonar obstructiva crónica y sarcoidosis (63).
Efectos sobre el riñón. Los efectos sobre la función renal se deben a daño glomerular, vascular, tubular e intersticial, que lleva a atrofia glomerular, esclerosis glomerular, proliferación de células mesangiales, trombosis y ruptura del asa capilar, engrosamiento de la membrana basal capilar, edema y necrosis de las células epiteliales tubulares, intersticio con focos de necrosis y hemorragia. El consumo crónico conduce al deterioro progresivo de la tasa de filtración glomerular y al desarrollo de albuminuria (64,65).
Efectos sobre el sistema gastrointestinal. No son tan frecuentes pero se han descrito el desarrollo de pancreatitis, colitis, úlceras pépticas y necrosis intestinal (66).
Efectos en el embarazo y el feto. Se presenta el retraso en el crecimiento intrauterino, parto prematuro, muerte fetal intrauterina y elevado riesgo de morbilidad y mortalidad neonatal (67).
Como parte del abordaje diagnóstico se emplea la medición en sangre u orina de los compuestos metabólicos de la cocaína, y cuando se sospecha su consumo crónico, además, se indica la toma de radiografía de tórax, ecocardiografía, electrocardiografía, pruebas de función renal y hepática, así como espirometría (68).
Consideraciones sobre el tratamiento
Las medidas terapéuticas inician con la realización de una historia clínica completa que incluya el patrón de consumo, antecedentes y comorbilidades; examen físico completo, química sanguínea y control toxicológico, entre otros de acuerdo con los hallazgos. Con frecuencias, los consumidores de basuco usan otras sustancias psicoactivas que deben tenerse en cuenta. Según la valoración y la presentación de la intoxicación aguda se inicia el tratamiento específico (tabla 3).
Tabla 3 Manejo de las condiciones clínicas durante la intoxicación aguda
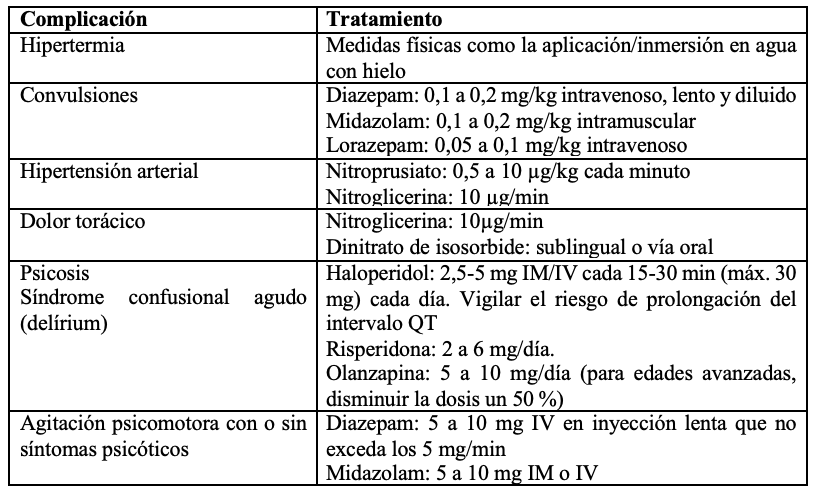
Fuente: modificado de (69).
El manejo de la dependencia al basuco se considera un reto. En la actualidad debe combinarse el apoyo psicológico con las medidas farmacológicas. A continuación, se resume la evidencia disponible sobre su uso:
Agonistas dopaminérgicos. Dentro de este grupo farmacológico se encuentran la amantadina, la bromocriptina, la pergolida y el mazindol. En un metanálisis de la literatura que evaluó la amantadina, la bromocriptina y la pergolida no se encontró un efecto significativo comparados contra placebo, sobre la adicción (RR: 1,04; IC95 %: 0,94-1,14) (70). En el caso del mazindol, aunque este parecía ser útil (71), otras observaciones han mostrado que su efecto es limitado (72). Actualmente, no se comercializa en muchos países del mundo, entre ellos Colombia.
Antidepresivos. En pacientes que cursan con patología dual existe un beneficio de su uso para el control de los síntomas del síndrome de la intoxicación, la abstinencia o el trastorno depresivo. El bupropión puede utilizarse en el tratamiento de pacientes depresivos duales, buscando el efecto antidepresivo o facilitando el abandono tabáquico con consumo de cocaína concurrente, ya que su eficacia como tratamiento antitabáquico es independiente de su acción antidepresiva (73). En pacientes sin trastornos depresivos no se ha encontrado un beneficio sobre el uso de los antidepresivos para lograr el manejo de la dependencia (74).
Psicoestimulantes. Dentro de ellos se encuentran el metilfenidato y el modafinilo, pero la evidencia de la literatura no ha demostrado que estos medicamentos produjeran un efecto superior al placebo (75).
Antipsicóticos. Distintos medicamentos se han evaluado, entre ellos el haloperidol, la risperidona y la olanzapina. En pacientes sin comorbilidad psiquiátrica que justifique su uso no existe beneficio como tratamiento de la adicción (RR: 1,30; IC95 %: 0,73-2,32) (76). La psicosis (trastorno psicótico inducido por sustancias) o las exacerbaciones de condiciones psiquiátricas con psicosis son frecuentes en los consumidores de derivados de la cocaína. Se debe tener presente que cuando se usan antipsicóticos potentes para tratar estos cuadros, existe la posibilidad de una saturación aguda de los receptores de dopamina D2. Estudios preclínicos sugieren que los receptores sigma 1 y sigma 2 encontrados en regiones motoras del cerebro que se relacionan con el control postural pueden estar asociados con la presentación de distonías severas, estatus distónico y mayor riesgo de presentación de síndrome neuroléptico maligno en este grupo de individuos (77).
Anticonvulsivantes. El uso de medicamentos anticonvulsivantes, comparado contra placebo, no ha mostrado beneficios significativos (RR: 0,95; IC95 %: 0,86-1,05) (78).
Disulfiram. Su uso se ha propuesto porque se ha encontrado un efecto en la prevención del metabolismo de la dopamina por medio de la inhibición de la enzima dopamina-beta hidroxilasa, que bloquea la conversión de dopamina a norepinerfina. Existe evidencia de baja calidad sobre su utilidad en adicción única a cocaína, que muestra resultados modestos sobre la aparición de la abstinencia y lograr reducir la dependencia (79). Ensayos controlados y abiertos sugieren que el disulfiram puede reducir el consumo de alcohol y cocaína en sujetos que abusan de ambas sustancias, pero que su efecto sobre el consumo de cocaína es independiente de su efecto sobre el consumo de alcohol (73).
Naltrexona. Existe poca evidencia sobre su uso y utilidad. En la mayoría de los casos se ha evaluado en codependencia con alcohol y su uso debe estar ligado a un tratamiento integral. No se ha documentado utilidad de su uso (80).
Agonistas de opiáceos. La metadona y la buprenorfina son los medicamentos que han sido sugeridos dentro del manejo de la adicción. Estos no han mostrado beneficio cuando la adicción es únicamente a la cocaína, pero sí muestran beneficios cuando se presenta en codependencia con los opiáceos (81).
N-acetilcisteína (NAC). Su potencial beneficio en el manejo de la dependencia de sustancias psicoactivas está en relación con la neurotransmisión glutamatérgica, al aumentar las concentraciones de glutamato extracelular en el cerebro. Se han demostrado beneficios en el manejo de la adicción a cocaína, en la reducción de los antojos del consumo de cocaína y la prolongación del tiempo de esta y otras sustancias psicoactivas. Hacen falta estudios utilizando NAC en sujetos con adicción al basuco, específicamente para evaluar la eficacia de dicho fármaco en esta población (82).
Vacunas. Se ha investigado una vacuna contra la cocaína que impide la entrada de cocaína al cerebro. Se proyecta como un potencial para reducir el riesgo de recaídas o rebotes en el consumo. Hasta el momento no existe evidencia suficiente que apoye su uso (83).
Terapia de adicciones. Existe un arsenal de opciones para tratar la adicción de sustancias psicoactivas, incluido el basuco. Incluyen terapias cognitivo-conductuales y terapias analíticas y psicodinámicas, cada una con otras opciones de intervenciones para seleccionar. La elección del tipo de terapia se debe basar en la evaluación y entrevistas que se le realiza al paciente y su conduta adictiva (84). Una de las estrategias es el manejo de contingencias o incentivos para realizar la motivación. Es una forma de terapia individual y grupal que ha dado resultados positivos en los procesos de rehabilitación del trastorno por consumo de estimulantes. Esta estrategia usa un sistema fundamentado en recompensas que premian a los pacientes que mantienen la abstención (85).
En términos generales, la combinación de medicamentos utilizados con racionalidad, el direccionamiento del tratamiento de las patologías psiquiátricas subyacentes, sumado a intervenciones psicoterapéuticas y la existencia de un programa dirigido al apoyo durante las recaídas, parece mostrar los mejores efectos, en términos del control de la adicción. Sin embargo, los resultados se han evaluado solo hasta las dieciséis semanas (86).
La complejidad de esta adicción la convierte en un reto para el médico tratante y se requiere un abordaje interdisciplinario. En general, existen pocas herramientas científicamente validadas para combatirla.
Conclusión
El consumo de basuco es un problema de salud pública en los países de Latinoamérica. El impacto familiar, social y personal que produce justifica la búsqueda de nuevas herramientas terapéuticas para su tratamiento. La adicción se produce por mecanismos complejos que hacen difícil su tratamiento y los efectos del basuco sobre el cuerpo son severos y afectan casi a todos los sistemas del organismo. Para la intoxicación aguda, el tratamiento se centra en el manejo sintomático, y para el consumo crónico de basuco existen medidas terapéuticas farmacológicas y no farmacológicas que deben ir ligadas a un tratamiento integral y se eligen según la valoración inicial y seguimiento que se lleva a cabo con el paciente. Futuros estudios deberán intentar medir los efectos de diferentes intervenciones sobre esta adicción.