Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Ciencias Hortícolas
versão impressa ISSN 2011-2173
rev.colomb.cienc.hortic. vol.7 no.1 Bogotá jan./jun. 2013
1 Facultad de Ciencias, Departamento de Biología, Universidad Nacional de Colombia, Bogotá (Colombia).
2 Facultad de Agronomía, Departamento de Agronomía, Universidad Nacional de Colombia, Bogotá (Colombia).
3 Facultad de Agronomía, Programa de Maestría en Ciencias Agrarias, Línea Fisiología de Cultivos, Universidad Nacional de Colombia, Bogotá (Colombia).
4 Autor para correspondencia. nemorenobu@unal.edu.co
Fecha de recepción: 23-01-2013 Aprobado para publicación: 28-05-2013
RESUMEN
En Colombia el anón es propagado sexualmente, ya que el método asexual no ha alcanzado resultados óptimos. Sin embargo, debido al bajo e irregular potencial germinativo, este método es poco efectivo y los cultivos extensivos son escasos. En semillas de anón común provenientes de Apulo (Cundinamarca), se evaluó el efecto de cuatro concentraciones de zeatina (0,25 mg L-1; 0,5 mg L-1; 1 mg L-1 y 4 mg L-1) sobre la germinación, para lo cual las semillas fueron imbibidas 48 horas en zeatina comercial y posteriormente llevadas a pruebas de germinación en un fitotrón a 35°C. Con el uso zeatina se obtuvieron mejores porcentajes de germinación (69,6% con 1 mg L-1), mayores velocidades de germinación (1,91 semillas germinadas/día con 0,25 mg L-1) y menores tiempos de germinación (9 días con 0,25 mg L-1).
Palabras clave adicionales: Annonaceae, latencia, citoquininas, tratamientos pregerminativos.
ABSTRACT
In Colombia, the sugar apple is propagated sexually because the asexual method has not reached optimal results. However, due to its low and irregular seed germination potential, this method is ineffective and crops are scarce. Using sugar apple seeds from Apulo (Cundinamarca), the effects of four zeatin concentrations (0.25 mg L-1, 0.5 mg L-1, 1 mg L-1, and 4 mg L-1) on germination were evaluated by soaking seeds for 48 hours in commercial zeatin, which were then tested for germination in growth chambers at 35°C. The seeds with zeatin had a higher germination percentage (69.6% with 1 mg L-1), average germination speed (1.91 germinated seeds/day with 0.25 mg L-1), and lower average germination time (9 days with 0.25 mg L-1).
Additional key words: Annonaceae, dormancy, cytokinins, pregerminative treatments.
INTRODUCCIÓN
La familia Annonaceae se distribuye pantropicalmente bajo los 2.000 msnm, comprende aproximadamente 2.500 especies en 140 géneros. Los géneros cultivables más importantes son Annona y Rollinia (Sanjinés et al., 2006), y el género Annona que agrupa 150 especies, donde se encuentran las especies de mayor importancia económica que son Annona squamosa L., A. muricata L., A. cherimola Mill. y el híbrido atemoya (A. squamosa × A. cherimola); estos frutos son buena fuente de vitamina A, hierro y calorías (Guerrero y Fischer, 2007), producen aceites esenciales y medicinales, y actualmente se ha aislado de ellos componentes antitumorales relacionados con cáncer de próstata y seno (Ojeda, 2005).
El anón (A. squamosa L.) tiene muchos nombres comunes, en Colombia se conoce con esta denominación, pero en otros países puede encontrarse como riñón (Venezuela), saramuya o chirimoya (Guatemala) (Geilfus, 1994).
No se conoce con exactitud el centro de origen del anón. Inicialmente fue situado en la India, pero datos históricos y filogenéticos lo ubican en las regiones tropicales de Centroamérica o las Antillas. Annona squamosa es la especie del género Annona más ampliamente distribuida en el mundo (Guerrero y Fischer, 2007). En Colombia hay poco conocimiento sobre de las anonáceas, los primeros indicios sobre esta familia en el país fueron publicados por Lotero (1976) que realizó un estudio donde registró la existencia de 72 especies distribuidas en 17 géneros; posteriormente Sánchez (1987) revisó 11 especies de Guatteria de la sección Chasmanta, y Murillo y Restrepo (2000) revisaron 94 especies y 19 géneros que crecen en la región de Araracuara (Amazonía).
El anón crece desde el nivel del mar hasta los 1.000 msnm (Hoyos, 1989), no requiere de periodos fríos, por lo que se desarrolla y crece bien en condiciones relativamente estables de temperatura (George y Nissen, 1987), en Colombia se encuentra en las zonas secas de los valles interandinos en los departamentos de Valle, Caldas, Tolima, Cundinamarca y los Santanderes (Guerrero y Fischer, 2007).
La temperatura mínima media, conveniente para su cultivo, se encuentra en unos 15°C y la máxima entre 22 y 28°C (Guerrero y Fischer, 2007; Morton, 1987).
Es la anonácea más resistente al frío, junto con la chirimoya (Navarro, 2001), aunque los árboles jóvenes no toleran temperaturas bajo 0°C, los árboles adultos muestran cierta tolerancia a las heladas (Campbell y Phillips, 1994). El anón soporta periodos prolongados de sequía y es una de las anonáceas más tolerantes a esta (Guerrero y Fischer, 2007); requiere de una precipitación anual entre 750 y 1.200 mm (Guerrero, 2012).
La germinación de las semillas es un proceso que inicia con la imbibición en agua de las semillas (Bewley y Black, 1994) y se desarrolla en tres etapas principales, durante las cuales el metabolismo celular se incrementa, en condiciones favorables la radícula del embrión penetra las capas adyacentes hasta que se presenta protrusión radicular, signo visible de la finalización de la germinación (Bewley, 1997).
Algunas semillas no germinan debido a dos razones: la quiescencia, cuando el medio no es favorable para el crecimiento vegetativo por baja humedad o temperaturas no adecuadas; o a la latencia, un bloqueo al proceso de la germinación de semillas intactas y viables, incluso bajo condiciones favorables (Baskin y Baskin, 2004).
Los diferentes tipos de latencia determinan las condiciones que necesitan las semillas para poder germinar: la latencia exógena o de cubierta, se produce porque la testa puede ser muy dura, o impermeable, o puede estar acumulando sustancias inhibidoras de la germinación (Finch-Savage y Leubner-Metzger, 2006). La latencia morfológica se relaciona con embriones inmaduros, que son rudimentarios o no están desarrollados por lo que requieren tiempo para madurar antes de la germinación (Baskin y Baskin, 2001).
Otro tipo de latencia, es la interna que es controlada en el interior de los tejidos por dos fenómenos independientes: la presencia de una cubierta semipermeable y un mecanismo fisiológico inhibidor (Finch-Savage y Leubner-Metzger, 2006). También existen la latencia morfofisiológica, que se presenta cuando el embrión no está desarrollado en su totalidad y además existen mecanismos fisiológicos fuertes que inhiben la germinación (Baskin y Baskin, 2004).
Para superar la latencia, existen algunos tratamientos que se efectúan antes de la germinación, por lo que son denominados tratamientos pregerminativos: la estratificación, permite superar la latencia proveniente de un embrión inmaduro que es incapaz de germinar con normalidad (Baskin y Baskin, 2001; Chien et al., 1998), debido a que promueve el incremento transitorio de la concentración de giberelinas y citoquininas en las semillas (Solís, 2006). La escarificación que incluye cualquier proceso que rompa, raye o ablande la testa o cubierta seminal para hacerlas permeables al agua o a los gases: puede ser de tipo mecánico, donde las semillas son lijadas, cortadas o punzadas, también puede ser con agua a temperaturas entre los 70 y 100°C, o de tipo químico que incluye el uso de ácidos altamente concentrados, este tratamiento se emplea para semillas con latencia de cubierta (Fang et al., 2006).
Otros tratamientos comúnmente empleados son: la lixiviación, que permite eliminar inhibidores; la combinación de varios tratamientos para semillas que presentan más de un tipo de latencia, y el uso de hormonas y otros estimulantes químicos como el nitrato de potasio (KNO3), el etileno, las citoquininas y el ácido giberélico que en algunos casos puede reemplazar la estratificación (Finch-Savage y Leubner-Metzger, 2006).
Las citoquininas son importantes en todas las etapas del desarrollo vegetal, desde la división celular hasta la elongación de las células, por lo cual se encuentran en mayor concentración en los meristemos de embriones y frutos inmaduros, en donde normalmente se encuentra en concentraciones inferiores a la mayoría de fitohormonas y el efecto fisiológico que genera depende de la especie (Smith y Atkins, 2002).
Durante el desarrollo temprano de las semillas, las citoquininas se acumulan principalmente en el endospermo (Mok y Mok, 2001), y se ha propuesto que desde allí se moviliza la concentración necesaria para promover la división celular en el embrión (Fischer-Iglesias y Neuhaus, 2001). Ensayos conducidos en Arabidopsis, muestran que el incremento de la concentración de citoquininas puede actuar de forma antagonista en la síntesis de ácido abscísico (ABA) y por tanto revertir el efecto inhibitorio en la germinación de las semillas (Jeon et al., 2010). En los granos de sorgo su contenido es alto en el embrión y bajo en el endospermo, aunque durante la imbibición esta relación cambia, hasta que se produce la protrusión de la radícula en donde las citoquininas alcanzan la más alta concentración, asociada con la acumulación de a-amylasa (Dewar et al., 1998). Este incremento revierte casi completamente el efecto inhibitorio del ABA en la síntesis de a-amilasa y el crecimiento del coleóptilo en la semilla, por lo que el efecto de esta hormona puede ser considerado antagonista-permisivo: antagonista sobre el ABA y permisivo con la acción del GA3 (gibberellic acid) (Khan, 1968). Por lo que participa activamente en la regulación de la división celular y la elongación de la raíz. Posteriormente la fitohormona se redistribuye dentro del embrión a las regiones donde dirige el crecimiento de la raíz (Kucera et al., 2005).
La germinación de las semillas de A. squamosa se presenta en dos etapas consecutivas: la ruptura de la testa y la posterior ruptura del endospermo (Martínez, 2012), y este proceso tarda entre 1 y 3 meses, las semillas presentan un embrión pequeño e inmaduro, que necesita tiempo para su desarrollo después de la dispersión (Setten y Koek-Norman, 1992; Hayat, 1963). Respecto a la latencia, en la familia Annonaceae existen indicios de latencia morfofisiológica (Baskin y Baskin, 2001), y específicamente en A. squamosa reportaron latencia morfológica varios autores, citados por Baskin y Baskin (2001).
En Brasil se han realizado estudios con el fin de establecer qué métodos pregerminativos son útiles para potenciar la germinación de anón. Ferreira et al. (2002) reportaron que la aplicación de giberelinas en una concentración de 250 mg L-1, permitió porcentajes de germinación del 77%; un año después, Stenzel et al. (2003) alcanzaron porcentajes de germinación en A. squamosa del 75% mediante escarificación con lija de las semillas en el extremo basal seguido por la aplicación de giberelinas en concentraciones de 50 mg L-1.
Estudios realizados en otras annonáceas como chirimoya y guanábana, indican que se puede superar el periodo de latencia con la aplicación simultánea de estratificación caliente en un periodo mayor a 90 d y giberelinas (Lobo et al., 2007). Pinto (1976) alcanzó mayores porcentajes en la germinación de semillas de guanábana con aplicación de 300 mg L-1 de ácido giberélico. Hernández (1993) logró que la germinación de chirimoya se incrementara a través de la imbibición con GA3, 100 mg L-1 mientras Da Silva et al. (2007) describieron un efecto promotor del GA sobre la germinación de semillas de Annona crassiflora.
Dado que el principal método de propagación del anón es por vía sexual y que actualmente existe poca información sobre tratamientos pregerminativos que mejoren este proceso a través del rompimiento de latencia; en esta investigación se evaluó qué efecto causa la aplicación de diferentes concentraciones de citoquininas sobre la germinación de semillas de A. squamosa, y qué concentraciones resultan más adecuadas.
MATERIALES Y MÉTODOS
La investigación se realizó en el Laboratorio de Fisiología de Cultivos de la Facultad de Agronomía de la Universidad Nacional de Colombia, Bogotá; empleando semillas de anón (Annona squamosa L.), obtenidas de frutos cosechados de las accesiones C2AS224, C2AS225 y C2AS226 (C: Cundinamarca; 2: código de municipio; AS: especie Annona squamosa L.; 224: número de consecutivo) que forman parte de las accesiones colectadas para el desarrollo del proyecto del Banco Colombiano de Germoplasma de Anón, en el municipio de Apulo (Cundinamarca).
Frutos maduros y blandos al tacto fueron seleccionados y lavados con agua a temperatura ambiente para remover hongos, tierra o cualquier residuo presente en su superficie; se separó el pericarpio del mesocarpio y se retiró manualmente la semilla de la pulpa y el arilo; posteriormente, las semillas fueron lavadas y secadas en toallas de papel absorbente durante 3 d a temperatura ambiente (media: 18,7°C; máxima: 22,9°C; mínima: 17,3°C).
Como sustrato se usó turba rubia (Klassmann®) que fue desinfectada con Benomyl 50® (1 g L-1) y Vitavax® 300 (2 g L-1), con el fin de evitar la presencia de hongos o bacterias. Las semillas también fueron desinfectadas con inmersión en hipoclorito al 1% durante 9 minutos, lavado con agua destilada y etanol al 96%, y finalmente una limpieza con agua destilada para retirar el etanol que pudiera quedar en la semilla.
Para evaluar el efecto de las citoquininas sobre la germinación, se configuraron los tratamientos en un diseño completamente aleatorio con cinco repeticiones de 25 semillas, que fueron imbibidas durante 48 h en cuatro concentraciones de zeatina (Z0164-Zeatin, Sigma-Aldrich®, St. Louis, MO) (0,25 mg L-1; 0,5 mg L-1; 1 mg L-1 y 4 mg L-1).
Los tratamientos se ubicaron en un fitotrón Conviron CMP3244 (Winnipeg, Canadá) a 35°C y se realizaron observaciones cada 5 d durante 30 d, registrando como semillas germinadas aquellas con protrusión de la radícula.
Posteriormente, mediante la metodología de tinción con Tetrazolio (ISTA, 1996), se determinó la viabilidad de las semillas. Esta evaluación se realizó mediante el corte longitudinal ventral de las semillas, y sumersión en Tetrazolio al 1% durante un periodo mayor a 24 h en completa oscuridad a 32°C y 60% de humedad relativa.
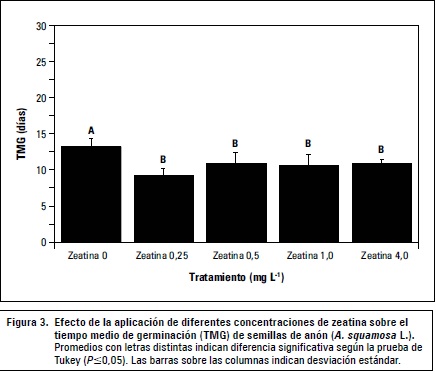
Luego de las evaluaciones se calculó el porcentaje de germinación (PG), la velocidad media de germinación (VMG), el tiempo medio de germinación (TMG) y la frecuencia de germinación (tabla 1).
Se realizó un Anova y una prueba de comparación de medias múltiples de Tukey, con un 95% de confianza. Para el procesamiento y análisis de los datos se usaron los paquetes estadísticos Statistica v.10 y Origin Pro 8.5.1 SR2 (OriginLab Corporation).
RESULTADOS
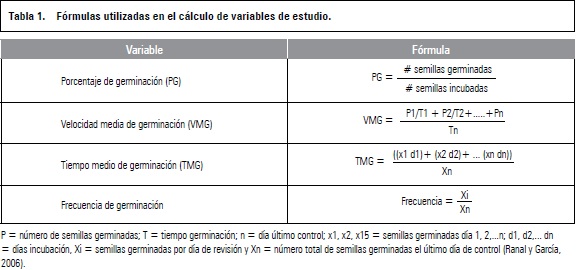
La aplicación de zeatina tuvo un efecto significativo sobre las variables PG, VMG y TMG (P≤0,05). El PG se incrementó de 24% en el testigo a 69,6% con el tratamiento zeatina 1,0 mg L-1. La prueba de Tukey no mostró diferencias significativas entre los PG de las semillas sometidas a los diferentes tratamientos aplicados, aunque sí fueron diferentes comparados con el testigo (figura 1).
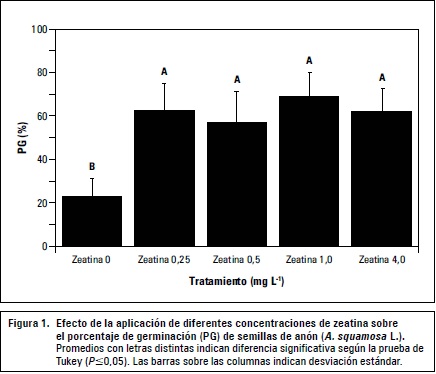
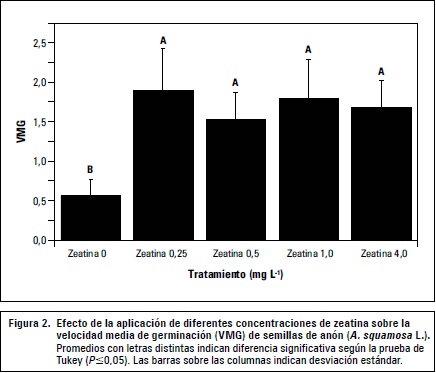
La VMG se comportó similar al PG, las semillas germinaron más rápidamente con la aplicación de zeatina 0,25 mg L-1 con un VMG de 1,91 semillas germinadas/día, mientras que sin la aplicación de esta citoquinina la velocidad fue de 0,56 semillas germinadas/día (figura 2). El TMG también se redujo en respuesta a la aplicación de 0,25 mg L-1 de zeatina, las semillas del tratamiento testigo tardaron en promedio 13 d en germinar mientras que el tratamiento mencionado redujo el tiempo a 9 d (figura 3). En ambos casos la prueba de Tukey indicó que existían diferencias entre los tratamientos y el testigo pero no entre los tratamientos (figuras 2 y 3).
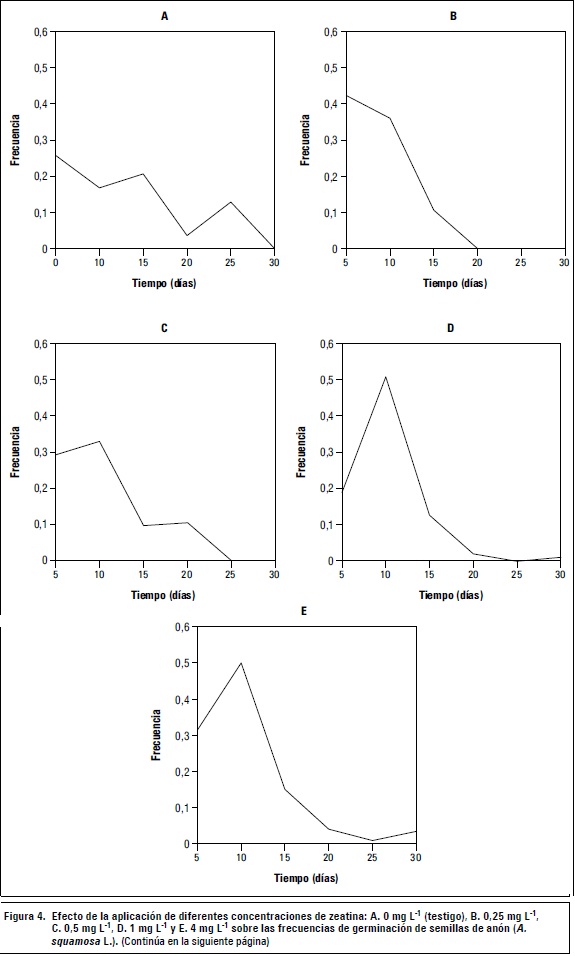
La aplicación de cualquier concentración de zeatina redujo la frecuencia de germinación de las semillas, que germinaron en su mayoría antes de los 20 d, a diferencia del control, que germinó hasta los 30 d (figura 4). La viabilidad presentada por las semillas de este ensayo estuvo entre 80-88% y no varía con la aplicación de los tratamientos.
DISCUSIÓN
Previamente se reportó que el anón presentaba latencia morfológica (Baskin y Baskin, 2001); pero resultados obtenidos por Martínez (2012) demostraron cómo el tejido endospermático y la testa restringen el crecimiento de un embrión poco desarrollado y con bajo potencial de crecimiento. Así mismo, la respuesta positiva obtenida sobre la germinación, mediante tratamientos de estratificación fría y caliente en A. squamosa (Moreno, 2011), parecen indicar que las semillas presentan latencia morfofisiológica compleja no profunda.
Para que ocurra la germinación, debe debilitarse el endospermo con el objeto de reducir las restricciones mecánicas al crecimiento radicular y para liberar carbohidratos que proporcionaran la energía necesaria para el desarrollo del embrión (Martínez, 2012). En anón este debilitamiento puede estar relacionado con la acción de enzimas hidrolíticas como la endo-b-mannanasa y la b-1,3-glucanasa, que debilitan el endospermo mediante la digestión de las membranas celulares, facilitando la protrusión radicular (Leubner-Metzger y Meins, 1999; Bewley, 1997).
La síntesis de estas enzimas se ve inhibida por la acción del ABA, que retarda tanto su acumulación como la consecuente degradación del endospermo. Por esto la aplicación de una giberelina como el GA3 que revierte parcialmente la acción del ABA (Chrispeels y Varner, 1967), permite la germinación de las semillas de anón y de otras anonáceas (Pinto, 1976; Hernández, 1993; Ferreira et al., 2002; Stenzel et al., 2003; Da Silva et al., 2007; Lobo et al., 2007).
Por otro lado, previamente se reportó el papel antagónico de las citoquininas en la síntesis de ABA, y frente al efecto inhibitorio del ABA en la síntesis de diversas enzimas como la a-amilase (Khan, 1968), lo que puede ocurrir de forma similar en el proceso de síntesis de b-mannanasa y la b-1,3-glucanasa en la semilla, que también resultan inhibidas por la acción del ácido abscísico.
La aplicación exógena de zeatina en las semillas de anón, permitió que se superara el efecto inhibitorio del ácido abscísico, confirmando que esta fitohormona puede ser usada como tratamiento pregerminativo en esta especie; en el ensayo, las diferentes concentraciones de zeatina empleadas superaron en todas las variables analizadas al control: el PG se incrementa a 69,6%, la velocidad media alcanza 1,91, y el tiempo medio se reduce a 9 días; aunque no se presentaron diferencias entre los tratamientos (figura 1).
Finalmente, se concluye que pueden obtenerse mejores porcentajes de germinación, mayores velocidades y menores tiempos de germinación tanto con la aplicación de zeatina en una concentración de 0,25 mg L-1 como de 1 mg L-1.
AGRADECIMIENTOS
Este proyecto se realizó gracias al apoyo financiero de la Dirección de Investigación (DIB) de la Universidad Nacional de Colombia, Bogotá y al programa Material de Siembra y Mejoramiento Genético del Anón (Annona squamosa L.) del proyecto Establecimiento del Banco Colombiano de Germoplasma Colombiano de Anón (Annona squamosa L.), financiado con recursos del Ministerio de Agricultura y Desarrollo Rural.
REFERENCIAS BIBLIOGRÁFICAS
Baskin, C.C. y J.M. Baskin. 2004. A classification system for seed dormancy. Seed Sci. Res. 14, 1-16. [ Links ]
Baskin, C.C. y J.M. Baskin. 2001. Seeds. Ecology, biogeography, and evolution of dormancy and germination. Academic Press, San Diego, CA. [ Links ]
Bewley, J.D. y Black, M. 1994. Seeds: Physiology of development and germination. Plenum Press, New York, NY. [ Links ]
Bewley J.D. 1997. Seed germination and dormancy. Plant Cell 9, 1055-1066. [ Links ]
Campbell, C. y R. Phillips. 1994. The sugar apple. Horticultural Sciences Department, Florida, Cooperative Extension Service, Institute of Food and Agricultural Sciences, University of Florida. Gainesville, FL. [ Links ]
Chien, C., L. Kuo-Huang y T.P. Lin. 1998. Changes in ultrastructure and abscisic acid level, and response to applied gibberellins in Taxus mairei seeds treated with warm and cold stratification. Ann. Bot. 81, 41-47. [ Links ]
Chrispeels, M.J. y J.E. Varner. 1967. Hormonal control of enzyme synthesis: On the mode of action of gibberellic acid and abscisin in aleurone layer of barley. Plant Physiol. 42, 1008-1016. [ Links ]
Da Silva, E.A.A., D.L.B. de Melo, A.C. Davide, N. de Bode, G.B. Abreu, J.M.R. Faria y H.W.M. Hilhorst. 2007. Germination ecophysiology of Annona crassiflora seeds. Ann. Bot. 99, 823-830. [ Links ]
Dewar, J., J.R.N. Taylor y P. Berjak. 1998. Changes in selected plant growth regulators during germination in sorghum. Seed Sci. Res. 8, 1-8. [ Links ]
Fang, S., Y. Wang, Z. Wei y Z. Zhu. 2006. Methods to break seed dormancy in Ciclocarya paliurus (Batal) Iljinskaja. Sci. Hortic. 110(3), 305-309. [ Links ]
Ferreira, G., P.R. Erig y E. Moro. 2002. Uso de ácido giberélico em sementes de fruta-do-conde (Annona squamosa L.) visando à produção de mudas em diferentes embalagens Rev. Bras. Frutic. 24(1), 178-182. [ Links ]
Finch-Savage, W.E. y G. Leubner-Metzger. 2006. Seed dormancy and the control of germination. New Phytologist 171, 501-523. [ Links ]
Fischer-Iglesias, C. y G. Neuhaus. 2001. Zygotic embryogenesis - Hormonal control of embryo development. pp. 223-247. En: Bhojwani, S.S. y W.Y. Soh (eds.). Current trends in the embryology of angiosperms. Kluwer Academic Publ., Dordrecht, The Netherlands. [ Links ]
Geilfus, F. 1994. El árbol al servicio del agricultor. Manual de Agroforestería para el desarrollo rural. Vol. 2. Guía de especies. Turrialba, Costa Rica. [ Links ]
George, A. y R. Nissen. 1987. Propagation of Annona species: A review. Sci. Hortic. 33, 75-85. [ Links ]
Guerrero, E. 2012. Anón (Annona squamosa L.). pp. 915- 927. En: Fischer, G. (ed.). Manual para el cultivo de frutales en el trópico. Produmedios, Bogotá [ Links ].
Guerrero. E. y G. Fischer. 2007. Manejo integrado en el cultivo de anón (Annona squamosa L.). Rev. Colomb. Cienc. Hortic. 2(1), 154-169. [ Links ]
Hayat, M.A. 1963. Morphology of seed germination and seedling in Annona squamosa. Bot. Gaz. 124(5) (Sep.), 360-362. [ Links ]
Hernández, L.V. 1993. La reproducción sexual y reproducción vegetativa de las Annonaceas. Universidad Veracruzana, Xalapa, México. [ Links ]
Hoyos, J. 1989. Frutales en Venezuela. Sociedad de Ciencias Naturales La Salle. Monografía 36, Caracas. pp. 35-48. [ Links ]
ISTA. 1996. International rules for seed testing, 1996. International Seed Testing Association. Seed Sci. Technol. 24 (Supplement). Zurich, Suiza. [ Links ]
Jeon, J., N.Y. Kim, S. Kim, N.Y. Kang, O. Novák, S.J. Ku, C. Cho, D.J. Lee, E.J. Lee, M. Strnad y J. Kim. 2010. A subset of cytokinin two-component signaling system plays a role in cold temperature stress response in Arabidopsis. J. Biol. Chem. 285(30), 233-283. [ Links ]
Khan, A.A. 1968. Inhibition of gibberellic acid-induced germination by abscisic acid and reversal by cytokinins. Plant Physiol. 43, 1463-1465. [ Links ]
Kucera, B., M.C. Cohn y G. Leubner-Metzger. 2005. Plant hormone interactions during seed dormancy release and germination. Seed Sci. Res. 15, 281-307. [ Links ]
Leubner-Metzger, G. y F. Meins. 1999. Functions and regulation of plant-1.3-glucanases (PR-2). pp. 49-76. En: Datta, S.K. y S. Muthukrishnan (eds.) Pathogenesis-related proteins in plants. CRC Press, Boca Raton, FL. [ Links ]
Lobo, M. Delgado, O. Cartagena, J.R. Fernández y E. Medina, 2007. Categorización de la germinación y la latencia en semillas de chirimoya (Annona cherimola L.) y guanábana (Annona muricata L.), como apoyo a programas de conservación de germoplasma. Agron. Colomb. 25(2), 231-244. [ Links ]
Lotero, B. 1976. Géneros de la flora de Colombia. III. Trabajo de grado. Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá [ Links ].
Martínez, F. 2012. Caracterización morfoanatómica de semillas de anón (Annona squamosa L.) y evaluación de algunos parámetros fisiológicos del proceso de germinación y latencia. Tesis de maestria. Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá [ Links ].
Mok, D.W.S. y M.C. Mok. 2001. Cytokinin metabolism and action. Ann. Rev. Plant Physiol. Plant Mol. Biol. 52, 89-118. [ Links ]
Moreno B., N. 2011. Efecto de algunos tratamientos pregerminativos en la germinación de semillas de anón (Annona squamosa L.) (Annonaceae). Trabajo de grado. Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá [ Links ].
Morton, J. 1987. Sugar apple. pp 69-72. En: Fruits of warm climates. Julia F. Morton, Miami, FL. [ Links ]
Murillo J. y D. Restrepo. 2000. Las anonáceas de la región de Araracuara. Serie Estudios en la Amazonía Colombiana XX. Soporte Editorial, Bogotá [ Links ].
Navarro, J. 2001. Guía de las frutas cultivadas. Identificación y cultivo. Ediciones Mundi-Prensa, Madrid. [ Links ]
Ojeda M. 2005. Consideraciones sobre anonáceas. II Curso de Actualización de Conocimientos en Fruticultura. Posgrado de Horticultura, Universidad Centroccidental Lisandro Alvarado (UCLA), Lara, Venezuela. [ Links ]
Pinto, A.C. 1976. Influência do hormônio sobre o poder germinativo de sementes de graviola. pp. 415-420. En: Anais Congreso Brasileiro de Fruticultura, Rio de Janeiro, Brasil. [ Links ]
Ranal, M.A. y D. Garcia de Santana, 2006. How and why to measure the germination process? Rev. Brasil. Bot. 29(1), 1-11. [ Links ]
Sánchez, D. 1987. Revisión de las partir de otra manera de la sección Chasmantha del género Guatteria (Annonaceae). Tesis de maestría en Botánica Sistemática, Universidad Nacional de Colombia, Bogotá [ Links ].
Sanjinés, A., B. Øllgaard y H. Balslev. 2006. Frutos comestibles. Botánica económica de los Andes Centrales. Universidad Mayor de San Andrés, La Paz. pp. 329-346. [ Links ]
Setten, K. y J. Koek-Noorman. 1992. Fruits and seeds of Annonaceae. Morphology and its significance for classification and identification. Bibliotheca Botanica 142, 1-101. [ Links ]
Smith P.M y C.A. 2002. Atkins purine biosynthesis, big in cell division, even bigger in nitrogen assimilation. Plant Physiol. 128, 793-802. [ Links ]
Solís Fuentes, A.A. 2006. Algunos factores que influyen sobre la germinación de semillas de borraja (Borago officinalis L.). Universidad de Concepción, Chillán, Chile. [ Links ]
Stenzel, N.M.C., I.M. Murata y C.S.V.J. Neves. 2003. Superação da dormência em sementes de atemóia e fruta-do-conde. Rev. Bras. Frutic. 25(2), 305-308. [ Links ]













