Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Ciencias Hortícolas
versión impresa ISSN 2011-2173
rev.colomb.cienc.hortic. vol.7 no.2 Bogotá jul./dic. 2013
1 Facultad de Ingeniería Agronómica, Universidad de Ciencias Aplicadas y Ambientales (UDCA), Bogotá (Colombia).
2 Autor para correspondencia. mcano@udca.edu.co
Fecha de recepción: 06-09-2013. Aprobado para publicación: 31-10-2013
RESUMEN
La fresa es un cultivo de alto valor económico, nutricional y medicinal. Sin embargo, es altamente susceptible al ataque de patógenos, por lo cual, uno de los principales retos en el desarrollo del cultivo e incluso en la poscosecha de la fruta, es el manejo de las enfermedades que en su gran mayoría, son de carácter fungoso; seguidas por algunos problemas bacterianos, de nematodos y muy pocos ocasionados por virus. El manejo de estas patologías está fundamentado en el uso de un amplio arsenal de productos para la protección de cultivos comúnmente llamados pesticidas, los cuales generan alto riesgo para la salud humana y ambiental, además de afectar la inocuidad de la fruta e incrementar los costos de producción. En este sentido, surge la necesidad de buscar alternativas para el manejo integrado de enfermedades. Una de las estrategias más estudiadas en los últimos años ha sido el uso de antagonistas microbianos con el fin de regular las poblaciones de fitopatógenos en los cultivos. El amplio espectro de estos microorganismos contra diferentes blancos patológicos; la posibilidad de incluirlos antes y durante el establecimiento del cultivo e incluso en la poscosecha; y la multifuncionalidad que presentan no solo como agentes de control biológico, sino como promotores del crecimiento vegetal y biofertilizantes, hacen que la inclusión de esta estrategia biológica en el manejo integrado de enfermedades sea atrayente para los productores, los cuales deben adaptarse a las exigencias de los consumidores que cada día demandan más productos limpios e inocuos.
Palabras clave adicionales: regulación biológica de patógenos, resistencia sistémica inducida, agentes de control biológico, antagonistas.
ABSTRACT
The strawberry is a crop of high economic, nutritional and medicinal value. However, it is highly susceptible to attack by pathogens; thus, one of the principal challenges in the development of crops and post-harvest fruits is the management of diseases, mostly fungi followed by bacterial problems, nematodes, and some viruses. The management of these disorders is based on the use of a broad array of products for crop protection that are commonly called pesticides, which generate high risks to humans and environmental health, affect the safety of the fruits and increase production costs. In this sense, there is a need to find alternatives for integrated disease management. One of the most-studied strategies in recent years has been the use of microbial antagonists with the aim of regulating plant pathogen populations in crops. The broad range of organisms used against various pathological targets, the possibility of including them before and during crop establishment and even during post-harvest, and their multi-functionality as not only biological control agents but also as promoters of plant growth and bio-fertilizers make the inclusion of this biological strategy in integrated disease management attractive to producers who must adapt to the demands of consumers for cleaner and safer products that increase every day.
Additional key words: biological control of pathogens, induced systemic resistance, biological control agents, antagonists.
INTRODUCCIÓN
Las fresas (Fragaria spp.) se cultivan en diferentes zonas del mundo, tropicales, subtropicales e incluso en áreas templadas. Además de su interés comercial, este cultivo es de gran importancia social debido a la alta demanda de trabajadores requeridos para su producción y procesamiento en campo, en poscosecha y en la industria (Pedraza et al., 2007). En la actualidad, la fresa debido a su alto contenido de flavonoides, antocianinas y compuestos fenólicos, además del contenido nutricional y el aporte de algunas vitaminas como la A y C (Cao et al., 2011), puede ser considerada como un producto nutracéutico, ampliando las posibilidades comerciales que existen para este tipo de productos, que cada día aumentan en los mercados internacionales.
De la producción mundial de frutas finas "Berries o frutos rojo", la fresa supera en la actualidad el 62% de la producción de este grupo (fresa, frambuesa, mora y arándano), en un área cultivada de 254.027 ha que representan una producción aproximada de 5 millones de toneladas. Estados Unidos se encuentra como principal productor con 1´312.960 t año-1, seguido por Turquía con 302.416 t año-1 y España con 262.730 t año-1, según estadísticas de la FAO (2011).
Colombia, hasta el año 2011 contaba con un área de cultivo de 1.130 ha, con una producción de 45.000 t año-1 y un rendimiento aproximado de 39.718 kg ha-1, con una distribución de cultivos principalmente en las departamentos de Cundinamarca (63,4%), Antioquia (23,8%), Norte de Santander (7%), Cauca (3,6%), Boyacá (1,6%) y otros (0,6%), según el anuario estadístico de frutas y hortalizas 2007-2011 (Agronet, 2013).
Por otra parte, este cultivo es altamente demandante de productos como insecticidas, fungicidas y plaguicidas para lograr una aceptable producción de fruta. Requiere grandes cantidades de recursos renovables y no renovables tales como: la cobertura del suelo que consiste en cubrir las eras, surcos o camas, con algún material plástico que impida que la fruta tenga contacto directo con el suelo, impidiendo así daños patológicos y a su vez evitando el crecimiento de arvenses. De igual forma, requiere una cantidad considerable de agua para el establecimiento de las plantaciones y depende de aplicaciones frecuentes de fertilizantes de síntesis química, para aumentar su productividad (Pritts, 2002).
Uno de los principales retos en el desarrollo del cultivo comercial de fresa, e incluso en la poscosecha de la fruta, es el manejo de las enfermedades que en su gran mayoría son de carácter fungoso; seguido por algunos problemas bacterianos, de nematodos y muy pocos ocasionados por virus. La fresa es una especie altamente susceptible a patógenos, algunos edáficos como los oomycetes Phytophthora cactorum, que ocasionan la enfermedad de la pudrición de la corona (Martínez et al., 2010), Phythophthora fragariae var fragariae, que causa la podredumbre roja y Pythium sp. Asimismo hongos como Rhizoctonia sp., Fusarium sp. y Verticillium sp. (Vestberg et al., 2004). Otros patógenos aéreos que ocasionan enfermedades como la antracnosis, causada por varias especies del género Colletotrichum entre los cuales se incluyen C. acutatum J.H. Simmonds, C. fragariae Brooks, y C. gloeosporioides (Penz.) Penz. y Sacc. (Freeman y Katan, 1997; Legard et al., 2005; Turechek et al., 2006; Chalfoun et al., 2011), el moho gris conocido también como Botrytis, cuyo agente causal es el hongo Botrytis cinerea Pers. (Chaves y Wang, 2004; Zhang et al., 2007), viruela o peca de la hoja causada por Mycosphaerella fragariae, oidium ocasinada por Sphaeroteca macularis f.sp. fragariae (Podosphaera aphanis) (De Cal et al., 2008) y Alternaria spp. Diversas enfermedades fungosas como la podredumbre blanda causada por Rhizopus stolonifer y la podredumbre negra ocasionada por hongos tales como: Mucor spp., Aspergillus niger y Pythium spp., y otros patógenos como: Penicillium digitatum y Rhizoctonia solani, son también comunes en poscosecha (Farrera et al., 2007; Guédez et al., 2009; Chalfoun et al., 2011).
Estas enfermedades revisten gran importancia en el cultivo debido a que pueden afectar todos los tejidos vegetales, como: raíces, estolones, coronas, tallos, hojas, flores y frutos (Freeman y Katan, 1997), dando como resultado grandes pérdidas de la fruta, afectando la calidad, la cantidad y la rentabilidad (Brimner y Boland, 2003).
El moho gris causado por B. cinerea es una de las enfermedades más destructivas durante el desarrollo del cultivo y en la postcosecha (Zhang et al., 2007), ocasionando graves pérdidas económicas estimadas alrededor del 30% del total de la producción y entre un 40% a 50% en condiciones de alta humedad. Incluso en poscosecha este patógeno es aún más agresivo, afectando al 95% de los frutos 48 h después de cosechados (Matamoros, 1986; citado por Chaves y Wang, 2004). Así mismo, las pérdidas debidas a la antracnosis pueden superar el 50% cuando las condiciones son favorables para el desarrollo del patógeno (Turechek et al., 2006) (temperatura >18°C y humedad relativa (HR) >80%), condiciones normales en fresa de altura en la Sabana de Bogotá.
Durante muchos años se han utilizado fungicidas sintéticos para controlar a estos patógenos, pero se ha demostrado que estos microorganismos se hacen resistentes a dichos productos, además de representar un riesgo potencial para el ambiente y la salud humana (Pritts, 2002; Pedraza et al., 2007; Guédez et al., 2009; Ge et al., 2010; Pedraza et al., 2010; Peres et al., 2010; Tortora et al., 2011a y b).
Por tanto, el propósito de esta revisión es realizar un análisis del uso de antagonistas solos o en mezclas en el cultivo de fresa; los productos de estos (enzimas y metabolitos secundarios); sus diversos mecanismos y modos de acción, entre los cuales se incluye: la competencia por espacio y nutrientes, el parasitismo y micoparasitismo, la antibiosis, la producción de sideróforos y la estimulación del sistema de defensa de las plantas.
REGULACIÓN BIOLÓGICA DE PATÓGENOS EN EL CULTIVO DE FRESA
Durante los últimos 20 años, varios agentes de control biológico (BCA, por sus siglas en inglés), también conocidos como biocontroladores o biorreguladores, han sido ampliamente investigados en diferentes cultivos, con el fin de realizar una regulación biológica de diversos patógenos. Estos BCA, han sido estudiados, propagados, registrados y formulados para ser utilizados como una de las principales alternativas al manejo convencional de las enfermedades en los cultivos, amparado en el uso muchas veces indiscriminado de plaguicidas sintéticos.
Lo más interesante de la estrategia de regulación biológica de patógenos, mediante la utilización de BCA, tiene que ver con los variados mecanismos de acción de estos microorganismos para la regulación, los cuales incluyen la competencia por nutrientes y espacio, el parasitismo y micoparasitismo, la producción de antibióticos, enzimas líticas, sideróforos y otros metabolitos secundarios de interés, y la estimulación del sistema de defensas en la planta huésped, entre otros (Brimner y Boland, 2003; Spadaro y Gullino, 2004; Hernández-Lauzardo et al., 2007).
La inclusión de esta estrategia en el manejo de enfermedades en el cultivo de fresa se condensa detalladamente en la tabla 1, haciendo referencia al patógeno objeto de la regulación, a la condición donde se realiza el estudio en campo abierto, invernadero o laboratorio, al antagonista utilizado, al efecto de supresión de patógenos y al benéfico proporcionado por los BCA a las plantas y las referencias.
HONGOS MICORRÍCICO ARBUSCULARES (AMF) EN LA NUTRICIÓN Y MANEJO DE FITOPATÓGENOS EN EL CULTIVO DE FRESA
La simbiosis micorrícica ejerce un efecto importante en las interacciones de las plantas con patógenos e insectos. En general, los AMF (por sus siglas en inglés) conducen a una reducción en el daño causado por patógenos del suelo, compitiendo por espacio y nutrientes (Pozo y Azcón-Aguilar, 2007). Los efectos en patógenos foliares y plagas, dependerá de la forma de vida de estos organismos y de la inducción de resistencia por parte de los AMF en las plantas. Es así como plantas inoculadas con AMF, toleran mejor patógenos necrotróficos e insectos masticadores (Whipps, 2004; Pozo y Azcón-Aguilar, 2007).
Matsubara et al. (2004) encontraron que plantas de fresa inoculadas con AMF fueron más tolerantes al marchitamiento producido por Fusarium sp., comparado con plantas sin tratar. A partir de los cambios metabólicos observados en las plantas inoculadas con AMF, en cuanto al aumento del contenido de aminoácidos totales, Matsubara et al. (2009) sugieren que es necesario seguir trabajando para determinar si alguno de los cambios en los aminoácidos de las plantas micorrizadas tienen una relación directa con la supresión de los síntomas de la enfermedad.
Experimentos in vitro mostraron que después de 48 h de inocular el patógeno P. fragariae en las raíces de plantas de fresa colonizados por Glomus etunicatum y G. monosporum, la esporulación de P. fragariae se redujo en 67% y 64%, respectivamente, comparado con las plantas control. Después de 72 h, la esporulación del patógeno se redujo 83% y 89% respectivamente. Con estos resultados, Norman y Hooker (2000), sugieren que el mecanismo de acción de los AMF es el cambio en la producción de exudados radicales por parte de la planta, lo cual afecta directamente la esporulación de los patógenos. De hecho, Finlay (2004), menciona que los exudados de los AMF modifican la composición de rizósfera y esto modula las interacciones con otros organismos presentes en esta zona. De igual forma, Murphy et al. (2000) inocularon microplantas de fresa silvestre (Fragaria vesca) en la fase de adaptación en invernadero con los inoculantes comerciales Endorize IV, VAMINOC y la especie Glomus mosseae, a la vez utilizaron un sustrato enriquecido Supresor®, de turba comercial modificado con restos de mariscos que contenían quitina en su composición, encontrando que: hubo un efecto aditivo en la estimulación de la longitud de raíces y porcentajes de colonización radicular, cuando las plantas se trataron con VAMINOC, la especie G. mosseae y el sustrato enriquecido, pero no con las plantas inoculadas con Endorize IV y el sustrato. También se presentó un efecto aditivo cuando se inocularon las plantas con VAMINOC y el sustrato enriquecido Supresor® en cuanto a la resistencia de las plantas a la enfermedad de la pudrición de la corona (P. cactorum).
Borowicz (2010) analizó la respuesta de tres genotipos de fresa (Fragaria virginiana Duch.) inoculados con especies nativas de AMF sometidos a estrés de tipo biótico, daños ocasionados a nivel estructural de las raíces por la inoculación artificial de herbívoros y estrés abiótico sometiendo las plantas a déficit hídrico, notando que las plantas inoculadas con AMF responden muy bien al daño causado por los herbívoros y se recuperan más fácilmente al estrés hídrico inducido, que las plantas no micorrizadas. En cuanto a la actividad hídrica en las plantas inoculadas con AMF, Hernández-Sebastià et al. (1999), en plantas micropropagada fresa (Fragaria x ananassa Duch. cv. Kent) inoculadas con Glomus intraradices Schenck y Smith, demostraron que los contenidos relativos de agua y la turgencia de las células eran mayores en las raíces de las plantas inoculadas comparado con las no inoculadas.
Por otra parte, los beneficios en la nutrición vegetal y en la estimulación del crecimiento y absorción de agua en platas micorrizadas, se encuentran ampliamente documentados (Cano y Hoyos, 2011), y estos beneficios repercuten directamente en la sanidad de los cultivos y la calidad de los productos. En este sentido, Alarcón et al. (2000), encontraron una mejor absorción de fósforo y nitrógeno en plantas in vitro de fresa (Fragaria x ananassa Duch. cv. Fern) inoculadas con tres especies de AMF del género Glomus sp., notando un efecto directo en la estimulación del crecimiento puesto que las plantas inoculadas produjeron más estolones que las no inoculadas, resultados importantes en la adaptación y propagación de la fresa.
No obstante se debe tener presente que existe cierto tipo de especificidad entre las especies de AMF y las plantas de fresa, observando que no todas las especies de AMF, aportan beneficios en el crecimiento, nutrición y absorción de agua. De hecho la respuesta de las plantas a la inoculación y co-inoculación con diversas especies de micorrizas es variada. En este sentido, Taylor y Harrier (2001), comprobaron la diversidad de efectos, en cuanto a la estimulación del crecimiento, desarrollo y estado nutricional de plantas micropropagadas de fresa (Fragaria × ananassa cv. Elvira) en respuesta a la inoculación con nueve especies de AMF Glomus clarum, G. etunicatum, G. intraradices, Gigaspora rosea, G. gigantea, G. margarita, Scutellospora calospora, S. heterogama y S. pérsica. Notando que: todas las especies de Scutellospora y G. rosea afectaron negativamente el crecimiento de las plantas, contrario a lo que ocurrió con las especies G. intraradices y G. margarita las cuales estimularon el crecimiento de las plantas. En general, las concentraciones de Mn y Mg fueron significativamente más altas en las plantas colonizadas con todos los aislamientos de las micorrizas empleadas. Comprobando de esta manera las múltiples respuestas de las plantas y la especificidad de las especies de AMF en el cultivo de fresa.
BACTERIAS Y RIZOBACTERIAS PROMOTORAS DEL CRECIMIENTO VEGETAL (PGPB-PGPR) COMO BCA DE ENFERMEDADES EN EL CULTIVO DE FRESA
Las interacciones entre el sistema de raíces de las plantas y las rizobacterias tienen un profundo efecto en la sanidad, el rendimiento de los cultivos y en la composición de la microbiota del suelo. Las bacterias de la zona de raíces son capaces de generar una amplia gama de metabolitos secundarios (enzimas, hormonas, sideróforos y antibióticos, entre otros) que pueden tener una influencia positiva sobre el establecimiento, crecimiento y desarrollo vegetal; mejorar la disponibilidad de minerales y nutrientes (especialmente la solubilización de fosfatos); mejorar la capacidad de fijación de nitrógeno, disminuir la susceptibilidad de las plantas a factores abióticos como las heladas y mejorar la sanidad vegetal mediante la regulación biológica de fitopatógenos e inducción de resistencia sistémica en las plantas (Sturz y Nowak, 2000; Sturz y Christie, 2003; Hernández-Rodríguez et al., 2006).
Algunos trabajos en la supresión de patógenos tratados con PGPB se presentan en la tabla 2, haciendo referencia al patógeno objeto de la regulación, a la condición donde se realiza el estudio, al antagonista utilizado y al efecto benéfico proporcionado en las plantas.
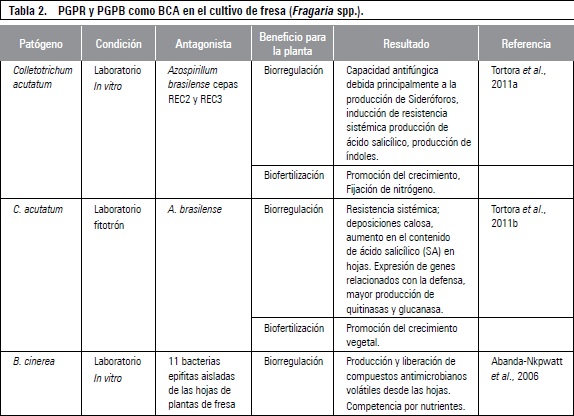
RESISTENCIA SISTÉMICA INDUCIDA EN PLANTAS DE FRESA
Las plantas pueden ser inducidas a desarrollar una mayor resistencia a los patógenos mediante el tratamiento con diversos inductores bióticos y abióticos (químicos y físicos). La resistencia inducida es de amplio espectro y puede ser de larga duración, pero rara vez proporciona un control completo de la enfermedad. La mayoría de agentes inductores reducen la infección entre 20% y 85%. Una posible razón para esto es que las plantas en el campo ya son inducidas a través de las continuas interacciones con factores biótico y abiótico (Terry y Joyce, 2004; Walters et al., 2005; Walters, 2009; Zhang et al., 2010; Cao et al., 2011; Chalfoun et al., 2011; Grellet-Bournonville et al., 2012).
Muchos autores han reportado interacciones entre cultivares de fresa y microorganismos patógenos, pero poco se sabe sobre los mecanismos de defensa desencadenados en la planta a partir de esta interacción. Para dilucidar un poco las implicaciones de esta interacción, Grellet-Bournonville et al. (2012) sometieron plantas de fresa (Fragaria x ananassa cv. Pajarito) a Colletotrichum acutatum cepa virulenta M11 y una cepa no virulenta de C. fragariae M23. Notando que en las plantas inoculadas con la cepa M23, presentaron una acumulación temporal de ácido salicílico (AS) acompañada con la expresión de genes relacionados con la defensa (PR-1), posteriores a eventos oxidativos debidos a la acumulación de peróxido de hidrógeno (H2O2) y el anión superóxido. Resultados similares fueron obtenidos al realizar una aplicación exógena de AS. Los resultados obtenidos apoyan la hipótesis de que las plantas de fresa activan una ruta de defensa mediada por AS, la cual resulta ser eficaz contra la antracnosis. En otros cultivares de fresa también se había obtenido este tipo de respuesta al ser tratados con cepas virulentas de C. fragarie y este tipo de inducción es no específico, es decir de amplio espectro contra otros patógenos (Chalfoun et al., 2011).
La respuesta a la inoculación y coinoculación de inductores de resistencia, no solo presenta en la planta sino en los frutos, los cuales se aumentan la producción de enzimas líticas como las b-1,3-glucanasas y fitoalexinas que estimulan los mecanismos de defensa (Hernández-Lauzardo et al., 2007). En este sentido, Cao et al. (2011) trataron frutos de fresa (Fragaria x ananassa Duch.) con el éster S-metil 1,2,3-benzotiadiazol-7-carbotioico (BTH) inductor químico de resistencia, observando que las actividades enzimáticas mejoraron incluyendo la producción de enzimas antioxidantes, superóxido dismutasa, ascorbato peroxidasa y glutatión reductasa. De igual forma, los contenidos de compuestos fenólicos, antocianinas y la capacidad de captación de radicales libres aumentaron. También se indujo la resistencia sistémica adquirida (SAR) en los frutos, disminuyendo la presencia del moho gris (B. cinerea) en las frutas tratadas.
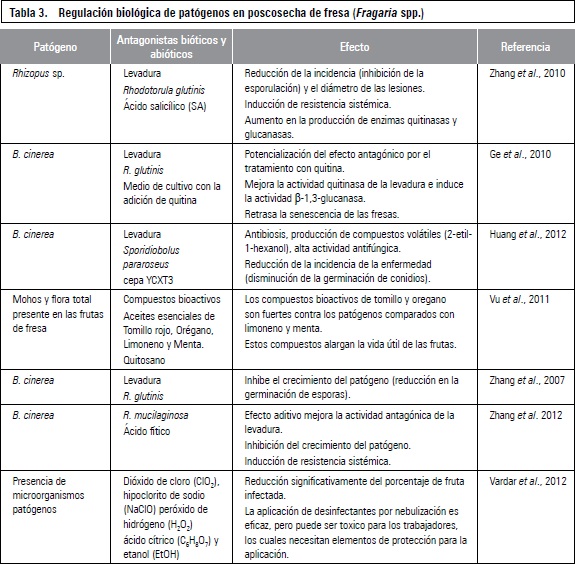
REGULACIÓN BIOLÓGICA DE ENFERMEDADES EN POSCOSECHA DE FRESA
Las enfermedades poscosecha de los productos hortofrutícolas, son comúnmente controladas mediante el uso de fungicidas. Sin embargo, el uso de agentes químicos ha sido continuamente restringido debido al desarrollo de resistencia en los patógenos, la contaminación ambiental y el riesgo para la salud humana. El control biológico en esta área ha tenido menos desarrollo que las investigaciones en precosecha. Los mecanismos de acción que se le atribuyen al uso de antagonistas en poscosecha son: competencia por espacio y nutrientes, parasitismo, antibiosis, principalmente (Bautista-Baños, 2006; Sharma et al., 2009).
La ocurrencia de hongos patógenos en la poscosecha de la fresa (Fragaria spp) es amplia, variada y compleja, se presentan por lo general Aspergillus, Botrytis, Colletotrichum, Geotrichum, Mucor, Penicillium, Pestalotiopsis, Phytophthora, Phytium y Rhizopus stolonifer, además de algunos hongos saprófitos. La presencia de estos patógenos se relaciona con la susceptibilidad de las variedades, las características de los sistemas de producción y las prácticas culturales que se realicen para mitigar el daño producido por los patógenos (Fraire- Cordero et al., 2003).
Información reciente del manejo biológico de enfermedades en la poscosecha de fresas se condensa en la tabla 3, haciendo énfasis en el patógeno, la alternativa biológica, el efecto sobre la fruta y el patógeno y la referencia. Además se incluye el tratamiento con extractos vegetales (aceites esenciales) y algunos elicitores comerciales.
CONCLUSIONES
Pese a que la mayoría de las investigaciones en regulación biológica de patógenos con el uso de antagonistas en fresa, se ha realizado en condiciones controladas de laboratorio o semicontroladas de invernadero, el paso a condiciones de campo es el reto fundamental de los investigadores en esta área, los cuales trabajan incansablemente para aislar, purificar, identificar y caracterizar especies viables y estables, que se puedan registrar y formular para poderlas utilizar en diversos sistemas productivos, bajo diferentes condiciones agroecológicas. Sin embargo, no se trata de una tarea fácil debido a los múltiples factores bióticos y abióticos que modulan la interacción suelo-planta-patógeno-antagonista.
Ingentes esfuerzos deben seguirse realizando para tratar de explicar la complejidad de esta interacción en condiciones de campo.
Lo interesante de las prácticas de manejo integrado de enfermedades es la búsqueda continua de alternativas para el uso racional de los recursos destinados para la protección de los cultivos. El uso de inoculantes microbianos multifuncionales con atributos en la promoción del crecimiento vegetal y en la regulación biológica de patógenos, directa o indirectamente proporciona múltiples beneficios para las plantas, aumentando los rendimientos, la calidad, la sanidad de los productos y el respeto al medio ambiente y se convierte en una estrategia biológica que puede incluirse en el MIE o ser una opción independiente ajustada a los sistemas de producción limpia y sostenible.
AGRADECIMIENTOS
El autor agradece a la Universidad de Ciencias Aplicadas y Ambientales (UDCA), por el apoyo para la realización de los estudios de doctorado, a la Universidad Nacional de Colombia por la formación investigativa y especialmente a los doctores Ruth Bonilla de Corpoica, Pedro Jiménez de la Universidad Militar Nueva Granada, Jairo Cuervo de la Universidad Nacional de Colombia y Édgar Martínez de la UDCA, por sus valiosas sugerencias y recomendaciones.
REFERENCIAS BIBLIOGRÁFICAS
Abanda-Nkpwatt, D., U. Krimm, H.A. Coiner, L. Schreiber y W. Schwab. 2006. Plant volatiles can minimize the growth suppression of epiphytic bacteria by the phytopathogenic fungus Botrytis cinerea in co-culture experiments. Environ. Exp. Bot. 56, 108-119. [ Links ]
Agronet. 2013. Anuario estadístico de frutas y hortalizas 2007-2011 y sus calendarios de siembras y cosechas. Resultados Evaluaciones Agropecuarias Municipales 2011. (http://www.agronet.gov.co/www/htm3b/public/Anuario/ANUARIO%20ESTADISTICO%20DE%20FRUTAS%20Y%20HORTALIZAS%202011.pdf. 305p.; consulta: 15 de octubre de 2013. [ Links ]
Alarcón, A., C.R. Ferrera, M.C. González C. y A. Villegas M. 2000. Hongos micorricicos arbusculares en la dinámica de estolones y nutrición de fresa cv. Fern obtenidas por cultivo in vitro. Terra 18(3), 210-218. [ Links ]
Bautista-Baños, S. 2006. El control biológico en la reducción de enfermedades postcosecha en productos hortofrutícolas: uso de mcroorganismos antagónicos. Rev. Iber. Tecnología Postcosecha 8(1), 1-6. [ Links ]
Borowicz, V.A. 2010. The impact of arbuscular mycorrhizal fungion strawberry tolerance to root damage and drought stress. Pedobiología 53, 265-270. [ Links ]
Brimner, T.A. y G.J. Boland. 2003. A review of the nontarget effects of fungi used to biologically control plant diseases. Agric. Ecosyst. Environ 100, 3-16. [ Links ]
Cano T., M.A. y L.M. Hoyos C. 2011. Interacción de microorganismos benéficos en plantas: Micorrizas, Trichoderma spp. y Pseudomonas spp. Una revision. Rev. UDCA Act. & Div. Cient. 14(2), 15-31. [ Links ]
Cao, S., Z. Hu, Y. Zheng, Z. Yang y B. Lu. 2011. Effect of BTH on antioxidant enzymes, radical-scavenging activity and decay in strawberry fruit. Food Chem. 125, 145-149. [ Links ]
Chalfoun, N.R., A.P. Castagnaro y J.C. Díaz R. 2011. Induced resistance activated by a culture filtrate derived from an avirulent pathogen as a mechanism of control of anthracnose in strawberry. Biol. Control 58, 319-329. [ Links ]
Chaves, N. y A. Wang. 2004. Combate del moho gris (Botrytis cinerea) de la fresa mediante Gliocladium roseum. Agron. Costarricense 28(2), 73-85. [ Links ]
Costa, L.B., E.N. Rangel D.; M.A.B. Morandi y W. Bettiol. 2013. Effects of UV-B radiation on the antagonistic ability of Clonostachys rosea to Botrytis cinerea on strawberry leaves. Biol. Control 65, 95-100. [ Links ]
Cota, L.V., L.A. Maffia, E.S.G. Mizubuti, P.E.F. Macedo y R.F. Antunes. 2008. Biological control of strawberry gray mold by Clonostachys rosea under field conditions. Biol. Control 46, 515-522. [ Links ]
Cota, L.V., L.A. Maffia, E.S.G. Mizubuti y P.E.F. Macedo. 2009. Biological control by Clonostachys rosea as a key component in the integrated management of strawberry gray mold. Biol. Control 50, 222-230. [ Links ]
De Cal, A., C. Redondo, A. Sztejnberg y P. Melgarejo. 2008. Biocontrol of powdery mildew by Penicillium oxalicum in open-field nurseries of strawberries. Biol. Control 47, 103-107. [ Links ]
Farrera P., R.E., A.H. Zambrano V. y F.A. Ortiz M. 2007. Identificación de hongos asociados a enfermedades del fruto de la fresa en el municipio Jáuregui del estado Táchira. Rev. Fac. Agron. 24, 269-281. [ Links ]
Finlay, R.D. 2004. Mycorrhizal fungi and their multifunctional roles. Mycologist 18, 91-96. [ Links ]
Food and Agriculture Organization of the United Nations. 2011. FAOSTAT. (http://faostat.fao.org/DesktopDefault.aspx?PageID=339&lang=es; consulta: 20 de octubre de 2013). [ Links ]
Fraire-Cordero, M.L., M.J. Yáñez-Morales, D. Nieto-Angel y G. Vázquez-Gálvez. 2003. Hongos patógenos en frutos de fresa (Fragaria x ananassa. Duch) en postcosecha. Rev. Mex. Fitopatol. 21(3), 285-291. [ Links ]
Freeman, S. y T. Katan. 1997. Identification of Colletotrichum species responsible for anthracnose and root necrosis of strawberry in Israel. Phytopathol. 87, 516-521. [ Links ]
Ge, L., H. Zhang, K. Chen, L Mab y Z. Xu. 2010. Effect of chitin on the antagonistic activity of Rhodotorula glutinis against Botrytis cinerea in strawberries and the possible mechanisms involved. Food Chem. 120, 490-495. [ Links ]
Gordon, H.L., A. Stensvand y A. Tronsmo. 2000. Effect of temperature and nutrient stress on the capacity of commercial Trichoderma products to control Botrytis cinérea and Mucor piriformis in greenhouse strawberries. Biol. Control 19, 149-160. [ Links ]
Grellet-Bournonville, C.F., M.G. Martinez-Zamora, A.P. Castagnaro y J.C. Díaz-Ricci. 2012. Temporal accumulation of salicylic acid activates the defense response against Colletotrichum in strawberry. Plant. Physiol. Biochem. 54:10-16. [ Links ]
Guédez, C., L. Cañizález, C. Castillo y R. Olivar. 2009. Efecto antagónico de Trichoderma harzianum sobre algunos hongos patógenos postcosecha de la fresa (Fragaria spp.). Rev. Soc. Ven. Microbiol. 29(1), 34-38. [ Links ]
Hernández-Lauzardo, A.N., S. Bautista B, M.G. Velázquez- del Valle y A. Hernández R. 2007. Uso de microorganismos antagonistas en el control de enfermedades postcosecha en frutos. Rev. Mex. Fitopatol. 25(1), 65-74. [ Links ]
Hernández-Rodríguez, A., M.H. Pérez, M.G. Velázquez del Valle y A.N. Hernández-Lauzardo. 2006. Perspectivas del empleo de rizobacterias como agentes de control biológico en cultivos de importancia económica. Rev. Mex. Fitopatol. 24(1), 42-49. [ Links ]
Hernández-Sebastià, C., Y. Piché y Y. Desjardins. 1999. Water relations of whole strawberry plantlets in vitro inoculated with Glomus intraradices in a tripartite culture system. Plant Sci. 143, 81-91. [ Links ]
Huang, R., H.J. Che, J. Zhang, L. Yang, D.H. Jiang y G.Q. Li. 2012. Evaluation of Sporidiobolus pararoseus strain YCXT3 as biocontrol agent of Botrytis cinerea on post-harvest strawberry fruits. Biol. Control 62, 53-63. [ Links ]
Legard, D.E., S.J. MacKenzie, J.C. Mertely, C.K. Chandler y N.A. Peres. 2005. Development of a reduced use fungicide program for control of Botrytis fruit rot on annual winter strawberry. Plant Dis. 89(12), 1353-1358. [ Links ]
Martínez, F., S. Castillo, E. Carmona y M. Avilés. 2010. Dissemination of Phytophthora cactorum, cause of crown rot in strawberry, in open and closed soilless growing systems and the potential for control using slow sand filtration. Sci. Hortic. 125, 756-760. [ Links ]
Matsubara, Y., I. Hirano, D. Sassa y K. Koshikawa. 2004. Increased tolerance to Fusarium wilt in mycorrhizal strawberry plants raised by capillary watering methods. Environ. Control Biol. 42, 185-191. [ Links ]
Matsubara, Y., T. Ishigaki, y K. Koshikawa. 2009. Chages in free amino acid concentrations in mycorrhizal strawberry plants. Sci. Hortic. 119, 392-396. [ Links ]
Murphy, J.G., S.M. Rafferty y A.C. Cassells. 2000. Stimulation of wild strawberry (Fragaria vesca) arbuscular mycorrhizas by addition of shellfish waste to the growth substrate: interaction between mycorrhization, substrate amendment and susceptibility to red core (Phytophthora fragariae). Appl. Soil. Ecol. 15, 153-158. [ Links ]
Nobre, S.A.M., L.A. Maffia, E.S.G. Mizubuti, L.V. Cota y A.P.S. Dias. 2005. Selection of Clonostachys rosea isolates from Brazilian ecosystems efective in controlling Botrytis cinérea. Biol. Control 34, 132-143. [ Links ]
Norman, J.R. y J.E. Hooker. 2000. Sporulation of Phytophthora fragariae shows greater stimulation by exudates of non-mycorrhizal than by mycorrhizal strawberry roots. Mycol. Res. 104(9), 1069-1073. [ Links ]
Pedraza, R.O., J. Motok, M.L. Tortora, S.M. Salazar y J.C. Díaz-Ricci. 2007. Natural occurrence of Azospirillum brasilense in strawberry plants. Plant Soil 295, 169-178. [ Links ]
Pedraza, R.O., J. Motok, S.M. Salazar, A. Ragout, M.I. Mentel, M.L. Tortora, M:F: Guerrero-Molina, B.C. Wini, y J.C. Díaz-Ricci. 2010. Growth-promotion of strawberry plants inoculated with Azospirillum brasilense. World J. Microbiol. Biotechnol. 26(2), 265-272. [ Links ]
Peres, N.A., T.E. Seijo y W.W. Turechek. 2010. Pre- and post-inoculation activity of a protectant and a systemic fungicide for control of anthracnose fruit rot of strawberry under different wetness durations. Crop Prot. 29, 1105-1110. [ Links ]
Pertot, I., R. Zasso, L. Amsalem, M. Baldessari, G. Angeli y Y. Elad. 2008. Integrating biocontrol agents in strawberry powdery mildew control strategies in high tunnel growing systems. Crop Prot. 27, 622- 631. [ Links ]
Pozo, M.J. y C. Azcón-Aguilar. 2007. Unraveling mycorrhiza-induced resistance. Curr. Opin. Plant Biol. 10, 393-398. [ Links ]
Pritts, M., 2002. Growing strawberries, healthy communities, strong economies and clean environments: what is the role of the researcher? Acta Hort. 567, 411417. [ Links ]
Sharma, R.R., D. Singh y R. Singh. 2009. Biological control of postharvest diseases of fruits and vegetables by microbial antagonists: A review. Biol. Control 50, 205-221 [ Links ]
Sosa, R.T., N.J. Sánchez, G.E. Morales y C.F. Cruz. 2006. Interacción micorrizas arbusculares Trichoderma harzianum (Moniliaceae) y efectos sobre el crecimiento de Brachiaria decumbens (Poaceae). Acta. Biol. Colomb. 11(1), 43-54. [ Links ]
Spadaro, D. y M.L. Gullino. 2004. State of the art and future prospects of the biological control of postharvest fruit diseases. Int. J. Food. Microbiol. 91, 185-194. [ Links ]
Sturz, A.V. y J. Nowak. 2000. Endophytic communities of rhizobacteria and the strategies required to create yield enhancing associations with crops. Appl. Soil Ecol. 15, 183-190. [ Links ]
Sturz, A.V. y B.R. Christie. 2003. Beneficial microbial allelopathies in the root zone: the management of soil quality and plant disease with rhizobacteria. Soil. Tillage. Res. 72, 107-123. [ Links ]
Taylor, J. y L.A. Harrier. 2001. A comparison of development and mineral nutrition of micropropagated Fragaria × ananassa cv. Elvira (strawberry) when colonised by nine species of arbuscular mycorrhizal fungi. Appl. Soil. Ecol. 18, 205-215. [ Links ]
Terry, L.A. y D.C. Joyce. 2004. Elicitors of induced disease resistance in postharvest horticultural crops: a brief review. Postharv. Biol. Technol. 32, 1-13. [ Links ]
Tortora M.L., J.C. Díaz-Ricci y R.O. Pedraza. 2011a. Protection of strawberry plants (Fragaria ananassa Duch.) against anthracnose disease induced by Azospirillum brasilense. Plant Soil. DOI 10.1007/ s11104-011-0916-6. [ Links ]
Tortora, M.L., J.C. Díaz-Ricci y R.O. Pedraza. 2011b. Azospirillum brasilense siderophores with antifungal activity against Colletotrichum acutatum. Arch Microbiol. 193, 275-286. [ Links ]
Turechek, W., N. Peres y N. Werner. 2006. Pre- and postinfection activity of pyraclostrobin for control of anthracnose fruit rot of strawberry caused by Colletotrichum acutatum. Plant. Dis. 90(7), 862-868. [ Links ]
Vardar, C., K. Ilhan y O.A. Karabulut. 2012. The application of various disinfectants by fogging for decreasing postharvest diseases of strawberry. Postharvt. Biol. Technol. 66, 30-34. [ Links ]
Vestberg, M., S. Kukkonen, K. Saari, P. Parikka, J. Huttunen, L. Tainio, N. Devos, F. Weekers, C. Kevers, P. Thonart, M.-C. Lemoine, C. Cordier, C. Alabouvette y S. Gianinazzi. 2004. Microbial inoculation for improving the growth and health of micropropagated strawberry. Appl. Soil. Ecol. 27, 243-258. [ Links ]
Vu, K.D., R.G. Hollingsworth, E. Leroux, S. Salmieri y M. Lacroix. 2011. Development of edible bioactive coating based on modified chitosan for increasing the shelf life of strawberries. Food. Res. Int. 44, 198-203. [ Links ]
Walters, D., D. Walsh, A. Newton y G. Lyon. 2005. Induced resistance for plant disease control: maximizing the efficacy of resistance elicitors. Phytopathol. 95, 1368-1373. [ Links ]
Walters, D.R. 2009. Are plants in the field already induced? Implications for practical disease control. Crop. Prot. 28, 459-465. [ Links ]
Wan, M., G. Li, J. Zhang, D. Jiang y H.-C. Huang. 2008. Effect of volatile substances of Streptomyces platensis F-1 on control of plant fungal diseases. Biol. Control 46, 552-559. [ Links ]
Whipps, J.M. 2004. Prospects and limitations for mycorrhizas in biocontrol of root pathogens. Can. J. Bot. 82, 1198-1227. [ Links ]
Yang, H.-H., S.L. Yang, K.-C. Peng, C.-T. Lo y S.-Y. Liu. 2009. Induced proteome of Trichoderma harzianum by Botrytis cinerea. Mycol. Res. 13:924-932. [ Links ]
Zhang, H., l. Wang, Y. Dong, S. Jiang, J. Cao y R. Meng. 2007. Postharvest biological control of gray mold decay of strawberry with Rhodotorula glutinis. Biol. Control. 40(2), 287-292. [ Links ]
Zhang, H., L. Ma, M. Turner, H. Xu, X. Zheng, Y. Dong y S. Jiang. 2010. Salicylic acid enhances biocontrol efficacy of Rhodotorula glutinis against postharvest Rhizopus rot of strawberries and the possible mechanisms involved. Food Chem. 122, 577-583. [ Links ]
Zhang, H., Q. Yang, H. Lin, X. Ren, L. Zhao y J. Hou. 2012. Phytic acid enhances biocontrol efficacy of Rhodotorula mucilaginosa against postharvest gray mold spoilage and natural spoilage of strawberries. Food. Sci. Technol. 49. 1-6. [ Links ]













