Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Hortícolas
Print version ISSN 2011-2173
rev.colomb.cienc.hortic. vol.9 no.1 Bogotá Jan./June 2015
https://doi.org/10.17584/rcch.2015v9i1.3751
Doi: http://dx.doi.org/10.17584/rcch.2015v9i1.3751
1 Facultad de Ingeniería, Programa de Ingeniería de Alimentos, Universidad de Córdoba, Montería (Colombia).
2 Autor para correspondencia. guillermo.arrazola@ua.es
Fecha de recepción: 27-02-2015. Aprobado para publicación: 28-05-2015
RESUMEN
Con la escasez de recursos naturales y los problemas ambientales en la industria alimentaria, crece el interés en recuperar subproductos para la obtención de ingredientes, las cáscaras de la mazorca de cacao representa el principal desecho de esta agroindustria y una fuente de contaminación para los mismos cultivos. El objetivo del presente trabajo fue evaluar el contenido de polifenoles, epicatequina, teobromina y cafeína en las cáscaras de mazorca de cacao y la determinación de su capacidad antioxidante. En la extracción se empleó etanol y agua en relación 1:1, sin acidificar y acidificado con HCL al 1%, se adecuaron las cáscaras de cacao hasta humedad 8 ±1% y partículas menores 0,5 mm. Los extractos se obtuvieron mediante agitación 200 rpm/6 horas y ultrasonido 60 Hz/2 horas, el contenido de polifenoles totales se determinó con el método Folin-Ciocalteau, mediante patrón estándar con ácido gálico, la capacidad antioxidante se determinó mediante OR AC, FR AP y ABTS, se realizó una curva patrón con Trolox para los tres casos, el contenido de (-) - epicatequina, teobromina y cafeína se determinó por HPLC. Los resultados obtenidos mostraron que las cáscaras de cacao presentan polifenoles de 16,40-23,01 EAG/g, capacidad antioxidante con valores FR AP de 13660,13-16904,25 mm TE/100 g, ABTS de 11603,12-22961,57 mm TE/100 g y OR AC de 25150,94-34292,71 mm TE/100 g, un contenido de (-) - epicatequina 0,2482-0,3505 mg g-1, cafeína 0,0209-0,0427 mg g-1 y teobromina 0,0200-0,0375 mg g-1.
Palabras clave adicionales: agroindustria, desechos cáscara, polifenoles.
ABSTRACT
The increasing scarcity of natural resources and serious environmental problems in the food industry have resulted in interest in recovering by-products to obtain ingredients; cacao husks represent the principal waste of this agro-industry and a source of pollution for these crops. The objective of this study was to evaluate the contents of polyphenols, epicatechin, theobromine and caffeine in cacao husks and determine the antioxidant capacity. For the extraction, ethanol and water were used at a 1:1 ratio, without acidification and acidified with 1% HCL, cacao husks are adapted to up to 8 ±1% humidity and particles smaller than 0.5 mm. Extracts were obtained by agitation at 200 rpm/6 hours and ultrasound of 60 Hz/2 hours; the total polyphenol content was determined by the Folin-Ciocalteau method, using a standard method with gallic acid; the antioxidant capacity was determined by the techniques of OR AC, FR AP and ABTS, a pattern curve was generated with Trolox for the three cases; the contents of (-) - epicatechin, theobromine and caffeine were determined with HPLC. The results showed that the cacao husks had polyphenol contents between 16.40-23.01 EAG/g, an antioxidant capacity with FR AP values of 13660.13-16904.25 mm TE/100 g, along with an ABTS of 11603.12-22961.57 mm TE/100 g and an OR AC of 25150.94 - 34292.71 mm TE/100 g, a (-) - epicatechin content of 0.2482-0.3505 mg g-1, caffeine content of 0.0209-0,0427 mg g-1 and theobromine content of 0.0200-0.0375 mg g-1.
Additional key words: agro-industry, pod husk waste, polyphenol compounds.
INTRODUCCIÓN
El cultivo de cacao cuenta con ventajas comparativas en Colombia derivadas de las condiciones naturales para su producción, esto es, características agroecológicas en términos de clima y humedad (Agrocadenas, 2005). Las cáscaras (epicarpio) de cacao representan un alto porcentaje del peso total del fruto, lo cual lo convierte en el principal desecho, no comestible representando un alto porcentaje por cada tonelada de semilla seca y constituye un grave problema para las industrias deshacerse de estas; sin embargo, su composición les da el potencial de ser utilizado para otros fines, por ejemplo para obtener compuestos bioactivos y fibra dietética que podrían ser utilizados como ingrediente en la elaboración de alimentos (Vriesmann et al., 2011).
La industria alimentaria está experimentando una creciente demanda de nuevos ingredientes de origen natural, la cual ha motivado a los investigadores a obtener ingredientes a partir de subproductos agroindustriales (Guerrero et al., 2008; Fernández-López et al., 2009, Ruiz-Navajas et al., 2010; Viuda-Martos et al., 2012). Dependiendo de la disponibilidad de una tecnología adecuada, los subproductos pueden ser convertidos en productos comerciales, ya sea como materias primas para procesos secundarios (ingredientes de alimentos intermedios) o como ingredientes de nuevos productos (Sánchez-Zapata et al., 2009), ganando cada vez más interés debido a que estos son productos de alto valor y su recuperación puede ser económicamente atractiva (Murthy y Naidu, 2012).
Actualmente, a nivel mundial se producen 3,5 millones de toneladas de cacao, de los cuales la cáscara representa 65% (Figueira et al., 1993; Kalvatchev et al., 1998) que son desechadas como residuos cada año, una convincente razón de investigadores para llegar a una mayor utilidad y salida rentable para este subproducto de la industria de chocolate. La idea de usar cáscara de cacao como aditivo para la industria de alimentos no es nueva y varias patentes ya existen para el uso de cáscara de cacao a este respecto (Hess, 1969; Eggen, 1979; Kleinert, 1982; Manez y Barfuss, 1998).
Los compuestos polifenólicos son los compuestos bioactivos antioxidantes más abundantes en la dieta poseen estructuras con anillos aromáticos y dobles enlaces conjugados a partir de los cuales ejercen su acción antioxidante (Arranz, 2010). Además son efectivos donadores de hidrógenos, particularmente los flavonoides (Nava, 2009). Los compuestos fenólicos constituyen un grupo de compuestos heterogéneos de alto peso molecular resultante del metabolismo secundario en plantas Soler (2009). Los grupos de polifenoles más abundantes en cacao son metabolitos tipo flavonoide, especialmente tres grupos básicos con un núcleo común tipo flavan-3-ol: catequinas (37%), antocianinas (4%) y proantocianidinas (58%). La principal catequina es epicatequina que representa cerca del 30% del contenido de polifenoles del grano (Kim y Keeney, 1984, Cádiz-Gurrea et al., 2014). La configuración estereoquímica de los flavanoles, tiene una profunda influencia sobre la salud asociados con el consumo de alimentos ricos en flavanoles, siendo la (-)-epicatequina el estereoisomero simple con mejores resultados sobre la salud cardiovascular, pues presenta la mayor capacidad de dilatación arterial. Los polifenoles son producidos en el metabolismo secundario de las plantas y cumplen un papel importante en los procesos de maduración, mecanismos de defensa y caracterización sensorial de los productos alimenticios derivados de las plantas (Wollgast y Anklam, 2000; Pal y Verma, 2013).
Un antioxidante es cualquier sustancia que cuando está presente a bajas concentraciones respecto a las de un sustrato oxidable, retrasa o previene significativamente la oxidación de este sustrato (Payne et al., 2010). Esta definición se enfoca en la importancia que tiene la matriz o tejido sobre el cual va a actuar el antioxidante y se observa que según este término pueden existir diferentes tratamientos antioxidantes dependiendo del sitio de acción y del origen del mismo; pero no se tenían en cuenta otros aspectos y sistemas del metabolismo, por lo cual se simplifica la definición a "cualquier sustancia (o acción) que retrasa, previene o elimina el daño oxidativo de una molécula" (Cuevas et al., 2008). El oxígeno es esencial para los organismos vivos. Sin embargo, la generación de especies reactivas del oxígeno (EROS) y radicales libres (RL) es inevitable en el metabolismo aeróbico. Estas especies oxidantes provocan daños acumulativos en moléculas fundamentales para el funcionamiento del organismo, tales como proteínas, lípidos y ADN, no obstante, el organismo tiene sus propios mecanismos de defensa para hacer frente a la acción de las especies oxidantes. En determinadas situaciones las defensas antioxidantes pueden verse desbordadas por la excesiva generación de EROS. Este desequilibrio entre especies oxidantes y antioxidantes se conoce como estrés oxidativo, el cual está asociado a numerosas enfermedades y al proceso normal de envejecimiento Pereira et al., (2013). La dieta desempeña un papel importante en la prevención de enfermedades relacionadas con el estrés oxidativo, fundamentalmente a través del aporte de compuestos bioactivos de origen vegetal, entre ellos, las vitaminas hidrosolubles y liposolubles, carotenoides y una gran variedad de compuestos fenólicos, cuya actividad antioxidante y potenciales efectos beneficiosos están siendo ampliamente investigados en los últimos años (Díaz, 2011).
Según (Cíz y Cízová, 2010) es muy difícil evaluar la actividad antioxidante de un producto sobre la base de un único método que proporcionará información básica sobre las propiedades antioxidantes; una combinación de métodos describe las propiedades antioxidantes de la muestra en más detalle.
Existen diversos métodos para evaluar la actividad antioxidante, ya sea in vitro o in vivo. Una de las estrategias más aplicadas en las medidas in vitro para determinar la capacidad antioxidante total de un compuesto, mezcla o alimento, consiste en determinar la actividad del antioxidante frente a sustancias cromógenas de naturaleza radical; la pérdida de color ocurre de forma proporcional con la concentración Mishra et al. (2012). No obstante, las determinaciones de la capacidad antioxidante realizadas in vitro brindan solo una idea aproximada de lo que ocurre en situaciones complejas in vivo, alternativamente, diversos compuestos cromógenos (ABTS, DPPH, DMPD, DMPO y FR AP) son utilizados para determinar la capacidad de los compuestos fenólicos que contienen los frutos para captar los radicales libres generados, operando así en contra los efectos perjudiciales de los procesos de oxidación, que implican a especies reactivas de oxígeno (EROS) (Kuskoski et al., 2005).
Los métodos empleados para medir la actividad antioxidante son el análisis del poder reductor férrico/antioxidante (FR AP). El análisis de FR AP se basa en la capacidad de los polifenoles para reducir Fe3+ a Fe2+, formando un complejo azul leído a una absorción alta a una longitud de onda de 716 nm (García et al., 2004; Márquez, 2006; Martínez, 2007).
El ensayo de decoloración con el radical catiónico ABTS+ se fundamenta en la cuantificación de la decoloración del radical ABTS+, debido a la interacción con especies donantes de hidrógeno o de electrones. El radical catiónico ABTS+ es un cromóforo que absorbe a una longitud de onda de 415 o 734 nm y se genera por una reacción de oxidación del ABTS (2,2'-azino-bis-(3-etil benzotiazolin -6- sulfonato de amonio) con persulfato de potasio (Guerrero et al., 2008; García et al., 2004; Rodríguez, 2006; Rojano et al., 2008; Alvis et al., 2011).
El método de ensayo de OR AC se basa en la generación de radicales hidrófilos piróxilo (ROO*) por la descomposición térmica del compuesto diazo AAPH (2,2'-azobis (2-amidinopropano) dihidrocloruro), estos radicales oxidan el sustrato fluorescente fluoresceína (FL) causando una extinción de su fluorescencia. Por tanto, la inhibición de este proceso por un antioxidante es una medida de su capacidad para reducir la producción de ROO.
El objetivo de esta investigación fue evaluar el contenido de epicatequina, teobromina y cafeína en las cáscaras de mazorca de cacao y la determinación de su capacidad antioxidante.
MATERIALES Y MÉTODOS
Adecuación de cáscara de la mazorca de cacao
La muestra de cacao del clon TSH 565 se tomó aleatoriamente de los cultivares de cacao en el municipio de Tierralta, departamento de Córdoba (Colombia) en la fase de maduración comercial; para la adecuación de la cáscara de la mazorca se utilizó un procesador de vegetales, obteniéndose cubos de 1 cm de largo por 1 cm de ancho y 3 mm de espesor, estos cubos se sometieron a escaldado en una solución de ácido cítrico al 1% durante 5 min a una temperatura de 75°C ±2°C. Posterior al proceso de escaldado se secaron a 50°C durante 24 h en un horno con circulación de aire Pallomaro (Miele Italia, Appiano, Italia) hasta obtener una humedad de 8% ±1%, posteriormente se realizó una reduc ción de tamaño en un molino (fresh ground coffee) hasta partículas menores de 0,5 mm.
Obtención de los extractos
La obtención de los extractos se realizó teniendo en cuenta las combinaciones descritas en la tabla 1.

Para la obtención de los diferentes extractos se utilizaron recipientes color ámbar a una relación 1:10 cáscara de cacao- solución de extracción. Las extracciones se realizaron en un mesa agitadora TECNAL modelo TE-1401 (ETW International Incusa, Chicago, IL) y un equipo ultrasónico Elma-LC60H (National Ultrasound, Duluth, GA) luego de extraídos los compuestos se filtraron en papel filtro corrugado industrial, el filtrado se aforó a un volumen conocido.
Contenido de polifenoles totales de Folin-Ciocalteau (Merck®, grado analítico)
Se determinó por el método Folin-Ciocalteau, descrito por Leighton y Urquiaga (2001), adaptando a un volumen de 3 mL se mezclaron 2.370 mL de agua destilada, 30 mL de muestra, 150 mL del reactivo de Folin-Ciocalteau al 2M y 450 mL de una solución de carbonato de sodio al 20%, agitando luego de cada adición. La mezcla se incubó 120 min a temperatura ambiente (25°C) y protegida de la luz, transcurrido el tiempo se registró la absorbancia a una longitud de onda de 765 nm en un espectrofotómetro Génesis 20 (Analytik Jena, Jena, Alemania). El análisis cuantitativo se realizó por el método del están dar externo y para ello se construyó una curva de calibración con ácido gálico (Sigma-Aldrih®) (5,0-1.000 ppm) con el fin de expresar los resultados en términos de equivalentes de ácido gálico (GAE).
Capacidad antioxidante
Técnica de ORAC
Este método fue adaptado del descrito por Ou et al. (2001) con algunas modificaciones (Gil (2013). Todos los reactivos se prepararon en buffer fosfato 10 mM a pH 7,4. Como estándar se utilizó Trolox (ácido 6-hidroxi-2,5,8 tetrametilchromano 2-carboxílico) Sigma® (Chemical Co., St. Louis, MO), en el rango de concentración (0-200 mM). Una mezcla de fluoresceína (150 mL de una solución de 1 mM en buffer fosfato) y la muestra (25 mL de una dilución 1:100) se preincubó durante 30 min a 37°C, luego se le adicionó 25 mL de una solución de AAPH 250 mM preparada en buffer fosfato. Se midió la intensidad de fluorescencia cada 2 min durante 120 min a una longitud de onda de excitación y de emisión de 485 y 520 nm, respectivamente. La caída en la intensidad de la fluorescencia indica la oxidación de la FL por radicales piróxilo derivados del AAPH. Los resultados de los extractos se compararon con curvas construidas con concentraciones conocidas de Trolox. Las mediciones se realizaron por triplicado. Se calculó el área bajo la curva (AUC) y los resultados se expresaron como mmoles equivalente de Trolox (TE) por cada 100 g de muestra (mmol TE/100g).
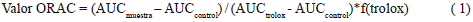
Donde, AUC, es el área bajo la curva y f es el factor de dilución de los extractos.
Técnica de FRAP
Consiste en evaluar la capacidad antioxidante de una muestra de acuerdo con su capacidad para reducir el complejo tripiridiltriazina. El ensayo FR AP se determinó sobre la base de la reducción de Fe3+ a un color azul Fe2+. El reactivo FR AP se preparó mediante la mezcla de 300 mM de tampón de acetato (pH 3,6), 10 mM y 20 mM TPTZ FeCl3 · 6H2O en una proporción de 10:01:01, en a 37°C. Reactivo FR AP (3 mL) se pipeteó en tubos de ensayo. A continuación se añadió un total de 100 mL de muestra y 300 mL de agua destilada a los mismos tubos de ensayo, y se incubó a 37°C durante 4 min. Cada muestra se realizó por triplicado. Se midió la absorbancia a 593 nm. El valor FR AP se calculó utilizando la ecuación descrita por Benzie y Strain (1996). En el ensayo FR AP, el potencial antioxidante de la muestra se determinó a partir de una curva patrón trazada utilizando, FeSO4·7H2O en un rango de concentración entre 200 y 1000 mM.
Técnica de ABTS [2,2-Azinobis- (3-etilbenzotiazolin-6-sulfónico]
Este método fue adaptado del método descrito por Leighton et al. (1999) para un volumen de 3 mL. Las mediciones de absorbancia se realizaron a una longitud de onda de 732 nm empleando un espectrofotómetro (Génesis 20). El radical ABTS se generó por la reacción de oxidación del ABTS (2,2-azino-bis-(3-etilbenzotiazolin-6-sulfonato de amonio)) (3,5 mM) con per sulfato de potasio (1,25 mM). Después de 16 h de reacción, se diluyó el reactivo ABTS concentrado con solución buffer fosfato a pH 7,4 hasta absorbancia 0,70±0,01, a una longitud de onda de 732 nm. Para la evaluación se emplearon 150 mL del extracto diluido y 2.850 mL de la solución del radical ABTS+, luego de 7 min de reacción a temperatura ambiente y oscuridad, se leyó el cambio en la absorbancia de la muestra, se midió también el blanco (buffer) y la referencia (solvente) en iguales condiciones. Los resultados se expresaron mmol TE/100g (Martínez, 2007).
Cuantificación de epicatequina, cafeína y teobromina por medio de cromatografía líquida de alta resolución (HPLC).
El análisis cromatográfico se llevó a cabo utilizando la metodología propuesta por Carrillo (2013). Los análisis se realizaron mediante un sistema Agilent Serie 1200 (Agilent Technologies, Palo Alto, CA), equipada con un desgasificador de vacío, muestreador automático, bomba cuaternaria y un detector de red de diodos (DAD). Los extractos se centrifugaron durante 15 min a 980 RCF y 4°C y luego se utilizó un filtro de 0,45 micras (membranas de nylon, Supelco, Bellefonte, PA) antes del análisis por HPLC.
Para separar los compuestos, la velocidad de flujo se varió entre 0,75 y 1,0 mL min-1 y el análisis se llevó a cabo a 30°C una columna Supelco Ascentis® C18 (25 cm × 4,6 mm, con un tamaño de partícula 5 micras) se utilizó para la separación cromatográfica. La fase móvil utilizada fue agua con ácido acético al 0,1% como eluyente A y metanol como eluyente B. El método óptimo cromatográfico consistió en el siguiente gradiente lineal: 0 min, 6% de A; 7 min, 25% de A; después isocráticamente hasta 30 min, y finalmente un ciclo de acondicionamiento de 3 min con las condiciones iniciales para el siguiente análisis. El volumen de inyección en el sistema de HPLC fue de 10 mL. Los compuestos separados se monitorearon con detector DAD ajustado a una longitud de onda de 280 nm y los espectros de pico se registraron entre 200 y 400 nm. Las catequinas (epicatequina) y metilxantinas (teobromina y la cafeína) se identificaron comparando los tiempos de retención y los datos espectrales a las de los estándares, epicatequina, cafeína, y teobromina (Sigma-Aldrich®) efectuando la medición por un patrón externo.
Análisis estadístico
Los análisis experimentales se realizaron por triplicado para cada método y los resultados fueron evaluados estadísticamente mediante análisis de varianza (Anova) de clasificación simple y prueba de rango múltiples de Duncan empleando el software IBM SPSS Statistics Versión 21.
RESULTADOS Y DISCUSIÓN
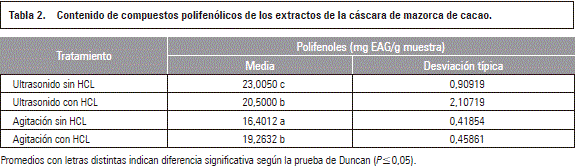
En la tabla 2 se describen los resultados estadísticos, que evidenciaron diferencias significativas (P≤0,05) entre las técnicas de extracción y las soluciones de extracción, por lo cual se realizó la prueba de rangos múltiples sobre la interacción. Los mayores valores se obtuvieron para el tratamiento (sin HCL) y ultrasonido, que es diferente de los demás tratamientos, los tratamientos (con HCL) agitación y ultrasonido no son estadísticamente diferentes (P≤0,05) entre ellos. Igualmente, estudios realizados por Carrillo y Londoño (2013) reportaron que los valores de polifenoles en semillas de cacaos colombianos están entre 44,940 y 70,090 mg EAG/g. Beda et al. (2014) reportaron un contenido de polifenoles de la cáscara cacao de 68,93 mg EAG/g (cacaos procedentes de costa de marfil), valores mayores a los encontrados en la cáscara de mazorca de cacao de este estudio, descritos (tabla 2). Cádiz et al. (2014) obtuvieron 0,76 g/kg de epicatequina en un Tr de 13,48 para semillas de cacao.
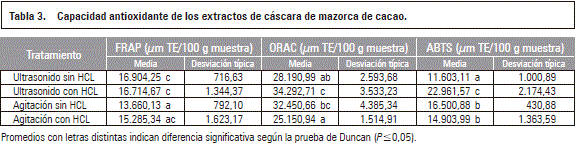
Como se puede apreciar en la tabla 3 los extractos de la cáscara de mazorca de cacao poseen un alto contenido de antioxidantes, para FR AP, los mayores valores se obtienen para los tratamientos ultrasonido sin y con HCL, que no son significativamente diferentes entre ellos ni diferentes a agitación con HCL. Por otra parte, agitación con y sin HCL no son diferentes (P>0,05) entre sí. En el caso de OR AC, los mayores valores se obtienen con los tratamientos Ultrasonido con HCL y agitación sin HCL que no son significativamente diferentes entre ellos. Agitación y ultrasonido sin HCL no son diferentes (P>0,05) entre sí. Para técnica de ABTS los mayores valores se obtienen para el tratamiento de ultrasonido con HCL, que es significativamente diferente (P≤0,05) de los demás tratamientos. Los tratamientos con agitación con y sin HCL no son diferentes (P>0,05) entre ellos y el tratamiento ultrasonido sin HCL es diferente de los demás. El contenido de antioxidantes en la cáscara de mazorca de cacao es inferior al de la semilla de cacao seca, que reporta valores OR AC de 55,653 mmol TE/100g (USDA, 2010) y en las semillas de cacaos colombianos de 63,951 a 38,729 mmol TE/100g (Carrillo et al., 2013). Según Beda et al. (2014) la cáscara de cacao de Costa de Marfil presenta valores ABTS 5.187 mm TE/100 g muestra y FR AP 12.950 mm TE/100 g muestra, menores a los encontrados en este estudio, con valores FR AP de 13.660,13-16.904,25 mm TE/100 g muestra, ABTS 11.603,12-22.961,57 mm TE/100 g muestra y OR AC de 25.150,94-34.292,71 mm TE/100 g muestra.
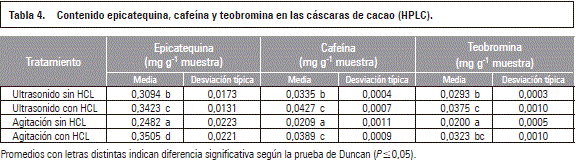
En la tabla 4 se evidencia que el ultrasonido con HCL y agitación con HCL son los que dan mayor valor promedio de epicatequina, no son diferentes (P>0,05) entre ellos y sí lo son del resto de los tratamientos. Para la cafeína todos los tratamientos son significativamente diferentes entre ellos (P≤0,05), siendo ultrasonido con HCL el de mayor valor. Para la teobromina los tratamientos con mayores valores son ultrasonido con HCL y agitación con HCL y no muestran diferencia significativa entre ellos ni de los demás. Carrillo et al. (2013) reportaron que los valores de epicatequina en los cacaos colombianos están entre 1,405 a 3,78 mg g-1, cafeína 0,724 a 1,879 mg g-1, teobromina 7,67 a 9,679 mg g-1, lo cual evidencia menores valores para todos los casos en las cáscaras de mazorca de cacao con valores de epicatequina entre 0,2482-0,3505 mg g-1, cafeína 0,0209-0,0427 mg g-1 y teobromina 0,0200-0,0375 mg g-1.
Hoy son muy pocos los resultados de trabajos en cuanto al aprovechamiento de compuestos fenólicos derivados u obtenidos de la cáscara del cacao, Zapata et al. (2015) reportan valores de fenoles totales para semillas de cacao que van de 20,60-41,77 mg g-1 de semilla tostada de cacao. Ortega et al. (2008) realizando una caracterización de fenoles totales, en diferentes fuentes de cacao, reportan para epicatequina, 3,011 ±0,053, teobromina, 43,42 ±4,54 y cafeína, 4,5 ±0,12 mg g-1 para cáscara deshidratada. Para la industria de compuestos funcionales esta es una alternativa de obtener metabolitos secundarios, dada su incidencia en el bienestar y salud de posibles consumidores.
CONCLUSIONES
Las cáscaras de mazorca de cacao del clon TSH 565 poseen un alto contenido de polifenoles que varían teniendo en cuenta la técnica de extracción de 23,0 a 16,40 mg EAG/g muestra y una buena capacidad antioxidante que varía con valores FRAP de 16.904,25 a 13.660,13 mm TE/100 g muestra, ABTS de 22.961,57 a 11.603,12 mm TE/100 g muestra y ORAC de 34.292,71 a 25.150,94 mm TE/100 g muestra; lo que hace a este subproducto una fuente atractiva para la obtención de compuestos bioactivos, como epicatequina (0,2482-0,3505 mg g-1), cafeína (0,0209-0,0427 mg g-1) y teobromina (0,0200-0,0375 mg g-1). La mejor técnica para la obtención de polifenoles y antioxidantes de la cáscara de mazorca de cacao es ultrasonido. El mejor tratamiento para la obtención de polifenoles es ultrasonido sin HCL (23,00 mg EAG/g muestra) y para la capacidad antioxidantes varía teniendo en cuenta el radical; para FRAP la mejor técnica es ultrasonido sin HCL (16.904,25 mm TE/100 g muestra); para ORAC ultrasonido con HCL (34.292,71 mm TE/100 g muestra), y para ABTS es ultrasonido con HCL (22.961,57 mm TE/100 g muestra). Aquí se presenta una alternativa para aprovechamiento agroindustrial de un subproducto.
AGRADECIMIENTOS
A Colciencias, Universidad de Córdoba, Grupo de Investigación en Procesos y Agroindustria de vegetales (GIPAVE) y Grupo de Investigación en Sustancias Bioactivas de la Universidad de Antioquia.
REFERENCIAS BIBLIOGRÁFICAS
Agrocadenas, 2005. La cadena del cacao en Colombia: una mirada global de su estructura y dinámica. En: http://www.agronet.gov.co; consulta: mayo de 2013. [ Links ]
Alvis, A., W. Martínez y G. Arrazola. 2011. Obtención de extractos hidro-alcohólicos de limoncillo (Cymbopogon citratus) como antioxidante natural. Información Tecnológica 23(2), 3-10. Doi: 10.4067/S0718-07642012000200002 [ Links ]
Arranz, S. 2010. Compuestos polifenólicos (extraíbles y no extraíbles) en alimentos de la dieta española: metodología para su determinación e identificación. Tesis de maestría. Universidad Complutense, Madrid. [ Links ]
Beda M., V. Besson, S. Beourou y K. Kouassi. 2014. Optimization of water-extract of phenolic and antioxidant compounds from kinkéliba (Combretum micranthum) leaves. Afr. J. Food Sci. Res. 2(1), 37-43. Doi: 10.1016/j.foodchem.2015.03.047 [ Links ]
Benzie, I. y J. Strain. 1996. Ferric reducing ability of plasma (FR AP) as a measure of antioxidant power: The FR AP assay. Anal Biochem. 239(1), 70-76. [ Links ]
Cádiz-Gurrea, M., J. Lozano, M. Contreras, L. Legeai, S. Fernández y A. Segura. 2014. Isolation, comprehensive characterization and antioxidant activities of Theobroma cacao extract. J. Funct. Foods 10, 485-498. Doi: 10.1016/j.foodres.2013.06.019 [ Links ]
Carrillo, L., J. Londoño y A. Gil. 2013. Comparison of polyphenol, methylxanthines and antioxidant activity in Theobroma cacao beans from different cocoa-growing areas in Colombia. Int. J. Food Sci. Technol. 60, 1-8. [ Links ]
Cuevas, M., A. Antezana y P. Winterhalter. 2008. Análisis y caracterización de antocianinas en diferentes variedades de maíz (Zea mays) boliviano. Memorias del Encuentro Final Alfa Lagrotech, Cartagena, Colombia, 21-26 de Septiembre 2008. [ Links ]
Cíz, M. y N. Cízová. 2010. Different methods for control and comparison of the antioxidant properties of vegetables. Food Control 21(4), 518-523. Doi: 10.1016/j.foodcont.2009.07.017 [ Links ]
Díaz, J. 2011. Optimización de extracción y análisis de la capacidad antioxidante de la piel de kiwi. Tesis de maestría. Universidad Politécnica de Catalunya, ciudad, España. [ Links ]
Eggen, I.B. 1979. Preparation of flavour extract by treating cocoa shells with acidified ethanol. Societe d'AssistanceTechnique pour Produits Nestle, Patent US. [ Links ]
Fernández-López, J., E. Sendra-Nadal, C. Navarro, E. Sayas, M. Viuda-Martos y J. Perez. 2009. Storage stability of a high dietary fiber powder from orange by-products. Int. J. Food Sci. Technol. 44, 748-756. Doi: 10.1111/j.1365-2621.2008.01892.x [ Links ]
Figueira, A., J. Janick y J. BeMiller. 1993. New products from Theobroma cacao: seed pulp and pod gum. pp. 475-478. In: Janick, J. y J.E. Simin (eds.). New Crops. Wiley, New York, NY. [ Links ]
García, J., M. Periago, M. Vida, C. Ramírez y A. Gil. 2004. Evaluación nutricional y estado antioxidante de un grupo de ancianos institucionalizados de Murcia, España. Arch. Latinoam. Nutr. 54(2), 180-188. [ Links ]
Gil, A. 2013. Identificación y cuantificación de catequinas y xantinas por cromatografía liquida de alta eficiencia (HPLC). Tesis de maestría, Universidad de Antioquia, Medellín, Colombia. [ Links ]
Guerrero, M., J. Torres y M. Núñez. 2008. Extraction of polyphenols from white distilled grape pomace: Optimization and modelling. Bioresource Technol. 99(5), 1311-1318. [ Links ]
Hess, E. 1969. Process for manufacturing flavouring material from cocoa shell-containing chocolate manufacturing by products. Bachman Chocolate Manufacturing Co., Patent US 3. [ Links ]
Kalvatchev, Z., D. Garzaro y F.G. Cedezo. 1998. Theobroma cacao L.: un nuevo enfoque para nutrición y salud. Agroalimentaria 6, 23-25. [ Links ]
Kim, H. y P. Keeney. 1984. Epicatechin content in fermented and unfermented cocoa beans. J. Food. Sci. 49(4), 1092-1092. [ Links ]
Kleinert, J. 1982. Process for producing dietary fibre for improving the digestive properties of foods and drinks. Lindt, & Sprungli, A.G., Patent EP 0 068229 A1. [ Links ]
Kuskoski, M., A. Asuero, A. Troncoso y J. Manzini. 2005. Aplicación de diversos métodos químicos para determinar actividad antioxidante en pulpa de frutos. Ciênc. Tecnol. Aliment. 25(4), 726-732. [ Links ]
Leighton, F. y I. Urquiaga. 2001. Polifenoles del vino y salud humana, antioxidantes y calidad de vida. Revista Antioxidantes y Calidad de Vida Online, Pontificia Universidad Católica de Chile. En: www.antioxidantes.com.ar/Home2.htm; consulta: febrero de 2013. [ Links ]
Leighton F., A. Cuevas, V. Guasch, D.D. Pérez, P. Strobel, A. San Martín, M.S. Díez, R. Foncea, O. Castillo, C. Mizón, M.A. Espinoza, I. Urquiaga, J. Rozowski, A. Maiz y A. Germain. 1999. A plasma polyphenols and antioxidants, oxidative DNA damage, and endothelial function, in a diet and wine intervention study in humans. Drugs Exptl. Clin. Res. 25(2-3), 133-141. [ Links ]
Manez, A. y D. Barfuss. 1998. Production of a compound liquor for compound coatings and alternatives to chocolate. Nestec S.A. Vevey, Switzerland, Patent US 5919502. [ Links ]
Márquez, E., N. Pak, H. Araya y J. Rodríguez. 2006. Actividad antioxidante total de algunas hortalizas evaluadas mediante el ensayo FR AP. Cienc. Tecnol. Alimentaria 16(1), 37-41. [ Links ]
Martínez., J. 2007. Evaluación de la actividad antioxidante de extractos orgánicos de semillas de (Heliocarpus Terebinthinaceus). Tesis en Ingeniería de Alimentos. Universidad Tecnológica de la Mixteca, Oaxaca, México. [ Links ]
Mishra, K., H. Ojha y N. Chaudhury. 2012. Estimation of antiradical properties of antioxidants using DPPH assay: A critical review and results. Food Chem. 130, 1036-1043. Doi: 10.1016/j.food-chem.2011.07.127 [ Links ]
Murthy, P. y M. Naidu. 2012. Recovery of phenolic antioxidants and functional compounds from coffee industry by-products. Food Bioprocess Technol. 5(3), 897-903. Doi: 10.1007/s11947-010-0363-z [ Links ]
Ortega, N., M. Romero, A. Macia, J. Reguant y M. Motilva. 2008. Obtention and characterization of phenolic extracts from different cocoa sources. J. Agric. Food Chem. 56(20), 9621-9627. Doi: 10.1021/jf8014415 [ Links ]
Ou, B., M. Hampsch-Woodill y R. Prior. 2001. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe. J. Agr. Food Chem. 49(10), 4619-4626. Doi: 10.1021/jf010586o [ Links ]
Payne, M., W. Hurst, K. Miller, C. Rank y D. Stuart. 2010. Impact of fermentation, drying, roasting, and Dutch processing on epicatechin and catechin content of cacao beans and cocoa ingredients. J. Agr. Food Chem. 58(19), 10518-10527. Doi: 10.1021/jf102391 [ Links ]
Pal, D. y P. Verma. 2013. Flavonoids: a powerful and abundant source of antioxidants. International J. Pharmacy Pharmaceutical Sci. 5(3), 95-98. [ Links ]
Pereira, G., G. Borges, C. Nagai, M. Jackson, T. Yokota, A. Crozier y H. Ashihara. 2013. Profiles of phenolic compounds and purine alkaloids during the development of seeds of Theobroma cacao cv. Trinitario J. Agr. Food Chem. 61(2), 427-434. Doi: 10.1021/jf304397m [ Links ]
Rodríguez, J., O. Valdez y A. Alemán. 2009. Evaluación de la actividad antioxidante de cinco hierbas aromáticas. ppâ¦â¦ 8th International Workshop on Natural Products Chemistry, 14-18 September 2009, Havana, Cuba. www.etnomedicina2009.com [ Links ]
Rojano, B., C. Gaviria, M. Gil, J. Saez, G. Schinella y H. Tournier. 2008. Actividad antioxidante del isoespintanol en diferentes medios. Vitae 15(1), 173-181. [ Links ]
Sánchez-Zapata, E., E. Fuentes-Zaragoza, J. Fernández-López, E. Sendra, E. Sayas, C. Navarro y J. Pérez-Álvarez. 2009. Preparation of dietary fibre powder from tiger nut (Cyperus esculentus) milk ("horchata") byproducts and its physicochemical properties. J. Agr. Food Chem. 57(17), 7719-25. Doi: 10.1021/jf901687r [ Links ]
Soler, A. 2009. Estudio de la capacidad antioxidante y la biodisponibilidad de los compuestos fenólicos del aceite de oliva. Primeras etapas en el desarrollo de un aceite de oliva funcional. Tesis de doctorado. Universidad de Lleida, España. [ Links ]
USDA. 2010. Nutrient data laboratory. Database for the Oxygen Radical Absorbance Capacity (OR AC) of Selected Foods. U.S. Department of Agriculture, Washington DC. [ Links ]
Viuda-Martos, M., Y. Ruiz-Navajas, A. Martin-Sánchez, E. Sánchez-Zapata, J. Fernández-López, E. Sendra, E. Sayas-Barberá y C. Navarro. 2012. Chemical, physico-chemical and functional properties of pomegranate (Punica granatum L.) bagasses powder co-product. J. Food Eng. 110, 220-224. Doi: 10.1016/j.jfoodeng.2011.05.029 [ Links ]
Vriesmanna, L. y R. Dias de Mello C. Oliveira. 2011. Cacao pod husks (Theobroma cacao L.) Composition and hot-water-soluble pectins. Ind. Crops Prod. 34(1), 1173-1181. Doi: 10.1016/j.indcrop.2011.04.004 [ Links ]
Wollgast, J. y E. Anklam. 2000. Review on polyphenols in Theobroma cacao: Changes in composition during the manufacture of chocolate and methodology for identification and quantification. Food Res. Int. 33(6), 423-447. Doi: 10.1016/S0963-9969(00)00068-5 [ Links ]
Zapata, S., A. Tamayo y B. Rojano. 2015. Efecto del tostado sobre los metabolitos secundarios y la actividad antioxidante de clones de cacao colombiano. Rev. Fac. Nal. Agr. Medellin 68(1), 7497-7507. Doi: 10.15446/rfnam.v68n1.47836 [ Links ]













