Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Hortícolas
Print version ISSN 2011-2173
rev.colomb.cienc.hortic. vol.10 no.1 Bogotá Jan./June 2016
https://doi.org/10.17584/rcch.2016v10i1.4921
Doi: http://dx.doi.org/10.17584/rcch.2016v10i1.4921
Certificación de material vegetal sano en Colombia: un análisis crítico de oportunidades y retos para controlar enfermedades ocasionadas por virus
Certification of healthy plant material in Colombia: A critical analysis of opportunities and challenges to control virus diseases
MARLON H. RODRÍGUEZ1, 5, NANCY E. NIÑO2, JOSEPH CUTLER3, JULIANE LANGER3, FÁNOR CASIERRA-POSADA4, DIEGO MIRANDA2, MARTINA BANDTE3, CARMEN BÜTTNER3
1 Faculty of Life Sciences, Division Phytomedicine, Thaer-Institute, Humboldt-Universität zu Berlin, Berlin (Alemania) / Facultad de Ciencias Agropecuarias, Universidad Francisco de Paula Santander – GICAP, Cúcuta (Colombia).
2 Facultad de Ciencias Agrarias, Departamento de Agronomía, Universidad Nacional de Colombia, Bogotá (Colombia)
3 Faculty of Life Sciences, Division Phytomedicine, Thaer-Institute, Humboldt-Universität zu Berlin, Berlin (Alemania).
4 Facultad de Ciencias Agropecuarias, Universidad Pedagógica y Tecnológica de Colombia, Tunja (Colombia).
5 Autor para correspondencia. mhrodrigueza@gmail.com
Fecha de recepción: 15-04-2016 Aprobado para publicación: 14-05-2016
RESUMEN
Los virus fitopatógenos afectan en gran medida la producción agrícola colombiana. Diferentes estudios indican que las pérdidas económicas causadas por estos problemas fitosanitarios podrían evitarse teniendo un mejor conocimiento de estos patógenos y empleando un procedimiento estándar de manejo preventivo como guía. Los productores, viveros, comercializadores y consumidores, se beneficiarían con productos de calidad, al controlarse las fuentes de transmisión de virus. Los acuerdos de libre comercio han dado lugar a una expansión de la producción agrícola y a la proliferación de cientos de viveros que no pudieron ser objeto de inspección minuciosa por parte del Estado. Este artículo presenta los principales virus que afectan dos importantes frutales exóticos de exportación para Colombia, la uchuva (Physalis peruviana) y las pasifloras (Passiflora sp.). A su vez, esquematiza un programa de certificación de material vegetal sano para viveros y la creación de un programa nacional de certificación agrícola, dirigido por el Ministerio de Agricultura y Desarrollo Rural y el Instituto Colombiano Agropecuario (ICA); apoyado por universidades con programas en agricultura, centros de investigación y laboratorios de diagnóstico fitosanitario que proporcionarían un sistema de supervisión y control adecuados, para el material vegetal. Adicionalmente, serían un soporte para las unidades municipales de asistencia técnica agropecuaria. Esta iniciativa interinstitucional también apoyaría la implementación y ajuste de las resoluciones fitosanitarias del ICA en semillas (R.2046/2003), material de propagación en frutales (R.3180/2009) y transporte interno de material vegetal (R.3973/2016). La competitividad de la agricultura colombiana en los mercados internacionales depende del uso de material vegetal sano.
Palabras clave adicionales: viveros, problemas fitosanitarios, uchuva, pasifloras, protección de plantas.
ABSTRACT
Phytopathogenic viruses greatly affect Colombian agricultural production. Several studies indicate that economic losses caused by these phytosanitary problems could be avoided by having a better understanding of these pathogens and using a standard procedure for preventive management as a guide. Producers, nurseries, distributors and consumers would benefit from quality products by controlling the sources of virus transmission. Free trade agreements have resulted in an expansion of agricultural production and the proliferation of hundreds of nurseries that could not have undergone thorough inspection by the state. This article presents the main viruses that affect two important exotic fruits exported from Colombia, cape gooseberry (Physalis peruviana) and Passiflora (Passiflora sp.). The article then outlines a certification program for healthy plant material for nurseries and the establishment of a national agricultural certification program, addressed by the Ministry of Agriculture and Rural Development and the Colombian Agricultural Institute (ICA). This program would be also assisted by agricultural universities, research centers and phytosanitary laboratories that would provide monitoring and control systems for the plant material. In addition, it would be a support for municipal agricultural technical assistance units. This inter-agency initiative would also support the implementation and adjustment of phytosanitary ICA resolutions for seeds (R.2046/2003), propagation material in fruit (R.3180/2009) and internal transport of plant material (R.3973/2016). The competitiveness of Colombian agriculture in international markets depends on the use of healthy plant material.
Additional keywords: nurseries, phytosanitary problems, cape gooseberry, passion fruit, plant protection.
INTRODUCCIÓN
Los virus tienen una importancia en los programas de control fitosanitario, debido a que no se pueden tratar curativamente por lo que los procedimientos preventivos se convierten en una medida eficiente de manejo. La transmisión viral es distinta para los diferentes tipos de virus, por lo cual un correcto y confiable diagnóstico es indispensable para poder evitar la infección. Estas transmisiones virales pueden ocurrir, por ejemplo, en el caso de los potyvirus mediante áfidos semillas o mecánicamente y en el caso de virus más estables, a través del suelo o el agua (Hong et al., 2014). También es necesario considerar que tanto hongos, nematodos y polen pueden ser transmisores de virus (Büttner et al., 2015).
En este sentido, se debe tener en cuenta que la transmisión de muchos virus se hace mediante acción mecánica, siendo clave para su control un adecuado manejo de la sanidad en la finca. Esto se logra con procedimientos de desinfeción de herramientas y soluciones nutritivas recirculantes, complementadas con buenas prácticas de cultivo y un monitoreo fitosanitario permanente (Bandte et al., 2016).
En Colombia, los patógenos del suelo y los virus de plantas son un serio problema para la producción agrícola. Su importancia ha cobrado relevancia en los últimos años, principalmente por los tratados de libre comercio (TLC) y la situación sociopolítica y económica de la región. Lamentablemente para la agricultura del país, desde la apertura de los mercados en los años noventa, se experimenta un nuevo periodo de comportamiento empresarial similar al denominado producción-especulación y que originó las llamadas bonanzas de exportación entre 1850 y 1882 (Ocampo, 1984). En el caso del área fitosanitaria se produjo cierto vacío legislativo y de asistencia técnica que propició el incremento del contrabando de productos agropecuarios y la creación de cientos de viveros de producción de material vegetal que buscaban abastecer la oleada de bonanzas en cultivos con gran demanda para la exportación, pero que en su totalidad, fueron difíciles de inspeccionar por parte del Estado. Finalmente, muchos de estos viveros donde se emplearon prácticas agronómicas deficientes se convirtieron en un foco de multiplicación y diseminación de patógenos del suelo y de virus que contribuyeron a la mayoría de los problemas que actualmente perjudican la calidad y cantidad de la producción agrícola nacional. Si bien es cierto que durante este periodo, diferentes centros de investigación y universidades con programas agrícolas han generado resultados concretos a problemas fitosanitarios, estas instituciones no pueden remplazar las funciones del Estado y menos gestar programas sustentables sin un apoyo real y permanente del gobierno.
Este manuscrito busca proporcionarle a los diferentes actores que participan dentro del modelo de producción de frutales exóticos en Colombia (uchuva y pasifloras), una visión acerca de los problemas fitosanitarios ocasionados por virus, con el fin de generar cultura de responsabilidad hacia un modelo de certificación que permita la competitividad y sustentabilidad de la fruticultura en un mercado de exportación especializado para los próximos años.
PROBLEMAS DE VIROSIS EN LOS FRUTALES EXÓTICOS DE COLOMBIA
En un esfuerzo estratégico por recuperar y re-direccionar la producción del país, el Ministerio de Agricultura y Desarrollo Rural diseñó la apuesta exportadora agropecuaria 2006-2020 que busca la modernización y la especialización de la estructura productiva a través del aprovechamiento del potencial del campo y las oportunidades de mercado de cada producto promisorio exportable (Fischer y Miranda, 2012). Esta apuesta priorizó 10 grupos de productos, entre los que se encuentran algunos frutales exóticos como pitahaya (Hylocereus undatus), mango (Mangifera indica), bananito (Musa acuminata), lima Tahití (Citrus latifolia), feijoa (Acca sellowiana), aguacate (Persea americana), uchuva (Physalis peruviana), piña (Ananas comosus), maracuyá (Passiflora edulis var. flavicarpa), lulo (Solanum quitoense), mora (Rubus glaucus), granadilla (Passiflora ligularis) y tomate de árbol (Cyphomandra betacea) (Ministerio de Agricultura y Desarrollo Rural, 2006a).
Dentro de este grupo, el maracuyá fue la principal Passiflora de exportación en la cual el gobierno centró sus esfuerzos. Esto no indica que haya dejado de lado las otras 500 especies de pasifloras que tienen posibilidades de comercialización a nivel internacional, las cuales son atractivas por sus propiedades culinarias, nutricionales, ornamentales y medicinales. Debido a que Colombia es el centro de diversidad de un grupo importante de estas especies, es prioritario para el país explorar estratégicamente los diferentes mercados para frutos y plantas de este género como gulupa (Passiflora edulis), granadilla, cholupa (Passiflora maliformis), badea (Passiflora quadrangularis) y curuba (Passiflora tripartita var. mollissima) (Miranda et al., 2009; Ministerio Agricultura y Desarrollo Rural, 2016b).
Desafortunadamente, este panorama económico se ha nublado en los últimos 5 años y su futuro es incierto, principalmente, por los problemas fitosanitarios que se presentan en todas las áreas productoras del país.
Dejando de lado los patógenos de suelo que son un problema serio y limitante como es el caso de Fusarium oxysporum (Forero et al., 2015), entre otros y se centra la atención en las enfermedades causadas por virus, ya a nivel nacional se observan problemas en frutales exóticos como uchuva, curuba, granadilla, maracuyá, tomate de árbol y gulupa, algunos de los cuales forman parte del paquete bandera de nuevos cultivos que el gobierno nacional considera como prioridades de exportación, especialmente hacia la Unión Europea para los próximos 10 años. Estos cultivos son un ejemplo contundente de cómo en sólo 5 años la producción de material vegetal y su transporte sin ningún tipo de supervisión, ha diseminado por más de 15 departamentos los virus Tomato spotted wild virus (TSWV), Tobacco mosaic virus (TMV), Cucumber mosaic virus (CMV), Alfalfa mosaic virus (AMV), Potato leafroll virus (PLRV), Potato virus X (PVX), Potato virus Y (PVY), Tomato mosaic virus (ToMV), Potato virus S (PVS), Soybean mosaic virus (SMV) y Passion fruit yellow mosaic virus (PFYMV) (Rodríguez et al., 2008; Benscher et al., 1996; Morales et al., 2001; Morales et al., 2002; Castaño, 2009; Camelo, 2010).
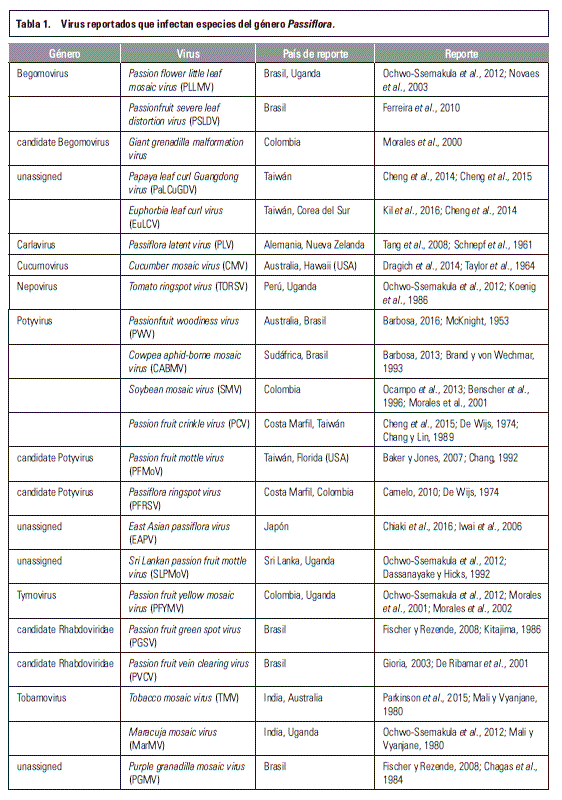
Varios de los virus que afectan económicamente las pasifloras a nivel mundial ya están en Colombia afectando cultivos de este género (tabla 1). Se ha reportado la presencia de los virus Soybean mosaic virus (SMV) (Benscher et al., 1996; Morales et al., 2001) y Passion fruit yellow mosaic virus (PFYMV) en maracuyá y granadilla (Morales et al., 2001; Morales et al., 2002; Castaño, 2009). En gulupa, Camelo (2010) reportó Soybean mosaic virus (SMV), Cucumber mosaic virus (CMV) y Cowpea aphid-borne mosaic virus (CABMV) en la región de Sumapaz (Cundinamarca). Hay que tener en cuenta que las regiones de Cundinamarca, Valle del Cauca, Antioquia, Santanderes y Huila son importantes también por tener varios viveros de multiplicación de material vegetal de frutales exóticos, donde en plántulas es común observar síntomas de mosaicos, amarillamientos, manchas cloróticas y puntos cloróticos. En campo, adicionalmente se perciben pérdidas económicas por decoloraciones y deformaciones en frutos. En algunas localidaes en particular, como Huila y Santanderes, se han encontrado necrosamientos en frutos y tallos, los cuales se encuentran en estudio en la actualidad, y casos similares han sido reportados en New South Wales Australia, cuando se presentan infecciones mixtas con los virus CMV and Passionfruit woodiness virus (PWV) (Liberato y Zerbini, 2016; Pares et al., 1985).
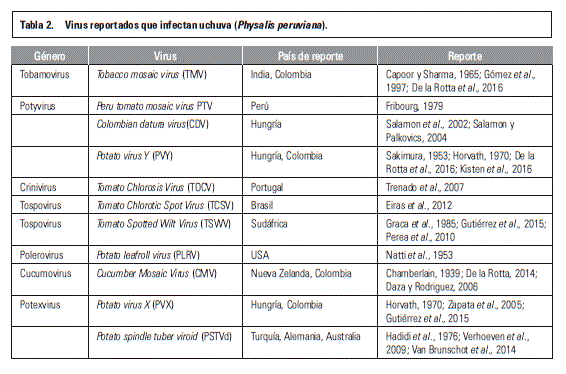
Posiblemente una de las mayores preocupaciones de la comunidad científica es que se repita el caso del cultivo de uchuva, cultivo que hace 15 años se consideraba como la apuesta económica más importante para los agricultores y exportadores en el área de frutales exóticos y cuyos problemas fitosanitarios como los patógenos de suelo y los virus (tabla 2), a través de la multiplicación y traslado de material vegetal sin control alguno, hicieron que se redujera su potencial productivo y tambien su posibilidad de exportación. Esta situación ocasionó serios problemas económicos y sociales, como consecuencia de esta bonanza especulativa en los departamentos de Cundinamarca, Boyacá, Santanderes y Antioquia; además, se afectó económicamente la producción de cultivos como papa, tomate, pimentón, hortalizas, flores de corte para exportación y gulupa entre otros, por la contaminación de áreas geográficas importantes con diferentes patógenos del suelo y virus entre los que se destacan Fusarium spp., Rhizoctonia spp., Pythium spp., Ralstonia solanacearum, Sclerotinia spp., Spongospora subterránea, Pectobacterium sp., Xanthomonas spp., Pseudomonas spp., Phytophthora spp., los virus TMV, TSWV, CMV, PVY, PVX, AMV, SMV, PVS, asi como nematodos, sinfílidos y colémbolos. Como ejemplo en una plantación de uchuva en la granja experimental de la Universidad Nacional de Colombia en Mosquera (Cundinamarca), Aguirre-Ráquira et al. (2014) observaron mediante microscopía electrónica la presencia de dos partículas virales diferentes y congruentes con la morfología de los géneros Potyvirus y Tobamovirus.
Actualmente, los académicos e investigadores ven con preocupación cómo la historia se está repitiendo pero a una escala mayor en los cultivos de pasifloras, como es el caso del maracuyá, donde la producción se había concentrado principalmente en el Valle del Cauca, Santander, Antioquia, Caldas, Cundinamarca, Córdoba, Meta, Huila y Magdalena, desde la entrega por parte del ICA de las variedades Venezuela, Brasil y Hawaii en 1966 (CIAT, 2001), pero que recientemente y debido a la especulación de las exportaciones se cultiva en más de 18 departamentos. La falta de material vegetal y la oferta de nuevas variedades han generado que agricultores de diferentes zonas estén introduciendo semillas de manera ilegal provenientes de Kenia, Zimbabwe y Sudáfrica o material vegetal desde Brasil y Venezuela, sin tener en cuenta los problemas fitosanitarios a los cuales se expone la producción nacional. La falta de información es evidente, los datos sobre producción y áreas sembradas en Colombia, si bien han mejorado, aún no son confiables, debido a que las cifras existentes se manipulan acorde con el interés de cada organización. Un ejemplo son los datos oficiales y públicos de viveros registrados en el ICA para la producción de material vegetal en frutales, los cuales no superan los 300 a nivel nacional (ICA, 2013). Para el caso del departamento del Huila se reportan 13 viveros. Sin embargo, al visitar la zona productora en noviembre de 2013, se contabilizaron más de 100, donde se producía material de maracuyá, granadilla y gulupa entre otros.
Entre los casos observados estan igualmente los del departamento de Norte de Santander, donde entre los años 2012 y 2015, los agricultores podían fácilmente adquirir sin ninguna inspección, plántulas económicas de origen venezolano. De igual manera en la zona fronteriza (Colombia– Venezuela), el primer autor de este artículo observó, que la clínica de plantas de la Universidad Francisco de Paula Santander sede-Cúcuta, ha detectado en múltiples ocasiones mediante pruebas serológicas los virus TMV, CMV, TSWV, ToMV y potivirus en plántulas de tomate transportadas con material vegetal de maracuyá, gulupa y uchuva con destino a Boyacá, Cundinamarca y Santander.
LA CERTIFICACIÓN COMO HERRAMIENTA DE APOYO PARA LA PRODUCCIÓN AGRÍCOLA EN COLOMBIA
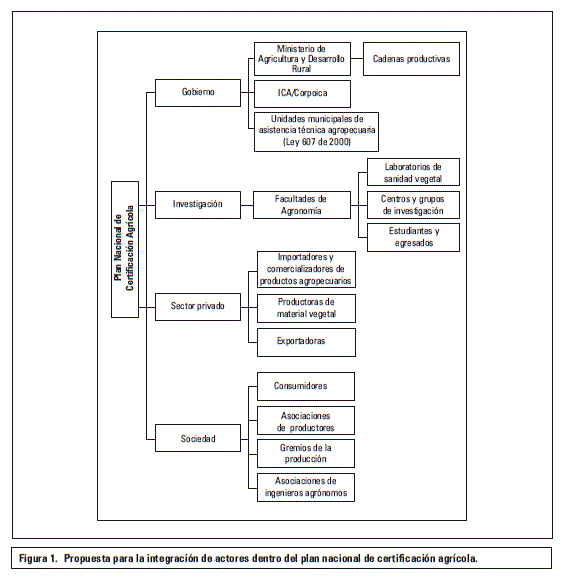
Es necesario que el gobierno nacional busque soluciones, y los actores involucrados en cada eslabón de la cadena productiva reflexionen y comprendan que son parte activa del problema. Es en este punto, donde la academia debe liderar y proponer alternativas reales que permitan la redefinición y coevolución de la agricultura en Colombia, dentro de un mercado globalizado y especializado. Para tal fin, es necesario implementar programas de certificación, entendido esto como el establecimiento de normas que regulen la producción de material vegetal de buena calidad, la realización de controles técnicos y administrativos para su comercialización e importación y como una herramienta que permita fortalecer la cultura de producción entre los agricultores y su valor en la sociedad. Es importante empezar por la creación de un programa nacional de certificación de material vegetal, el cual debe ser liderado por el Ministerio de Agricultura y Desarrollo Rural, el ICA y los gremios de ingenieros agrónomos, apoyados por las universidades, centros de investigación y laboratorios de sanidad vegetal del país. Su implementación deberá integrar de manera dinámica a los diferentes actores que participan en la producción agrícola nacional, sin dejar de lado a las empresas multinacionales de semillas, productos fitosanitarios y entidades internacionales que regulan la legislación en materia de sanidad vegetal (figura 1).
La certificación no debe ser vista sólo como un requisito obligatorio el cual termina siendo un documento para poder producir o comercializar productos agrícolas en Colombia. Su función principal debe ser la de generar una cultura de responsabilidad, con la cual podamos cambiar las malas prácticas agronómicas que no deben ser trasmitidas a las nuevas generaciones. Así mismo, la certificación debe interactuar de manera dinámica con la sociedad a través de un programa de sensibilización, para que esta reconozca el esfuerzo y apoye el valor económico de producir alimentos de calidad, respetando los recursos naturales de la nación.
A su vez en esta herramienta el Ministerio de Agricultura y Desarrollo Rural, y el ICA que juegan un papel fundamental, pueden supervisar en tiempo real los problemas agrícolas con el fin de planificar y establecer políticas nacionales oportunas en favor de la protección de la riqueza natural y la competitividad agricola del país. Los demás actores tienen que asumir su papel dentro del sistema para que la información fluya de manera permanente y articulada. Las universidades con programas relacionados con la agricultura deben comprometerse a formar profesionales con responsabilidad social activa y para esto es fundamental integrar en sus programas académicos asignaturas adicionales a la práctica profesional que permitan la interpretación y el análisis de las normativas agrícolas para dar soporte a las unidades municipales de asistencia técnica agropecuaria, como parte obligatoria de la implementación de un programa de certificación. La integración de las universidades con los centros de investigación y los laboratorios de sanidad vegetal dentro de una red apoyada por el ICA y el gobierno nacional, permitirá la supervisión del territorio nacional y le dará al agricultor la posibilidad de acceder a una asistencia técnica real y oportuna. Este trabajo interinstitucional será el soporte para la implementación y supervisión de las resoluciones del ICA sobre semillas (R.2046/2003), producción de material de propagación de frutales (R.3180/2009) y transporte de material vegetal (R.3973/2016) en el territorio nacional. A su vez, detectará los vacíos jurídicos que hay en las normas para su pronta corrección.
Las cadenas productivas del Ministerio de Agricultura y Desarrollo Rural deben cumplir con su función de enlace y apoyar la integración del pequeño agricultor por medio de asociaciones. La certificación será una herramienta de apoyo para las cadenas, ya que permitirá que todos los actores participen bajo las mismas reglas rompiendo con el ciclo especulativo. La implementación de la certificación facilitará la adaptación a las nuevas regulaciones internacionales sobre tolerancia a residualidad de productos químicos y elementos pesados en la producción agrícola que será uno de los problemas críticos para la exportación hortofrutícola de Colombia.
Finalmente, la certificación debe cumplir un bien social, rompiendo el paradigma agrícola convencional de consumo por volumen y proyectarlo hacia un sistema de producción sostenible y amigable con el ambiente, permitiéndole al pequeño agricultor interactuar con la sociedad dentro de un ambiente enfocado a la calidad de los productos hortofrutícolas. El valor de esta integración será reconocido por las próximas generaciones que podrán disfrutar de una mejor calidad de vida al consumir frutas y vegetales producidos responsablemente.
REFERENCIAS BIBLIOGRÁFICAS
Aguirre-Ráquira, W., D. Borda y L. Hoyos-Carvajal. 2014. Potyvirus affecting uchuva (Physalis peruviana L.) in Centro Agropecuario Marengo, Colombia. Agr. Sci. 5, 897-905. [ Links ]
Baker, C.A. y L. Jones. 2007. A new Potyvirus found in Passiflora incence in Florida. Plant Dis. 91(2), 227-227. Doi: 10.1094/PDIS-91-2-0227A [ Links ]
Bandte, M., M.H. Rodríguez, J. Schuch, U. Schmidt y C. Büttner. 2016. Plant virus in irrigation water: reduced dispersal of virus using sensor-based disinfection. Irrig. Sci. 34, 221-224. Doi: 10.1007/s00271-016-0500-1 [ Links ]
Barbosa, N.C.S. 2016. Anatomia foliar e diversidade genética em Passiflora spp. (Passifloraceae L.) resistentes ao Cowpea aphid-borne mosaic virus (CA-BMV). Tesis de doctorado, Universidade Federal da Bahia, Salvador de Bahia, Brasil. [ Links ]
Barbosa, N.C.S. 2013. Anatomia foliar comparada de quatro espécies de Passiflora L. (Passifloraceae) infectadas pelo vírus do endurecimento dos frutos do maracujazeiro. Trabajo de grado. Universidade Federal da Bahia, Salvador de Bahia, Brasil. [ Links ]
Benscher, D., S.S Pappu, C.L. Niblett, F.M. Varón de Agudelo, E. Hodson y R.F. Lee. 1996. A strain of soybean mosaic virus infecting Passiflora spp. in Colombia. Plant Dis. 80(3), 258-262. Doi: 10.1094/PD-80-0258 [ Links ]
Brand, R.J. y M.B. von Wechmar. 1993. Characterization of two viruses implicated in the woodiness disease complex of South African passionfruit: Cucumber mosaic virus and a new Potyvirus. J. South. Afr. Soc. Hort. Sci. 3, 28-33. [ Links ]
Büttner, C., S. von Bargen y M. Bandte. 2015. Phytopatogenic viruses. pp. 115-122. En: Lugtenberg, B. (ed.). Principles of plant-microbe interactions microbes for sustainable agriculture. Springer Verlag, Berlin. [ Links ]
Camelo, G. 2010. Detección e identificación de los virus patógenos de cultivos de Gulupa (Passiflora edulis Sims) en la región del Sumapáz (Cundinamarca). Tesis de doctorado. Universidad Nacional de Colombia, Bogotá [ Links ].
Capoor, S.P. y D.C. Sharma. 1965. Purple leaf disease of beet. Indian Phytopathology 18(1), 88-89. [ Links ]
Castaño-Zapata, J. 2009. Enfermedades importantes de las pasifloráceas en Colombia. pp. 223-244. En: Miranda, D., G. Fischer, C. Carranza, S. Magnitskiy, F. Casierra, W. Piedrahíta y L.E. Flórez (eds.). Cultivo, poscosecha y comercialización de las pasifloráceas en Colombia: maracuyá, granadilla, gulupa y curuba. Sociedad Colombiana de Ciencias Hortícolas, Bogotá [ Links ].
CIAT (Centro Internacional de Agricultura Tropical). 2001. Propuesta para un programa de frutas tropicales. En: https://cgspace.cgiar.org/handle/10568/54538; consulta: marzo de 2016. [ Links ]
Chagas, C.M., P.P. Joazeiro, M. Kudamatsu y J. Vega. 1984. Mosaico do maracujá-roxo, uma nova virose no Brasil. Fitopatología Bras. 9, 241-247. [ Links ]
Chamberlain, E.E. 1939. Cucumber-mosaic (Cucumis virus 1 of Smith 1937). N.Z. J. Sci. Tech. A 21, 74-90. [ Links ]
Chang, C.A. 1992. Characterization and comparison of Passion fruit mottle virus, a newly recognized Potyvirus, with Passion fruit woodiness virus. Phytopathology 82, 1358-1363. Doi: 10.1094/Phyto-82-1358 [ Links ]
Chang, C.A. y H.H. Lin. 1989. Passion fruit crinkle virus, a new Potyvirus isolated from passionfruit in Taiwan. Plant Prot. Bull, 31, 409-410. [ Links ]
Cheng, Y.H., T.C. Deng, C.C. Chen, C.H. Chiang y C.A. Chang. 2015. First report of Euphorbia leaf curl virus and Papaya leaf curl Guangdong virus on passion fruit in Taiwan. Phytopathology 105(7), 1026-1032. Doi: 10.1094/PDIS-05-13-0554-PDN [ Links ]
Cheng, Y.H., T.C. Deng, C.C. Chen, C.H. Chiang y C.A. Chang. 2014. First report of Euphorbia leaf curl virus and Papaya leaf curl Guangdong virus on passion fruit in Taiwan. Plant Dis. 98(12), 1746-1746. [ Links ]
Chiaki, Y., T. Fukumoto, M. Nakamura y H. Iwai. 2016. Population genetics analysis of East Asian Passiflora virus on Amami Oshima Island. Eur. J. Plant Pathol. 144(1), 109-120. Doi: 10.1007/s10658-015-0755-z [ Links ]
Dassanayake, E.M. y R.G.T. Hicks. 1992. Sri Lankan Passion fruit mottle virus, a Potyvirus infecting golden passion fruit in Sri Lanka. Ann. Appl. Biol. 120(3), 459-469. Doi: 10.1111/j.1744-7348.1992.tb04906.x [ Links ]
Daza, P.A. y P.A. Rodríguez. 2006. Enfermedades de origen viral en plantas de uchuva (Physalis peruviana L.) en el Departamento de Cundinamarca. Trabajo de grado. Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá [ Links ].
De la Rotta, M.C. 2014. Enfermedades de la uchuva (Physalis peruviana L.). En: Carvalho, C.P. y D.A. Moreno (eds.). Physalis peruviana: fruta andina para el mundo. Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo – CYTED, Limencop SL, Alicante, España. [ Links ]
De la Rotta, M.C., K. Quevedo y D. Miranda. 2016. Principales problemas ocasionados por enfermedades en el cultivo de uchuva (Physalis peruviana L.). pp. 51-68, 78. En: Miranda, D., C. Carranza y G. Fischer (eds.). Problemas de campo asociados al cultivo de uchuva (Physalis peruviana L.). Editorial Universidad Nacional de Colombia, Bogotá [ Links ].
De Ribamar, J.N., N.T.V. Junqueira, D. Avila y M.J. Charchar. 2001. Incidência e distribuição do vírus do endurecimento dos frutos do maracujazeiro no Cerrado do Brasil Central. Embrapa Cerrados, Planaltina, Brasil. [ Links ]
De Wijs, J.J. 1974. A virus causing characterization of Passionfruit Crinkle Potyvirus - a newly found virus infecting passion fruit 353 ringspot of Passiflora edulis in the Ivory Coast. Ann. Appl.. Biol. 77, 33-40. Doi: 10.1111/j.1744-7348.1974.tb01385.x [ Links ]
Dragich, M., M. Melzer y S. Nelson. 2014. Cucumber Mosaic Virus in Hawaii. Plant Disease PD 101, College of Tropical Agriculture and Human Resources, University of Hawaii at Mãnoa, Hawái. [ Links ]
Eiras, M., I.F. Costa, A.L. Chaves, A. Colariccio y R. Harakava. 2012. First Report of a Tospovirus in a commercial crop of cape gooseberry in Brazil. New Disease Reports 25, 25. Doi: 10.5197/j.2044-0588.2012.025.025 [ Links ]
Ferreira, S.S., D.R. Barros, M.R De Almeida y F.M. Zerbini. 2010. Characterization of Passion fruit severe leaf distortion virus, a novel begomovirus infecting passion fruit in Brazil, reveals a close relationship with tomato-infecting begomoviruses. Plant Pathol. 59, 221-230. Doi: 10.1111/j.1365-3059.2009.02205.x [ Links ]
Fischer, G. y D. Miranda. 2012. Introducción. pp. 10-15. En: Fischer, G. (ed.). Manual para el cultivo de frutales en el trópico. Produmedios, Bogotá [ Links ].
Fischer, I.H. y J.A. Rezende. 2008. Diseases of passion flower (Passiflora spp.). Pest Technol. 2(1), 1-19. [ Links ]
Forero, R., E. Ortiz, W. de León, J.C. Gómez y L. Hoyos-Carvajal. 2015. Análisis de la resistencia a Fusarium oxysporum en plantas de Passiflora maliformis L. Rev. Colomb. Cienc. Hortic. 9(2), 197-208. Doi: 10.17584/rcch.2015v9i2.4174 [ Links ]
Fribourg, C.E. 1979. Host plant reactions, some properties, and serology of Peru tomato virus. Phytopathology 69(5), 441-445. Doi: 10.1094/Phyto-69-441 [ Links ]
Gioria, R. 2003. Caracterização biológica, serológica e molecular de uma estirpe do Passion Fruit Woodiness Virus (PWV) que infecta sistemicamente algumas cucurbitáceas. Tesis de doctorado. Universidade de São Paulo, São Paulo, Brasil. [ Links ]
Gómez, J.E., F. Morales y J. Arroyave. 1997. Mosaic disease of Physalis peruviana in Colombia. ASCOLFI Informa 23(6), 52. [ Links ]
Graca, J., T.N. Trench y M.M. Martin. 1985. Tomato spotted wilt virus in commercial Cape gooseberry (Physalis peruviana) in Transkei. Plant Pathol. 34(3), 451-453. Doi: 10.1111/j.1365-3059.1985.tb01390.x [ Links ]
Gutiérrez, P.A., J.F. Alzate y M.M. Montoya. 2015. Complete genome sequence of an isolate of Potato virus X (PVX) infecting Cape gooseberry (Physalis peruviana) in Colombia. Virus Genes 50(3), 518-522. Doi: 10.1007/s11262-015-1181-1 [ Links ]
Hadidi, A., D. Jonesf, D. Gillespiet, F. Wong-Staalt y T. Dienert. 1976. Hybridization of Potato spindle tuber viroid to cellular DNA of normal plants. Proc. Nat. Acad. Sci. 73(7), 2453-2457. Doi: 10.1073/pnas.73.7.2453 [ Links ]
Hong, C., G.W. Moorman, W. Wohanka y C. Büttner (eds.). 2014. Biology, detection, and management of plant pathogens in irrigation water. APS Press, St. Paul, MN. [ Links ]
Horvath, J. 1970. Reaction of Physalis species to plant viruses. I. The Cape Gooseberry as a symptomless carrier of Potato virus X and Y. Acta Phytopatho-logy Acad. Sci. Hungaricae 5(1), 65-72. [ Links ]
ICA (Instituto Colombiano Agropecuario). 2013. Base de datos de viveros registrados en Colombia Feb-2013. En: http://www.ica.gov.co/Areas/Agricola/Servicios/Certificacion-de-Semillas/Base-de-datos-de-Viveros-registrados-Feb-2013.aspx; consulta: marzo de 2016. [ Links ]
Iwai, H., Y. Yamashita, N. Nishi y M. Nakamura. 2006. The Potyvirus associated with the dappled fruit of Passiflora edulis in Kagoshima prefecture, Japan is the third strain of the proposed new species East Asian Passiflora virus (EAPV) phylogenetically distinguished from strains of Passion fruit woodiness virus. Arch. Virol. 151(4), 811-818. Doi: 10.1007/s00705-005-0659-x [ Links ]
Kil, E.J., H. Seo, H.S. Byun, S.S. Suh, T.K. Lee, K.Y. Lee y C.S. Kim. 2016. First report of Euphorbia leaf curl virus in passion fruits in South Korea and its natural occurrence in papaya. Plant Dis. 100(4), 865. Doi: 10.1094/PDIS-08-15-0854-PDN [ Links ]
Kisten, L., V. Moodley, A. Gubba y P.L. Mafongoya. 2016. First report of Potato virus Y (PVY) on Physalis peruviana in South Africa. Plant Dis. 100(7), 1511. Doi: 10.1094/PDIS-12-15-1442-PDN [ Links ]
Kitajima, E.W., C.M. Chagas y O.A. Crestani. 1986. Enfermidades de etiologia viral e associadas a organismos do tipo micoplasma em maracujazeiro no Brasil. Fitopatol. Bras. 11, 409-432. [ Links ]
Koenig, R. y C.E. Fribourg. 1986. Natural occurrence of tomato ringspot virus in Passiflora edulis from Peru. Plant Dis. 70(3), 244-245. Doi: 10.1094/PD-70-244 [ Links ]
Ley 607 Republica de Colombia. 2000. Por medio de la cual se modifica la creación, funcionamiento y operación de las unidades municipales de asistencia técnica agropecuaria (UMATA), y se reglamenta la asistencia técnica directa rural en consonancia con el Sistema Nacional de Ciencia y Tecnología. Diario Oficial No. 44.113, de 3 de agosto de 2000. En: https://www.minagricultura.gov.co/Normatividad/Leyes/Ley%20607%20de%202000.pdf consulta: abril de 2016. [ Links ]
Liberato, J.R. y F.M. Zerbini. 2016. Diseases of passionfruit (Passiflora spp.). The American Phytophatological Society En: http://www.apsnet.org/publications/commonnames/Pages/Passionfruit.aspx; consulta: abril de 2016. [ Links ]
Mali, V.R. y N.T. Vyanjane. 1980. Occurrence of tobacco mosaic virus on passionflower (Passiflora caerulea). Ind. J. Mycol. Plant Pathol. 11, 112-114. [ Links ]
McKnight, T. 1953. The woodiness virus of the passion vine (Passiflora edulis Sims). Queensl. J. Agr. Sc. 10, 4-35. [ Links ]
Ministerio de Agricultura y Desarrollo Rural. 2016a. Apuesta Exportadora Agropecuaria 2006-2020 República de Colombia. Ed. Ministerio de Agricultura y Desarrollo Rural. En: http://www.bibliotecadigital.agronet.gov.co/jspui/bitstream/11348/6004/1/006.pdf; consulta: abril de 2016. [ Links ]
Ministerio de Agricultura y Desarrollo Rural. 2016b. Sistema de información de gestión y desempeño de organizaciones de cadenas. Passifloras. En: http://sioc.minagricultura.gov.co/index.php/art-inicio-cadena-pasifloras/?ide=27; consulta: abril de 2016. [ Links ]
Miranda, D., G. Fischer, C. Carranza, S., Magnitskiy, F. Casierra, W. Piedrahíta y L.E. Flórez (eds.). 2009. Cultivo, poscosecha y comercialización de las pasifloráceas en Colombia: maracuyá, granadilla, gulupa y curuba. Sociedad Colombiana de Ciencias Hortícolas, Bogotá [ Links ].
Morales, F.J., I. Lozano, M. Castaño, J. Arroyave, A.C. Velasco y F. Varon. 2002. Partial characterization of a Tymovirus infecting passion fruit in Colombia, South America. J. Phytopathology 150(4-5), 292-296. [ Links ]
Morales, F.J., I. Lozano, C. Muñoz, M. Castaño y F. Arroyave. 2001. Caracterización molecular de los virus que afectan el maracuyá (Passiflora edulis Sims) y otras Passifloras en Colombia. Fitopatol. Colomb. 25(2), 99-102. [ Links ]
Morales, F.J., C. Muñoz, M. Castaño y C.A. Velasco. 2000. Geminiviruses transmitted by whitefly in Colombia. Fitopatol. Colomb. 24(½), 95-98. [ Links ]
Natti, J.J., H.C. Kirkpatrick y A.F. Ross. 1953. Host range of Potato leaf roll virus. Amer. Potato J. 30(3), 55-64. [ Links ]
Novaes, Q.S., J. Freitas-Astua, V.A. Yuki, E.W. Kitajima, L.E.A. Camargo y J.A.M. Rezende. 2003. Partial characterization of a bipartite Begomovirus infecting yellow passion flower in Brazil. Plant Pathol. 52, 648-654. [ Links ]
Ocampo, J., R. Urrea, K. Wyckhuys y M. Salazar. 2013. Exploración de la variabilidad genética del maracuyá (Passiflora edulis f. flavicarpa Degener) como base para un programa de fitomejoramiento en Colombia. Acta Agron. 62(4), 352-360. [ Links ]
Ocampo, J.A. 1984. Colombia y la economía mundial 1830–1910. Ed. Siglo Veintiuno, Bogotá [ Links ].
Ochwo-Ssemakula, M., T. Sengooba, J.J. Hakiza, E. Adipala, R. Edema, M.G. Redinbaugh y S. Winter. 2012. Characterization and distribution of a Potyvirus associated with passion fruit woodiness disease in Uganda. Plant Dis. 96(5), 659-665. [ Links ]
Pares, R.D., A.B. Martin y R.D. Fitzell. 1985. Virus-induced tip necrosis of passion fruit (Passiflora edulis Sims). Aust. Plant Pathol. 4(4), 76-78. [ Links ]
Parkinson, L.E., K.S. Crew, J.E. Thomas y E.K. Dann. 2015. Efficacy of acibenzolar-S-methyl (Bion®) treatment of Australian commercial passionfruit, Passiflora edulis f. sp. flavicarpa, on resistance to Passionfruit woodiness virus (PWV) and activities of chitinase & ß-1, 3-glucanase. Aust. Plant Pathol. 44(3), 311-318. [ Links ]
Perea D., M., N.C. Rodríguez, G. Fischer, M. Velásquéz y Y. Micán G. 2010. Uchuva Physalis peruviana L. (Solanaceae). pp. 466-490. En: Perea D., M., L.P. Matallana R. y A. Tirado P. (eds.). Biotecnología aplicada al mejoramiento de los cultivos de frutas tropicales. Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá [ Links ].
Rodríguez, M., N. Niño, C. Carranza, O. Lanchero, D. Miranda y S. Magnitskiy, S. 2008. Detection of virus in the principal producing zones of tomato (Solanum lycopersicum L.) in the municipalities of Fómeque, Fusagasuga and Villa de Leyva (Colombia). Acta Hortic. 821, 175-180. [ Links ]
Sakimura, K. 1953. Potato virus Y in Hawaii. Phytopathology 43(4), 217. [ Links ]
Salamon, P. y L. Palkovics. L. 2004. Occurrence of Colombian datura virus in Brugmansia hybrids, Physalis peruviana L. and Solanum muricatum Ait. in Hungary. Acta Virologica 49(2), 117-122. [ Links ]
Salamon, P., L. Palkovics y G.J. Kövics. 2002. Colombian Datura Virus (cdv): occurrence of a new dangerous Potyvirus in Hungary. pp. 70-78. 7. Tiszántúli Növényvédelmi Fórum, 16-17 October 2002, Debrecen, Hungary. [ Links ]
Schnepf, E. y J. Brandes. 1961. Über ein Virus aus Passiflora spec. J. Phytopathology 43, 102-105. Doi: 10.1111/j.1439-0434.1961.tb01970.x [ Links ]
Tang, J., G.R.G. Clover, B.J.R. Alexander y B.D. Quinn. 2008. First report of Passiflora latent virus in banana passionfruit (Passiflora tarminiana) in New Zealand. Plant Dis. 92(3), 486. Doi: 10.1094/PDIS-92-3-0486C [ Links ]
Taylor, R.H. y K.A. Kimble. 1964. Two unrelated viruses which cause woodiness of passion fruit (Passiflora edulis Sims). Aust. J. Agr. Res. 15 , 560-570. Doi: 10.1071/AR9640560 [ Links ]
Trenado, H.P., I.M. Fortes, D. Louro y J. Navas-Castillo. 2007. Physalis ixocarpa and P. peruviana, new natural hosts of Tomato chlorosis virus. Eur. J. Plant Pathol. 118(2), 193-196. Doi: 10.1007/s10658-007-9129-5 [ Links ]
Van Brunschot, S.L., J.T.L. Verhoeven, D.M. Persley, A.D.M. Geering, A. Drenth y J.E. Thomas. 2014. An outbreak of Potato spindle tuber viroid in tomato is linked to imported seed. Eur. J. Plant Pathol. 139(1), 1-7. Doi: 10.1007/s10658-014-0379-8 [ Links ]
Verhoeven, J.T.J., M. Botermans, J.W. Roenhorst, J. Westerhof y E.T.M. Meekes. 2009. First report of Potato spindle tuber viroid in Cape Gooseberry (Physalis peruviana) from Turkey and Germany. Plant Dis. 93(3), 316-316. Doi: 10.1094/PDIS-93-3-0316A [ Links ]
Zapata, J.L., A. Saldarriaga, M. Londoño y C. Díaz. 2005. Las enfermedades limitantes en cultivo y poscosecha de la uchuva y su control. pp. 97-110. En: Fischer, G., D. Miranda, W. Piedrahíta y J. Romero (eds.). Avances en cultivo, poscosecha y exportación de la uchuva Physalis peruviana L. en Colombia. Unibiblos, Bogotá [ Links ].