Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Ciencias Hortícolas
versão impressa ISSN 2011-2173
rev.colomb.cienc.hortic. vol.10 no.2 Bogotá jul./dez. 2016
https://doi.org/10.17584/rcch.2016v10i2.5750
Doi: http://dx.doi.org/10.17584/rcch.2016v10i2.5750
1 Facultad de Ciencias Agrícolas, Universidad de Nariño, Pasto (Colombia).
2 Grupo de Investigación en Producción de Frutales Andinos, Universidad de Nariño, Pasto (Colombia).
3 Autor para correspondencia. hcriollo@udenar.edu.co
Fecha de recepción: 02-08-2016. Aprobado para publicación: 24-11-2016.
RESUMEN
El tomate de árbol es un frutal de importancia en Colombia, con una productividad limitada por la presencia de problemas sanitarios que se transmiten a través de los métodos tradicionales de propagación, que obligan a buscar métodos más eficientes para la obtención de plantas sanas. Este trabajo pretendió evaluar diferentes alternativas de micropropagación para determinar la opción más eficiente de multiplicación masiva de plántulas de tomate de árbol (Solanum betaceum); se evaluaron tres auxinas: ácido indolacético (AIA), ácido naftalenacético (ANA) y ácido 2,4-diclorofenoxiacético (2,4-D) en diferentes dosis, combinadas con 6-bencilaminopurina (BAP) (1,0 mg L-1 y 3,0 mg L-1), en un medio de cultivo Murashige Skoog (1962), utilizando hipocotilos como explantes. El mayor promedio de brotes por explante (11,6 brotes) se obtuvo con AIA 0,5 mg L-1 + BAP 3,0 mg L-1; el porcentaje de enraizamiento del explante fue mayor en el testigo sin fitorreguladores y con la inclusión de AIA. La variable formación de plantas completas tuvo mejor comportamiento con AIA 0,5 mg L-1 con el 36,9%. El mejor porcentaje de enraizamiento de brotes obtenidos a partir de hipocotilos, se obtuvo con AIA 1,0 mg L-1 + BAP 3,0 mg L-1, con un porcentaje de 96,23% y con AIA 1 mg L-1 + BAP 1,5 mgL-1 con 88,83% respectivamente. Las plantas enraizadas fueron exitosamente trasferidas a campo con un 96,6% de supervivencia para hipocotilos.
Palabras clave adicionales: bencilaminopurina, ácido indolacético, ácido naftalenacético, ácido 2,4-diclorofenoxiacético, micropropagación, hipocotilos.
ABSTRACT
The tree tomato is a fruit of importance in Colombia, with a productivity limited by the presence of sanitary problems that are transmitted through the traditional methods of propagation, that force to look for more efficient methods for the obtaining of healthy plants. This study was carried out to evaluate different alternatives of micropropagation that would allow us to determine the most efficient option for the mass production of tamarillo plants (Solanum betaceum). Hypocotyls explants were evaluated under the effect of three auxins: AIA, ANA and 2,4-D in different doses, combined with BAP. The basic medium used was Murashige Skoog (1962). The largest average of number of shoots was obtained when using AIA 0.5 mg L-1 + BAP 3.0 mg L-1 with a value of 11.6 shoots. The best treatment for rooting of hypocotyls was AIA and the control without phytoregulators. Regeneration of complete plants was better to AIA 0.5 mg L-1, with an average of 36.9%. The best average for rooting of shoots obtained was obtained with AIA 1.0 mg L-1 + BAP 3.0 mg L-1 with 96.23% and with AIA 1.0 mg L-1 + BAP 1.5 mg L-1 (88.83%). The rooted plant were successfully transplanted into the soil with a 96.6% survival rate.
Additional key words: benzylaminopurine, indoleacetic acid, naphthaleneacetic acid, 2.4-D, micropropagation, hypocotyls.
INTRODUCCIÓN
El tomate de árbol es una fruta tropical de origen andino (Pringle y Murray, 1991) de amplias posibilidades de exportación (Bonnet y Cárdenas, 2012); desde el punto de vista nutricional, posee un alto contenido de fibra, vitaminas A y C, además de ser rico en minerales como calcio, hierro y fósforo; actúa como antioxidante y fortalece el sistema inmunológico (Cadena, 2006).
El cultivo de tomate de árbol genera un impacto positivo en el desarrollo socioeconómico de las zonas productoras, mediante la generación de empleo rural, además de ser una alternativa en la diversificación de la producción de los cultivos andinos; sin embargo, y pese a su creciente demanda, no ha logrado desarrollarse principalmente por la escasa oferta de cultivares mejorados (Tafur, 2006).
Las dificultades para el mantenimiento de la variabilidad genética en campo, así como la conservación de los atributos genéticos de las variedades producidas por el fitomejorador, debido al carácter alógamo de la especie, requieren de metodologías de multiplicación vegetal de alta eficiencia y con fidelidad genética; los cultivos de tejidos poseen estas características, reducen los riesgos por contaminación de patógenos, requieren de áreas reducidas para la producción de grandes cantidades de plantas uniformes (clones) y facilidad de transporte (Rathore et al., 2016; Rout et al., 2006).
El cultivo in vitro es una herramienta biotecnológica que utiliza el concepto de la totipotencia celular, como uno de sus fundamentos; este concepto indica que cualquier célula vegetal, contiene una copia íntegra del material genético de la planta a la que pertenece, independiente de su función o posición en ella; gran parte de las respuestas de totipotencia celular, de morfogénesis in vitro y de regeneración de plantas, ocurren en presencia de niveles apropiados de citoquininas y auxinas (Ferl y Paul, 2000; Hoyos et al., 2008).
Estos sistemas facilitan una rápida multiplicación de variedades mejoradas o de clones élite y se constituyen en una herramienta fundamental para la ingeniería genética (Kothari et al., 2010), ya que permiten multiplicar de forma rápida, económica y rentable, material élite en cualquier época del año (Calva y Pérez, 2005). Técnicas de cultivo in vitro se utilizan con éxito en la creación de variabilidad genética, producción de haploides y de variantes somaclonales que han dado origen a plantas mejoradas; permiten la eliminación de patógenos del material vegetal, incrementando sus rendimientos (Rathore et al., 2016; Ashrafuzzaman et al., 2009).
Según Twyman et al. (2003), el cultivo de tejidos y células vegetales presenta grandes ventajas en investigación básica, en micropropagación y en producción de compuestos con actividad biológica, como metabolitos secundarios, proteínas y productos transgénicos; permiten reducir el tiempo de investigación y controlar las condiciones de cultivo.
En el caso de frutales, el periodo de mejoramiento es sustancialmente mayor respecto a los cultivos anuales, lo que dificulta el desarrollo de nuevas variedades. Esta limitante puede ser superada complementando el fitomejoramiento convencional con la micropopagación masiva de cultivares libres de patógenos, a través de la técnica de tejidos in vitro (Lasso, 2007). Los recursos genéticos requieren mejorarse mediante programas de mejoramiento tradicional o con ingeniería (Hu et al., 2015).
Contreras y Almeida (2003) cultivaron cotiledones e hipocotilos de semillas de tomate de árbol recién germinadas en medio Murashige y Skoog (1962) suplementado con bencilaminopurina (BA) (2,0; 3,5 y 5,0 mg L-1) más ácido indolacético (AIA) (0,5; 0,75 y 1,0 mg L-1), como inductores de morfogénesis; en dos meses, observaron organogénesis de yemas y obtuvieron plantas normales al cultivarlas en medio MS sin reguladores.
Apraez et al. (2012) regeneraron plantas de Cyphomandra betacea utilizando MS + 5 mg L-1 de 2,4-D a partir de callos, con un porcentaje de 14,66%. Guimarães et al. (1996) describieron la obtención de plántulas de tomate in vitro por organogénesis, utilizando como explantes hipocotilos y hojas cotiledonares de tomate de árbol en presencia de ácido naftalenacético (ANA) más ácido indolbutírico (AIB); además describen procesos organogénicos y embriogénicos de tomate de árbol a partir de hipocotilos, cotiledones, raíces, embriones cigóticos maduros y a partir de protoplastos.
A partir de lo anterior, se realizó el presente trabajo con el objeto de contribuir al conocimiento de la producción in vitro de plántulas de tomate de árbol, evaluando el efecto de diferentes combinaciones de fitorreguladores y la capacidad de las plántulas obtenidas para aclimatarse.
MATERIALES Y MÉTODOS
Localización
El estudio se realizó en el Laboratorio de Cultivo de Tejidos Vegetales y el invernadero de la Universidad de Nariño, ubicados en San Juan de Pasto, departamento de Nariño (Colombia) a una altitud de 2.540 msnm con una temperatura promedio interna de 18 y 24°C, respectivamente.
Obtención de semilla
La semilla sexual de tomate de árbol, Solanum betaceum (Cav.) Sendt., se obtuvo a partir de frutos en estado de madurez, completamente rojos, seleccionados de un mismo árbol y teniendo en cuenta sus características de sanidad y productividad.
Lavado y siembra de semilla in vitro
La desinfestación de las semillas se realizó con inmersión en yodo al 5% durante 15 min, tres lavados con agua estéril; estas semillas se sumergieron en hipoclorito al 1,5% durante 10 min y se lavaron cinco veces con agua estéril. La siembra de estas semillas se realizó en cámara de flujo, colocando ocho semillas por frasco con 20 mL de medio de cultivo agar (7,0 g L-1).
Seis semanas después de la siembra se extrajeron las plántulas para separar los hipoctilos que se dividieron en trozos de 1 cm aproximadamente; éstos se colocaron horizontalmente sobre un medio de cultivo MS suplementado con diferentes dosis de fitorreguladores (Tab. 1), con 7,0 g L-1 de agar, 3% de sacarosa y un pH de 5,8. Los explantes sembrados se mantuvieron en condiciones de 12/12 h de luz/oscuridad y una temperatura media de 22°C.
Diseño experimental
Los tratamientos se distribuyeron en un diseño irrestrictamente al azar (DIA) con arreglo factorial; factor A: dosis de BAP (0 mg L-1, 1,5 mg L-1 y 3,0 mg L-1), factor B: auxinas (ANA, AIA, BAP) y factor C: dosis de auxinas (3) para un total de 27 tratamientos, 10 repeticiones y 270 unidades experimentales; cada unidad experimental estuvo conformada por tres explantes.
Variables
Cada 30 d y por un espacio de 60 d se realizaron las siguientes evaluaciones:
• Porcentaje de explantes con emisión de brotes.
• Porcentaje de explantes enraizados.
• Porcentaje de explantes con emisión de plantas completas.
Los datos correspondientes a estas variables se sometieron al análisis de varianza según el modelo DIA con arreglo trifactorial y pruebas de comparación para las interacciones con Pr > | t | 0,05.
Producción de plántulas
A los 60 d, todos los brotes producidos se cortaron y sembraron en medio básico MS (1962), suplementado con 0,5 mg L-1 de ácido giberélico (AG3) y 30 d después, se evaluó el porcentaje de enraizamiento de los brotes. El análisis de los tratamientos se realizó en un diseño irrestrictamente al azar (DIA) con diez repeticiones, y una prueba de comparación de medias (DMS) al 95% de confiabilidad.
Fase de aclimatación
Las plántulas completas obtenidas en este proceso, se sembraron en bandejas de germinación con turba canadiense y se colocaron en condiciones de invernadero con reducción del 50% de luminosidad, 25°C y más del 80% de humedad relativa. Treinta días después se procedió a evaluar el porcentaje de aclimatación con base en el número de plántulas vivas en sustrato/ plántulas transferidas.
RESULTADOS Y DISCUSIÓN
El análisis de varianza para las variables número de brotes (NB), porcentaje de enraizamiento (R), porcentaje de formación de plántulas completas (FPC), mostró diferencias estadísticas altamente significativas en todas las fuentes de variación (Tab. 2).
Número de brotes (NB)
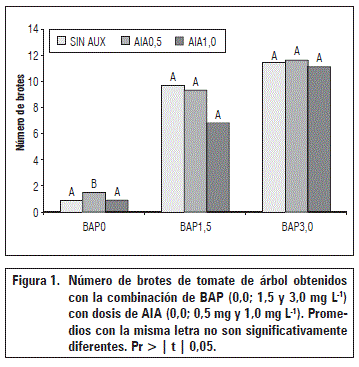
Los resultados del análisis de varianza indican que los tres factores inciden en forma diferente sobre la formación de brotes a partir de hipocotilos. La formación de brotes fue estimulada por la aplicación de BAP solo o combinado con AIA y totalmente inhibida por la inclusión de los fitorreguladores ANA y 2,4-D (Fig. 1). Estos resultados confirman que las citoquininas son hormonas claves para inducir la proliferación de brotes en diversos explantes in vitro (hojas, raíces, cotiledones) (Martínez et al., 2012); el desarrollo de un mayor número de brotes en el medio de cultivo con BAP coincide con lo reportado por Correia y Canhoto (2012) y puede asociarse con un mayor estímulo de procesos fisiológicos del desarrollo, regulados por la interacción y balance entre los fitorreguladores adicionados al medio, según lo manifiestan Aremu et al. (2014).
La incorporación de ANA y de 2,4-D, inhibió la formación de brotes de tomate de árbol a partir de hipocotilos, mientras que el testigo sin auxinas presentó un promedio de 0,9 brotes por frasco. El medio de cultivo con 0,5 mg L-1 de AIA, incrementó la formación de brotes (1,5 brotes) con diferencias estadísticas respecto al testigo y a la incorporación de 1,0 mg L-1 de AIA, los cuales presentaron un promedio de 0,9 brotes (Fig. 1).
Sin la adición de ANA y 2,4-D, la incorporación de BAP (1,5 mg L-1 y 3,0 mg L-1), indujo los mayores incrementos en la formación de brotes a partir de hipocotilos de tomate de árbol. La combinación de BAP con AIA, no fue efectiva en la brotación; con BAP (1,5 mg L-1), la formación de brotes se redujo de 9,7 brotes sin AIA, a 9,3 brotes con 0,5 mg L-1 de AIA y a 6,8 brotes con 1,0 mg L-1 de AIA., sin diferencias estadísticas (Fig. 1). Con la mayor dosis de BAP (3,0 mg L-1), la brotación fue de 11,4 brotes, que se mantuvo al adicionar AIA (0,5 mg L-1) con 11,6 brotes y 11,1 brotes con la dosis de 1,0 mg L-1, sin diferencias estadísticas entre ellos (Fig. 1). Los brotes obtenidos a partir de hipocotilos de tomate de árbol en un medio MS con BAP y BAP+AIA estuvieron listos para su enraizamiento entre los 45 y 60 d después de la siembra.
Resultados similares reportaron Obando y Jordán (2001) con hipocotilos de tomate de árbol en presencia de TDZ (Tidiazuron), solo o combinado con AIA, que inducían inicialmente callos y posteriormente brotes, los cuales se formaron 4-5 semanas después de iniciado el cultivo; mejores resultados se obtuvieron con TDZ solo (93,3%), mientras que Contreras y Almeida (2003) encontraron que BAP+AIA indujo mayor brotación. De igual manera, Kurshid et al. (2008) indujeron embriones somáticos de Solanum melongena, a formar brotes en MS suplementado con 0,25 mg L-1 de BAP obteniendo un promedio de 46 brotes.
Se considera que en los cultivos in vitro, la inducción de organogénesis por efecto de citoquininas está encaminada a la formación de yemas, las cuales son obtenidas con base en una proporción de citoquinina alta con respecto a la auxina (Espinosa et al., 2005).
Porcentaje de enraizamiento (PE)
El análisis de varianza para la variable PE (Tab. 2) mostró diferencias estadísticas altamente significativas para todas las fuentes de variación con sus interacciones.
En general, se presentaron altos porcentajes de enraizamiento en medio de cultivo sin fitorreguladores y con la adición de AIA pero la formación de raíces se inhibió cuando el medio contenía el 2,4-D y ANA, presentándose el fenómeno de callogénesis. Estos resultados implican que los hipocotilos de tomate de árbol poseen contenidos adecuados de auxinas y que en esta especie el enraizamiento está determinado principalmente por el AIA y no por otras auxinas como lo afirman Quintero et al. (2003) y Uribe et al., (2012); los resultados de este mismo tratamiento con AIA contradicen a Litz y Jarret (1993), quienes indicaron que la adición de auxinas al medio de cultivo promueve la formación de callo, como sí ocurrió en el medio con dosis altas de 2,4-D y ANA.
La prueba de comparación de medias para BAP*auxinas* dosis, mostró que sin BAP (Fig. 2) las dosis 0,0 mg L-1, 0,5 mg L-1 y 1,0 mg L-1 de AIA indujeron una respuesta similar en el enraizamiento de 93, 100 y 93,3%, respectivamente. Con la aplicación 2,4-D y ANA se redujo significativamente el enraizamiento observado con el testigo sin aplicación de hormonas, cuyo porcentaje fue 93%.
Cuando se aplicó BAP (1,5 mg L-1) (Fig. 2), la inclusión de 2,4-D y ANA inhibió la formación de raíces, en comparación con BAP solo, con un promedio de enraizamiento del 6,6%. Por el contrario, la aplicación de AIA (0,5 mg L-1) mostró el mejor comportamiento con un promedio de 36,6% con diferencias estadísticas cuando se comparó con AIA (1,0 mg L-1) y con el testigo cuyos promedios fueron de 6,6 y 13,3%, respectivamente.
Con 3,0 mg.L-1 de BAP, el proceso de enraizamiento se inhibió completamente. Al respecto, Kaparakis y Alderson (2002) en un trabajo de embriogénesis somática en tomate (Lycopersicon esculentum) encontraron que dosis altas de BAP inhibieron la formación de raíces y produjeron tejidos aéreos con limitado crecimiento; según Lee (1974), parte de los efectos biológicos producidos por las citoquininas como el BAP, puede deberse a que inhiben la actividad, distribución y composición del AIA. Así mismo, Pedroza-Manrique (2009) afirma que altas concentraciones de citoquininas (0-10 mg L-1) inhiben la formación de raíces y el efecto promotor de otros fitorreguladores (Elias et al., 2015). Por esta razón, estos reguladores se omiten en el cultivo de tejidos cuando se requiere el enraizamiento de brotes, o se requiere de varios subcultivos en medio libre de citoquininas antes de iniciar el enraizamiento.
Porcentaje de formación de plantas completas (FPC)
El análisis de varianza para la variable FPC (Tab. 2), mostró diferencias altamente significativas para todos los factores individuales y sus interacciones.
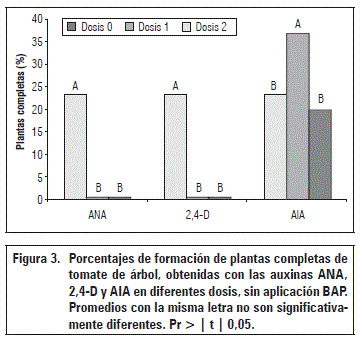
La formación de plántulas completas se presentó en el testigo sin reguladores y con AIA en el medio MS. En la micropropagación de plantas, el efecto principal de las auxinas es la formación de raíces y crecimiento de callos (Gonzales, 2003), procesos que se presentan de acuerdo con el tipo y concentración del fitorregulador que se utilice (Smith, 2012).
Sin BAP, la aplicación de AIA (0,5 mg L-1) indujo el mayor porcentaje de plántulas completas (36,9%); sin AIA y con AIA (1,0 mg L-1), los promedios fueron 23,3 y 19,97%, respectivamente (Fig. 3). Ningún tratamiento con inclusión de BAP condujo a la formación de plantas completas.
Chacón et al. (2013) al evaluar diferentes medios de cultivo para tomate de árbol, encontraron la mejor respuesta en la obtención de raíz y tallo in vitro con los medios de cultivo MS suplementados con 6,0 g L-1 de agar y 3% de sacarosa y con 8,0 g L-1 de agar y 3% de sacarosa, los cuales mostraron menor tiempo de enraizamiento, mayor número de raíces y mayor longitud promedio de raíz y tallo.
Cuando se aplicó 2,4 D (1,5 g L-1 y 3,0 g L-1) y ANA (3,0 g L-1 y 6,0 g L-1) no se presentó formación de plántulas, con diferencias estadísticas significativas al compararse con el testigo sin fitorreguladores.
Cuando se aplicó BAP (1,5 g L-1 y 3,0 g L-1) con auxinas en cualquiera de sus dosis, no hubo formación de plántulas completas.
Porcentaje de enraizamiento de brotes
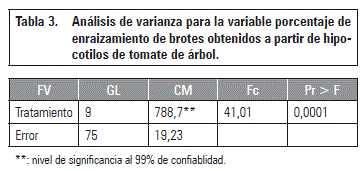
Teniendo en cuenta que la eficiencia en la multiplicación de plantas pasa por inducir un alto número de brotes para posteriormente enraizarlos, se procedió a la formación de plantas completas a partir de los brotes obtenidos en los tratamientos anteriormente evaluados. En la tabla 3 se muestra el análisis de varianza para esta variable. En esta variable se presentaron diferencias estadísticas altamente significativas.
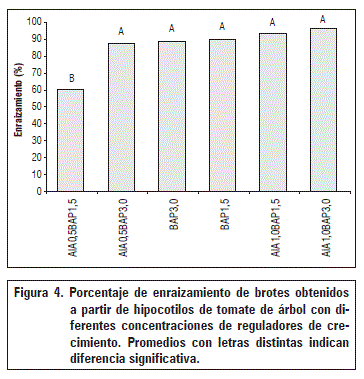
En la figura 4 se presenta el enraizamiento de los brotes provenientes de explantes de hipocotilos sembrados con diferentes combinaciones hormonales; los mayores enraizamientos se obtuvieron con brotes obtenidos en el medio MS con la inclusión de AIA 1 mg L-1 + BAP 3 mg L-1, con un porcentaje de 96,23%. Cuando los brotes provenían de los tratamientos AIA 0,5 mg L-1 + BAP 3 mg L-1, BAP 3 mg L-1, BAP 1,5 mg L-1, AIA 1,0 mg L-1 + BAP 1,5 mg L-1, los enraizamientos oscilaron entre 87,2 y 93,3%, sin diferencias estadísticas (P>0,05) entre ellos. Los menores enraizamientos de brotes se observaron en aquellos provenientes de la combinación de AIA (0,5 mg L-1) y BAP (1,5 mg L-1), con diferencias estadísticas respecto a los demás tratamientos (Fig. 4).
Fase de aclimatación
Se obtuvieron plantas completas, regeneradas a partir de hipocotilos con un 96,6% de supervivencia. La aclimatación es un factor importante en la posterior supervivencia de la planta, ya que es una etapa crítica dentro del proceso, en la que se produce la mayor pérdida de plantas; fue importante en este trabajo la reducción gradual de la humedad relativa, lo cual permite el endurecimiento de la cutícula y disminuye la pérdida de agua; por otra parte, se comprobó que para tener mejores resultados en el establecimiento in vivo es necesario el desarrollo radicular in vitro (Flores et al., 2012).
CONCLUSIONES
El mejor medio de cultivo para la proliferación de brotes de tomate de árbol a partir de hipocotilos estuvo constituido por el medio básico MS suplementado con BAP (3 mg L-1) solo o con AIA (0,5 mg L-1) y AIA (1,0 mg L-1).
El fitorregulador AIA se comportó como el más efectivo para la inducción de enraizamiento en explantes de hipocotilos de tomate de árbol sembrados en MS; por el contrario, la inclusión de BAP en el medio, inhibió el enraizamiento de los explantes.
Los brotes generados in vitro a partir de los tratamientos con BAP y con la combinación de BAP + AIA (0,5 mg L-1 y 1,0 mg L-1) mostraron altos porcentajes de enraizamiento en un medio MS con AG3 (0,5 mg L-1).
Las plantas de tomate de árbol regeneradas in vitro obtenidas a partir de hipocotilos, tienen altos porcentajes de supervivencia, obteniéndose plantas vigorosas en invernadero.
AGRADECIMIENTOS
Al grupo de Investigación en Producción de Frutales Andinos por todo el apoyo y colaboración prestada.
REFERENCIAS BIBLIOGRÁFICAS
Apraez, J., J. Romo y T. Lagos. 2012. Regeneracion de plantas de tomate de árbol (Cyphomandra betacea (Cav.) Sendt.) mediante organogénesis inducida a partir de callos. Rev. Cienc. Agric. 29(2), 108-115. [ Links ]
Aremu, A., L. Placková, M. Bairu, O. Novák, L. Szücová, K. Dolezal, J. Finnie y J. Staden. 2014. Endogenous cytokinin profiles of tissue-cultured and acclimatized ‘Williams’ bananas subjected to different aromatic cytokinin treatments. Plant Sci. 214, 88-98. Doi: 10.1016/j.plantsci.2013.09.012
Ashrafuzzaman, M., M. Hossain, M. Razi y S. Shahidul. 2009. Regeneration potential of seedling explants of chilli (Capsicum annuum). Afr. J. Biotechnol. 18(1), 591-596. [ Links ]
Bonnet, J.G. y J.F. Cárdenas. 2012. Tomate de árbol (Cyphomandra betacea Sendt.). pp. 825-850. En: Fischer, G. (ed.). Manual para el cultivo de frutales en el trópico. Produmedios, Bogotá [ Links ].
Cadena, E. 2006. Estudio de prefactibilidad para el tomate de árbol. Technical report. SICA, Ministerio de Agricultura y Ganadería del Ecuador, Quito. [ Links ]
Calva, G. y J. Pérez. 2005. Cultivo de células y tejidos vegetales. Rev. Digital Univ. 6(11), 1-16. [ Links ]
Castro, J. y D. Florez. 2007. Establecimiento in vitro y pruebas preliminares de micropropagación en medio semisólido y líquido de frambuesa (Rubus idaeus L.). Tecnol. Marcha. 20(3), 46-54 [ Links ]
Contreras, I. y J. Almeida. 2003. Micropropagación del Tomate de Árbol (Cyphomandra betacea (Cav.) Sendtn.), Solanaceae silvestre usada en la alimentación humana. Rev. For. 47(2), 9-13. [ Links ]
Chacón, R., D. Mora, L. Marchena, A. Schmidt y C. Ulloa. 2013. Cultivo in vitro del tomate de árbol (Cyphomandra betacea (Cav.) Sendt. (Fenotipo naranja) proveniente de Costa Rica. Rev. VI Encuentro Investig. 6(4), 45-55. [ Links ]
Contreras, I. y J. Almeida. 2003. Micropropagación del tomate de árbol (Cyphomandra betacea (Cav.) Sendtn.), Solanaceae silvestre usada en la alimentación humana. Rev. For. Venez. 47(2), 9-13. [ Links ]
Correia, S. y J. Canhoto. 2012. Biotechnology of tamarillo (Cyphomandra betacea): From in vitro cloning to genetic transformation. Sci. Hortic. 148, 161-168. Doi: 10.1016/j.scienta.2012.09.037 [ Links ]
Elias, H., R. Taha, N. Hasbullah, N. Mohamed, A. Manan, N. Mahmad y S. Mohajer. 2015. The effects of plant growth regulators on shoot formation, regeneration and coloured callus production in Echinocereus cinerascens in vitro. Plant Cell Tiss. Organ Cult. 120, 729-739. Doi: 10.1007/s11240-014-0642-x [ Links ]
Espinosa, J., O. Trillos, L. Afanador y G. Correa. 2005. Potencial de propagación in vitro de tomate de árbol partenocarpico (Cyphomandra betacea Cav.). Rev. Fac. Nal. Agr. Medellín 58(2), 2685-2695. [ Links ]
Ferl, R. y A. Paul. 2000. Genome organization and expression. pp. 312-357. En: Buchanan B., W. Gruissem y R. Jones. (eds.). Biochemistry and molecular biology of plants. American Society of Plant Physiologists, Rockville, MD. [ Links ]
Flores, D., R. Chacón, V. Jiménez y F. Ortiz. 2012. Enraizamiento de mora (Rubus adenotrichus) en medio líquido en el sistema de inmersión temporal y su aclimatación en invernadero. Tecnol. Marcha 4(25), 3-9. Doi: 10.18845/tm.v25i2.300 [ Links ]
Gonzales, S. 2003. Medios de cultivo. Departamento de Biología Vegetal, Facultad de Biología, Universidad de la Habana, La Habana. [ Links ]
Guimarães, M., M. Tomé y G. Cruz. 1996. Cyphomandra betacea (Cav.) Sendt. (tamarillo). Biotecnol. Agr. For. 35(4), 120-137. [ Links ]
Hoyos, J., C. Perea y R. Velasco. 2008. Evaluación del efecto de diferentes concentraciones de fitohormonas. en la micropropagación del plátano Dominico Hartón (Musa AAB Simmonds). Fac. Cienc. Agropec. 6(2), 99-104 [ Links ]
Hu, G., Y. Dong, Z. Zhang, X. Fan, F. Ren y J. Zhou. 2015. Virus elimination from in vitro apple by thermotherapy combined with chemotherapy. Plant Cell Tiss. Organ Cult. 121, 435-443. Doi: 10.1007/s11240-015-0714-6 [ Links ]
Kaparakis, G. y P. Alderson. 2002. Influence of high concentrations of cytokinins on the production of somatic embryos by germinating seeds of tomato, aubergine and pepper. J. Hort. Sci. Biotechnol. 77, 186-190. Doi: 10.1080/14620316.2002.11511477 [ Links ]
Kothari, S., A. Joshi, S. Kachhwaha y N. Ochoa. 2010. Chilli peppers. A review on tissue culture and transgenesis. Biotechnol. Adv. 28, 35-48. Doi: 10.1016/j.biotechadv.2009.08.005 [ Links ]
Kurshid, A., A. Singh, S. Jaadep y S. Satbir. 2008 Genotype, explant and culture medium effects on somatic embryogenesis in eggplant (Solanum melogena L). Genet. Biotechnol. 49(3), 182-187. [ Links ]
Lasso, M. 2007. Propuesta para la creación de una cooperativa comercializadora de productos derivados del tomate de árbol orgánicos en el municipio de Funes de Nariño, Colombia. Trabajo de grado. Universidad de Nariño, Pasto, Colombia. [ Links ]
Lee, T. 1974. Cytokinin control in subcellular localization of indoleacetic acid oxidase and peroxidase. Phytochem. 13, 2445-2453. Doi: 10.1016/S0031-9422(00)86919-8 [ Links ]
Litz, R.E. y R.L. Jarret. 1993. Regeneración de plantas en el cultivo de tejidos: Embriogénesis somática y organogénesis. pp. 143-172. En: Roca, W.M. y L.A. Mroginski (eds.). Cultivo de tejidos en la agricultura: Fundamentos y aplicaciones. Centro Internacional de Agricultura Tropical (CIAT), Cali, Colombia. [ Links ]
Martínez, S., R. Gómez, L. Posada, R. Barbón, M. Acosta, M. Reyes, M. Pérez, D. Torres, M. Pons, M. Cárdenas, A. Aguilera y M. Tejeda. 2012. Efecto de dos citoquininas, ácido ascórbico y sacarosa en la obtención de plantas in vitro de Sorghum bicolor para la formación de callos. Rev. Colomb. Biotecnol. 14(2), 101-110. [ Links ]
Moshkov, I., G. Novikova, M. Hall y E. George. 2008. Plant growth regulators III: gibberellins, ethylene, abscisic acid, their analogues and inhibitors. pp. 227-282. En: George, E., M.A. Hall y G. De Klerk (eds). Plant propagation by tissue culture. 3rd ed. Springer, Dordrecht, The Netherlands. [ Links ]
Murashige, T. y F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Plant Physiol. 15, 473-497. Doi: 10.1111/j.1399-3054.1962.tb08052.x [ Links ]
Obando, M. y M. Jordan. 2001. Regenerative responses of Cyphomandra betacea (Cav.) Sendt. (Tamarillo) cultivated in vitro. Acta Hortic. 560, 429-432. Doi: 10.17660/ActaHortic.2001.560.83 [ Links ]
Pedroza-Manrique, J. 2009. Efecto del carbón activado, ácido indolacético (AIA) y bencil amino purina (BAP) en el desarrollo de protocormos de Epidendrum elongatum Jacq bajo condiciones in vitro. Rev. Colomb. Biotecnol. 11(1), 17-32 [ Links ]
Pringle, G. y B. Murray. 1991 Interspecific hybridization involving the tamarillo, Cyphomandra betacea (Cav.) Sendt. (Solanacea). New Zeal. J. Crop Hort. Sci. 19, 103-111. Doi: 10.1080/01140671.1991.10421787 [ Links ]
Quintero, I., J. Polo, A. Jarma y A. Espitia. 2003. Enraizamiento in vitro de Dioscoreas sp. Rev. Colomb. Biotecnol. 5(2), 51-56. [ Links ]
Rathore, M., S. Yadav, P. Yadav, J. Kheni y B. Jha. 2015. Micropropagation of elite genotype of Jatropha curcas L. through enhanced axillary bud proliferation and ex vitro rooting. Biomass Bioenergy 83, 501-510. Doi: 10.1016/j.biombioe.2015.10.023 [ Links ]
Rout, G. y S. Mohapatra. 2006. Tissue culture of ornamental pot plant: A critical review on present scenario and future prospects. Biotechnol. Adv. 24, 531-560. Doi: 10.1016/j.biotechadv.2006.05.001 [ Links ]
Smith, R. 2000. Plant tissue culture. 3rd ed. Academic Press, New York, NY. [ Links ]
Tafur, R. 2006. Propuesta frutícola para Colombia y su impacto en la actividad económica, nacional, regional y departamental. pp. 47-66. En: Memorias Primer Congreso Colombiano de Horticultura, Sociedad Colombiana de Ciencias Hortícolas, Bogotá [ Links ].
Twyman, R., E. Stoger, S. Schillberg, P. Christou y R. Fischer. 2003. Molecular farming in plants: host systems and expression technology. Trends Biotechnol. 21(12), 570-578. Doi: 10.1016/j.tibtech.2003.10.002 [ Links ]
Uribe, M., J. Ulloa, C. Delaveau, K. Sáez, F. Muñoz y P. Cartes. 2012. Influencia de las auxinas sobre el enraizamiento in vitro de microtallos de Nothofagus glauca (Phil.) Krasser. Gayana Bot. 69(1), 105-112. Doi: 10.4067/S0717-66432012000100010 [ Links ]