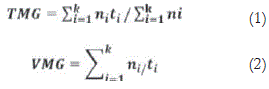Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Hortícolas
Print version ISSN 2011-2173
rev.colomb.cienc.hortic. vol.10 no.2 Bogotá July/Dec. 2016
https://doi.org/10.17584/rcch.2016v10i2.5791
Doi: http://dx.doi.org/10.17584/rcch.2016v10i2.5791
1 Escuela de Ciencias Agrícolas, Pecuarias y del Medio Ambiente, Universidad Nacional Abierta y a Distancia (UNAD), Bogotá (Colombia).
2 Facultad de Ciencias Agrarias, Departamento de Agronomía, Universidad Nacional de Colombia, Bogotá (Colombia).
3 Autor para correspondencia: carlos.carranza@unad.edu.co
Fecha de recepción: 10-10-2016. Aprobado para publicación: 24-11-2016.
RESUMEN
La badea es una de las frutas priorizadas por la cadena de pasifloras debido a su potencial de exportación. Las semillas de esta especie presentan una baja germinación, por lo que se requiere un mayor número de semillas para cumplir con los pedidos de los viveristas y, por ende, se tiene una baja eficiencia en la producción de plántulas. Investigaciones sobre el tema han encontrado estimulación en la germinación con la aplicación de fitorreguladores de crecimiento como el ácido giberélico, ácido indulbutirico, zeatina, ethephon y KNO3. El objetivo del estudio fue evaluar el efecto de la aplicación exógena de reguladores de crecimiento sobre la germinación de semillas de badea en condiciones de invernadero. Los tratamientos consistieron en la aplicación de los siguientes reguladores de crecimiento: ácido giberélico (400, 800 y 1.200 ppm), ácido indolbutirico (200, 400 y 600 ppm), zeatina (0,5; 1 y 2 ppm), ethephon (100, 200 y 300 ppm), KNO3 (0,4; 0,6 y 0,8% p/v) y un testigo. Las semillas fueron establecidas en bandejas de germinación con sustrato turbia rubia. Se evaluó el porcentaje de germinación (PG), el tiempo medio de germinación (TMG) y la velocidad media de germinación (VMG). La aplicación de 1.200 ppm de AG3 y nitrato de potasio al 0,4% presentaron los mayores porcentajes de germinación con 54,5 y 59% respectivamente, disminuyendo el tiempo medio de germinación con 29,4 y 30,3 días y aumentando la velocidad de germinación de la semilla de badea con 6,55 y 6,39 semillas/día. Estos resultados contribuirán a mejorar la eficiencia de los procesos de reproducción sexual desarrollados por los viveristas que propagan badea en Colombia.
Palabras clave adicionales: Passifloraceae, ácido giberélico, nitrato de potasio, exportación.
ABSTRACT
Badea is one of the fruits prioritized by the passifloras chain due to its export potential. The seed of this species presents a low germination, leading to require a greater number of seeds and therefore a low efficiency in the production of seedlings. It has been found stimulation in germination with the application of growth regulators with gibberellic acid, indulbutyric acid, zeatin, ethephon and KNO3. The objective of the study was to evaluate the effect of the exogenous application of growth regulators on the germination of badea seeds in greenhouse conditions. The treatments consisted in the application of the following growth regulators: gibberellic acid (400, 800 and 1,200 ppm), indole butyric acid (200, 400 and 600 ppm), zeatin (0.5, 1 and 2 ppm), ethephon (100, 200 and 300 ppm), KNO3 (0.4, 0.6 and 0.8% w/v) and a control. The seeds were established in germination trays with a blonde peat substrate. The percentage of germination (PG), the mean germination time (MGT) and the mean germination rate (MGR) were evaluated. The results showed significant differences within the percentages of germination and the application of 1,200 ppm GA3 and 0.4% potassium nitrate with 54.5% and 59% respectively, the average germination time decreased to 29.4 and 30.3 days and the speed of germination of the badea seed increased to 6.55 and 6.39 seeds/day, respectively. These results will contribute to enhance the application methods with the nurserymen in the propagation of badea in Colombia.
Additional key words: Passifloraceae, gibberellic acid, potassium nitrate, promissory crop, exports.
INTRODUCCIÓN
Entre las especies de pasifloras en Colombia, la badea (Passiflora quadrangularis L.) se encuentra priorizada por el Ministerio de Agricultura y Desarrollo Rural como fruta promisoria para exportación por su aceptación como fruta fresca, jugos y aperitivos dentro de las frutas tropicales. De acuerdo con la FAO (2005), el fruto de badea presenta unas características de aroma agradable con un sabor dulce y a la vez ligeramente ácido característico de la fruta. El aroma de la badea es dado principalmente por la sustancia geraniol (Montero et al., 2016). En 2013, se presentó en Colombia un área sembrada de 431 ha con una producción de 3.881 t y rendimiento de 14,8 t ha-1 (MADR, 2015).
Las hormonas de las plantas incluyen ABA, etileno, auxinas, citoquininas, giberélinas y brasinoestoroides son sustancias químicas que controlan muchos procesos fisiológicos y bioquímicos en plantas (Miransari y Smith, 2014), pueden afectar diferentes actividades en las plantas incluyendo la latencia y germinación de las semillas (Graeber et al., 2012).
La germinación de semillas es un proceso en el cual se generan cambios morfológicos y fisiológicos que terminan en el crecimiento del embrión (Miransari y Smith, 2014). La germinación requiere de condiciones específicas de temperatura, niveles de oxígeno y luz, con las proporciones adecuadas para cada especie (Corbineau et al., 2014). La semilla absorbe agua, lo que resulta en expansión y elongación del embrión. Cuando la radícula crece fuera de la testa el proceso de germinación ha terminado (Hermann et al., 2007).
Los compuestos nitrogenados pueden mejorar la germinación de las semillas en condiciones de salinidad incrementando la absorción de K por ajuste en la relación K+/Na+ y un incremento en la producción de ATP y en la respiración en las semillas (Zheng et al., 2009).
La latencia es un mecanismo en el cual las semillas pueden inhibir su germinación, siendo el embrión viable y con las condiciones ambientales favorables. La latencia primaria en algunas ocasiones es causada por el efecto del ácido abscísico durante el desarrollo de la semilla (Miransari y Smith, 2014) las cuales no pueden germinar (Bewley, 1997). La latencia es un rasgo hereditario, pero su intensidad en la cosecha y su mantenimiento después de la cosecha es regulada por las condiciones ambientales durante el desarrollo y maduración de semillas en la planta y durante el almacenamiento de semillas (Bewley, 1997). Los parámetros más importantes que controlan el proceso de latencia en semillas, son cambios a nivel molecular, incluyendo alteraciones de proteínas y alteración hormonal y el balance entre ABA y giberélinas (Ali-Rachedi et al., 2004; Finch-Savage y Leubner-Metzger 2006; Finkelstein et al., 2008; Graeber et al., 2010). La latencia de las semillas está bajo la influencia de las hormonas de las plantas, y de las características morfológicas y estructurales de la semilla, tal como, el endospermo, pericarpio del fruto y propiedades de la cubierta seminal (Kucera et al., 2005).
Las giberélinas son importantes para activar semillas latentes, aunque la hormona no controla la latencia de la semilla (Bewley, 1997; Miransari y Smith, 2009). El ABA puede inhibir la germinación en maíz por afectación en el ciclo celular (Miransari y Smith, 2014). Por afectar el balance hormonal en la semilla, los parámetros ambientales incluyendo la salinidad, la acidez, la temperatura y la luz, pueden influenciar la germinación de las semillas (Ali-Rachedi et al., 2004; Alboresi et al., 2006).
El ABA y las giberélinas son necesarias para la iniciación de la latencia y la germinación de las semillas, respectivamente (Groot y Karssen, 1992; Matilla y Matilla-Vázquez, 2008). El balance giberélinas/ABA determina la habilidad de las semillas para germinar o las vías necesarias para la germinación (White et al., 2000; White y Rivin, 2000; Chibani et al., 2006; Finch-Savage y Leubner-Metzger, 2006). El N puede inhibir la latencia en la semilla al disminuir los niveles de ABA en la semilla (Ali-Rachedi et al., 2004; Finkelstein et al., 2008).
De acuerdo con Nascimiento (2000), el etileno estimula la germinación de semillas y supera la latencia en varias especies. Puede interactuar con la luz y las giberelinas para promover la germinación de semillas de alfalfa.
El etileno y las giberélinas afectan el crecimiento de la radícula (Miransari y Smith, 2014). Por otro lado, se ha encontrado que las auxinas presentes en la punta de la radícula de las semillas durante y después de la germinación, estimulan un rápido crecimiento de las plántulas (Hentrich et al., 2013). Las auxinas acumuladas en los cotiledones de semillas, son la mayor fuente de auxina durante el crecimiento de las plántulas (Miransari y Smith, 2014). Aunque las auxinas por sí solas no son importantes para la germinación de semillas, su interacción y cruce con las giberelinas y el etileno puede influenciar los procesos de germinación de semillas y establecimiento (Fu y Harberd, 2003; Chiwocha et al., 2005).
Las giberelinas son necesarias para la producción de la enzima mananasa, la cual es necesaria para la germinación de la semilla (Wang et al., 2005). Sin embargo, en mutantes deficientes en giberelinas, el etileno puede actuar de manera similar a las giberelinas y las semillas son capaces de germinar completamente en tal situación (Karssen et al., 1989; Matilla y Matilla-Vázquez, 2008).
Las citoquininas son hormonas de crecimiento que regulan un amplio rango de comportamientos en la planta incluyendo la germinación de las semillas. Pueden mejorar la germinación de las semillas y ayudan a aliviar el estrés generado por la salinidad, la sequía, los metales pesados y el estrés oxidativo (Khan y Ungar, 1997; Atici et al., 2005; Nikolic et al., 2006; Peleg y Blumwald, 2011).
Las semillas de badea presentan una baja germinación alrededor del 30% de acuerdo con informaciones suministradas por técnicos y viveristas del departamento del Huila. Puede estar asociada a problemas de latencia exógena (física y mecánica) o fisiológica por altas concentraciones de ácido abscísico (ABA). Esto conlleva a los viveristas a utilizar una mayor cantidad de semillas, para suplir los requerimientos de plántulas solicitadas por productores de badea en Neiva, Rivera y otros municipios pequeños productores de esta fruta, generando retrasos en la entrega de plántulas y en la siembra de la plantación de badea.
El objetivo del estudio fue evaluar el efecto de la aplicación exógena de reguladores de crecimiento sobre la germinación de semillas de badea en condiciones de invernadero.
MATERIALES Y MÉTODOS
Ubicación
El ensayo se realizó en el invernadero de la Corporación CEPASS Colombia, ubicado en el municipio de La Plata (Huila). Los frutos fueron recolectados en fincas de productores en el municipio de Neiva y llevados al Laboratorio de Biología y Microbiología de la Universidad Nacional Abierta y a Distancia en Bogotá, se extrajeron las semillas y se dejaron fermentar durante 72 h a temperatura ambiente.
Tratamientos y diseño experimental
Los tratamientos consistieron en la aplicación de los siguientes fitorreguladores de crecimiento: ácido giberélico ≥90% marca SIGMA® (400, 800 y 1.200 ppm), ácido indolbutirico ≥99% marca SIGMA® (200, 400 y 600 ppm), zeatina ≥95% marca SIGMA® (0,5, 1 y 2 ppm), ethephon (Ethrel®) (100, 200 y 300 ppm), KNO3 ≥95% marca SIGMA® (0,4; 0,6 y 0,8% p/v) y un testigo (semillas germinadas con agua destilada). Se estableció en un diseño experimental completamente al azar con cuatro repeticiones, la unidad experimental estuvo conformada por 100 semillas.
Las semillas fueron imbibidas en los fitorreguladores a temperatura ambiente por un tiempo de 48 h y sembradas en sustrato turba rubia sin nutrientes (Klasman®), en bandejas plásticas de 50 alveolos. Se colocaron en un cuarto oscuro recubierto de plástico negro. Los datos de temperatura y humedad relativa del aire se registraron con un datalogger (marca Extech Instruments®). En el cuarto oscuro se presentó una temperatura promedia de 25,2°C y una humedad relativa aire de 92,87%, con un delta de temperatura entre el día y la noche de 15°C. Las bandejas fueron retiradas del cuarto oscuro a los 11 días después de la siembra (dds) cuando las semillas alcanzaron un 30% de emergencia visible en la superficie del sustrato para así evitar etiolación en las plántulas y siguiendo las condiciones para la producción de plántulas, las bandejas se llevaron a un invernadero por tiempo de 40 días con una temperatura promedia de 24,6°C y humedad relativa promedia de 71,4%.
Variables medidas
Se realizó la toma de datos con una frecuencia de 3 d donde se registró el número de semillas germinadas, durante 51 d. Con los datos del muestreo en el tiempo se determinaron los índices: tiempo medio de germinación (TMG) y velocidad media de germinación (VMG), siguiendo las ecuaciones (1) y (2), respectivamente.
Donde:
ni = número de semillas germinadas en la iésima toma de datos,
ti = tiempo (d) de la iésima toma de datos,
K = tiempo (d) de duración de la prueba de germinación,
tomado de Ranal y Santana (2006) y Anjum y Bajwa (2005).
El porcentaje de germinación (PG) se tomó como la sumatoria de todas las semillas germinadas en los días del muestreo sobre el total de semillas puestas en la caja de Petri (Anjum y Bajwa, 2005; Ranal y Santana, 2006).
Análisis estadístico
Se realizó un análisis de varianza (ANOVA) y se aplicó la prueba de comparación múltiple de promedios de Tukey con una confiabilidad del 95%. Para el procesamiento de los datos se utilizó el paquete estadístico SAS v. 9.2.
RESULTADOS Y DISCUSIÓN
Porcentaje de germinación
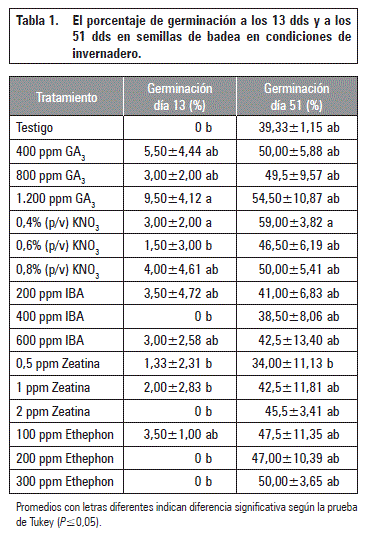
De acuerdo con las condiciones ambientales descritas para el cuarto oscuro y para el invernadero las semillas iniciaron germinación después de los 11 d de aplicados los tratamientos. En la tabla 1, se presentan los resultados de los tratamientos pregerminativos sobre el porcentaje de germinación (PG), de semillas de badea. A los 13 dds la AG3 a 1.200 ppm y el nitrato de potasio 0,4% p/v tuvieron significativamente mayores porcentajes de germinación: (9,5 y 3%, respectivamente) en comparación con los tratamientos Zeatina 0,5, 1 y 2 ppm, Etephon 200 y 300 ppm, IBA 400 ppm, nitrato de potasio 0,6% p/v y el testigo.
A los 51 dds el mayor PG de las semillas fue de 59% con el tratamiento con KNO3 al 0,4% (p/v) seguido por el tratamiento GA3 1.200 ppm con 54,5%. Los tratamientos con menor PG fueron Zeatina al 0,5 ppm con el 34% y el testigo con 39%. Aunque estos tratamientos no tuvieron diferencias significativas con el testigo en el último muestreo, en la figura 1 se observa que durante todo el muestreo las semillas tratadas tuvieron mayores PG promedios que el testigo. La baja germinación de las semillas en todos los tratamientos se puede relacionar con presencia de latencia física y fisiológica en las semillas, de acuerdo con Ellis et al. (1985) han reportado que las semillas de pasifloras tienen latencia exógena, que es una combinación de latencia mecánica (cubierta seminal restringe el crecimiento radicular) y química (inhibidores en la cubierta seminal), por lo cual las semillas tienden a presentar una baja germinación. Para el caso de las semillas de badea no se observó rompimiento de la testa, por lo tanto, se expresa una latencia combinada entre mecánica y fisiológica en el cual con la aplicación exógena de AG3 contribuyó con una mayor germinación.
El efecto del KNO3 sobre la germinación se puede atribuir a que ayuda a romper la latencia en las semillas de badea incrementando la germinación en un 33% con relación al testigo. Los nitratos han sido reportados por varios autores como Nonogaki et al. (2010) que los nitratos también podrían estimular la germinación a través de otras vías, como las implicadas en el metabolismo de las hormonas o después de haber sido reducidos a nitrito, pudiendo acelerar el flujo metabólico a través de la vía de las pentosas fosfato al incrementar indirectamente la oxidación de NADPH actuando, así como un componente importante de traducción de señales.
Tiempo medio de germinación
El tiempo medio de germinación TMG (Tab. 2) fue significativamente menor en los tratamientos con 1.200 ppm AG3 y KNO3. Los tratamientos con mayores TMG fueron los tratamientos con Etephon 4,68±0,92 d correspondientes a la concentración de 100 ppm. La cantidad de etileno incrementa durante la germinación de muchas semillas de plantas incluyendo trigo, maíz, soya y arroz, afectando la tasa de germinación (Pennazio y Roggero, 1991; Zapata et al., 2004). Algunos estudios indican que durante la etapa final de la germinación de las semillas el etileno es producido en diferentes especies de plantas y puede contribuir a la germinación de las semillas después de la latencia (Miransari y Smith, 2014). También se puede considerar en la respuesta un mecanismo por el cual el etileno inhibe el efecto adverso del ABA sobre la latencia de la semilla puede ser atribuido a la producción de OH en el apoplasma (Chen, 2008; Muller et al., 2009; Graeber et al., 2010). En el experimento las semillas presentaron un mayor TMG con la aplicación de Etephon, lo cual para el caso de la badea si estimula la germinación, pero con un mayor tiempo de germinación.
Velocidad media de germinación
Se presentó una mayor VMG (Tab. 2) con la aplicación exógena de 1.200 ppm de GA3 y 0,4% de KNO3 con 6,55 y 6,39 semillas/día respectivamente. En general las aplicaciones de IBA y etephon disminuyeron la velocidad media de germinación. Las menores VMG se obtuvieron con la aplicación de IBA 200, 400, y 600 ppm, y etephon a 200 y 300 ppm.
En otras pasifloras como la granadilla se han encontrado que concentraciones de 400 ppm de GA3 y KNO3 al 0,1% presentaron los mejores porcentajes de germinación (Cárdenas, 2011). El nitrato y las giberelinas son importantes para mejorar la germinación. El nitrato de potasio puede actuar sobre el funcionamiento del fitocromo en semillas fotoblásticas (Murdoch y Elis, 2002). El nitrato de potasio también puede actuar como fuente de N y potenciador en la germinación de semillas (Miransari y Smith, 2014). De acuerdo con Caldeira (1989) la acción del ion nitrato dentro de la planta: en primer lugar, estimula la producción endógena de etileno a partir de la reducción de nitratos a la metionina, la segunda explicación está relacionada con altas concentraciones de nitrato que puede causar estrés físico y químico, estimulando la producción endógena de etileno.
El NO3 se reduce para incorporar el N en aminoácidos y proteínas, siendo transformado en enzimas como el nitrito reductasa, nitrato reductasa y glutamina sintetasa. De igual forma, las giberelinas mejoran la germinación de semillas por inhibición de la actividad de ABA (Miransari y Smith, 2014). Esto es causado por la activación en el catabolismo de las enzimas e inhibición de las vías de biosíntesis relacionadas, lo que también disminuye las cantidades de ABA (Toyomasu et al., 1994; Atia et al., 2009).
Con la aplicación de zeatina se presentó una baja respuesta en la VMG con la respuesta de la citoquinina en la germinación de las semillas se encuentra atribuida a varias funciones de las citoquininas en diferentes tipos de células (Werner et al., 2001). Miransari y Smith (2014) indican que la aplicación de citoquinina N-6 benzil adenina disminuyó la respuesta de etileno en mutantes resistentes a ABA, lo que indica que no todos los efectos de la citoquinina sobre la germinación de semillas actúan sobre la actividad del etileno.
CONCLUSIONES
Los fitorreguladores de crecimiento giberelinas a 1.200 ppm y nitrato de potasio al 4% aumentaron el porcentaje y la velocidad de germinación de las semillas de badea.
AGRADECIMIENTOS
Los autores agradecen a la Universidad Nacional Abierta y a Distancia por la financiación del proyecto. A la Corporación CEPASS Huila por facilitar los invernaderos para el desarrollo del ensayo.
REFERENCIAS BIBLIOGRÁFICAS
Alboresi, A., C. Gestin, M.T. Leydecker, M. Bedu, C. Meyer y H.N. Truong. 2006. Nitrate a signal relieving seed dormancy in Arabidopsis. Plant Cell Environ. 28, 500-512. Doi: 10.1111/tpj.12186 [ Links ]
Ali-Rachedi, S., D. Bouinot, M.H. Wagner, M. Bonnet, B. Sotta, P. Grappin y M. Jullien. 2004. Changes in endogenous abscisic acid levels during dormancy reléase and maintenance of mature seeds: studies with the Cape Verde Islands ecotype the dormant model of Arabidopsis thaliana. Planta 219, 479-488. Doi: 10.1007/s00425-004-1251-4 [ Links ]
Anjum, T. y R. Bajwa. 2005. Importance of germination indices in interpretation of allelochemical effects. Intern. J. Agric. Biol. 7(3), 417-419. Doi: 1560-8530/2005/07-3-417-419 [ Links ]
Atia, A., A. Debez, Z. Barhoumi, A. Smaoui y C. Abdelly. 2009. ABA GA3, and nitrate may control seed germination of Crithmum maritimum (Apiaceae) under saline conditions. Com. Rend. Biol. 332, 704-710. Doi: 10.1016/j.crvi.2009.03.009 [ Links ]
Atici, O., G. Agar y P. Battal. 2005. Changes in phytohormone contents in chickpea seeds germinating under lead or zink stress. Biol. Plant. 49, 215-222. Doi: 10.1007/s10535-005-5222-9 [ Links ]
Bewley, J.D. 1997. Seed germination and dormancy. Plant Cell 9, 1055-1066. [ Links ]
Caldeira, M.L. 1989. Indução química do florescimento em manga. pp. 63-157. En: Anais Simpósio sobre Mangicultura 2. FUNEP, Jaboticabal, Brasil. [ Links ]
Corbineau, F., Q. Xia, C. Bailly y H. El-Maarouf-Bouteau. 2014. Ethylene, a key factor in the regulation of seed dormancy. Front. Plant Sci. 5, 1-13. Doi: 10.3389/fpls.2014.00539 [ Links ]
Chen, J., 2008. Heterotrimeric G-proteins in plant development. Front. Biosci. 13, 3321-3333. [ Links ]
Chibani, K., S. Ali-Rachedi, C. Job, D. Job, M. Jullien y P. Grappin. 2006. Proteomic analysis of seed dormancy in Arabidopsis. Plant Physiol. 142, 1493-1510. Doi: 10.1104/pp.106.087452 [ Links ]
Chiwocha, S.D., A.J. Cutler, S.R. Abrams, S.J. Ambrose, J. Yang, A.R. Ross y A.R. Kermode. 2005. The etr1- 2 mutation in Arabidopsis thaliana affects the abscisic acid, auxin, cytokinin and gibberellin metabolic pathways during maintenance of seed dormancy, moistchilling and germination. Plant J. 42, 35-48. Doi: 10.1111/j.1365-313X.2005.02359.x [ Links ]
Ellis, R., T. Hong y E. Roberts. 1985. Handbook of seed technology for genebanks. Vol. II: Compendium of specific germination. Information and test recommendations. International Board for Plant Genetic Resources (IBPGR), Roma. [ Links ]
FAO. 2005. Commodities and trade division, Food and Agriculture Organization of the United Nations, Roma. [ Links ]
Finch-Savage, W. y G. Leubner-Metzger. 2006. Seed dormancy and the control of germination. New Phytol. 171, 501-523. Doi: 10.1104/pp.106.087452 [ Links ]
Finkelstein, R., W. Reeves, T. Ariizumi y C. Steber. 2008. Molecular aspects of seed dormancy. Ann. Rev. Plant Biol. 59, 387-415. Doi: 10.1146/annurev.arplant.59.032607.092740 [ Links ]
Fu, X. y N.P. Harberd. 2003. Auxin promotes Arabidopsis root growth by modulating gibberellin response. Nature 421, 740-743. Doi: 10.1038/nature01387 [ Links ]
Graeber, K., A. Linkies, K. Muller, A. Wunchova, A. Rott y G. Leubner-Metzger. 2010. Cross-species approaches to seed dormancy and germination: conservation and biodiversity of ABA-regulated mechanisms and the Brassicaceae DOG1 genes. Plant Mol. Biol. 73, 67-87. Doi: 10.1007/s11103-009-9583-x [ Links ]
Graeber, K., K. Nakabayashi, E. Miatton, G. Leubner-Metzger y W. Soppe. 2012. Molecular mechanisms of seed dormancy. Plant Cell Environ. 35, 1769-1786. Doi: 10.1111/j.1365-3040.2012.02542.x [ Links ]
Groot, S.P.C. y C.M. Karssen. 1992. Dormancy and germination of abscisic acid deficient tomato seeds: studies with the sitiens mutant. Plant Physiol. 99, 952-958. Doi: 10.1104/pp.99.3.952 [ Links ]
Hermann, K., J. Meinhard, P. Dobrev, A. Linkies, B. Pesek, B. Heβ, I. Machackova, U. Fischer y G. Leubner-Metzger. 2007. 1-Aminocyclopropane-1-carboxylic acid and abscisic acid during the germination of sugar beet (Beta vulgaris L.) - A comparative study of fruits and seeds. J. Exp. Bot. 58, 3047-3060. Doi: 10.1093/jxb/erm162
Karssen, C.M., S. Zagórsky, J. Kepczynski y S.P.C. Groot. 1989. Key role for endogenous gibberellins in the control of seed germination. Ann. Bot. 63, 71-80. [ Links ]
Kenanoglu, B.B., I. Demir, K. Mavi, H. Yetisir y D. Keles. 2007. Effect of priming of germination of Lagenaria siceraria genotypes at low temperatures. Tarim Bilimleri Dergisi 12(3), 169-175. [ Links ]
Khan, A.A. y X.L. Huang. 1988. Synergistic enhancement of ethylene production and germination with kinetin and1-aminocyclopropane-1carboxylic acid in lettuce seeds exposed to salinity stress. Plant Physiol. 87, 847- 852. Doi: 10.1104/pp.87.4.847 [ Links ]
Khan, M.A. e I.A. Ungar. 1997. Alleviation of seed dormancy in the desert forb Zygophyllum simplex L. from Pakistan. Ann. Bot. 80, 395-400. Doi: 10.1006/anbo.1997.0449 [ Links ]
Kucera, B., M.A. Cohn y G. Leubner-Metzger. 2005. Plant hormone interactions during seed dormancy release and germination. Seed Sci. Res. 15, 281-307. Doi: 10.1079/SSR2005218 [ Links ]
Hentrich, M., C. Boettcher y P. Duchting. 2013. The jasmonic acid signaling pathway is linked to auxin homeostasis through the modulation of YUCCA8 and YUCCA9 gene expression. Plant J. 74, 626-637. Doi: 10.1111/tpj.12152 [ Links ]
MADR. 2015. Boletín cadena de pasifloras. En: Sistema de Información de Gestión y Desempeño de Organizaciones de Cadenas. Ministerio de Agricultura y Desarrollo Rural, Bogotá [ Links ].
Matilla, A.J. y M.A. Matilla-Vázquez. 2008. Involvement of ethylene in seed physiology. Plant Sci. 175, 87-97. Doi: 10.1016/j.plantsci.2008.01.014 [ Links ]
Miransari, M. y D.L. Smith. 2014. Plant hormones and seed germination. Environ. Exp. Bot. 99, 110-121. Doi: 10.1016/j.envexpbot.2013.11.005 [ Links ]
Montero, D.AV., M.O.M. Marques, L.M.M. Meletti, M.H. Van Kampen y S.C. Polozzi. 2016. Floral scent of Brazilian Passiflora: five species analised by dynamic headspace. Anais Acad. Bras. Ciênc. 88(3), 1191-1200. Doi: 10.1590/0001-3765201620150285 [ Links ]
Muller, K., A. Linkies, R.A.M Vreeburg, S.C. Fry, A. Krieger- Liszkay y G. Leubner-Metzger. 2009. In vivo cell wall loosening by hydroxyl radicals during cress (Lepidium sativum L.) seed germination and elongation growth. Plant Physiol. 150, 1855-1865. Doi: 101104/pp.109.139204 [ Links ]
Murdoch, A.J. y R.H. Ellis. 2000. Dormancy, viability and longevity. pp. 183-214. En: Ferner, M. (ed.). Seeds: the ecology of regeneration in plants communities. CAB Internacional, Wallingford, UK. Doi: 10.1079/9780851994321.0183 [ Links ]
Nascimento, W.M. 2000. Envolvimento do etileno na germinação de sementes. Rev. Bras. Fisiol. Veg. 12, 163-174. [ Links ]
Nikolic, R., N. Mitic, R. Miletic y M. Neskovic. 2006. Effects of cytokinins on in vitro seed germination and early seedling morphogenesis in Lotus corniculatus L. J. Plant Growth Regul. 25, 187-194. Doi: 10.1007/s00344-005-0129-4 [ Links ]
Nonogaki, H., G.W. Bassel y D. Bewley. 2010. Germination - still a mystery. Plant Sci. 179, 574-581. Doi: 10.1016/j.plantsci.2010.02.010 [ Links ]
Peleg, Z. y E. Blumwald. 2011. Hormone balance and abiotic stress tolerance in crop plants. Curr. Opin. Plant Biol. 14, 290-295. Doi: 10.1016/j.pbi.2011.02.001 [ Links ]
Pennazio, S. y P. Roggero. 1991. Effects of exogenous salicylate on basal and stress induced ethylene formation in soybean. Biol. Plant. 33, 58-65. Doi: 10.1007/BF02873789 [ Links ]
Ranal, M. y D.G. de Santana. 2006. How and why to measure the germination process? Rev. Bras. Bot. 29(1), 1-11. Doi: 10.1590/S0100-84042006000100002 [ Links ]
Seo, M., E. Nambara, G. Choi y S. Yamaguchi. 2009. Interaction of light and hormone signals in germinating seeds. Plant Mol. Biol. 69, 463-472. Doi: 10.1007/s11103-008-9429-y [ Links ]
Taiz, L. y E. Zeiger. 2004. Fisiología vegetal. 3a ed. Artmed, Porto Alegre, Brasil. [ Links ]
Toyomasu, T., H. Yamane, N. Murofushi y Y. Inoue. 1994. Effects of exogenously applied gibberellin and red light on the endogenous levels of abscisic acid in photoblastic lettuce seeds. Plant Cell Physiol. 35, 127-129. [ Links ]
Wang, A.X., X.F. Wang, Y.F. Ren, X.M. Gong y J.D. Bewley. 2005a. Endo-bmannanase and b-mannosidase activities in rice grains during and following germination, and the influence of gibberellin and abscisic acid. Seed Sci. Res. 15, 219-227. Doi: 10.1079/SSR2005212 [ Links ]
Wang, X., X. Li, J. Meisenhelder, T. Hunter, S. Yoshida, T. Asami y J. Chory. 2005b. Autoregulation and homodimerization are involved in the activation of the plant steroid receptor BRI1. Develop. Cell 8, 855-865. Doi: 10.1016/j.devcel.2005.05.001 [ Links ]
Werner, T., V. Motyka, M. Strnad y T. Schmulling. 2001. Regulation of plant growth by cytokinin. Proc. Nat. Acad. Sci. USA 98, 10487-10492. Doi: 10.1073/pnas.171304098 [ Links ]
White, C.N. y C.J. Rivin. 2000. Gibberellins and seed development in maize II. Gibberellin synthesis inhibition enhances abscisic acid signaling in cultured embryos. Plant Physiol. 122, 1089-1097. Doi: 10.1104/pp.122.4.1089 [ Links ]
White, C.N., W.M. Proebsting, P. Hedden y C.J. Rivin. 2000. Gibberellins and seed development in maize I. Evidence that gibberellin/abscisic acid balance governs germination versus maturation pathways. Plant Physiol. 122, 1081-1088. Doi: 10.1104/pp.122.4.1081 [ Links ]
Zapata, P.J., M. Serrano, M.T. Pretel, A. Amorós y M.A. Botella. 2004. Polyamines and ethylene changes during germination of different plant species under salinity. Plant Sci. 167, 781-788. Doi: 10.1007/s10535-015-0510-5 [ Links ]
Zheng, C., D. Jiang, F. Liub, T. Dai, W. Liu, Q. Jing y W. Cao. 2009. Exogenous nitric oxide improves seed germination in wheat against mitochondrial oxidative damage induced by high salinity. Environ. Exp. Bot. 67, 222-227. Doi: 10.3390/ijms12042488 [ Links ]