INTRODUCCIÓN
El problema a resolver con la investigación es de doble impacto, por un lado, La existencia de grandes cantidades de residuos poscosecha de la papa (Solanum tuberosum) y agroindustriales potencialmente contaminantes (Montoya et al., 2004), y por el otro los altos costos que representa la alimentación del ganado rumiante especialmente en los pequeños y medianos productores. En la papa se encuentran componentes nutritivos (energía, macro y micronutrientes) y componentes no nutritivos (agua, celulosa, hemicelulosa, pectina, glucoalcaloides, ácidos orgánicos, enzimas, entre otros minoritarios). Luego de su cosecha los tubérculos contienen un promedio de 80% de agua y 20% de materia seca (60% de esta corresponde a almidón) (Pertuz, 2012). Los ácidos orgánicos contribuyen con el pH característico del alimento: pH de 5,6 a 6,2. Los más representativos son el málico, el cítrico y el clorogénico que reacciona con iones de hierro. Este componente y la fermentación de cantidades importantes de carbohidratos los cuales se encuentran mayoritariamente como almidón y un pequeño porcentaje como azúcares (sacarosa, fructosa, glucosa), hacen posible una disminución considerable del pH (Mundo Pecuario, 2010). En las fermentaciones de residuos de cosecha se mide el comportamiento del pH para la buena calidad del mismo ya que pH muy bajos limitará el crecimiento bacteriano, alterando la composición química del producto fermentado y la síntesis ruminal en el animal (Elías et al., 1990; Yang et al., 2015).
Por ello, el objetivo de este trabajo fue evaluar la inclusión del CaCO3 en la cinética de fermentación en estado sólido de residuos poscosecha de Solanum tuberosum inoculado con un preparado microbiano con actividad ácido láctica.
MATERIALES Y MÉTODOS
Localización geográfica del área de estudio Los experimentos de FES, a escala de laboratorio, se realizaron en condiciones de trópico alto (2.860 msnm), en el Laboratorio de Bioquímica y Nutrición Animal de la Universidad Pedagógica y Tecnológica de Colombia (UPTC), ubicado en la ciudad de Tunja, departamento de Boyacá, Colombia.
Procedimiento experimental
Preparado microbiano
Una vez obtenido el yogurt se procedió a mezclarlo con los componentes descritos en el protocolo establecido por Borras et al. (2017) a un 2%, y se llevó a un volumen final con agua corriente (solvente del sistema) y se incubó por 48 h a una temperatura ambiente promedio 15ºC, hasta estabilizar el pH a 4,5 con agitación tres veces al día por 20 min.
En cuanto al análisis microbiológico, este se realizó al preparado microbiano a las 48 h de fermentación en un laboratorio certificado de control microbiológico, ubicado en Boyacá, Colombia. Para aerobios mesófilos (UFC/mL) (AOAC 966.23.C: 2001), coliformes totales (NMP) (ICMSF NMP: 2000), coliformes totales y fecales (NMP), (ICMSF NMP: 2000), esporas de Clostridium Sulfito reductor (UFC/mL), (ISO 15213:2003), hongos y levaduras (UFC/mL) (ISO 7954:1987), Salmonella sp. (AS 5013.10:2009), bacterias ácido lácticas (NTC 5034: 2002).
Se utilizaron residuos de poscosecha de la papa (Solanum tuberosum), variedad pastusa; en la preparación del producto se empleó los tubérculos de la papa obtenidos comercialmente, limpios y picados finamente, donde se utilizó proporciones de 89% de S. tuberosum, 5% material fibroso (salvado de trigo); 2% de melaza, 1% de urea; 2% del preparado microbiano, 0,5% premezcla mineral y 0,5% de sulfato de sodio, modificación realizada a la metodología propuesta por Elías et al. (1990). Estos ingredientes se mezclaron hasta obtener una pasta homogénea, que luego fueron distribuidas en bolsas plásticas selladas no herméticamente. En cuanto a los tratamientos, se evaluaron cuatro inclusiones de CaCO3 a razón de 0; 0,25; 0,50 y 0,75% de inclusión en reemplazo del porciento de papa propuesto. En cuanto a la temperatura y tiempo de fermentación, se incuba el producto en bolsas plásticas a diferentes temperaturas (20 y 25ºC), en incubadoras individuales marca Memmert® y durante 24 y 48 h. Cada bolsa representó una unidad experimental, con tres repeticiones cada una, según los tratamientos.
Toma de muestra
Se tomaron muestras a las 0, 24 y 48 h de fermentación, para la medición de pH, análisis microbiológico y químico. Para la medición de pH, el contenido de las bolsas de cada tratamiento fue recolectado en su totalidad y homogeneizado, luego se tomaron 5 g de muestra que se colocaron en Erlenmeyers de 100 mL y se les adicionó 45 ml de agua destilada estéril. La preparación se agitó durante 30 min en un agitador eléctrico marca Adams® y posteriormente se obtuvo el filtrado para medición del pH en un potenciómetro automático marca Okaton®.
El cuanto, al análisis químico, para esto se tomó las muestras a diferentes tiempos y temperaturas, según tratamiento. Para lo cual, la totalidad de los sólidos que quedaron en cada una de las bolsas se secaron y se molieron en un molino de martillo marca UDY®, con criba de 1 mm, para luego realizar el respectivo análisis bromatológico mediante las siguientes técnicas analíticas: la cuantificación de ácidos grasos volátiles (AGCC) se realizó siguiendo el método reportado por Dinkci (2007), por medio de cromatografía líquida de alta eficiencia HPLC; materia seca (MS), nitrógeno amoniacal (NH3) prueba de Berthelot, método reportado por Martínez (2003) y proteína bruta (PB), métodos establecidos por la AOAC (2005); proteína verdadera del filtrado (PV) según Berstein, citado por Meir (1986).
Análisis estadístico
En el estudio se aplicó un análisis de varianza según diseño completamente aleatorizado con arreglo factorial (2×2×4). Para el análisis de pH y MS (%) se utilizaron como factores 2×2×4 donde los factores fueron dos temperaturas 20 y 25ºC, dos tiempos de fermentación 24 y 48 h, y cuatro niveles de inclusión de carbonato de calcio 0; 0,25; 0,50 y 0,75% y tres repeticiones. Se aplicó dócima de Duncan para P≤0,05 en los casos necesarios. Para los análisis se utilizó el paquete estadístico INFOSTAT, versión 2012 (Di Rienzo et al., 2012).
RESULTADOS Y DISCUSIÓN
En la Tabla 1 se muestra el estudio de la influencia del carbonato de calcio en el pH y la MS durante la fermentación en estado sólido de residuos poscosecha de S. tuberosum inoculado con un preparado microbiano con actividad ácido láctica, se observa interacción entre los factores en estudios (P<0,0001). El pH se incrementa a medida que aumenta el porcentaje de adición del CaCO3 suministrado para ambas temperaturas de incubación en 48 h, según los valores obtenidos en la cinética de fermentación, exceptuando a los 25ºC en el nivel más alto de inclusión (0,75%) donde se presenta un descenso significativo que pudiera ser por un efecto de temperatura. Yang et al. (2015), al realizar el análisis de la composición y estructura de carbonato de calcio, observaron que posee características únicas que le permiten mantener un pH más alto.
Tabla 1 Estudio de la influencia del CaCO3 en el pH durante la fermentación en estado sólido de residuos poscosecha de S. tuberosum inoculado con un preparado microbiano con actividad ácido láctica.

Promedios con letras distintas indican diferencia significativa según la prueba de Duncan (P≤0,05).
Los resultados experimentales indicaron que un valor de pH superior y la adición de nitrógeno podrían aumentar el rendimiento de la fermentación de ácido láctico por Lactobacillus lactis, logrando aumentar su biomasa, y plantean que el pH óptimo en general de BAL es 6,0 a 7,0. A un valor de pH bajo, dicho crecimiento sería inhibido debido a la mayor presencia de ácido láctico libre. Si se tiene en cuenta que el alimento fue inoculado con un preparado microbiano rico en BAL, permite inferir que al existir un pH adecuado nos permitirá un buen crecimiento microbiano reflejado en el importante porcentaje de proteína verdadera (72,76%). La estabilidad en el pH se asocia a un buen crecimiento bacteriano y por ende favorece la producción de proteína de origen bacteriano (Elías et al., 1990; Ramos et al., 2006; Becerra et al., 2008), aunque estos autores utilizaron otros sustratos encontraron incremento en la PV, relacionándolo al crecimiento microbiano que se desarrollan durante el proceso de FES.
En general hay una incidencia positiva por la inclusión del CaCO3, en el comportamiento del pH, evitando un descenso rápido que pudiera ser limitante en el crecimiento y comportamiento de los microorganismos presentes, la estabilidad en el pH se puede atribuir al poder buferante del carbonato de calcio.
Con respecto a la MS se observa un incremento en los distintos niveles de inclusión del carbonato de calcio a una temperatura de 20oC durante la fermentación, aunque el mayor valor alcanzado de 39,66% no dista de lo obtenido con la inoculación del preparado microbial con 5% de salvado de trigo (38,13%), aún muy bajo para este tipo de aditivo microbial. Sin embargo, a la temperatura de 25ºC tuvo un comportamiento opuesto donde se observa que no hay tendencia definida en los valores de materia seca con los diferentes niveles de carbonato de calcio, encontrándose valores altos y bajos indistintamente. Este comportamiento de los indicadores químicos del alimento indica que la papa al ser cortada inicia rápidamente un proceso de lixiviación lo cual lleva a humedecer sensiblemente el alimento alterando las características organolépticas de este y su conservación esto se pudiera explicar por la hidrólisis de la urea realizado por los microorganismos presentes en la fermentación durante su proceso metabólico para la síntesis celular con la producción de amoníaco y este se pudiera volatilizar en dependencia del pH final del proceso y, posiblemente en menor escala, a la desaminación de péptidos y aminoácidos. Parte del agua producida durante la oxidación de las moléculas se pudiera evaporar por el calor metabólico que se genera durante el proceso de FES (Pandey et al., 2001; Mitchell et al., 2002).
En los resultados obtenidos el incremento proteico está muy ligado al comportamiento del pH lo cual se denota en la calidad del producto final. En la Tabla 2 se expone el estudio realizado de las proteínas para determinar la influencia que ejerce el carbonato de calcio CaCO3, durante la fermentación en estado sólido de los residuos poscosecha de S. tuberosum inoculado con un preparado microbiano con actividad láctica.
Tabla 2 Estudio de la influencia del CaCO3 en las proteínas durante la fermentación en estado sólido de residuos poscosecha de S. tuberosum inoculado con un preparado microbiano con actividad láctica.

Promedios con letras distintas indican diferencia significativa según la prueba de Duncan (P≤0,05).
En la Tabla 2 se muestran los dos indicadores de proteína donde se observan diferencias en todos los niveles de inclusión de carbonato con respecto al tiempo y a las temperaturas estudiadas (P<0,0001). Sin embargo, se mantienen los niveles de proteína bruta en comparación con los del preparado microbial obteniendo el valor más alto con la inclusión del 0,50% de CaCO3 a los 20ºC, presentando una diferencia marcada con los tenores de proteína a los 25ºC los cuales siempre estuvieron porcentualmente por debajo de la fermentación a los 20ºC.
A las 48 h de fermentación se encontró comportamientos similares tendiendo al incremento en la proteína bruta con la adición de 0,50% de CaCO3 a los 25ºC, pero más bajo a lo esperado según los resultados del pH y la humedad del sistema. Sin embargo, la relación de PV y la PB (PV/PB×100), es la misma para las dos temperaturas (20 y 25ºC) con un 72,76% por lo que en condiciones de fermentación sólida rústica o de campo es más factible utilizar temperaturas de 20ºC.
La proteína verdadera mostró incremento de un 3,03% con respecto al preparado microbial para la temperatura de 20ºC en 24 h de fermentación y se mantienen estos valores con diferencias con respecto a los niveles de carbonato de calcio a las 48 h, por lo que este compuesto favoreció la síntesis microbiana de la concentración en UFC/ml inicial del preparado microbial. Siebald et al. (2002) resaltan que aproximadamente el 50% de la proteína bruta corresponde a compuestos nitrogenados no proteicos, uno de los cuales es la solanidina, alcaloide, que puede estar presente libre o combinado en forma de glicoalcaloides denominados chaconina y solanina, ambos tóxicos para los animales. Estos compuestos son eliminados por la fermentación en estado sólido, pues en este estudio la mayoría de la proteína es de origen microbiano y no directamente del alimento.
Han et al. (2013) comprobaron que la adición de CaCO3 en fermentaciones con bacterias incrementan su crecimiento, además los niveles de proteínas transportadoras de azúcar y de las proteínas involucradas en la síntesis, reparación, recombinación y replicación del DNA y Tian et al. (2015) obtuvieron resultados con la inclusión de CaCO3 en la fermentación del bagazo de caña de azúcar por Clostridium termocellun, degradación de este sustrato y un efecto estimulador en la producción de biohidrógeno.
El comportamiento de los AGCC (Tab. 3) se presenta ausencia de ácido acético y el propiónico solo se expresa en la concentración más baja de carbonato de calcio, mientras que el láctico presenta un comportamiento creciente evidenciado en las dos temperaturas evaluadas siendo más evidente en las concentraciones mayores (0,5 y 0,75%) de carbonato.
Tabla 3 Comportamiento del NH3 y AGCC, de la fermentación de los residuales poscosecha de Solanum tuberosum con el preparado microbial e inclusión de CaCO3.
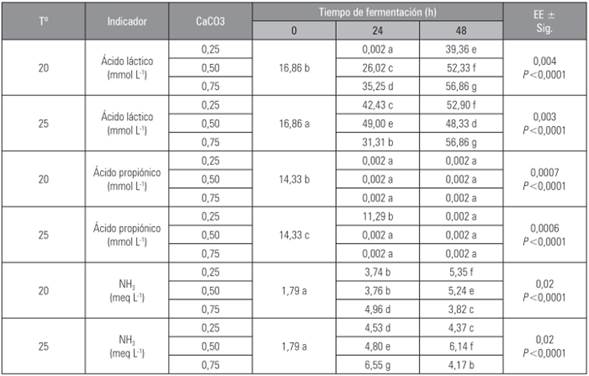
Promedios con letras distintas indican diferencia significativa según la prueba de Duncan (P≤0,05).
En la Tabla 4 se puede observar los resultados del análisis microbiológico realizado a las diferentes muestras. Se aprecia el buen comportamiento del crecimiento de las bacterias ácido lácticas, lo cual se puede explicar por el inóculo empleado en las diferentes temperaturas de incubación de 20 y 25ºC. En la misma se aprecia el buen crecimiento de hongos y especialmente de levaduras, deseables en el proceso fermentativo, y lo más importante persiste la ausencia de patógenos como Salmonella y Clostridium.
CONCLUSIONES
La mejor inclusión del CaCO3 en la fermentación de los residuales poscosecha de Solanum tuberosum con el preparado microbial fue de 0,50% a los 20ºC, el cual permitió un crecimiento adecuado de los microorganismos BAL reflejado en el incremento de la proteína verdadera. Lo cual indica, además, que para las fermentaciones a nivel de campo se definió que la mejor temperatura es de 20ºC según los indicadores de calidad de la fermentación.
En el proceso fermentativo se observó un aumento en la MS, aun así el producto final es muy húmedo, según los indicadores de calidad para este tipo de alimento.















