INTRODUCCIÓN
El cultivo de hongos comestibles representa importancia socioeconómica que provee un alimento de alto valor nutricional para consumo humano (Guzmán et al., 2008). En Colombia el cultivo de hongos comestibles con fines comerciales ha tenido aceptación en algunos sectores de la economía, con la utilización de residuos agroindustriales para su producción (Amortegui y Suárez, 2003; Álvarez y Mejía, 2011; Suárez y Holguín, 2011; Acosta-Chávez, 2010).
En México, se han realizado estudios de recolecta y selección de especímenes silvestres de Agaricus bisporus para identificar material genético con características productivas y competitivas (Salmones et al., 2012; Mata et al., 2016). Sin embargo, existen pocos estudios enfocados en el aislamiento y cultivo de especies de hongos silvestres comestibles utilizadas tradicionalmente (Guzmán et al., 2013). Arana- Gabriel et al. (2014) presentan el aislamiento y producción de inóculo de cinco especies de hongos silvestres usadas como alimento en el Nevado de Toluca, México. Así, los hongos silvestres pueden ser vistos como una alternativa productiva y de ingreso para las comunidades que habitan regiones boscosas (Alvarado-Castillo y Benítez, 2009), ya que representan una fuente de alimento e integran parte de los usos y costumbres de los pueblos que los utilizan (Ruan-Soto et al., 2013).
La obtención de fructificaciones mediante un conocimiento del manejo de las condiciones naturales de propagación y del entorno, hacen de estos un recurso ecológico con gran potencial para producción (Ardón, 2007). A nivel mundial se han cultivado aproximadamente 22 especies fúngicas, la mayoría provenientes de regiones tropicales y subtropicales (Morales et al., 2010).
Auricularia fuscosuccinea (Mont.) Henn. (Auriculariaceae) y Crepidotus palmarum Sing. (Inocybaceae) conocidas localmente como nacumas y carupas, son especies de hongos silvestres consumidas tradicionalmente por comunidades campesinas aledañas a bosques de roble, Quercus humboldtii Bonpl., en los municipios de Chiquinquirá y Pauna de los Andes nororientales (Peña y Enao, 2014).
El presente trabajo busca fortalecer el conocimiento tradicional e iniciar el proceso de cultivo con fines productivos de A. fuscosuccinea y C. palmarum, consumidos por campesinos de la vereda Monte y Pinal, municipio de Pauna, a partir de su aislamiento y producción de semilla.
MATERIALES Y MÉTODOS
Obtención de material fúngico
La recolecta de los basidiomas de A. fuscosuccinea y C. palmarum se realizó en la vereda Monte y Pinal, en la finca Santo Tomás, propiedad privada localizada a 5º35´6,59” N y 73º56´28,0” W, a 2.763 msnm, en borde de bosque de roble sobre troncos en descomposición, teniendo en cuenta los tiempos definidos en el calendario elaborado por Peña y Enao (2014). La identificación de las especies se corroboró utilizando las claves taxonómicas de Lowy (1952), Cheng y Tu (1978) y Matheny (2009).
Trabajo etnomicológico
Se realizaron talleres, entrevistas y visitas al bosque de roble con los conocedores locales en un intercambio de experiencias y conocimientos, buscando que el cultivo de hongos proyectado contara con los dos tipos de saberes: tradicional y académico. La interlocución de traductores culturales generó acercamiento, confianza y motivación para la participación activa de los pobladores en el proyecto. Las visitas fueron realizadas en las casas, parcelas y cotos de caza o cosecha de hongos silvestres. Los métodos de cultivo de hongos silvestres conocidos por los campesinos se enriquecieron con aportes de la literatura.
Aislamiento de hongos
Los medios de cultivo empleados para aislar micelio de A. fuscosuccinea y C. palmarum fueron Agar Papa Dextrosa (PDA) Oxoid® (16,8 g L-1), Extracto de Malta (EM) Oxoid® (19,5 g L-1) y Agar Papa Dextrosa y Extracto de Malta enriquecidos con 3 g L-1 de extracto de levadura, 5 g L-1 de peptona bacteriológica y 1 g L-1 de carboximetil celulosa; 1 g L-1 de cloranfenicol fue adicionado como antibiótico a estos dos últimos medios de cultivo que posteriormente serán identificados por las siglas PDAE y EME, respectivamente. El aislamiento del micelio se realizó en forma vegetativa dentro de cámara de flujo laminar y bajo condiciones de asepsia; se tomaron porciones de 3 mm de contexto de píelo y de lamela en el caso de C. palmarum. Estas se desinfectaron por inmersión consecutiva en etanol (70%) por 1 minuto e hipoclorito de sodio comercial (5,25% NaOCl activo) por 1 min y un lavado con agua destilada estéril. Fragmentos de hongo desinfectados se sembraron en la superficie del medio de cultivo; se realizaron cuatro réplicas por tratamiento. Las cajas de Petri se incubaron a 22 y 25°C en un ambiente obscuro. Con calibrador, se midió el diámetro (Ø) de crecimiento alcanzado por las colonias en cada tipo de medio de cultivo y al mismo tiempo de incubación, hasta que uno de los micelios cubrió completamente la superficie del medio.
Evaluación de medios de cultivo en la producción de micelio
Después de obtener micelio puro de A. fuscosuccinea y C. palmarum, se evaluaron estos mismos cuatro medios de cultivo (PDA, EM, PDAE, EME) para determinar su eficiencia en la producción de micelio. Para esto, se colocó una sección de 1 cm2 de medio de cultivo con micelio puro, en el centro de cajas de Petri (100×15 mm) conteniendo cada medio de cultivo y se midió el crecimiento radial cada 2 d, en cuatro sentidos opuestos y con ayuda de calibrador, hasta que el micelio alcanzó el borde de la placa.
Análisis estadístico
Se utilizó un arreglo de 2×4, con un diseño experimental completamente al azar, dos tipos de aislamiento en cuatro medios de cultivo diferentes y a dos temperaturas de incubación diferentes; se realizaron cuatro repeticiones por tratamiento para un total de 64 muestras analizadas. Se evaluó la diferencia significativa entre los tratamientos mediante un análisis de varianza (ANOVA). Cuando se encontró diferencia significativa entre los tratamientos se utilizó la prueba de Tukey (95% de nivel de confianza) para comparación por pares. El análisis de los datos se llevó a cabo en el Software R Studio® versión 3.3.1.
Elaboración del inóculo
Para la propagación de los micelios se utilizaron granos de trigo, cebada y arroz y se siguió la metodología de Gaitán-Hernández et al. (2006). Los granos limpios se hidrataron en agua por 12 h, se enjuagaron y escurrieron en cernidor. Se adicionó ácido láctico en proporción 1:1.000 a los granos húmedos. Se colocaron 100 g de grano en bolsas de polietileno y se esterilizaron dos veces a 121°C por 20 min. El material estéril se dejó enfriar antes de ser utilizado. Se depositaron tres fracciones de 2 cm2 de cultivo con micelio puro en cada bolsa con grano y se incubaron a 22 y 25°C. Se realizaron cuatro réplicas por especie y se midió el pH de los granos después de inoculados con micelio. La propagación del micelio se evaluó de forma cualitativa en relación al tiempo de incubación y la cobertura del sustrato, utilizando una escala de porcentaje de invasión, alto para un crecimiento rápido, medio para un crecimiento lento, poco para un crecimiento muy lento y sin crecimiento, de acuerdo con lo descrito en Suárez y Holguín (2011).
RESULTADOS Y DISCUSIÓN
Conocimientos etnoecológicos
En la documentación de las formas tradicionales de consumo de A. fuscosuccinea y C. palmarum, se encontró que los pobladores de la vereda Monte y Pinal de Pauna preparan y consumen estos hongos con gran agrado y los incluyen dentro de su dieta junto con otras especies de hongos silvestres comestibles. Peña y Enao (2014) señalan que A. fuscosuccinea se encuentra entre las especies con mayor importancia cultural y que C. palmarum es particularmente muy importante en la vereda Monte y Pinal, pero prácticamente desconocida en la región de los Andes nororientales colombianos.
Se documentó el uso de aserrín y hojarasca de roble como sustratos de crecimiento de hongos silvestres, sin embargo, de acuerdo con los relatos de algunos conocedores y consumidores locales de hongos no se ha tenido éxito en la fructificación. De acuerdo con lo mencionado por los conocedores locales, Ardón (2007) resalta que en la producción de hongos del género Auricularia en países como Guatemala, A. auricula se cultiva sobre subproductos agrícolas y agroindustriales, incluyendo la utilización de aserrín de madera.
Al potenciar un proceso de cultivo se puede conducir a un nuevo enfoque de conservación y uso sustentable de los recursos naturales (Alvarado-Castillo et al., 2015). Así, promover la participación activa de los conocedores locales de hongos de Monte y Pinal en la producción con fines comerciales de A. fuscosuccinea y C. palmarum se convierte en iniciativa que busca proteger los bosques de roble, afianzar saberes ancestrales y generar oportunidades de ingreso económico adicional a los productores rurales.
Aislamiento de hongos
La colonia de A. fuscosuccinea presentó una textura algodonosa con abundante desarrollo de micelio aéreo, borde entero y topografía ligeramente convexa; anverso y reverso de la colonia de color blanco (Fig. 1A). El micelio de C. palmarum presentó una textura aterciopelada con un desarrollo escaso de micelio aéreo, formando colonias de borde filamentoso y topografía plana. El anverso y reverso de la colonia fueron de color blanco (Fig. 1B). La apariencia y coloración de los micelios no mostraron variación después de un año de repique consecutivo e incubación prolongada. Sumado a esto, las condiciones estériles y el protocolo de desinfección usado para el aislamiento indican la eliminación de posibles hongos contaminantes, conocidos como fungícolas y obtenidos a partir de basidiomas sanos (Wan-Rou et al., 2016). A pesar de no haber obtenido esporocarpos en diferentes sustratos inoculados, el crecimiento lento de las colonias durante el aislamiento de micelio y la presencia de fíbulas y septos en las hifas tanto en A. fuscosuccinea como en C. palmarum confirman la veracidad de los aislamientos.

Figura 1 Apariencia del aislamiento de A. fuscosuccinea (carupas) en PDAE (A); Apariencia del micelio de C. palmarum (nacumas) en EME (B).
El crecimiento de micelio A. fuscosuccinea se evaluó a los 18 d de incubación. A 25°C, el micelio presentó mayor velocidad de crecimiento en medio PDAE, con un máximo de 8,9 cm de Ø. En EM el diámetro alcanzado por el micelio fue de 6,1 cm y con menor eficiencia en EME obtuvo 5,6 cm de Ø. En medio PDA el hongo no presentó crecimiento. A 22°C el medio de cultivo que favoreció el mayor crecimiento del micelio fue EME (6,2 cm de Ø), comparado con EM (5,7 cm de Ø), PDAE (4,1 cm de Ø) y PDA (1,3 cm de Ø).
En el caso de C. palmarum a 22°C el crecimiento de las hifas fue medido después de 20 días de incubación. En EME el micelio presentó el mayor crecimiento (8,7 cm de Ø), en PDAE alcanzó un diámetro de 4 cm y en EM se observó el menor crecimiento micelial (0,3 cm de Ø). En medio PDA no hubo crecimiento de hifas. A una temperatura de incubación de 25°C no se observó crecimiento de hifas de C. palmarum en los medios utilizados para el aislamiento.
Evaluación de medios de cultivo en la producción de micelio
En la evaluación de los medios de cultivo para A. fuscosuccinea a 22ºC el análisis de varianza arrojó un valor de significancia de 0,913 (P>0,05) indicando que no hubo diferencia significativa en el crecimiento micelial de la especie. De la misma forma, a una temperatura de 25°C, el valor resultante del análisis 0,975 (P>0,05) no mostró diferencia significativa en la eficiencia de los medios para la producción de micelio de esta especie. Estos datos obtenidos concuerdan con lo encontrado por Suárez y Holguín (2011), quienes indican que ningún medio de cultivo tuvo un comportamiento diferente para una cepa determinada.
Sin embargo, la curva de crecimiento de A. fuscosuccinea en los diferentes medios de cultivo mantenidos tanto a 22°C como a 25°C (Fig. 2A y B) muestra que los medios de cultivo que podrían proporcionar una mayor velocidad de crecimiento son PDA y PDAE respectivamente.
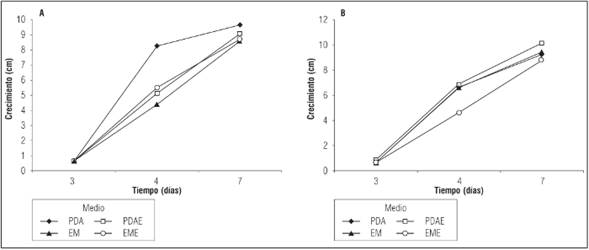
Figura 2 Crecimiento de A. fuscosuccinea a 22ºC (A) y 25ºC (B). EM: Medio de extracto de malta, EME: medio de extracto de malta enriquecido, PDA: medio papa, dextrosa y agar, PDAE: medio papa, dextrosa y agar enriquecido.
Por su parte, para C. palmarum el análisis de varianza muestra un valor de significancia de 0,131 (P>0,05) lo que indica que no hay diferencia significativa entre los medios de cultivo utilizados para evaluar el crecimiento de la especie a 22ºC. No obstante, los resultados, presentados en la Figura 3A revelan que el medio PDAE brinda condiciones favorables para un mayor crecimiento micelial de la especie a esta temperatura de incubación.
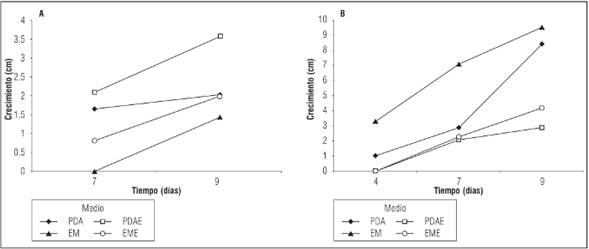
Figura 3 Crecimiento de C. palmarum a 22ºC (A) y 25ºC (B). EM: Medio de extracto de malta, EME: medio de extracto de malta enriquecido, PDA: medio papa, dextrosa y agar, PDAE: medio papa, dextrosa y agar enriquecido.
En el caso de C. palmarum a 25°C, el análisis ANOVA muestra un valor de significancia de 0,00055 (P≤0,05), indicando que existe una diferencia significativa en el crecimiento de la especie en los medios de cultivo evaluados. Así, el medio EM se muestra más eficiente a la hora de favorecer el crecimiento de C. palmarum, seguido de los medios PDA y EME y con menor eficiencia el medio PDAE (Fig. 3B). De acuerdo con la prueba de Tukey, tanto el medio EM como PDA pueden ofrecer condiciones que favorecen una mayor velocidad de crecimiento para C. palmarum (P>0,05). De igual forma corrobora que existe una diferencia significativa en la eficiencia de los medios EME y PDAE si comparados con EM (P≤0,05).
Un estudio realizado por Zervakis (2001) demostró que Auricularia auricula-judae presenta una temperatura óptima de crecimiento a 20 o 25°C, lo que está de acuerdo con los resultados de las pruebas realizadas, donde los aislados de A. fuscosuccinea y C. palmarum presentaron mayores diámetros de crecimiento micelial a temperaturas de incubación de 25 y 22°C, respectivamente. Sin embargo, también señala que dependiendo del medio de cultivo utilizado, la temperatura óptima de crecimiento puede variar. Lo anterior sugiere que se hace necesaria la evaluación de medios de cultivo enriquecidos con otras fuentes de carbono, nitrógeno y minerales (Petre y Teodorescu, 2011), para determinar si la temperatura óptima para el aislamiento y producción de micelio de A. fuscosuccinea y C. palmarum está condicionada por los nutrientes del medio de cultivo.
Elaboración del inóculo
El pH inicial de los inóculos de arroz, cebada y trigo fue de 5,2; 6,7 y 5,2, respectivamente. En la elaboración del inóculo, la propagación del micelio aislado de A. fuscosuccinea tuvo mayor vigor en granos de trigo incubado a 25°C, logrando una invasión total del sustrato en 18 d. En el inóculo realizado utilizando granos de cebada e incubado a 25°C, el micelio tardó 25 d para invadir totalmente el sustrato. Para el inóculo en granos de arroz no se obtuvo crecimiento del micelio. La propagación de C. palmarum en granos de cebada presentó mejor crecimiento incubada a 22°C, colonizando el sustrato en 18 d. En granos de trigo la propagación del micelio tardó 25 d a 22°C. En la elaboración del inóculo utilizando granos de arroz e incubado a 22°C, el micelio se propagó superficialmente sin invadir por completo los granos, lo que causó descomposición interna del grano, contaminación del sustrato y pérdida de la semilla (Tab. 1).
Tabla 1 Evaluación del crecimiento micelial en granos de cereal.
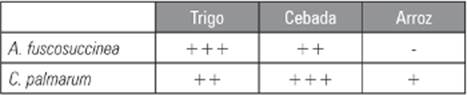
Escala: +++ alto porcentaje de invasión, crecimiento rápido; ++ porcentaje de invasión medio, crecimiento lento; + poco porcentaje de invasión, crecimiento muy lento; - sin crecimiento.
Estudios realizados para la propagación y cultivo de hongos silvestres demuestran que los mejores granos para la elaboración de semilla son trigo y cebada, teniendo en cuenta su capacidad de absorber mayores cantidades de agua y el contenido de nutrientes de fácil degradación (Stamets, 1993; Suárez y Holguín, 2011), lo que concuerda con los resultados obtenidos en el presente trabajo para dos especies de hongos lignocelulósicos con potencial para cultivo y comercialización.
Para continuar con el proceso de cultivo y tener éxito en la búsqueda de un sustrato y las condiciones favorables para la fructificación de A. fuscosuccinea y C. palmarum, se hace necesario realizar estudios fenológicos considerando variables ambientales como cobertura del bosque, composición de especies arbóreas, cantidad de luz, temperatura, contenido de materia orgánica y humedad del suelo de acuerdo a lo indicado por Toledo et al. (2014).
CONCLUSIONES
La efectividad en el aislamiento de micelio y en la obtención de semilla de A. fuscosuccinea y C. palmarum, hongos silvestres comestibles, se convierte en el primer paso para su proceso de cultivo y producción con fines comerciales. De igual forma, abre la posibilidad de que estas especies puedan convertirse en una demanda en mercados locales o próximos a la zona de estudio, generada por su importancia etnomicólogica dentro de las comunidades campesinas, e inclusive generar una forma de aprovechamiento sostenible de residuos agroindustriales de la zona y un enfoque integral del manejo de los bosques de roble. C. palmarum y A. fuscossucinea son especies de gran importancia a nivel local, sin embargo su producción industrial es un reto, haciéndose necesaria la evaluación de factores que induzcan a la fructificación.














