INTRODUCCIÓN
El sinergismo de fitorreguladores juega un papel importante en el crecimiento y desarrollo vegetal involucrando la integración de señales ambientales ligado a un programa genético intrínseco determinando la morfofisiología de la planta (Gray, 2004; López-Bucio et al., 2003).
Las plantas para su nutrición dependen de la fotosíntesis que se produce en las hojas. La raíz es un órgano heterotrófico, que también depende de la fotosíntesis, sin embargo, el proceso de la fotosíntesis depende del agua y minerales captados por la raíz. La planta siendo sésil, tiene como estrategia explorar el suelo en búsqueda de captación de nutrientes y agua desarrollando una raíz primaria, la formación de raíces adventicias y la formación de pelos radicales conformando la arquitectura de la raíz (Sato y Miura, 2011).
El número de ramificaciones determina el anclaje de las plantas y, con la densidad de pelos radiculares que posean, la eficiencia de absorción de agua y adquisición de nutrientes (Peret et al., 2009). La arquitectura de la raíz puede ser afectada por factores que actúan sobre la modificación de esta, entre ellos se encuentran los nutrientes minerales, como nitrato, fosfato, sulfato y hierro, los que dan origen a señales que modifican la división celular y procesos de diferenciación celular en la raíz (López-Bucio et al., 2003).
La formación de órganos y tejidos ocurre por interacciones entre fitorreguladores del crecimiento. Se ha descrito que las auxinas interactúan con las citoquininas para regular el crecimiento de la raíz primaria, la formación de pelos radiculares y de las raíces laterales. De hecho, la combinación de diferentes concentraciones de auxinas y de citoquininas en sistemas de cultivo de tejidos posibilita la regeneración de órganos y es la base para la propagación vegetal in vitro (López-Bucio et al., 2003). El crecimiento de la raíz ocurre por la producción de nuevas células en el meristemo radicular, que se localiza en la parte más distal de la raíz protegido por la cofia y es la región donde se lleva a cabo la división celular. Después de dividirse, las células pasan a la zona de elongación donde aumentan de tamaño antes de diferenciarse. Las raíces laterales surgen a partir de las células del periciclo, que es un tejido adyacente al sistema vascular, para formar un nuevo meristemo. Su función es aumentar la superficie de absorción de la raíz y la exploración del suelo (Himanen et al., 2002; Oakenfull et al., 2002). Los factores como la luz, la temperatura y la disponibilidad de nutrientes pueden impactar la división, elongación y diferenciación celular y de esta forma regular el crecimiento, actuando como señales que operan mediante rutas de transducción específicas o bien a través de su interacción con reguladores del crecimiento (López-Bucio et al., 2003).
Arabidopsis thaliana es una crucífera que gracias a su reducido tamaño, pequeño genoma y fácil manipulación genética ha llegado a ser uno de los sistemas más importantes para el estudio de muchos aspectos de la fisiología vegetal (Dolan et al., 1993; Koornneef y Meinke, 2010). Es una planta que en condiciones de laboratorio podemos utilizarla para conocer en detalle la respuesta de la raíz ante el efecto del extracto de Moringa oleifera facilitando el análisis. El objetivo de este trabajo fue evaluar el efecto del extracto de M. oleifera en la germinación y desarrollo radicular en Arabidopsis thaliana.
MÉTODOS
Material biológico y obtención del extracto de Moringa oleifera
Se utilizaron hojas de Moringa oleifera colectadas en la finca Casa Amarilla, Puerto Villamizar, Norte de Santander. Para la obtención del extracto se utilizó la metodología establecida preliminarmente (Ortiz-Rojas y Flórez, 2008). Se tomaron de 10 g de material liofilizado de hojas de M. oleifera en etanol 80% en agitación constante por 24 h en oscuridad, posteriormente el filtrado obtenido se concentró a presión reducida a 40°C hasta un volumen conocido.
Bioensayo y condiciones de crecimiento
Se utilizaron plantas de Arabidopsis thaliana L. (ecotipo Col-0). Las semillas de cada línea fueron desinfectadas durante 10 min mediante tratamiento superficial con etanol al 95% (v/v) y por 5 min con solución de cloro 20% V/V por 7 min, posteriormente se lavaron cinco veces con agua destilada y se incubaron en oscuridad a 4°C durante 24 h en la misma solución. Las semillas fueron colocadas en cajas de Petri con el medio de cultivo MS (Murashige y Skoog, 1962) 0,5× suplementado con sacarosa al 2% y agar para plantas (Phytotechnology Laboratorios A111) al 0,7% (p/v). El pH se ajustó a 5,7 después de la adición del agar. Las cajas con las semillas en germinación se llevaron a incubación de manera vertical para favorecer el crecimiento de las raíces sobre la superficie del medio y medir el crecimiento de la raíz primaria. Las condiciones de crecimiento fueron: temperatura 28°C, fotoperiodo de 12 h de luz y 12 h de oscuridad (Ortiz- Castro et al., 2009).
Efecto del extracto de Moringa oleifera sobre el crecimiento de raíces
Se utilizaron dos condiciones experimentales: (A) se germinaron diez semillas por tratamiento con medio MS 0.5X con diferentes diluciones del extracto de Moringa oleifera con KOH 0,05 M respectivamente: 0:2; 1:1; 1,5:0,5; 2:0 (extracto:KOH) y como patrón la citoquinina trans zeatina ribósido (ZR) 60 μM, lo cual permitió determinar cómo se afectaba el crecimiento de la raíz primaria, y (B) se germinaron diez semillas con medio MS 0,5X y se dejaron crecer durante 8 d después de la germinación (8 ddg). Estas plantas carecían de raíces laterales, se trasplantaron a cajas de Petri con medios MS con diferentes diluciones del extracto de Moringa oleifera con KOH 0,05 M respectivamente: 0:2; 0,5:1; 1:1; 1,5:0,5; 2:0 (extracto:KOH). Lo anterior permitió evaluar cómo se afectaba el crecimiento de raíces primarias y raíces laterales previamente formadas, al pasar rápidamente del medio MS a medios suplementados con el extracto.
Análisis del crecimiento
El crecimiento de la raíz primaria y raíces laterales fue registrado utilizando una regla graduada en mm para analizar el crecimiento de la raíz en las condiciones experimentales B. Se realizó captura de imágenes del inició germinación en el desarrollo de la raíz principal para las condiciones experimentales A. Igualmente, se realizaron capturas de imágenes para las dos condiciones experimentales en el estudio del sistema radicular de A. thaliana utilizando un microscopio OXION EUROMEX con cámara digital CMEX5 y un fotodocumentador UVP.
Análisis de datos
El diseño estadístico utilizado fue completamente al azar. Se realizó un análisis de viarianza (ANOVA) entre tratamientos y muestreos y se aplicó la prueba de comparación de Tukey al 5% de probabilidad, utilizando el programa SAS (Statystical Analysis System). Cada bioensayo constó de cinco tratamientos con cinco repeticiones por dilución del extracto. Las variables en estudio fueron la germinación de la semilla, longitud de la raíz principal, y número de raíces laterales.
RESULTADOS Y DISCUSIÓN
Cuando las semillas se colocaron a germinar en medio MS con 0,5 mL de la dilución del extracto de Moringa oleifera, se observó que a los 6 d aún no se presentaba germinación con respecto al control (Fig. 1F). Por el contrario, se observó una estimulación de la germinación en presencia del extracto en diluciones de 1 mL, 1,5 mL y 2,0 mL, al igual que el tratamiento con trans zeatina ribósido (ZR) a una concentración 60 μM (Fig. 1E).
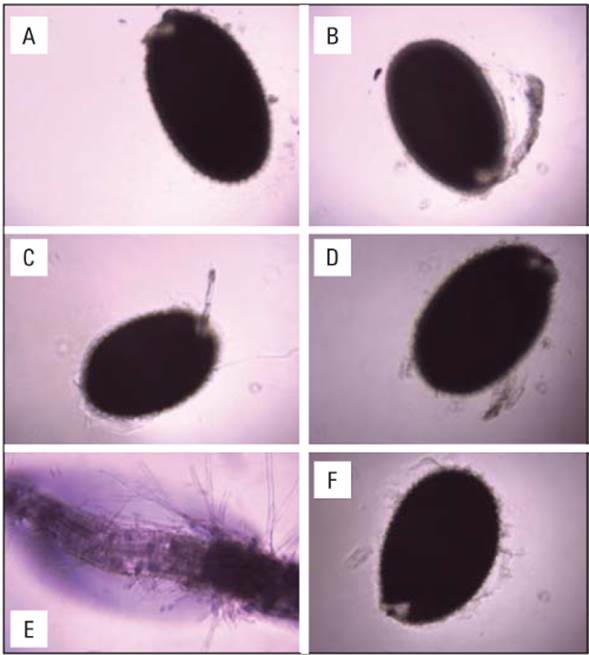
Figura 1 Efecto del extracto de Moringa oleifera en la germinación de plantas de A. thaliana en medio MS. Las semillas se colocaron a germinar con diferentes diluciones del extracto de moringa y observadas a los 6 días después de la siembra. A) 0,5 mL de extrato + 1,5 mL KOH 0,05 M; B) 1 mL de extracto + 1 mL KOH 0,05 M; C) 1,5 mL de extracto + 0,5 mL KOH 0,05 M; D) 2 mL de extracto; E) trans zeatina ribósido (ZR) 60 μM; F) 2 mL KOH 0,05 M. Las imágenes mostradas son representativas d 16 semillas analizadas para cada tratamiento.
Los bioensayos de germinación de semillas en medios MS con el extracto M. oleifera presentaron formación de raíz, al igual que el patrón con citoquinina (Fig. 1), confirmando la presencia de citoquininas en estudios cromatográficos de extractos de hoja de M. oleifera (Anjorin et al., 2010). Las CK son fitorreguladores que desempeñan un papel esencial en la regulación de la citocinesis, el crecimiento y el desarrollo en las plantas. Tanto la CK como la AIA pueden producirse en raíces y brotes (Aloni et al., 2005; Miyawaki et al., 2004; Nordstrom et al., 2004; Tanaka et al., 2006). El estudio molecular y fisiológico de plantas han evidenciado los mecanismos de fitorreguladores que configuran el crecimiento, la diferenciación y la arquitectura de los sistemas radiculares. En la señalización de sus interacciones de la raíz principal, juegan un papel importante las citoquininas (CK) junto con la auxina (ácido indol-3-acético, AIA) y sus interacciones (Coenen y Lomax, 1997; Nordstrom et al., 2004; Woodward y Bartel, 2005). En estudios de aplicación de extractos de hojas de M. oleifera en semillas de trigo, observaron una mayor emergencia de estas reduciendo el tiempo de germinación (Ali et al., 2011). El tratamiento de semillas de maíz con extractos de moringa incrementa la capacidad de crecimiento de las plantas de maíz (Basra et al., 2011), al igual que en este estudio se presentó una estimulación de la germinación con tres diluciones de extractos de M. oleifera (Fig. 1E).
Las citoquininas (CK) juegan un papel importante con las auxinas en el crecimiento de la raíz primaria y raíces laterales. Este sinergismo de auxinas/citoquininas se ha evidenciado en regeneración de órganos en cultivo de tejidos (López-Bucio et al., 2003). La presencia de CK en el extracto de M. oleifera, evidencia su participación al colocar las plantas germinadas y crecidas por 8 d en medio MS, sin raíces laterales, transferidas a medios con diferentes diluciones del extracto (Fig. 2).
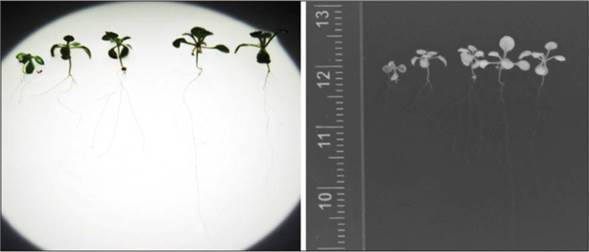
Figura 2 Efecto del extracto de hoja de Moringa oleifera en la raíz de A. thaliana con raíces laterales, transferidas del medio MS a medios suplementados con extracto de joka de M. oleifera. Las plantas de 8 d después de germinadas y crecidas en MS 0,5X se transfirieron a medios MS con diferentes diluciones de extracto de M. oleifera en KOH 0,05 M y se dejaron crecer por 5 d más. A) Control MS; B) 0,5:1; C) 1,5:0,5; E) 2:0.
En esta condición experimental, las respuestas del crecimiento de raíces de A. thaliana ante el extracto de M. oleifera demuestra el efecto del extracto en las cuatro diluciones trabajadas, presentando desarrollo de la raíz principal (RP) y raíces laterales (RL) con respecto al control. Las plantas de 8 ddg germinadas y crecidas en MS 0.5x transferidas a medios MS con una relación de dilución de extracto aumentó progresivamente la raíz primaria desde la dilución 0,5 hasta 1,5 y, presentándose una disminución en la mayor dilución correspondiente a 2,0 (Fig. 2A). La mayor longitud de la raíz principal se evidenció en la dilución 1,5:0,5 (extracto:KOH).
En cuanto al número de raíces laterales, se presentó una correlación directa al aumentar la cantidad de extracto. Sin embargo, no se presentaron diferencias significativas entre el control y las diluciones de 0,5 y 1,0 (Tab. 1B). El mayor número de RL, se mostró en la dilución con 2,0 mL del extracto de M. oleifera de (Tab. 1B), pero esta presentó una disminución de la longitud de la RP con respecto a la dilución anterior de 1,5 (Tab. 1A). Se revela en el estudio de la relación de RP y RL, que el mejor tratamiento en el desarrollo de la arquitectura de la raíz es la dilución del extracto de hojas de M. oleifera en KOH 0,05 M en una relación 1,5:0,5 (extracto:KOH 0,05 M).
Tabla 1 Prueba de comparación de Tukey al 5% de probabilidad. A) Longitud de la raíz principal (RP) y B) número de raíces laterales (RL) de plantas de A. thaliana crecidas en diluciones del extracto de M. olifera en KOH 0,05 M. Tratamiento 1, control negativo; tratamiento 2, 0,5 mL de extracto; tratamiento 3, 1 mL de extracto; tratamiento 4, 1,5 mL de extracto; tratamiento 5, 2 mL de extracto.
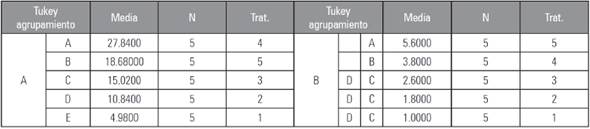
Promedios con letras distintas indican diferencia significativa según la prueba de Tukey (P≤0,05).
Cuando se refiere al crecimiento y diferenciación de la arquitectura radicular, se debe mencionar la señalización de fitorreguladores como son citoquininas (CK) y auxinas (AIA) (Bangerth et al., 2000; Nordstrom et al., 2004; Woodward y Bartel, 2005). Las células de una plántula tanto en raíz como en el brote son capaces de sintetizar CK. Los resultados obtenidos sugieren la posible participación de compuestos como CK que regulan positivamente el desarrollo y promueven el crecimiento de la raíz (Howell et al., 2003; Rahayu et al., 2005). Los extractos de hoja de moringa, son ricos en zeatina, una citoquinina que actúa junto con otros compuestos y minerales como un excelente potenciador de crecimiento.
Los resultados de este estudio contribuyen al conocimiento de los efectos benéficos de los extractos de hoja de moringa. Preliminarmente se describió su efecto positivo en cultivos de fríjol y rábano. La aplicación en campo podría permitir la formación de sistemas radiculares más robustos en el crecimiento y desarrollo de cultivos, mejorando la captación de agua y elementos esenciales, optimizando los recursos disponibles en el suelo, incrementando la producción y disminuyendo los costos de producción del cultivo.
CONCLUSIONES
El extracto de Moringa oleifera estimula la formación de la raíz principal y raíces laterales en Arabidopsis thaliana. La aplicación de extractos de plantas como M. oleifera, pueden estimular el crecimiento y desarrollo de cultivos, abre nuevas perspectivas para su aplicación en la agricultura.














