INTRODUCCIÓN
La "gota" o "tizón tardío" es uno de los problemas más limitantes del cultivo de papa causado por el patógeno Phytophthora infestans, esta enfermedad es capaz de afectar el follaje, tallos y el tubérculo en cualquier momento de desarrollo de la planta incluso en el almacenamiento (Marín y Mira, 1998) de no realizarse un control adecuado y preciso esta enfermedad puede llegar a causar el 100% de severidad (Montes et al., 2012). Esta enfermedad cobra importancia en el país puesto que para el 2017 se cosecharon 162.879 ha de papa con una producción de 3'706.563 t, siendo los departamentos de Cundinamarca, Boyacá y Nariño los principales productores (DANE - ENA, 2018), donde se siembran materiales altamente susceptibles como las variedades Diacol Capiro, Parda Pastusa, ICA Nevada y Tuquerreña que, además, los municipios productores presentan condiciones climáticas favorables para el desarrollo de esta enfermedad.
La alternativa más eficiente para el control de esta problemática se basa principalmente en el uso intensivo de fungicidas con moléculas protectantes y sistémicas (Granada et al., 2002) que representa un costo que oscila entre 10 y 30% del valor total de la producción de los cultivos de papa en el país (Jaramillo, 2004). Siendo los productos con moléculas sistémicas los más eficientes que presentan diferentes modos de acción como, por ejemplo, metalaxil afecta la síntesis de ARN ribosomal y por ende la síntesis de proteínas reduciendo el crecimiento del micelio (Nuninger et al., 1995); Cimoxanil por su parte posee un modo de acción multisitio y translaminar que incluye la inhibición de la síntesis de ADN, ARN, aminoácidos y lípidos, además afecta la respiración celular y la permeabilidad de la membrana celular (Erwin y Ribeiro, 1996; Garcia et al., 2008) y finalmente, Fluopicolide, ingrediente activo relativamente nuevo que se clasifica como piridinil-metil-benzamida que interrumpe la división celular y la mitosis actuando sobre las proteínas como la espectrina encargada de la estabilidad del citoesqueleto del patógeno (Briggs et al., 2006; FRAC, 2018).
El uso intensivo (hasta 18 aspersiones durante el ciclo del cultivo) de fungicidas sistémicos a lo largo del tiempo generan resistencia lo que se define como la disminución temporal de la sensibilidad a un determinado fungicida, resultado de la adaptación del patógeno. Así, por ejemplo, en el año 2001 se determinó que cerca del 75% de los aislamientos colectados en el departamento de Antioquia resultaron insensible a Metalaxil (Jaramillo, 2004), mientras que los resultados de sensibilidad a Cimoxanil han resultado variables (Ochoa, 2004).
Teniendo en cuenta la problemática el objetivo de la presente investigación se centró en determinar el nivel de sensibilidad de aislamientos de P. infestans a tres fungicidas sistémicos, con el fin de establecer acciones de monitoreo que apoyen a la toma de decisiones relacionadas con el uso de fungicidas de síntesis química en el cultivo de la papa en Colombia, puesto que la característica de resistencia al no ser heredable puede ser revertida por cambios en las estrategias de control químico (Pérez y Forbes, 2008).
MATERIALES Y MÉTODOS
Material evaluado
Las pruebas de sensibilidad se realizaron con 20 aislamientos de P. infestans obtenidos de Solanum tuberosum y S. phureja en el Departamento de Nariño y hacen parte del cepario del grupo de investigación de Genética y Evolución de Organismos Tropicales de la Universidad de Nariño (Tab. 1).
Tabla 1 Información aislamiento aislamientos de Phytophthora infestans.
| Código aislamiento | Localidad | Hospedero |
|---|---|---|
| SPP031 | Pasto | S. phureja |
| SPT055 | Túquerres | S. phureja |
| SPT056 | Túquerres | S. phureja |
| STA083 | Aldana | S. tuberosum |
| STG075 | Guachucal | S. tuberosum |
| STG105 | Pasto | S. tuberosum |
| STI155 | Ipiales | S. tuberosum |
| STI169 | Ipiales | S. tuberosum |
| STP062 | Pasto | S. tuberosum |
| STP063 | Pasto | S. tuberosum |
| STP067 | Pasto | S. tuberosum |
| STP113 | Pasto | S. tuberosum |
| STS035 | Sapuyes | S. tuberosum |
| STS037 | Sapuyes | S. tuberosum |
| STT144 | Túquerres | S. tuberosum |
| STT146 | Túquerres | S. tuberosum |
| STT159 | Túquerres | S. tuberosum |
| STT161 | Túquerres | S. tuberosum |
| STT162 | Túquerres | S. tuberosum |
Determinación de sensibilidad in vitro de los aislamientos
Para la determinación del efecto de los fungicidas sobre el patógeno se utilizaron los productos comerciales compuestos por Metalaxil 8% + Mancozeb 64%, Cimoxanil 6% + Propineb 70% y Fluo-picolide 6% + Propineb 66,7%, con el fin de asegurar la reproducibilidad del ensayo se hicieron tres replicas y tres repeticiones en el tiempo de cada tratamiento y un testigo absoluto sin fungicida. Las dosis evaluadas se calcularon en base a una escala exponencial, inicialmente se prepararon las soluciones stock a una concentración de 100.000 /μg mL-1 a partir de las cuales se prepararon las diferentes concentraciones que fueron adicionadas en el medio de cultivo agar tomate - arveja. El inoculo de 5 mm de diámetro se tomó de la zona de crecimiento activo de cultivos de 10 d y fue ubicado en el centro de cada caja petri con agar Tomate Arveja previamente suplementada con fungicida. Una vez efectuada la inoculación, las cajas petri se sellaron herméticamente y se incubaron a temperatura ambiente y oscuridad durante 10 d, desde el primer día se registró fotográficamente el crecimiento micelial y con los resultados de crecimiento final se calculó el porcentaje de inhibición.
Al décimo día se tomó el micelio formado en cada caja petri y se depositó en un volumen de 1,5 mL de agua destilada estéril, posteriormente se sometió a vortex por 30 s y se tomaron 100 /xL de esta solución para realizar el conteo de esporangios en cámara de Neubauer y se expresó como numero de esporangios sobre área de crecimiento final para cada uno de los aislamientos por tratamiento.
Determinación EC50
Se realizó un análisis Probit para encontrar la EC50 (concentración que reduce el crecimiento radial en un 50% respecto al control) con los valores de inhibición y concentración para cada uno de los aislamientos basado en un análisis de regresión lineal. Teniendo en cuenta los valores de EC50 calculados y de acuerdo con la clasificación de sensibilidad establecida por Wang et al. (2002).
Análisis de datos
Para determinar la existencia de diferencias significativas en esta investigación se realizaron tablas de contingencia con el programa Microsoft office Excel y se aplicó la prueba de Kruskal Wallis para comparar las concentraciones en el programa Minitab® 17.1.0 (© 2013 Minitab Inc).
RESULTADOS
Metalaxil 8% + Mancozeb 64%
Estos fungicidas redujeron el crecimiento del patógeno entre el 29 y 69% con las dosis 1 y 10 μg mL-1, respectivamente, alcanzando el 100% de reducción del crecimiento cuando se utilizaron las dosis 100 μg mL-1, 1.000 μg mL-1 y 10.000 μg mL-1 las cuales fueron letales para el inóculo. La prueba de Kruskal Wallis mostró que existen diferencias estadísticamente significativas (P<0,05) entre el control y los tratamientos (Tab. 2). Por otra parte, la acción antiesporulante de este fungicida se hizo efectiva a partir del tratamiento correspondiente a la dosis de 100 μg mL-1 hasta la dosis de 10.000 μg mL-1 inhibiendo el 100% la producción de esporangios (Tab. 3).
Tabla 2 Prueba de Kruskal Wallis (Bonferroni corrected) para porcentaje de inhibición entre concentraciones del fungicida Metalaxil 8% + Mancozeb 64%.
| Dosis (j/g mL-1) | Control | 10.000 | ||||
| Control | i | |||||
| 1 | 0,02863 | i | ||||
| 10 | 0,00044 | 0,18492 | 1 | |||
| 100 | 0 | 0 | 0,00002 | 1 | ||
| 1.000 | 0 | 0 | 0,00002 | 1 | 1 | |
| 10.000 | 0 | 0 | 0,00002 | 1 | 1 | 1 |
Tabla 3 Prueba de Kruskal Wallis (Bonferroni corrected) para tasa de esporulación entre concentraciones del fungicida Metalaxil 8% + Mancozeb 64%.
| Dosis (j/g mL-1) | Control | |||||
| Control | 1 | |||||
| 1 | 0,52906 | 1 | ||||
| 10 | 0,51616 | 0,98418 | 1 | |||
| 100 | 0 | 0 | 0 | 1 | ||
| 1.000 | 0 | 0 | 0 | 1 | 1 | |
| 10.000 | 0 | 0 | 0 | 1 | 1 | 1 |
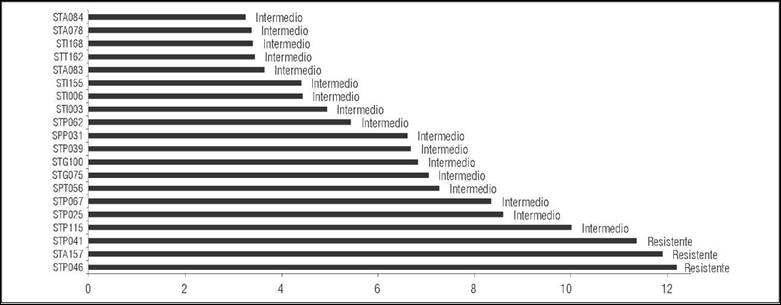
A partir de los resultados de inhibición se obtuvo el valor de la dosis media efectiva (EC50), encontrando que estos variaron entre 3,26 μg mL-1 en el aislamiento STA084 hasta 12,21 μg mL-1 en el aislamiento STP046 con un promedio de 6,67 μg mL-1 (Fig. 1) catalogando el 20% de los aislamientos resistentes y el 80% con sensibilidad intermedia.
Cimoxanil 6% + Propineb 70%
La concentración de 1 μg mL-1 causó una reducción promedio del 25% del crecimiento del patógeno con respecto al control y algunos aislamientos presentaron una alta sensibilidad a este producto, puesto que con la dosis mínima sus crecimientos fueron inhibidos en un 45% (aislamiento STI168) y 40% (aislamiento STT162). Cuando se evaluó la dosis de 10 μg mL-1, los porcentajes de inhibición presentaron un promedio del 89%, mientras que en las dosis superiores a esta (100, 1.000 y 10.000 μg mL-1) el porcentaje de inhibición fue 100% letal para el inóculo. Se encontraron diferencias significativas (P<0,05) entre el control y las concentraciones evaluadas (1, 10, 100, 1.000, 10.000 ug mL-1). Asimismo, hubo diferencias estadísticas (P<0,05) entre los tratamientos evaluados siendo las concentraciones de 1 y 10 μg mL-1 diferentes a las demás concentraciones (Tab. 4). La acción antiesporulante de este fungicida se evidenció a partir de la dosis 100 μg mL-1. El análisis estadístico mostró que existen diferencias estadísticas entre los tratamientos evaluados, siendo las dosis 1 y 10 μg mL-1 diferentes (P<0,05) a las dosis 100 hasta 10.000 μg mL-1, concentraciones en las cuales se inhibió el 100% la esporulación en todos los aislamientos (Tab. 5).
Tabla 4 Prueba de Kruskal Wallis (Bonferroni corrected) para porcentaje de inhibición entre concentraciones del fungicida Cimoxanil 6% + Propineb 70%.
| Dosis (j/g mL-1) | Control | K000 | 10^00 | |||
| Control | 1 | |||||
| 1 | 0,05047 | 1 | ||||
| 10 | 0,00005 | 0,03549 | 1 | |||
| 100 | 0 | 0 | 0,002 | 1 | ||
| 1.000 | 0 | 0 | 0,002 | 1 | 1 | |
| 10.000 | 0 | 0 | 0,002 | 1 | 1 | 1 |
Tabla 5 Prueba de Kruskal Wallis (Bonferroni corrected) para tasa de esporulación entre concentraciones del fungicida Cimoxanil 6% + Propineb 70%.
| Dosis (j/g mL-1) | Control | K000 | ||||
| Control | 1 | |||||
| 1 | 0,87894 | 1 | ||||
| 10 | 0,95142 | 0,83114 | 1 | |||
| 100 | 0 | 0 | 0 | 1 | ||
| 1.000 | 0 | 0 | 0 | 1 | 1 | |
| 10.000 | 0 | 0 | 0 | 1 | 1 | 1 |
Con respecto a los valores de EC50 para este fungicida se encontró que los valores oscilaron entre 0,02853 μg mL-1 (aislamiento STI168) y 6,8116 μg mL-1 (aislamiento STP046) con un promedio de 1,575 (Fig. 1). Estos valores permitieron clasificar los asilamientos siguiendo la escala propuesta por Wang et al. (2002) encontrando que el 85% presentaron sensibilidad intermedia, el 15% sensibilidad y ninguno resistencia a este fungicida.
Fluopicolide 6% + Propineb 66,7%
Los resultados mostraron que la combinación fúngica reduce el crecimiento del patógeno respecto al control en un 28,4% en la dosis 1 μg mL-1, algunos aislamientos presentaron valores bajos de inhibición con un 3,59% (aislamiento STP067), 5,06% (aislamiento STP056) y 6,91% (aislamiento STG075), lo que puede indicar que estos aislamientos pueden llegar a presentar un comportamiento resistente a futuro. Al evaluar la dosis 10 μg mL-1, los porcentajes de inhibición presentaron un promedio de 79,26%, mientras que las dosis mayores, entre 100 a 10.000 μg mL-1, producen una inhibición del 100% (Tab. 6).
Tabla 6 Prueba de Kruskal Wallis (Bonferroni corrected) para porcentaje de inhibición entre concentraciones del fungicida Fluopicolide 6% + Propineb 66,7%.
| Dosis (j/g mL-1) | Control | 10.000 | ||||
| Control | 1 | |||||
| 1 | 0,05074 | 1 | ||||
| 10 | 0,0001 | 0,05249 | 1 | |||
| 100 | 0 | 0 | 0,0001 | 1 | ||
| 1.000 | 0 | 0 | 0,0001 | 1 | 1 | |
| 10.000 | 0 | 0 | 0,0001 | 1 | 1 | 1 |
La actividad antiesporulante se evidenció a partir de la dosis 100 μg mL-1. El análisis estadístico mostró existencia de diferencias significativas entre las dosis 100, 1.000 y 10.000 μg mL-1 frente al control (P<0,05), en los cuales no se registró conteo de esporangios debido a que estas dosis resultaron letales al inóculo (Tab. 7).
DISCUSIÓN
Metalaxil 8% + Mancozeb 64%
Los resultados encontrados para la inhibición de crecimiento y esporulación corresponden a la característica del metalaxil como molécula altamente sistémica que afecta la síntesis de ARN ribosomal y la síntesis de las proteínas causando la reducción del crecimiento micelial y el desarrollo de esporangios del patógeno (Grunwald et al., 2006).
Los resultados de la dosis media efectiva (EC50) para este fungicida concuerdan con los reportados por Lagos (2002) al encontrar después de evaluar 63 aislamientos procedentes del Departamento de Nariño un 24% de reacción resistente. Dentro de las razones que expliquen la ausencia de poblaciones resistentes a metalaxil en este estudio, sean los cambios presentados en el ingrediente activo, ya que desde el año 2002 se ha distribuido en el mercado variantes dos veces más efectiva que el genérico conocido como Metalaxil - M. De igual manera, el uso intensivo de esta molécula para el control del tizón tardío en la zonas productoras de papa se ha visto reducida en virtud a la aparición de productos comerciales compuestos por nuevas mezclas que contienen fungicidas de tipo preventivo y curativo como Cimoxanil, Dimetomorf, Propamocarb o Estrobulinas (Santana et al. , 2013) y que resultan eficientes en el control del patógeno generando una sustitución gradual del metalaxil. Lo que indica que en general, las zonas productoras de papa en el Departamento de Nariño no generan una fuerte presión de selección y que aún se puede considerar el uso de productos a base de Metalaxil en programas de manejo que controlen este patógeno.
Los bajos niveles de sensibilidad del 20% de los aislamientos de P. infestans evaluados frente al fungicida compuesto por Metalaxil + Mancozeb encontrados en este estudio conducen a redoblar los esfuerzos por implementar estrategias antiresistencia en el Departamento de Nariño, según recomendadas de FRAC (2018) para el manejo de estos fungicidas y descritas por García et al. (2008) en los siguientes aspectos: implementar prácticas culturales de control, utilizar mezclas que incluyan fungicidas de tipo fenilaminas con productos protectantes multisitio en proporciones superiores al 75% y limitar el uso curativo o erradicarte de dichos fungicidas limitando el uso entre 2 a 4 aplicaciones por ciclo de cultivo en intervalos mínimos de 14 d.
Tabla 8 Clasificación de aislamientos de P. infestans según los valores de dosis media efectiva (EC50) del fungicida Metalaxil 8% + Mancozeb 64%.
| Clasificación | ||
|---|---|---|
| STP046 | 12,21 | Resistente |
| STA157 | 11,91 | Resistente |
| STP041 | 11,39 | Resistente |
| STP115 | 10,03 | Resistente |
| STP025 | 8,62 | Intermedio |
| STP067 | 8,38 | Intermedio |
| SPT056 | 7,29 | Intermedio |
| STG075 | 7,05 | Intermedio |
| STG100 | 6,84 | Intermedio |
| STP039 | 6,70 | Intermedio |
| SPP031 | 6,63 | Intermedio |
| STP062 | 5,46 | Intermedio |
| STI003 | 4,95 | Intermedio |
| STI006 | 4,44 | Intermedio |
| STI155 | 4,41 | Intermedio |
| STA083 | 3,65 | Intermedio |
| STT162 | 3,45 | Intermedio |
| STI168 | 3,42 | Intermedio |
| STA078 | 3,38 | Intermedio |
| STA084 | 3,26 | Intermedio |
Cimoxanil 6% + Propineb 70%
La eficiencia encontrada en la inhibición de producción de esporangios y crecimiento del patógeno, se deba a que este fungicida compuesto por Cimoxanil, un ingrediente activo que posee un modo de acción multisitio, incluye la inhibición de la síntesis de ADN, ARN, aminoácidos y lípidos, además de afectar la respiración celular y la permeabilidad de la membrana celular inhibiendo el crecimiento de micelio del oomycete durante el periodo de incubación (Escudero, 2005).
Con respecto a los valores de EC50 se encontró que los valores oscilaron entre 0.02853 μg mL-1 (aislamiento STI168) y 6,8116 μg mL-1 (aislamiento STP046), con un promedio de 1,575 (Fig. 2). Estos valores permitieron clasificar los asilamientos siguiendo la escala propuesta por Wang et al. (2002) encontrando que el 85% presentaron sensibilidad intermedia, el 15% sensibilidad y ninguno de los aislamientos mostró resistencia.
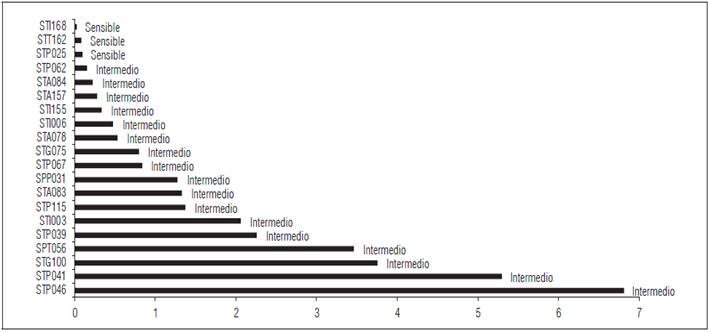
Figura 2 Dosis media efectiva (EC50) para aislamientos de Phytophthora infestans frente a Cimoxanil + Propineb.
Al comparar los valores encontrados de EC50 con otros estudios realizados en el país, se encuentra que es frecuente este comportamiento de sensibilidad en aislamientos de P. infestans frente a Cimoxanil. Estudios realizados por Lagos (2002) mostraron que de 64 aislamientos de P. infestans evaluados y procedentes de Nariño, el 83% resultó sensible al ingrediente activo Cimoxanil y ninguno alcanzó el nivel de clasificación de resistente. De igual forma, Ochoa (2004) al evaluar 50 aislamientos obtenidos de diferentes regiones de Colombia, encontró que ninguno tuvo la capacidad de crecer en medios de cultivos suplementados con una concentración del ingrediente activo Cimoxanil al 0,8 μg mL-1, estos resultados demuestran que en las poblaciones evaluadas no se reportó aislamientos resistentes a la molécula. En cuanto a evaluaciones con el producto comercial García et al. (2008) reporta que para poblaciones de P. infestans aisladas de los departamentos de Antioquia, Boyacá y Cundinamarca frente a Curzate M-8 (DuPont™), se observan altos niveles de sensibilidad con valores promedios de EC50 de 0,20 μg mL-1.
Tabla 9 Clasificación de aislamientos de P. infestans según los valores de dosis media efectiva (EC 50 ) del fungicida Cimoxanil 6% + Propineb 70%.
| Aislamiento | ||
|---|---|---|
| STP046 | 6.81 167519 | Intermedio |
| STP041 | 5.29215813 | Intermedio |
| STG100 | 3.75804642 | Intermedio |
| SPT056 | 3.46753449 | Intermedio |
| STP039 | 2.26203998 | Intermedio |
| STI003 | 2.06494207 | Intermedio |
| STP115 | 1.3771 1758 | Intermedio |
| STA083 | 1.33328641 | Intermedio |
| SPP031 | 1.28169424 | Intermedio |
| STP067 | 0.83474941 | Intermedio |
| STG075 | 0.79677689 | Intermedio |
| STA078 | 0.53733513 | Intermedio |
| STI006 | 0.48214208 | Intermedio |
| STI155 | 0.33825317 | Intermedio |
| STA157 | 0.27725433 | Intermedio |
| STA084 | 0.23039431 | Intermedio |
| STP062 | 0.151 17051 | Intermedio |
| STP025 | 0.09758411 | Sensible |
| STT162 | 0.09145114 | Sensible |
| STI168 | 0.02853526 | Sensible |
Los resultados encontrados permiten indicar la ausencia de poblaciones del patógeno resistente a Cimoxanil en las zonas productoras de papa en el Departamento de Nariño, indicando que la presión de selección no es muy fuerte y que el uso de fungicidas a base de Cimoxanil aún es un control eficiente de la enfermedad. Esto se debe principalmente a que la molécula ya no es utiliza de manera intensiva por la aparición de nuevas moléculas preventivas y curativas para el control de P. infestans, lo que facilita realizar rotaciones de ingredientes activos entre aplicaciones.
A pesar que Cimoxanil es calificado por la FRAC (2018) con un nivel de riesgo bajo, el hecho de encontrar aislamientos de P. infestans con valores de EC50 superiores hasta cinco veces con respecto al promedio encontrado en el resto de la población, es un indicativo de la necesidad de continuar con el monitoreo y especialmente de establecer medidas que eviten la aparición de aislamientos resistentes al producto, reduciendo la utilización de productos cuyo ingrediente activo sistémico sea Cimoxanil como un producto erradicante y alternando su aplicación con otros fungicidas sistémicos que presenten diferentes ingredientes activos y modos de acción (Gullino et al., 1997).
Fluopicolide 6% + Propineb 66,7%
La inhibición del crecimiento del patógeno se debe a que el fungicida interrumpe la división celular y la mitosis actuando sobre una proteína conocida como espectrina, la cual desempeña un papel vital en la estabilidad del citoesqueleto del patógeno, además induce lisis del micelio (Toquin et al., 2007; Briggs et al., 2006; FRAC, 2018). Por otra parte, la actividad antiesporulante se lleva a cabo primero con la detención, seguido del hinchamiento y ruptura de las estructuras reproductivas (esporangio y zoosporas) después de un minuto de ser tratados con el fungicida (Toquin et al., 2007).
Los resultados de esta investigación difieren a los obtenidos por Saville et al. (2015) reportan una EC-50 promedio de P. infestans frente a el ingrediente activo Fluopicolide (99.1 %) de 0.47 μg mL-1. Por otro lado, Keinath y Kousik (2011) en su evaluación de sensibilidad de aislamientos de P. infestans frente a Fluopicoli-de reportan valores de EC-50 valores promedio de 0,22 μg mL-1. Es importante destacar que los resultados de estos trabajos difieren con los reportados en esta investigación debido a que las metodologías de evaluación utilizadas y la fuente de la molécula química empleada fueron diferentes, pues en dichos trabajos se utilizó el ingrediente activo en grado técnico con una concentración del 99,1%, mientras que en este estudio la fuente correspondió a una formulación comercial, en la que el ingrediente activo Fluopicolide se encuentra al 6% además de estar acompañado por el fungicida protectante Propineb al 66,7%.
Tabla 10 Clasificación de aislamientos de P. infestans según los valores de dosis media efectiva (EC 50 ) del fungicida Fluopicolide 6% + Propineb 66,7%.
| Aislamiento | Ec50 |
| STP067 | 7,429858586 |
| STA157 | 7,289353415 |
| STI155 | 5,58909584 |
| STG075 | 5,332464088 |
| SPT056 | 5,009433128 |
| STP046 | 4,787867895 |
| STP115 | 3,995937667 |
| STA083 | 3,124509027 |
| STA078 | 2,502246318 |
| STI006 | 1,41583901 |
| STG100 | 1,15449664 |
| STP025 | 1,037538963 |
| STI003 | 0,814346463 |
| SPP031 | 0,653942765 |
| STP041 | 0,618132027 |
| STP039 | 0,542802924 |
| STP062 | 0,521781635 |
| STI168 | 0,506779778 |
| STA084 | 0,041677145 |
| STT162 | 0,025894094 |
Hasta la fecha no se conocen reportes de resistencia de poblaciones P. infestans a Fluopicolide (FRAC, 2018), por tal razón es importante implementar programas anti resistencia como lo propone la FRAC, quienes recomiendan el uso de mezclas de tanque o mezclas comerciales que incluyan fungicidas del tipo fenilamidas con productos protectantes multisitio, además de establecer una línea base del nivel de sensibilidad de P. infestans a Fluopicolide, de modo que cambios a futuro encaminados a generar resistencia en las poblaciones de este patógeno puedan ser comparados con la línea base de sensibilidad establecida y de esa manera tener más control sobre el uso de productos con este ingrediente activo (Keinath y Kousik, 2011). Es importante destacar que este estudio que establece las EC50 para este ingrediente activo (Fluopicolide) será útil a futuro como punto de referencia para investigaciones posteriores puesto que hasta el momento no se han realizado escalas para determinar la sensibilidad de P. infestans frente a este fungicida.
CONCLUSIONES
Los aislamientos de Phytophthora infestans evaluados presentaron diferentes niveles de sensibilidad al fungicida compuesto por Metalaxil + Mancozeb, encontrando asilamientos resistentes (20%) y medianamente sensibles (80%), debido al uso intensivo de fungicidas que contienen Metalaxil, lo cual ha llevado a que las poblaciones presenten o puedan llegar a presentar un proceso de adaptación a la molécula dando lugar a bajos porcentajes de inhibición y altos valores de EC50.
La inhibición del crecimiento micelial y la esporulación de P. infestans se vio reducida para los tres fungicidas a partir de la dosis 100 μg mL-1, la diferencia se encontró en los valores de EC50 en donde los fungicidas a base de Cimoxanil + Propineb y Fluopicolide + Propineb presentaron valores más bajos a los del fungicida a base de Metalaxil + Mancozeb, encontrando para Cimoxanil + Propineb aislamientos sensibles (15%) y medianamente sensibles (85%) y ningún aislamiento resistentes.