INTRODUCCIÓN
La agricultura requiere del uso intensivo de fertilizantes nitrogenados: nitrato (NO3 -), amonio (NH4+) o urea (CH4N2O). Su aplicación a base de NO3 - - y NH4 +- genera problemas ambientales como eutrofización de reservorios de agua, contaminación de acuíferos y polución atmosférica. Dicha problemática es un asunto serio de reconocimiento mundial, de preocupación pública y económica (Esteban et al., 2016). Entre las estrategias de los programas del manejo de la fertilización se debe considerar el acervo del NH4 + recientemente fijado para reducir sus pérdidas en el suelo e incrementar el uso eficiente del N (Nieder et al., 2011).
Las principales fuentes de nitrógeno tomadas por las raíces de las plantas son NO3 - y NH4 +. Dependiendo de la especie vegetal, etapa de desarrollo y órgano, el contenido de N necesario para el crecimiento óptimo varía entre 1 y 5% de la masa seca de las plantas puesto que constituye proteínas, ácidos nucleicos, clorofila, coenzimas, fitohormonas y metabolitos secundarios. La asimilación de estos iones tiene diferentes costos potenciales con respecto a energía y agua, siendo el NH4 + la fuente menos costosa, mientras que el NO3 - debe ser reducido a NH4 + para ser asimilado por la planta; usando el equivalente de 8 a 12 moles de ATP para cada mol de NO3 - reducido. La asimilación de NH4 + requiere de cinco ATPs por cada mol (Hawkesford et al., 2012).
El desempeño de las plantas es óptimo cuando las dos formas principales de N se suministran en una relación particular. La mejor relación a aplicar varía con factores como etapa fenológica (Cui et al., 2017) y temperatura (Liu et al., 2017). Un desbalance en la relación NH4 +:NO3 - puede afectar la solubilidad y disponibilidad de otros nutrientes esenciales para las plantas, debido a cambios en el pH del entorno radical (Helali et al., 2010). La toxicidad (sensibilidad) y tolerancia a NH4 + en plantas desde la hipótesis clásica hasta la más reciente es ampliamente abordada por Esteban et al. (2016), para quienes los cultivos de papa o remolacha azucarera en general son más sensibles a NH4 + que sus respectivos parientes silvestres; sin embargo, arroz, arándanos y cebolla se han adaptado a altas concentraciones y raramente alcanzan umbral de toxicidad por NH4 +. Esta relación también está asociada con susceptibilidad o tolerancia a plagas y enfermedades, conforme Zanic et al. (2011), para quienes con mayor concentración de N y alta proporción de NO3 - se aumenta la severidad de la infestación con mosca blanca en el estrato medio de plantas de tomate. Asimismo, dependiendo de la especie, dicha relación afecta indicadores del desarrollo y la nutrición mineral de las plantas. Según González et al. (2009), la relación NH4 +:NO3 - 0:100 en cebollín favoreció el área foliar y la producción de biomasa; la 20:80 en albahaca incrementó el rendimiento; y en eneldo no se observó diferencias en altura de planta, área foliar y biomasa total en las relaciones estudiadas. Mientras que en tomate la relación NO3 -:NH4 + 70:30 redujo la concentración de Ca foliar e incrementó la de P, también redujo alguno indicadores de crecimiento sin afectar la productividad, viabilizando el uso de la fuente amoniacal (Terraza et al., 2012). En lechuga se absorbe preferencialmente más NH4 + que NO3 -, e incrementos de hasta 30% del N total estimulan el crecimiento, probablemente como consecuencia del aumento en la absorción de P, resultante de un mejor control del pH en la zona radical. Los contenidos foliares de P, Mn, Zn y Cu aumentaron en función del incremento de la fuente amoniacal (Savvas et al., 2006).
Vélez (2012) en un sistema de cultivo en sustrato para clavel estándar cv. Delphi sometido a tres porcentajes de recirculación de drenajes reportó valores entre 70 y 510 mg L-1 de NO3 - en el lixiviado, por encima del máximo permitido por la Organización Mundial de la Salud (50 mg L-1) (WHO, 2011) y por la Agencia para la Protección del Medio Ambiente Norteamérica (10 mg L-1) (EPA, 2009). Y, aunque en el tratamiento con menos nitrógeno en la fórmula de fertirriego utilizada en miniclavel cv. Rony, Casas (2015) reportó una reducción en la concentración de nitrato en el lixiviado, está aún fue superior a 100 mg L-1, por encima del máximo permitido para aguas superficiales que se destinaran a tratamiento y luego consumo humano, según el Decreto 1594 de 1984 (concentración máxima de 10 mg L-1) (OAB, 2019).
Colombia presenta alrededor de 1.120 ha sembradas de clavel (Cámara de Comercio de Bogotá, 2015) que ha venido implementado el sistema de cultivo en sustrato, con un consumo de 150 a 220 mg L-1 de N en la fórmula de fertirriego, en 1 m3 de agua por cama por semana. El sistema genera una solución salina en el lixiviado, que corresponde entre 20 y 50% del volumen de agua aplicado por cama (Lorenzo et al., 1993). Por lo tanto, este sistema genera impactos ambientales negativos derivados del alto consumo de agua y del vertimiento de sales fertilizantes al medio ambiente. El potencial impacto ambiental en el agroecosistema de la Sabana de Bogotá aún no ha sido dimensionado.
Los esfuerzos por remediar esta situación teniendo en cuenta que la dinámica de la relación NH4 +:-NO3 - es compleja, dado que la asimilación de NH4 + por la planta es menos costosa en términos energéticos (Hawkesford et al., 2012), en condiciones aeróbicas se nitrifica (Coskun et al., 2017), es retenido en función de la capacidad de intercambio catiónico del sustrato (Nieder et al., 2011), la pérdida de NO3 - por lixiviación representan una amenaza ambiental y a la salud humana (Cameron et al., 2013), las relaciones NH4 +:NO3 - afectan la disponibilidad de nutrientes en la solución del suelo o sustrato (Helali et al., 2010), y el contenido de otros nutrientes en el tejido y los componentes de la producción (González et al., 2009). Por tanto, la disminución en la concentración del N total busca optimizar la fórmula de fertirriego y el aumento de la relación NH4 +:NO3 - pueden proveer información acerca de una mejor utilización y optimización el uso del N, de manera que se pueda afectar los contenidos de sales en el lixiviado, a fin de mitigar el impacto ambiental.
Es por esto, el objetivo del presente ensayo fue estudiar el efecto de la disminución de N y el aumento de la relación NH4 +:NO3 - en la solución de fertirriego utilizada para clavel (Dianthus caryophyllus L.), sobre el contenido de elementos en el tejido vegetal, el sustrato y el lixiviado.
MATERIALES Y MÉTODOS
La investigación se llevó a cabo en el Centro Agropecuario Marengo (CAM) de la Universidad Nacional de Colombia, sede Bogotá, ubicado en Mosquera (Cundinamarca) a 4°42' N y 74°12' W 2.540 msnm, 12,4°C de temperatura promedio anual, humedad relativa entre 76 y 89% y precipitación promedio anual de 1.124 mm (Ordoñez y Bolivar, 2014). Durante el estudio el promedio de temperatura y humedad relativa dentro del invernadero fueron de 17,5°C y 76%, respectivamente.
Para el ensayo se utilizó un invernadero tradicional de estructura metálica tipo flexon (Acuña y Ortiz, 2004), con ventilación lateral y cenital pasivas, en el cual se acondicionaron dos naves, de 9x70 m (630 m2). Se utilizaron seis camas de madera de 7,0 x 0,7 m levantadas a 0,4 m del suelo. Tuvieron doble contenedor de 0,25x0,2 m y al final de la pendiente se ubicó un tanque recolector de lixiviado. Se sembraron esquejes con raíz de clavel estándar (Dianthus caryophyllus L.) cv. Don Pedro a densidad 15,5 plantas/m2 en un sistema abierto de fertirriego. El sustrato consistió en la mezcla 50% cascarilla de arroz cruda (in natura), 15% cascarilla de arroz tostada, 25% de cascarilla de arroz tostada reutilizada y 10% compost, obtenido de los residuos de cultivo de rosa y clavel (v/v/v/v). La CE y el pH de la mezcla osciló entre 0,5 y 1,0 dS m-1 y entre 6,8 y 7,0, respectivamente. El manejo agronómico del cultivo se hizo conforme a lo descrito en Flórez et al. (2006).
Se establecieron seis tratamientos correspondientes a modificaciones en el contenido de N de la fórmula convencional aplicada comercialmente al cultivo de clavel (200-160 mg L-1 de N total para las fases vegetativa y productiva del cultivo, respectivamente, manteniendo una relación NH4+:NO3 - de 15:85). En esta fórmula el N total se redujo en 30% y la relación NH4 +:NO3 - se disminuyó o aumento en 10% (Tab. 1). En las soluciones de fertirriego la CE se mantuvo entre 1,5 y 2,5 y el pH entre 5,5 y 6,0; las concentraciones de los demás elementos (mg L-1) en las fases vegetativa y reproductiva fueron: P, 30; K, 150; Ca, 120; Mg, 40; Fe, 3; Cu, 1; Zn, 0,5; B, 1; Mo, 0,1; S osciló entre 2 y 116 mg L-1 en razón al balance estequiométrico de la fórmula para el ajuste de NH4 +. El cálculo de las soluciones nutritivas contempló los aportes de agua (CE = 0,6 y pH = 7,0) y los contenidos de Mn en el sustrato a base de cascarilla de arroz tostada (Martínez y Roca, 2011).
La determinación de la variable masa seca se registró en tres muestreos de carácter destructivo de la planta a las 16, 21 y 26 semanas después de siembra (SDS). En estas semanas se tomaron tres muestras de sustrato y una de lixiviado por tratamiento. La muestra de sustrato consistió en 1 kg aproximadamente por unidad experimental y 1 L aproximadamente de lixiviado en el canal de la cama por tratamiento. Se transportaron en condiciones refrigeradas. En tejido vegetal y sustrato se determinaron los contenidos de N, P, K, Ca, Mg, Cu, Fe, Mn, Zn y B de acuerdo con la metodología descrita por Carrillo et al. (1994); así como el pH del sustrato. En el lixiviado se determinó NO3-, NH4+, PO4, K+, HCO3, Ca++, Mg++, Na+, pH y CE de acuerdo con Rice et al. (1967). Los análisis se realizaron en el Laboratorio de Aguas y Suelos de la Facultad de Ciencias Agrarias de la Universidad Nacional de Colombia. El balance de nitrógeno fue calculado teniendo en cuenta el contenido de N en la fórmula de fertirriego, volumen total de lixiviado y la masa seca del último muestreo.
Se utilizó un diseño experimental completamente aleatorizado en arreglo factorial con dos niveles de nitrógeno total y tres relaciones NH4 +:NO3 - (Tab. 1). Los seis tratamientos tuvieron tres réplicas y la unidad experimental consistió en 2 m de cama con 46 plantas. El análisis inferencial se realizó por medio de análisis de varianza (Anova) y comparación múltiple de Tukey, con nivel de significancia α= 0,05. Se verificó normalidad y homogeneidad de varianza en los residuales por medio de las pruebas de Shapiro-Wilk y Levene, respectivamente, para validar el modelo ajustado. Todos los análisis fueron realizados con el software estadístico SAS v. 9.1.
Tabla 1 Concentraciones y relaciones NH4+:NO3 - de nitrógeno evaluadas en la fórmula de fertirriego utilizada en el cultivo de clavel cv. Don Pedro sembrado en sustrato.
| NH4+: NO3 - | ||||||||||||
| Tratamientos | NH4+ | NO3- | N total | NH4+ | NO3- | N total | ||||||
| % | (mg L-1) | |||||||||||
| 5% N-NH4 | 5:95 | 10 | 190 | 200 | 8 | 152 | 160 | |||||
| 15% N-NH4 | 15:85 | 30 | 170 | 24 | 136 | |||||||
| 25% N-NH4 | 25:75 | 50 | 150 | 40 | 120 | |||||||
| 30% menos N | 5% N-NH4 | 5:95 | 7 | 133 | 140 | 5,6 | 106,4 | 112 | ||||
| 15% N-NH4 | 15:85 | 21 | 119 | 16,8 | 95,2 | |||||||
| 25% N-NH4 | 25:75 | 35 | 105 | 28 | 84 | |||||||
RESULTADOS Y DISCUSIÓN
Contenido de nutrientes en el tejido vegetal
Disminución de nitrógeno total
Las concentraciones de N total en la fórmula de fertirriego evaluadas no presentaron diferencias estadísticamente significativas en las concentraciones de P, K, Ca, Mg, Fe, Mn y B en el tejido de la planta (datos no mostrados). Sin embargo, se evidenciaron diferencias estadísticamente significativas en algunos estadios fenológicos para N, Cu y Zn (Tab. 2).
Tabla 2 Contenidos de N, Cu, Zn y Mg en el tejido vegetal de plantas completas de clavel cv. Don Pedro, con disminución del N total e incrementos en el componente de N-NH4 + en la fórmula de fertirriego.
| Tratamiento | Semana después de siemb | ra | |
|---|---|---|---|
| 16 | 21 | 26 | |
| N* (mg L-1) | N (%) | ||
| 200 - 160 | 2,80 a | 1,89 a | 2,32 a |
| 140 - 112 | 2,92 a | 1,17 b | 2,74 a |
| Cu (mg kg-1) | |||
| 200 - 160 | 7,99 a | 7,91 a | 6,41 a |
| 140 - 112 | 8,03 a | 9,15 b | 7,12 a |
| Zn (mg kg-1) | |||
| 200 - 160 | 60,97 a | 76,75 a | 51,68 a |
| 140 - 112 | 72,93 b | 72,32 a | 60,46 a |
| N-NH4+ (%) | N (%) | ||
| 5 | 2,69 a | 1,60 a | 2,29 a |
| 15 | 2,94 b | 1,50 a | 2,62 b |
| 25 | 2,95 b | 1,48 a | 2,67 b |
| Mg (%) | |||
| 5 | 0,40 a | 0,37 a | 0,30 a |
| 15 | 0,35 b | 0,30 b | 0,28 a |
| 25 | 0,34 b | 0,31 b | 0,33 a |
| Zn (mg kg-1) | |||
| 5 | 67,18 a | 61,02 a | 56,57 a |
| 15 | 59,15 a | 68,72 a | 55,80 a |
| 25 | 74,52 a | 93,86 b | 55,84 a |
Promedios seguidos por la misma letra en la columna, indican una diferencia significativa según la prueba de Tukey (P<0,05). * Concentraciones de N total (mg L-1) para las fases vegetativa y productiva del cultivo, respectivamente.
El muestreo a las 21 SDS, las plantas del tratamiento con menor concentración de N (140-112N) muestran un contenido significativamente menor de N con respecto al tratamiento con mayor concentración (200-160N) (Tab. 2); de manera contrastante se encontró un contenido significativamente mayor de Cu en 140-112N (Tab. 2). Con lo cual, se visualiza una posible relación inversa entre N y Cu. También se constató una concentración significativamente mayor de Zn en el tratamiento 140-112N, en comparación con el tratamiento 200-160N (Tab. 2). Reportes sobre el tema donde se evalúan diferentes dosis de NPK en clavel cv. Master, por ejemplo, la dosis más baja de fertilización (75 mg L-1 de NPK), Singh et al. (2015) reportaron el menor porcentaje de N en el tejido foliar (1,8%); la aplicación de la dosis más alta de fertilización, El-Naggar (2009) encontró mayor contenido de N foliar en clavel cv. Red Sim. La relación N:Cu descrita en el presente estudio fue abordada por Broad-ley et al. (2012), donde concentraciones altas de N promueven la deficiencia de Cu. Navarro y Navarro (2003) afirman que en pastos la adición de dosis crecientes de fertilizantes nitrogenados en suelos con deficiencia de Cu origina descensos en la concentración de Cu; sin embargo, al adicionar Cu al suelo, incluso en presencia de fertilizantes nitrogenados, se incrementa el contenido de Cu en la planta. Asimismo, de acuerdo con Broadley et al. (2012), en condiciones de alto suministro de N, el contenido de Cu de las raíces se incrementa proporcionalmente a su concentración externa, aunque se inhibe drásticamente su transporte a la parte aérea.
Para el caso de Zn, cantidades elevadas de compuestos nitrogenados influye en el movimiento del elemento en el suelo; también puede provocar deficiencia de Zn a causa de la cinética de absorción propia de los dos elementos (Navarro y Navarro, 2003). Sin embargo, en semillas de canola Gao y Ma (2015) observaron que la concentración de Zn disminuyó con el menor suministro de N e incrementó con altos niveles de N. Rehman et al. (2018) indican que la aplicación de N aumenta la concentración y absorción de Zn en semillas de cereales; aunque, Kumar et al. (1985) encontraron efecto sinérgico en plantas de mijo perla entre las aplicaciones de N sobre las concentraciones de Zn en hojas y tallos, y antagónico en raíz.
Aumento de nitrógeno amoniacal
El aumento de N-NH4+ en la relación NH4+:NO3 - de la fórmula de fertirriego no presentó diferencias estadísticamente significativas en los contenidos de P, K, Ca, Cu, Fe, Mn y B en el tejido de la planta (datos no mostrados). Sin embargo, en los contenidos de N, Mg y Zn se evidencian diferencias estadísticamente significativas en algunos estadios fenológicos evaluados (Tab. 2).
En las 16 y 26 SDS las plantas con más contenido de NH4, 15 y 25%, respectivamente, de manera consecuente presentaron porcentajes significativamente mayores de N en el tejido de la planta (Tab. 2). Asimismo, en la 21 SDS, las plantas sometidas a mayor porcentaje de NH4 + (25%) presentaron contenidos significativamente mayores de Zn, con respecto a los tratamientos con 5 y 15% de NH4 + (Tab. 2). Contrario a lo visto con Mg a las 16 y 21 SDS, cuando con el menor porcentaje de NH4 + (5%) se observaron los mayores contenidos del ion (Tab. 2).
En estudios con adición de NH4 + en las soluciones nutritivas formuladas con NO3 -, Lorenzo et al. (2000) encontraron en rosa bajo hidroponía una mayor tasa de absorción de N durante la elongación del tallo y comportamiento similar en la absorción de K, mientras que la concentración de P aumenta solo en las raíces de las plantas. Choi et al. (2011) también encontraron que al aumentar la relación NH4+:NO3 - (65:35 y 100:0) se presentaron mayores porcentajes de N total en el tejido de las plantas de fresa, en comparación con la solución de menor proporción de NH4 +. Por otra parte, Abasi et al. (2016) evaluaron el efecto de cinco relaciones NH4+:N03- (0; 0,038; 0,074; 0,11 y 0,14) en tulipán, y contrario a lo encontrado en el presente estudio, las plantas con mayor proporción de NH4 + (0,14) presentaron concentraciones significativamente más bajas de N en los bulbos de las plantas (0,84%); los autores afirman que las plantas fertirrigadas con NO3 - generalmente tienen una concentración alta de N en comparación con las fertirrigadas con NH4 +. Sin embargo, Mengel y Kirkby (2001) señalan que las plantas fertilizadas con NH4 + tienen una mayor concentración de N en los tejidos de la parte aérea.
A mayores concentraciones de NH4+ en la solución nutritiva se disminuye la absorción de cationes como K, Ca y Mg. Con la relación NO3-:NH4+ de 70:30 la solución nutritiva para tomate, Terraza et al. (2012) encontraron 0,59% de Mg foliar, significativamente menor que en los tratamientos con relaciones 100:0 y 85:15, con 1,07 y 1,05%, respectivamente, de Mg foliar. Para Abasi et al. (2016) las concentraciones de N en bulbo y de Ca, Mg y K en la parte aérea del tulipán se vieron significativamente afectadas por la fuente de N. En general, en las plantas fertilizadas con NH4 + se observaron concentraciones más bajas de los cuatro elementos, con 0,84, 1,10, 0,80 y 0,53%, respectivamente. En la mayoría de los casos, el ajuste osmótico en plantas fertilizadas con NH4 + se afecta negativamente debido a la reducida absorción de tales cationes (Guo et al., 2007).
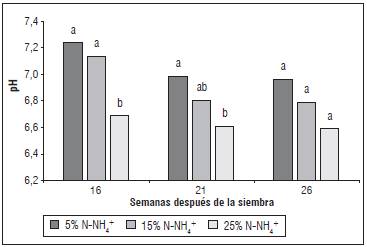
Savvas et al. (2006) en lechuga hidropónica con recirculación encontraron que las concentraciones de K, Ca, Mg y Fe en el tejido foliar no se vieron afectadas, mientras que P, Mn, Zn y Cu mejoraron al aumentar la proporción de NH4 +. En suelos neutros o alcalinos la acidificación de la rizosfera con la aplicación de amonio puede mejorar la movilización de fosfatos de calcio poco solubles y en consecuencia aumentar la absorción de P; asimismo aumenta la absorción de micronutrientes como B, Fe, Mn y Zn (Neumann y Rõmheld, 2012); para Alloway (2008) dicho efecto acidificante marcado aumenta la disponibilidad de Zn. Por lo tanto, el efecto del aumento en la proporción de NH4 + sobre el ion Zn puede atribuirse al impacto del NH4 + sobre el pH de la rizosfera (Tab. 2 y Fig. 2).
Contenido de NO3 en lixiviados
El NO3 - en el lixiviado no presentó diferencia significativa con los aumentos de NH4 + (datos no mostrados) pero sí con disminución de nitrógeno total. A las 16 y 26 SDS el contenido de NO3 - en el tratamiento 140-112 N fue significativamente menor en comparación con 200-160 N, alcanzando 49,5 y 41,1% menos NO3 - en el lixiviado, respectivamente en cada muestreo (Fig. 1). No se presentó diferencia significativa a la 21 SDS, probablemente debido al cambio de fórmula entre la fase vegetativa y productiva.
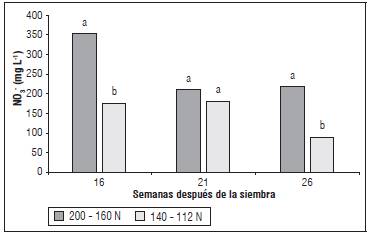
Figura 1 Valores promedio del contenido de nitrato en el lixiviado de un sistema de cultivo sin suelo con plantas de clavel cv. Don Pedro con disminución del N total en la fórmula de fertirriego. Análisis de forma independiente del porcentaje de NH4 +. Promedios con letras distintas indican una diferencia significativas con la prueba de Tukey (P<0,05).
Al respecto, Thompson et al. (2013) encontraron que mayores aplicaciones de N en plantas de tomate, entre 463 a 479 kg ha-1 de N, el porcentaje de lixiviación de NO3 - aumento de 31 a 37%, respectivamente; demostrando que al reducir la concentración del N en función del aplicado vs. absorbido se disminuye considerablemente la pérdida de NO3 - por lixiviación. De forma similar, Gheysari et al. (2009) encontraron que la mayor lixiviación de N durante el ciclo de cultivo en maíz coincide con la mayor aplicación de riego y dosis altas de N. El mismo patrón fue observado por Liang et al. (2011) en avena, donde la concentración de NO3 - en el lixiviado se incrementó de 11,3 a 17,2 mg L-1 con el aumento dosis de N. Otros factores como la fuente del fertilizante, forma y momento de aplicación pueden influir en la lixiviación (Broschat, 1995). La magnitud de la pérdida de iones por lixiviación es proporcional a la concentración del elemento en la solución del suelo y a la cantidad de agua drenada (Ghiberto et al., 2009).
Hong et al. (2014) mostraron que la producción de tomate en sistemas intensivos pueden llevar lixiviar cantidades de N cercanos a 788,6 kg ha-1 en todo el ciclo, unos 65,7 kg ha-1 por d. Bar-Yosef et al. (2009) mencionan observaciones semejantes en cuanto a la forma soluble de N en el lixiviado, aunque se aplicaran diferentes dosis y modos de fertilización; mientras Thompson et al. (2013), indican que la alta eficiencia en el uso de N es resultado de una concentración relativamente baja de N en el lixiviado.
pH en el sustrato
La reducción de pH en el sustrato fue estadísticamente significativa a las 16 y 21 SDS con el incremento de NH4+ (Fig. 2). En geranio, petunia e Impatiens,Dickson et al. (2016) observaron que dichos cambios varían con la especie y la relación NH4+:NO3 - aplicada. La solución 0% NH4 + mostró una reacción básica en todas las especies, con valores mayores en petunia en comparación con las otras dos especies; la solución 10% NH4 +, mostró una reacción neutra en geranio e Impatiens y básica en petunia. Finalmente la solución 20% NH4+, en geranio e Impatiens presentaron una reacción ácida y en petunia sin diferencia al pH neutro. De manera similar, ensayos en Ozothamnus diosmifolius (Silber, 2009) indican que el aumento en la concentración de NH4 +, por vías N total y relación NH4+:NO3 -, resultan en una marcada disminución de pH, entre 4 y 5, con la concentración 150 N total y relación 3:1. A pesar de la toxicidad provocada por las altas concentraciones de NH4 + en la solución del suelo que disminuye el pH (Silber, 2009; Esteban et al., 2016), como en el presente estudio se utilizó un sustrato con tendencia a valores de pH altos (pH ~7) (Vélez et al., 2014), la reducción de pH en el sustrato por aplicación de NH4 + habría generado un efecto benéfico al cultivo, con valores alcanzados en los tratamientos con mayor porcentaje de amonio próximos a 6,6, lo cual es descrito ampliamente en la literatura (Taiz y Zeiger, 2002; Neumann y Rõmheld, 2012), la franja de pH donde se aumenta la disponibilidad de la mayoría de los nutrientes.
Balance de nitrógeno
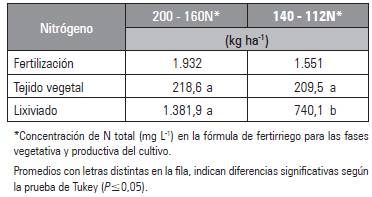
El contenido de N en el tejido vegetal no presentó diferencia significativa entre tratamientos mientras que el contenido de N lixiviado fue significativamente mayor en el tratamiento con la dosis alta de N (200-160N) (Tab. 3 ). Lo anterior evidencia una posible sobrefertilización nitrogenada en razón que a pesar de disminuir la concentración del N aplicado no se presenta un menor contenido de N en el tejido vegetal; observándose además pérdida de N en el lixiviado. Al contrario, Cabrera (2003) determinó en Ilex y Lagers-troemia, especies ornamentales leñosas, una relación directa entre la concentración de N aplicado y el porcentaje de este ion en el tejido foliar; sin embargo, las pérdidas de N por lixiviación cambiaron de 17,4% con la concentración más baja de N (15 mg L-1) a 52% con las concentraciones mayores (210 y 300 mg L-1), resultados similares a los encontrados en el presente estudio.
CONCLUSIONES
La reducción de nitrógeno total e incremento de la relación NH4 +:NO3 - modificó los contenidos de nutrientes en el tejido vegetal de clavel. Con el menor contenido de N total en la fórmula de fertirriego se aumentaron significativamente los contenidos de Cu y Zn. El incremento de NH4 + elevó significativamente los contenidos de N y Zn, y redujo Mg; también disminuyó significativamente el pH del sustrato.
La reducción de N total al 30% disminuye significativamente la pérdida de N por lixiviación a la semana 16 (49,5% <NO3) y 26 (41,1% <NO3) después de la siembra.
Los contenidos de N en el tejido de clavel no se vieron afectados significativamente por la reducción de N total, pero se logra una disminución significativa en la pérdida de N por lixiviación resultando en mayor eficiencia en el uso de nitrógeno