Introducción
La enfermedad de Parkinson (EP) es la segunda enfermedad neurodegenerativa más común después del Alzheimer, presentando una prevalencia de 4,7/1000 casos (Duque et al., 2015; Elbaz et al., 2016) y llegando a afectar alrededor del 1% de la población mayor de 60 años (Elgebaly et al., 2018). Actualmente, se ha identificado que además de los síntomas motores, como el temblor, la rigidez y la bradicinesia (Pagano et al., 2016; Zhang et al., 2021), esta enfermedad se relaciona con la aparición de déficits cognitivos, alteraciones del estado de ánimo y anormalidades conductuales (Armstrong & Okun, 2020; Rodríguez-Violante et al., 2015; Sáez-Francàs et al., 2016). Estos síntomas, se presume, subyacen tanto al proceso neurodegenerativo como al tratamiento farmacológico en terapias basadas en la modulación de dopamina (Armstrong & Okun, 2020; Huang et al., 2015; Oh et al., 2011).
Respecto a las alteraciones conductuales, se ha reportado estado de ánimo distímico, apatía y marcadores de depresión y ansiedad (Aguilar et al., 2011; Rektorova, 2019). Con frecuencia estos síntomas no motores son más resistentes a los tratamientos farmacológicos que los síntomas motores (Armstrong & Okun, 2020; Fasano et al., 2012). En cuanto a los déficits neuropsicológicos, es común encontrar trastornos visoperceptivos, posición relativa de los objetos y visión en tres dimensiones; déficits en velocidad de procesamiento; alteraciones en la percepción y estimación de tiempos o “timing”, y alteraciones en funciones ejecutivas (Bayram et al., 2021; Galtier et al., 2009; Garzón-Giraldo et al., 2015; Glozman, 2013; Haelterman et al., 2014; Stoessl, 2011).
A nivel expresivo se encuentra afectada la fluencia fonética (Demakis, 2007; El-Nazer et al., 2019; Foley et al., 2021). También se ha reportado que el lenguaje expresivo se altera debido a los déficits típicos de la enfermedad, en la que, alteraciones en la respiración, fonación, musculatura facial, reflejos, articulación, prosodia expresiva, entre otros, afectan la producción correcta de las palabras (El-Nazer et al., 2019; Galtier et al., 2009; Tröster, 2017). Adicionalmente, los pacientes con EP evidencian bajos rendimientos en tareas que implican flexibilidad cognitiva, solución de problemas, abstracción y memoria de trabajo (Ramos & Machado, 2021). En tareas de aprendizaje se reportan déficits en tareas con recuerdo libre de la información, pero sin problemas en el reconocimiento y con una mejora al utilizar claves, lo cual sugiere alteraciones en el uso de estrategias para codificar y recuperar la información más que en la función mnésica en si misma (Demakis, 2007; Harrington et al., 2020; Juri et al., 2010).
En cuanto al tratamiento de la EP, se ha dirigido principalmente al manejo farmacológico de las manifestaciones de la enfermedad (Armstrong & Okun, 2020), pero en casos puntuales, la estimulación cerebral profunda (Deep Brain Stimulation, DBS, [Estimulación Cerebral Profunda, ECP]) ha resultado ser un tratamiento plausible, efectivo y preferible, dada sus posibilidades de ajustar los parámetros y revertir, en caso de ser necesario (Deogaonkar et al., 2011; Evens et al., 2015; Lyons, 2011). Así mismo, la efectividad de este tipo de tratamiento en el control de síntomas motores es innegable, llegando a ser considerado un procedimiento extrapolable a otros desórdenes neuropsiquiátricos (Costanza et al., 2021; Evens et al., 2015; Liu et al., 2014; Martinez-Martinez et al., 2017; Zhang et al., 2021).
En las últimas décadas, la cantidad de estudios sobre el tratamiento de ECP y rendimiento neuropsicológico ha crecido considerablemente, analizando múltiples aspectos clínicos, tanto motores como no motores, asociados a la enfermedad (Castelli et al., 2010; Costanza et al., 2021; Cyron et al., 2010; Evens et al., 2015; Martinez-Martinez et al., 2017; Orduz-Bastidas et al., 2020; Zangaglia et al., 2009). Dentro de estos estudios, algunos reportan disminución del rendimiento en tareas de fluencia verbal después de la cirugía de ECP (Castelli et al., 2010; Combs et al., 2015; Hurtado et al., 2016; Martinez-Martinez et al., 2017), y que empeoran con el transcurrir del tiempo; así como un peor rendimiento en tareas de memoria episódica, funciones ejecutivas y abstracción, en comparación con pacientes de Parkinson sin ECP (Fasano et al., 2012). Sin embargo, otros estudios reportan mejoría en tareas de fluidez verbal luego de estimulación bilateral en el núcleo subtalámico (NST), en comparación con pacientes con ECP implantados bilateralmente en el núcleo globo pálido interno (GPi) (Elgebaly et al., 2018), sugiriendo que la posición cerebral de la ECP tiene diferentes consecuencias en los pacientes. Al respecto, un metanálisis reciente que compara los efectos motores en los pacientes implantados con ECP en núcleo subtalámico versus pacientes implantados en el núcleo globo pálido interno, reporta una mejoría en los síntomas motores de ambos grupos, pero una mejoría en la disminución de la medicación en el grupo de pacientes con ECP en el núcleo subtalámico (Zhang et al., 2021).
Por el contrario, en pacientes con ECP bilateral del NST se ha reportado una mejora significativa en el aprendizaje de información verbal y en las habilidades visoconstructivas, cuando hay un aumento de la amplitud del estimulador en comparación con pacientes sin ECP (Cyron et al., 2010; Schoenberg et al., 2008), así como una disminución en fluencia semántica verbal tanto en pacientes con ECP bilateral en NST o en GPi (Fasano et al., 2012; John et al., 2021). Sin embargo, estos estudios no reportan efectos no-motores consistentes y otros reportan que las funciones cognitivas muestran sólo unos cambios sutiles cuando los pacientes presentan alteraciones cognitivas antes de la cirugía o son mayores de 69 años, y están en riesgo de empeorar (Costanza et al., 2021; Dowsey-Limousin & Pollak, 2001; Evens et al., 2015; Kurtis et al., 2017; Negida et al., 2018).
A pesar de que existen numerosos estudios sobre los efectos de la ECP en el rendimiento cognitivo de los pacientes con EP (Deogaonkar et al., 2011; Kurtis et al., 2017; Liu et al., 2014; Negida et al., 2018; Wu et al., 2014; Zangaglia et al., 2009), en América Latina y, particularmente, en Colombia, el número de investigaciones sobre este tema es escaso (de la Peña et al., 2016; Orduz-Bastidas et al., 2020). Esto sugiere que son necesarias más investigaciones respecto al rendimiento de pacientes con EP sometidos al procedimiento de ECP, que permitan identificar mejor el impacto a nivel neuropsicológico de los pacientes tras implantarles el estimulador. Teniendo en cuenta lo anterior, el presente estudio tiene como objetivo central comparar el rendimiento de pacientes con EP con y sin ECP en pruebas cognitivas en población colombiana. Dentro de los alcances del estudio está mejorar la evaluación característica de los aspectos reportados como sensibles en los pacientes con ECP antes y después del procedimiento quirúrgico. Y el objetivo secundario es aportar resultados que puedan ser utilizados en posteriores metanálisis sobre reportes de los síntomas motores.
Método
Diseño
Investigación transversal prospectiva con diseño observacional de dos grupos independientes. Se tomó como variable de clasificación tener o no el dispositivo de estimulación cerebral profunda (ECP).
Participantes
Participaron en el estudio 47 pacientes diagnosticados con EP, y se dividieron en dos grupos, pacientes con ECP y pacientes sin ECP o control (n = 16 ECP; n = 31 sin ECP). Las características de los pacientes y las pruebas de cribado se presentan en la Tabla 1. La selección y reclutamiento de los pacientes candidatos a cirugía y no candidatos a cirugía se llevaron a cabo en el servicio de neurocirugía del Hospital Universitario San Ignacio entre los años 2011 a 2015 (Bogotá, Colombia). Los pacientes del grupo ECP tuvieron cirugía en diferentes áreas cerebrales (núcleo subtalámico y globo pálido) y tanto a nivel unilateral como bilateral, dependiendo de los principales síntomas motores. Por otro lado, los pacientes del grupo control, es decir, que no fueron considerados candidatos a cirugía de ECP fueron seleccionados a conveniencia.
Durante el proceso de selección, los pacientes candidatos a ECP presentaron baja respuesta farmacológica (lo cual se asoció al tratamiento farmacológico a largo plazo durante varios años), y su calidad de vida se vio comprometida, pero sin presentar un proceso de demencia. También es importante resaltar que algunos pacientes del grupo control se encontraban dentro del proceso de evaluación prequirúrgico y otros no consideraron la ECP porque el tratamiento con fármacos les seguía funcionando parcialmente. No se reportan los datos clínicos particulares de los pacientes con ECP y pacientes control debido a la variabilidad en las condiciones, el aseguramiento de la confidencialidad y el manejo de algunos datos sensibles.
Procedimiento e Instrumentos
A los pacientes que participaron en el estudio se les realizó una evaluación neuropsicológica de sus funciones cognitivas. El protocolo de evaluación incluyó las siguientes pruebas:
Wisconsin Card Sorting Test (WCST). Se utilizó la versión del Wisconsin de 128 tarjetas físicas para evaluar categorización visual, flexibilidad cognitiva y solución de problemas (Barceló, Lewis, & Moreno, 2006; Heaton, 1981). La prueba consistió en la clasificación de cartas en cuatro categorías diferentes a partir de la retroalimentación del evaluador. No se incluyeron datos sobre el número de categorías alcanzadas porque no se tuvieron en cuenta al momento del análisis de los datos. Esta prueba ha mostrado buenos índices de confiabilidad (alfa de Cronbach 0,74) en adultos mayores (Henao-Arboleda et al., 2010), pacientes con déficit frontal y pacientes diagnosticados con Parkinson juvenil en Colombia (Moreno et al., 2010).
Wechsler Adults Intelligence Scale (WAIS). En primer lugar, se aplicó la subprueba de Búsqueda de símbolos y Claves de la prueba para evaluar atención selectiva y velocidad de procesamiento; luego, la subprueba de Semejanzas, que evalúa categorización verbal a partir de la identificación de la categoría común de dos elementos (Guerrero, 2004). Posteriormente, se administraron las subpruebas de Dígitos, que evalúan atención y memoria de trabajo verbal a partir de la repetición de ítems en orden directo e inverso (Ardila et al., 2003; Siegert et al., 2008), y las escalas denominadas Dibujos, Escenas y Lista de palabras, que han sido utilizadas en jóvenes, adultos y adultos mayores sanos y con daño cerebral (Walker et al., 2009). Se utilizó la lista de palabras del Wechsler Memory Scale III, se repitieron 12 estímulos por 4 intentos, luego se mostró una lista de interferencia y se hizo un recobro a los 20 minutos con la subprueba de reconocimiento. Posterior a esto, se aplicó la prueba de colores y palabras Stroop que permitió evaluar la atención selectiva e inhibición conductual a partir de la lectura de palabras-colores que varían en el color de la tinta.
Cuestionario de calidad de vida en Enfermedad de Parkinson (Quality of life scale in Parkinson's disease [PDQ-39]). Compuesta por ocho dimensiones que puntúan en una escala de 1 a 100 y el mayor puntaje significa mayor afectación de la calidad de vida. Las dimensiones corresponden a movilidad, actividades diarias, bienestar emocional, estigma, soporte social, cognición, comunicación e incomodidad corporal. La evaluación de las propiedades psicométricas en población latinoamericana muestra adecuados valores de confiabilidad y validez convergente con pruebas de severidad de síntomas motores de EP (Martínez-Martín & Frades Payo, 1998; Martínez-Martín et al., 2005).
La información de los pacientes fue recolectada entre los años 2011 a 2015. Dichos pacientes fueron atendidos en el servicio de neurocirugía del Hospital Universitario San Ignacio, y además se contó con la participación de pacientes de la Fundación Nacional Esperanza contra el Parkinson (Colombia). Los pacientes fueron contactados durante la consulta médica. Se contó con una muestra muy heterogénea respecto al procedimiento quirúrgico de ECP, es decir, diferencias entre los pacientes en el tiempo de inicio de la enfermedad, tiempo de tratamiento y respuesta favorable al mismo, lugar específico del estimulador, tiempo de evaluación posterior cirugía, entre otras características. Esta condición llevó a que las pruebas se aplicaran en un rango de tiempo amplio. Así mismo, no todos los pacientes, tanto los de ECP como los del grupo control, presentaron la totalidad de las pruebas neuropsicológicas. La aplicación de las pruebas se realizó en un tiempo aproximado de 4 horas de acuerdo con los protocolos de evaluación neuropsicológica.
Consideraciones éticas
Los procedimientos y protocolos de la investigación fueron aprobados por el comité de ética del Hospital Universitario San Ignacio afiliado a la Pontificia Universidad Javeriana. En el servicio de neurocirugía del Hospital Universitario San Ignacio (Bogotá, Colombia) se explicó a los pacientes el propósito de la investigación y quienes decidieron participar de forma voluntaria firmaron el consentimiento informado. En esta investigación se siguieron las recomendaciones éticas para la investigación en psicología a nivel nacional e internacional (American Psychological Association, 2002; Ley 1090, 2006) y acordes a los requerimientos éticos internacionales de la última versión de la Declaración de Helsinki.
Resultados
Los pacientes de ambos grupos, con y sin ECP, presentaron resultados similares de las pruebas de cribado, de manera que no se encontraron diferencias en las variables sociodemográficas (edad, sexo, lateralidad y escolaridad) ni en las relacionadas con la enfermedad (tiempo de la enfermedad, percepción de calidad de vida) (Tabla 1).
Los resultados descriptivos de las pruebas de funciones ejecutivas se muestran en la Tabla 2, en la que se diferencia la puntuación por grupo y tipo de prueba. En cuanto a las puntuaciones de funciones ejecutivas, se presentan puntuaciones mayores para el grupo de pacientes sin ECP en la mayoría de las pruebas, pero sin diferencias significativas (Tabla 2).
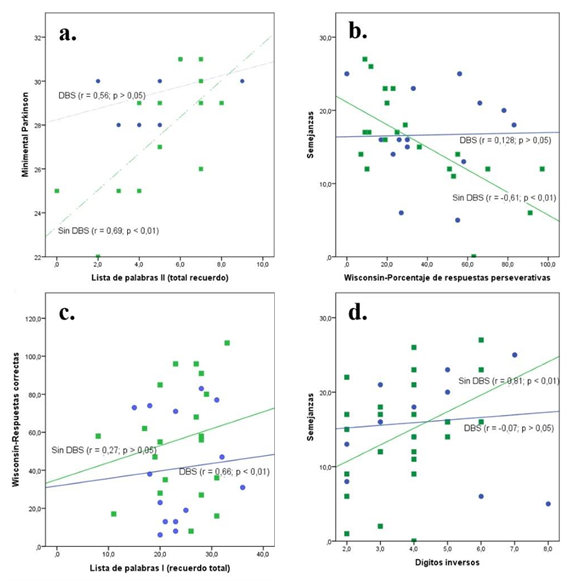
Al no encontrar diferencia entre las puntuaciones de las pruebas de evaluación neuropsicológica de funciones cognitivas de los grupos, se realizó un análisis de correlación entre las pruebas comparando los grupos (Tabla 3), esto con el fin de identificar algún tipo de marcador o perfil cognitivo en los grupos como ha sido propuesto en los casos de alteraciones no motoras de los pacientes con EP (Biundo et al., 2014; Hobson & Meara, 2015). En esta Tabla 3 se observa que la correlación entre las pruebas de los grupos difiere en algunas de ellas. Se encuentran resaltadas en color rojo los valores de correlación que son significativos para un grupo, pero no para el otro grupo. Para evidenciar esta diferencia se realizaron gráficas de dispersión comparando las pruebas que presentan esta característica y se observa un comportamiento diferencial para los grupos. En la Figura 1 se observa la distribución para las pruebas que presentan esta diferencia y una comparación entre lista de palabras II (recuerdo total) y Minimental Parkinson (Figura 1a), entre las respuestas correctas del WCST y el recuerdo total de la lista de palabras I (Figura 1b), semejanzas y porcentaje de respuestas perseverativas del WCST (Figura 1c) y semejanzas y dígitos inversos (Figura 1d).
Tabla 1 Variables sociodemográficas y resultados de las pruebas de cribado.
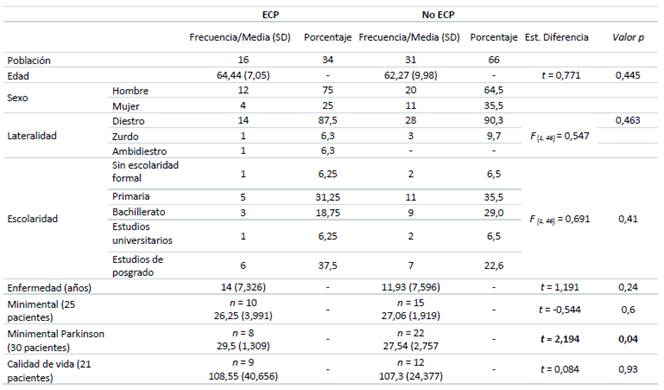
Nota: De las variables de edad, duración de enfermedad en años, Minimental, Minimental Parkinson y Calidad de vida se presentan los valores de media y entre paréntesis la desviación estándar. Las pruebas de Minimental, Minimental Parkinson y Calidad de vida no fueron presentadas por todos los participantes, entre paréntesis se presenta el número de participantes para cada una de estas pruebas. SD = desviación estándar. Est diferencia = estadísticos de diferencia, para la variable con dos grupos se realizó una prueba t de student para muestras independientes y para las variables con más de dos grupos se realizó una prueba F. * = p < 0,05.
Tabla 2 Comparación de resultados de las pruebas de funciones cognitivas.
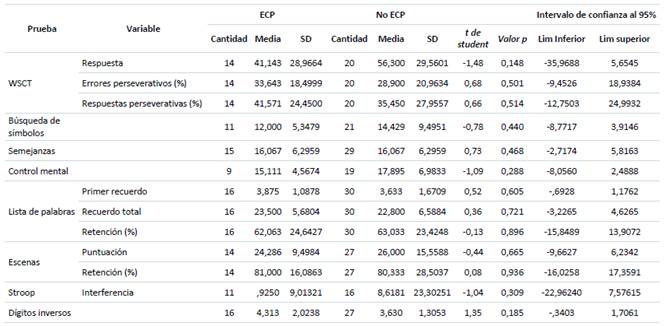
Nota: WCST = Wisconsin Card Sorting Test. En la columna de Cantidad se muestra la cantidad de aplicaciones que se realizaron por grupo. SD = desviación estándar.
Con el fin de evaluar esta diferencia se realizó una regresión lineal simple entre las variables: dependiente resultado de la prueba de semejanzas y como variables predictoras las variables de recuerdo total de lista de palabras II, control mental y dígitos inversos que fueron las que presentaron una correlación diferencial entre el grupo ECP con respecto al grupo sin ECP (Tabla 3). No se encontró que el modelo propuesto explicara más del 10% de la dispersión del grupo EPC.
Tabla 3 Correlaciones entre las pruebas de los grupos de ECP (azul) y sin ECP (gris).
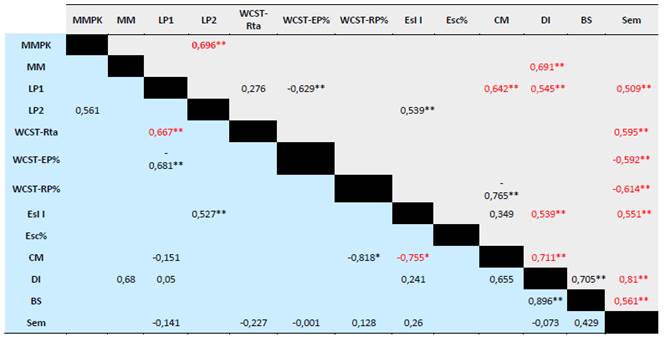
Nota: MMPk = Minimental Parkinson; MM = Minimental; LP1 = Lista de palabras I; LP2 = Recuerdo total lista de palabras; WCST-Rta = Respuestas correctas de Wisconsin Card Sorting Test; WCST-EP% = Porcentaje errores perseverativos de Wisconsin Card Sorting Test; WCST-RP% = Porcentaje respuestas perseverativas de Wisconsin Card Sorting Test; Es1 = Escenas I; Esc% = Porcentaje de retención Escenas; CM = Control Mental; DI = Dígitos Inversos; BS = Búsqueda de símbolos; Sem = Semejanzas. Los valores en rojo muestran el grupo donde se presenta la correlación significativa, pero en el otro grupo no. Color azul grupo ECP; Color gris grupo sin ECP. * p < 0,05; ** p < 0,01.
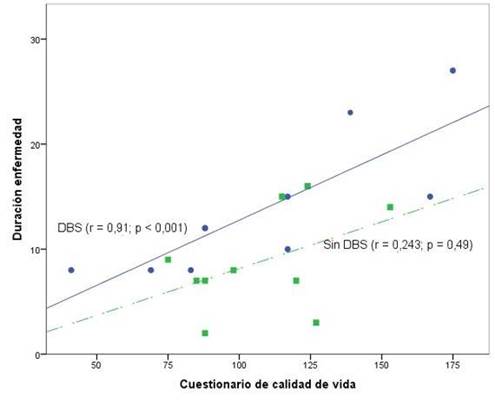
Finalmente, se evaluó la correlación entre la calidad de vida y los años de la EP, y se encontró una correlación positiva en ambos grupos (es decir, que a mayor tiempo de enfermedad los pacientes obtenían mayor puntuación en el Cuestionario de calidad de vida, lo que implica que a medida que transcurren los años con EP los pacientes perciben una menor calidad de vida), sin embargo, se presentó una correlación significativa (r = 0,91; p < 0,01; r2 = 0.82) en el grupo con ECP y no se presentó en el grupo sin ECP (r = 0,243; p = 0,49) (Figura 2).
Discusión
Al comparar el rendimiento en las pruebas cognitivas aplicadas a pacientes con EP, con y sin cirugía de ECP, los resultados no muestran una diferencia entre las puntuaciones que pueda ser atribuida al procedimiento de ECP; sin embargo, es claro que el rendimiento de los individuos es diferente durante el desempeño de las pruebas, es decir, en algunas pruebas se presentan mayores puntuaciones para el grupo de ECP y en otras para el grupo sin ECP. Esto es congruente con lo reportado en diversos estudios respecto a que la ECP podría cambiar el rendimiento de los pacientes en pruebas de funciones cognitivas, mejorando en unos casos y empeorando en otros (de la Peña et al., 2016; Hindle et al., 2014; Hobson & Meara, 2015; Negida et al., 2018). En este sentido, estudios recientes han relacionado los cambios cognitivos en la EP como un marcador de riesgo para el desarrollo de demencia, es más, la identificación temprana de biomarcadores o perfiles cognitivos permitirá desarrollar intervenciones terapéuticas efectivas (Armstrong & Okun, 2020; Biundo et al., 2016; John et al., 2021). Es importante considerar que las puntuaciones comparadas variaron en la cantidad de pacientes que las presentaron. Así, la falta en la diferencias reportada podría reflejar una limitación en la población estudiada, es decir, al contar con menor cantidad de pacientes en uno de los grupos no se apreciaría una posible diferencia en el desempeño.
Con respecto a los resultados de las pruebas que evalúan control mental, dígitos inversos y Stroop, no se encontraron diferencias significativas entre los dos grupos; hallazgos coherentes con los reportados por Bickel et al., (2010) y (Denheyer et al. 2009), quienes reportan rendimientos generales que se mantuvieron constantes en pruebas de función ejecutiva frontal después de ECP. Otros estudios informan que los resultados posteriores al procedimiento pueden tener ligeras diferencias en tareas que requieren coordinación visomotora, lo que podría identificar un cambio en el desempeño de tareas de dígitos, pero sin un efecto consistente (Elgebaly et al., 2018; Negida et al., 2018). En este mismo sentido, se ha encontrado que luego del tratamiento con la ECP se reporta una mejoría ligera en las tareas de atención visual dividida y memoria verbal (de la Peña et al., 2016).
Se observaron algunos cambios sutiles en las tendencias de rendimiento de las pruebas al comparar cada grupo. Por ejemplo, en la prueba de Wisconsin el grupo de pacientes sin ECP presenta mayor distribución de los rendimientos y número de errores perseverativos, comparado con los pacientes con ECP, quienes presentan un rendimiento con menor distribución y menor cantidad de errores. Llama la atención que, en la prueba de control mental, los sujetos del grupo con ECP presentan un rendimiento más bajo, mientras que, en la prueba de dígitos, se evidencia una mayor distribución de los resultados por parte de este grupo con tendencia a resultados más altos que el grupo sin ECP, lo cual parece ser un resultado contradictorio, teniendo en cuenta que ambas pruebas miden el mismo constructo, es decir, memoria de trabajo. Esto se podría explicar porque la prueba de dígitos inversos depende de la amplitud de memoria de trabajo mientras que la prueba de control mental está enfocada en la manipulación de la información. Una posibilidad adicional y que se podría constituir en una limitación de nuestro estudio, es la atribuida a la diferencia en la cantidad de pacientes en cada una de las pruebas y que podría no ser suficiente para mostrar una diferencia estadística.
Mientras algunos estudios han reportado una mejoría en la memoria después de la ECP (Cyron et al., 2010; Schoenberg et al., 2008), otros más recientes, reportan que este efecto de mejoría no es consistente y suele ser relativamente pequeño, probablemente, atribuido más a la condición de los pacientes o al sitio específico de la ECP (Biundo et al., 2016; Tröster, 2017). En la presente investigación no se encontraron diferencias en las pruebas de memoria, presentando un rendimiento homogéneo en las pruebas de lista de palabras y escenas. En metanálisis y revisiones sistemáticas recientes no se reporta una diferencia importante en las pruebas cognitivas aplicadas a pacientes con y sin ECP, sin embargo, se hace énfasis en que el sitio de estimulación podría tener mayor impacto en el detrimento durante la ejecución de pruebas neuropsicológicas, siendo menor el impacto en pacientes con ECP en el GPi (Martinez-Martinez et al., 2017; Xie et al., 2016; Xu et al., 2017; Zhang et al., 2021).
Por otra parte, en el grupo con ECP se encontró una correlación significativa entre el tiempo de la enfermedad y una mayor puntuación en el cuestionario de calidad de vida, es decir, que los pacientes con ECP reportan una percepción de calidad de vida más baja a mayor tiempo de la enfermedad, lo que podría relacionarse con las expectativas que se generan sobre los resultados de la cirugía, los cuales no suelen cumplirse en su totalidad; esta situación puede repercutir sobre el estado de ánimo y la adaptación a la vida cotidiana que impacta sobre su calidad de vida. Esta expectativa de mejoría ha sido reportada en varios estudios que analizan el impacto de los efectos terapéuticos de los pacientes luego del procedimiento (Armstrong & Okun, 2020; Becerra et al., 2016; McRae et al., 2004; Tröster, 2017). En el presente estudio, la evaluación de la calidad de vida hizo referencia a la mejoría percibida por parte de los pacientes en varias dimensiones evaluadas, sin entrar a analizar cada una de estas por separado sino como puntuación global debido a la alta heterogeneidad y particularidad de la EP en cada paciente, por lo que las conclusiones y comparaciones en con respecto a la mejoría en la calidad de vida deben tomarse con precaución. Estos resultados evidencian la necesidad de un acompañamiento psicológico y de suministrar una información precisa sobre el alcance de la cirugía a los pacientes sometidos a ECP.
De la misma forma que en la puntuación de calidad de vida, los resultados de las pruebas neuropsicológicas de los pacientes con ECP y sin ECP se analizaron basados en la puntuación total de cada prueba y tomando la ECP como análisis del desempeño. Sin embargo, es importante señalar que los pacientes con ECP recibieron el tratamiento en áreas cerebrales diferentes dependiendo de la evaluación de neurocirugía para cada paciente, también variaron en el tipo de estimulación cerebral que recibieron (unilateral o bilateral), el tratamiento farmacológico suplementario y el impacto que la ECP tuvo sobre los síntomas motores. Aunque, si bien la mayoría de los pacientes recibieron la cirugía en el núcleo subtalámico, se encontraron pacientes con cirugía de ECP en otras áreas y con diferentes tipos (unilateral y bilateral) y parámetros de estimulación, es decir, frecuencia e intensidad del ECP particulares en cada paciente. Esta diversidad en el tratamiento clínico podría afectar el rendimiento en las pruebas, mostrando una mejoría en algunas pruebas para algunos pacientes y otra mejoría en otras.
Una de las limitaciones importantes radica en que los protocolos de evaluación suelen variar aun en estudios similares, es decir, las pruebas utilizadas para medir las funciones cognitivas de los pacientes son diversas. Esto lleva a que la comparación sobre el rendimiento pueda ser relativo dependiendo de las pruebas utilizadas. Sin embargo, la consistencia en la mayoría de los resultados podría suponer una equivalencia entre los resultados. Una limitación adicional del presente estudio es la falta de consistencia en las pruebas y evaluaciones de los pacientes antes y después de la ECP, es decir, los pacientes son evaluados en intervalos de tiempo diferentes, dependiendo de las recomendaciones médicas y posteriores a la ECP. Es decir, este estudio se realizó para destacar la importancia de la calidad de vida de los pacientes antes y después del procedimiento quirúrgico, sin embargo, no todos los pacientes contaban con la evaluación objetiva previa antes de la cirugía de la ECP. Teniendo en cuenta que los pacientes participantes se evaluaron en diferentes momentos, no todos siguieron el mismo protocolo de evaluación, o por alguna dificultad no pudieron realizar pruebas específicas, por lo que los datos no fueron homogéneos. Otra limitación del estudio se relaciona con el tiempo de aplicación de las pruebas que estuvo determinado por el hecho de que los pacientes de Parkinson con y sin ECP son escasos y por lo tanto se tuvieron tamaños de muestra pequeños en comparación con países con otros estudios donde los pacientes pueden ser reclutados con mayor facilidad (Liu et al., 2014; Martinez-Martinez et al., 2017).
Finalmente, aunque no se reportan diferencias en los grupos, el procedimiento de ECP es considerado un tratamiento efectivo dirigido hacia la disminución de los síntomas motores y que tiene en cuenta la condición clínica de los pacientes (Martinez-Martinez et al., 2017; Xie et al., 2016; Zhang et al., 2021). Un análisis adicional que se ha indicado, desde el punto de vista de la viabilidad financiera del ECP, reporta que el costo efectivo de este tratamiento, si bien es alto al inicio debido al procedimiento quirúrgico, el dispositivo y los cuidados iniciales, suele ser, a largo plazo, de menor costo que el manejo farmacológico tradicional (Becerra et al., 2016), lo que sugiere un beneficio a largo plazo en el costo del tratamiento para los pacientes. Esta podría ser una razón adicional para considerar su viabilidad. Por otro lado, aunque se han reportado efectos adicionales luego del procedimiento (Costanza et al., 2021; Picillo et al., 2017), es necesario la evaluación particular de los pacientes y contemplar la posibilidad de revertir el procedimiento en caso de ser desfavorable.