Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Cirugía
versión impresa ISSN 2011-7582versión On-line ISSN 2619-6107
rev. colomb. cir. v.19 n.2 Bogotá abr./jun. 2004
Presentación de seis casos
(1) Cirugía General, Gastrointestinal, Endoscopia Digestiva. Servicio de Cirugía General y Especialidades, Fundación Cardio Infantil Instituto de Cardiología, Bogotá, Colombia.
(2) Cirugía General. Servicio de Cirugía General y Especialidades Fundación Cardio Infantil Instituto de Cardiología, Bogotá, Colombia.
(3) Cirugía General, Cabeza y Cuello. Servicio de Cirugía General y Especialidades, Fundación Cardio Infantil Instituto de Cardiología, Bogotá, Colombia.
(4) Cirugía General, Tórax. Servicio de Cirugía de Tórax, Fundación Cardio Infantil Instituto de Cardiología, Bogotá, Colombia.
(5) Gastroenterólogo. Departamento de Gastroenterología, Fundación Cardio Infantil Instituto de Cardiología, Bogotá, Colombia.
(6) Radiólogo. Departamento de Radiología, Fundación Cardio Infantil Instituto de Cardiología, Bogotá, Colombia.
(7) Hematooncólogo. Departamento de Hemato-Oncología, Fundación Cardio Infantil Instituto de Cardiología, Bogotá, Colombia.
(8) Patóloga. Departamento de Patología, Fundación Cardio Infantil Instituto de Cardiología, Bogotá, Colombia.
Correspondencia: Manuel Santiago Mosquera Paz, Calle 163A # 28-60 FCI-IC, Tel./Fax: 679 82 59, Bogotá, D.C., Colombia. mmosquera@cardioinfantil.org
Fecha de recibo: Junio 18 de 2003. Fecha de aprobación: Marzo 25 de 2004.
Resumen
Se presentan seis pacientes con diagnóstico inmuno-histoquímico de tumores estromales gastrointestinales y extragastrointestinales localizados en diferentes órganos del tracto digestivo y otras áreas, estudiados e intervenidos en nuestra institución a partir del año 2000, con seguimiento en su evolución clínica hasta la fecha por los servicios de hemato- oncología y cirugía; a excepción de una paciente. En su mayoría sin diagnóstico claro en su preoperatorio o con alta sospecha de presentar tumores mesenquimales complicados por masa compresiva, oclusión intestinal o sangrado.
Se plantean de manera concreta los aspectos relevantes en su diagnóstico y clasificación patológica, manejo quirúrgico y tratamiento en relación a la literatura actual, exponiendo algunas de las controversias existentes. Además de fijar nuestra posición como grupo terapéutico frente a esta neoplasia, con base en la revisión realizada y nuestra limitada experiencia.
Palabras clave: tumores estromales gastrointestinales, inmunohistoquímica, 50 campos de alto poder, hemorragia de vías digestivas, tomografía computarizada, c-Kit, CD34, actina de músculo liso.
Abstract
We hereby report six patients with inmunohistochemical diagnosis of GIST located in different organs of the gastrointestinal tract and other areas, who were managed at our institution, except one case, starting in 2000 and followed until now in the services of hemato-oncology and surgery. The majority of these patients did not have a clear preoperative diagnosis or presented with high suspicion of a mesenchyunal tumor, complicate by a compressing mass, intestinal obstruction, or bleeding.
We describe the most relevant aspects pertinent to diagnosis and pathologic classification, surgical management in the context of current literature reports, with emphasis on the ongoing controversies. Furthermore, we define our policy as a group on the basis of the literature review and the careful analysis of our limited experience.
Key words: GIST, inmunohistochemistry, 50 high power fields, gastrointestinal hemorrhage, computerized scanography, c-Kit, smooth muscle actin.
Introducción
El término tumor estromal gastrointestinal fue descrito por Mazur y Clark en 1983 para explicar las neoplasias gastrointestinales no epiteliales que semejaban aspectos inmunohistoquímicos de las células de Schwann, sin tener la característica ultra estructural de las células del músculo liso (1). Hirota y colaboradores, en 1998, descubrieron actividad en la mutación del protooncogen c-Kit (CD117) de los TEGI, situación crucial en el origen y clasificación de los mismos (2).
Recientemente se postuló el origen de los TEGI en las células intersticiales de Cajal (células marcapaso), o células precursoras que cumplen una importante función en la motilidad intestinal (3-7).
El protooncogen c-Kit (CD117) es un receptor transmembrana para el factor de crecimiento de las células de Stem. Está codificado por el protoncogen c-Kit localizado en el cromosoma 4q11-21. Posee sectores intra y extracelulares e intramembranosos, al ligarse el factor del crecimiento con el receptor, se produce dimerización del segundo y activación de la tirosina cinasa en el sector intracelular, produciendo reacciones en cascada que controlan la proliferación, adhesión y diferenciación celular (8). La expresión del antígeno CD 117 se manifiesta en casi todos los TEGI (90%) (9) y está sujeto a mutaciones en un 50% de los casos, otro de los mecanismos de activación del receptor (10-12).
Aunque el antígeno CD117 se expresa en otro tipo de tumores como: dermatofibrosarcoma protuberante, sarcoma sinovial, linfoma anaplásico de células grandes, glioma, germinoma, melanoma, leucemia mieloide aguda, mastocitoma, carcinoma pulmonar de células pequeñas, neuroblastoma, carcinoma adenoide quístico, angiosarcoma y sarcoma de Ewing (13-17), no se generan confusiones diagnósticas debido a su diferente morfología y localización.
Los TEGI son la forma más común de aparición de los tumores mesenquimales del aparato digestivo (80%) también se presentan en el epiplón, mesenterio o retroperitoneo (18-19). conocidos como tumores estromales extragastrointestinales (19). La incidencia anual estimada es de 10 a 20 casos por millón, de los cuales 20 a 30% son malignos (15, 21,22). Se presentan con igual frecuencia en ambos sexos, en una edad promedio de 60 años, en ocasiones por debajo de los 40 años y son extremadamente raros en niños (15, 21). Su localización más frecuente es en él estomago (40-70%) (23). luego el intestino delgado (20-40%), seguido de colon y recto (5-15%) (24), esófago (<5%), omento (<5%), mesenterio y retroperitoneon (15, 24-27). En general, los tumores gástricos tienen mejor sobrevida que los de intestino delgado con igual tamaño y actividad mitótica (28, 29); dentro de éstos los tumores duodenales mayores de 4,5 cm con dos o más mitosis por 50 campos de alto poder (CAP) y los yeyunoileales mayores a 5 cm y con cinco mitosis o más por 50 CAP y necrosis de coagulación, evolucionan estadísticamente con mal pronóstico (30-32). En recto los tumores mayores de 5 cm y con más de cinco mitosis por 50 CAP muestran un comportamiento agresivo (33). Los tumores estromales del omento aparecen menos agresivos que los mesentéricos (34). Además del tamaño y recuento mitótico, se han estudiado otros factores pronósticos como celularidad y atipia nuclear, invasión muscular, ulceración, diferenciación de marcadores inmunohistoquímicos (positividad para CD34 o expresión de actina del músculo liso) y positividad nuclear para análogos del Ki67 en un porcentaje mayor al 10%, lo cual sugiere mayor incidencia de metástasis y mortalidad en estos pacientes, pero sin superioridad pronóstica al recuento mitótico. Los otros factores tampoco aportan de manera relevante en el pronóstico (30-33, 35-39). En la experiencia de algunos autores, la invasión mucosa se observa exclusivamente en tumores malignos, lo cual se evidencia en biopsias endoscópicas y hace limitante su aplicación por su crecimiento endofítico (18). Hay tres series publicadas que lo refieren como un factor pronóstico negativo en tumores de intestino delgado (30-32).
Presentación de casos
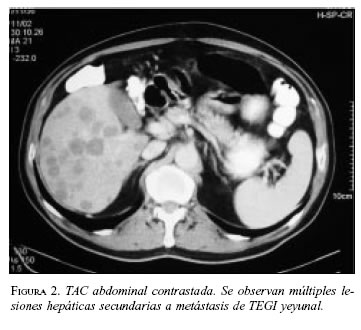
Paciente 1: Hombre de 64 años de edad, con cuadro clínico de hemorragia de vías digestivas (HVD) masiva y shock hipovolémico. La endoscopia de vías digestivas altas no mostró lesiones sangrantes. La colonoscopia evidenció enfermedad diverticular y pólipos con sangre en la luz intestinal. Es llevado a cirugía en enero de 2000 encontrándose una masa sangrante en el yeyuno, a 60 cm del ligamento de treitz (figuras 1A y B). Se practicó resección yeyunal con anastomosis término-terminal. La patología informó TEGI maligno, con bordes de sección negativos; la inmunohistoquímica (IMHQ) confirmó el diagnóstico (cuadro 1). En el postoperatorio mediato presentó infarto agudo del miocardio (enfermedad de dos vasos), por lo cual ha revascularizado. En su seguimiento se documentó por escanografía, en agosto de 2002, lesiones hepáticas múltiples sugestivas de metástasis (figura 2), que se documentaron histológicamente con diagnóstico de sarcoma fusocelular hepático. En el momento recibe tratamiento con imatinib, con interrupciones periódicas por neutropenia febril.
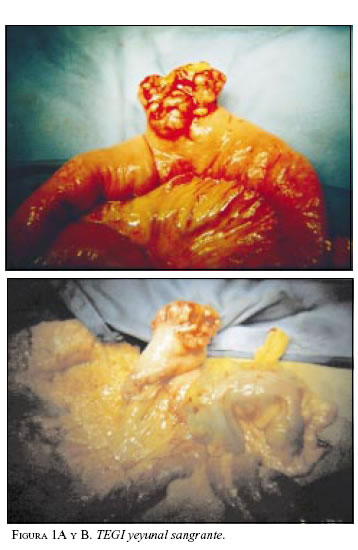
Paciente 2: Mujer de 37 años de edad, con cuadro clínico de varios meses de evolución de astenia, adinamia y pérdida severa de peso. La tomografía axial computarizada (TAC) mostró conglomerado ganglionar peri y para-aórtico que comprometía estructuras vasculares, con rechazo anterior del duodeno e hidronefrosis izquierda. En febrero de 2001 se llevó a cirugía y se encontró masa de características descritas, irresecable, por lo cual se tomaron biopsias. La patología informó fibromatosis retroperitoneal y la inmunohistoquímica fue positiva para marcadores como vimentina, actina muscular, con diagnóstico final de tumor miofibroblástico. Recibió interferón y talidomida con pobre respuesta. Un mes después presentó clínicamente y por vías digestivas altas una obstrucción duodenal, pero la paciente no aceptó derivación gastrointestinal quirúrgica mediata, que se practicó un año más tarde con nuevas biopsias, las cuales confirmaron por IMH2, TEGI (cuadro 1). En su evolución cursó con hidronefrosis bilateral manejada con nefrostomías percutáneas e insuficiencia renal, pseodoquiste de páncreas drenado percutáneamente. Falleció un mes después de iniciado el tratamiento con imatinib.
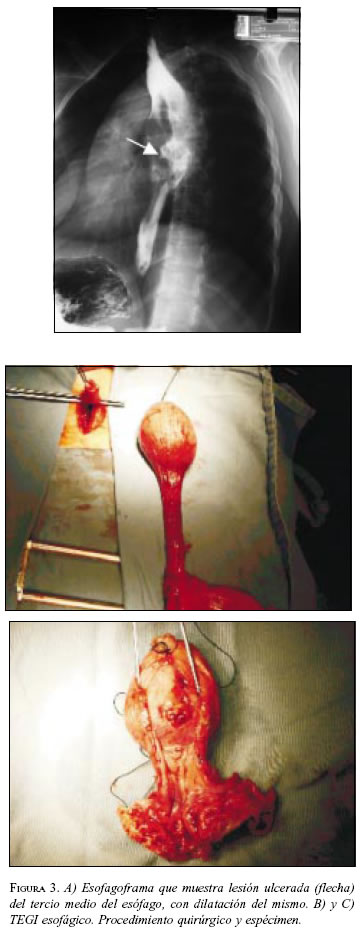
Paciente 3: Mujer de 30 años de edad, con cuadro clínico de disfagia y dolor torácico. La endoscopia digestiva alta mostró masa esofágica ulcerada, la biopsia informó TEGI, las vías digestivas altas revelaron masa ulcerada en el tercio medio del esófago torácico (figura 3A) y la TAC sugirió un leiomioma esofágico. En febrero de 2002 se practicó esofagectomía transhiatal con ascenso de tubo gástrico (figura 3B y C); cursó con un neumotórax derecho que se manejó con toracostomía cerrada y evolucionó adecuadamente. La patología reportó un TEGI con ulceración superficial focal, la IMHQ confirmó el diagnóstico (cuadro 1. Presentó estenosis de la anastomosis esofagoyeyunal que se manejó con dilataciones. No continuó asistiendo a control institucional.
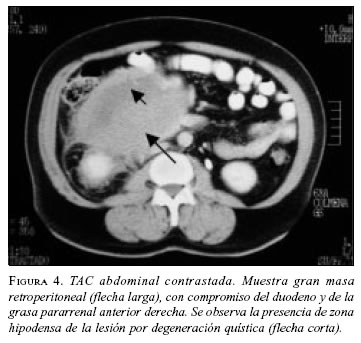
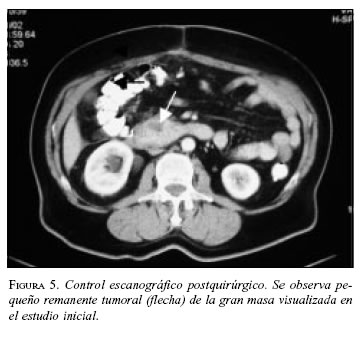
Paciente 4: Hombre de 63 años de edad, con cuadro clínico de sensación de masa abdominal, dolor y vómito. La TAC abdominal preoperatoria mostró gran masa retroperitoneal (figura 4). La esofagogastroduodenoscopia informó compresión extrínseca de la segunda y tercera porción duodenal; las biopsias mucosas fueron negativas para malignidad. En septiembre de 2002 se llevó a cirugía y se practicó resección de la masa, colectomía derecha e ileotransversostomía término-lateral; quedó con tumor residual en un volumen aproximado de 2% adherido a la cabeza del páncreas. Por riesgo quirúrgico del paciente (enfermedad cardiovascular y enfermedad pulmonar obstructiva crónica) no se consideró pertinente extender la resección a una pancreatoduodenectomía. La patología informó TEGI, sin invasión a colon. La IMHQ confirmó el diagnóstico (cuadro 1. En el postoperatorio inmediato cursó con infarto agudo del miocardio, que requirió angioplastia de urgencia, con evolución adecuada. Se encuentra en tratamiento con imatinib, sin evidencia de crecimiento tumoral por escanografía (figura 5).
Paciente 5: Mujer de 59 años de edad, con sensación de masa epigástrica y dolor. Había sido estudiada extrainstitucionalmente mediante TAC documentándose tumor hepático del lóbulo izquierdo susceptibilidad para resección quirúrgica. Se practicaron nuevos estudios: endoscopia digestiva que mostró masa intrínseca versus extrínseca ulcerada antral, las biopsias fueron reportadas como negativas para malignidad. Se realizó una arteriografía hepática con fines de embolización preoperatoria, que mostró tumor neovascular alimentado por ramas de la arteria gástrica derecha y gastroduodenal; la arteria hepática y sus ramas fueron normales. En octubre de 2002 se sometió a intervención quirúrgica, cuyo resultado mostró gran masa dependiente de la pared del antro gástrico, rechazando el lóbulo izquierdo del hígado. Se practicó gastrectomía subtotal y reconstrucción en BII. La patología reportó TEGI con bordes de sección negativos, atipia y necrosis focal en la masa. La IMHQ confirmó el diagnóstico (cuadro 1). Por el tamaño tumoral se indicó tratamiento complementario con imatinib, pero no fue autorizado por el servicio médico. A la fecha no hay evidencia de recidiva tumoral.
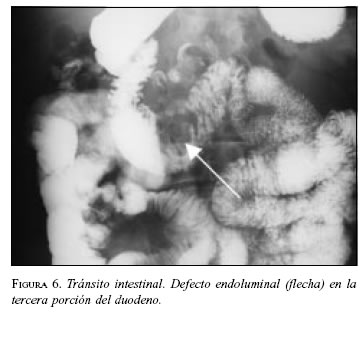
Paciente 6: Hombre de 68 años de edad, con cuadro de sangrado digestivo severo. En la endoscopia digestiva se visualizó una lesión ulcerada e infiltrante en la tercera porción duodenal con sangrado activo. Las vías digestivas altas mostraron masa en la tercera porción duodenal (figura 6).
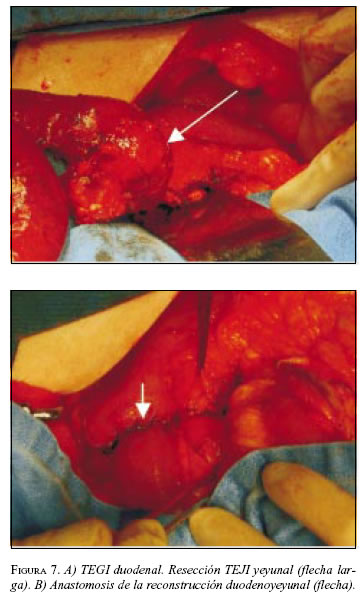
En abril de 2003 se llevó a cirugía y se encontró tumor en la tercera porción duodenal con sangrado activo. Se realizó duodenectomía de la tercera y cuarta porción con resección del segmento pancreático adherido a la lesión, y duodenoyeyunostomía en la segunda rodilla duodenal con drenajes (figura 7A y B). La patología informó TEGI con bordes de sección negativos, necrosis focal y alta celularidad. La IMHQ confirmó el diagnóstico (cuadro 1).
En el postoperatorio mediato cursó con fístula pancreática y posteriormente ictericia de tipo obstructivo en relación con el cuadro de colecistitis acalculosa por lo cual requirió reintervención y colecistectomía, con mejoría clínica, cierre de fístula pancreática y aparición de fístula biliar en manejo médico y evolución satisfactoria. Recibe tratamiento complementario con imatinib.
Discusión
Los pacientes revisados tienen igual distribución por sexo lo que concuerda con la bibliografía revisada; en contraposición, dos fueron menores de 40 años, probablemente debido al azar por el pequeño número de casos.
El estudio diagnóstico de estos pacientes no es diferente al de otros tumores del aparato digestivo, se practica en relación a las manifestaciones clínicas predominantes; tres de nuestros pacientes presentaron síntomas digestivos altos, por lo cual se practicó endoscopia digestiva y biopsia en dos de ellos con diagnóstico histológico en uno. La literatura habla de especificidad diagnóstica histológica preoperatoria en un 50% de los casos por ser lesiones submucosas con crecimiento endofítico. La ecoendoscopia puede evidenciar una masa hipoecoica contigua a la muscular propia de la pared intestinal.
Se practicaron estudios baritados como parte del mapeo para el plan quirúrgico en los tumores esofágico y duodenal, y para comprobar una complicación obstructiva de un tumor retroperitoneal. En estas imágenes se observan lesiones de origen submucoso, de ángulos obtusos con respecto a la mucosa, por lo general con la mucosa íntegra cubierta por bario o con zonas focales de ulceración (18, 40-41).
La TAC es el estudio imagenológico ideal para evaluar estos tumores; se presentan como lesiones con densidad de tejidos blandos, con importante realce periférico y zonas centrales hipodensas secundarias a necrosis o a degeneración quística. Las imágenes por resonancia magnética son variables ya que dependiendo del grado de necrosis o de hemorragia presentan características propias; la parte sólida del tumor es hipointensa en T1 e hiperintensa en T2 y existe realce periférico con la administración de gadolinio. La utilidad de la resonancia está en su capacidad multiplanar, que en ocasiones permite determinar con mayor precisión el órgano de origen del tumor.
El valor esencial de estas dos ultimas imágenes es la evaluación de la extensión tumoral y la existencia de metástasis, de presentación más frecuente en hígado, peritoneo (siembras); raramente en hueso, pulmón y en tejidos blandos de la parte interna de la pared abdominal o el tejido celular subcutáneo (42-43). El paciente 1 mostró lesiones hepáticas en el primer año de seguimiento, informadas por patología como sarcoma fusocelular, pero en el análisis integral del caso se asumieron como metástasis del tumor primario.
Es importante diferenciar los TEGI de otros tumores mesenquimales no epiteliales menos frecuentes como los leiomiomas y leiomiosarcomas que corresponden al 10 - 15%, los schwannomas al 5% y otros desórdenes malignos todavía menos frecuentes, para poder tomar decisiones clinicoterapéuticas coherentes.
Microscópicamente los TEGI son tumores sólidos o parcialmente quísticos, varían de color blanquecino a rojo o marrón según el grado de hemorragia; en tamaño varían entre 1 y 2 cm, hasta 20 cm o más; por lo regular son bien delimitados, no encapsulados, de localización submucosa (con o sin ulceración) o intramural. Hay dos tipos histológicos principales y combinaciones entre éstos. El tipo fusocelular es el más frecuente (60 ó 70%), caracterizado por células fusiformes, regulares, de citoplasma eosinofílico y núcleo ovalado, que se disponen formando fascículos cortos, formación de empalizadas y escaso estroma. El tipo epiteloide está compuesto por células redondeadas con citoplasma claro o eosinofílico. Los tumores mixtos contienen los dos componentes con transición abrupta entre ellos (26, 44-47). Entre nuestros pacientes hubo cinco con tumores fusocelulares y uno epiteloide.
Estas neoplasias expresan fuertemente el antígeno CD117 que es un epitome del receptor c-Kit de la tirosina cinase. Las neoplasias de músculo liso (leiomiomas, leiomiosarcomas), los tumores neurogénicos (schwannomas) y la fibromatosis desmoide típicamente no expresan el CD117 (15, 18, 48), por lo cual la IMHQ es un método esencial para su diferenciación. Los TEGI también expresan en un 60-70% el CD34 que es una glicoproteína transmembrana que igualmente se encuentra en las células endoteliales y hematopoyéticas progenitoras. Hasta el 40% son positivos para actina del músculo liso (AML). Rara vez expresa desmina o S100 un marcador de células neurales (schwann). En contraste los leiomiosarcomas son positivos para desmina y AML y negativos para el c-Kit, los schwannomas son positivos para el marcador S100 y negativos para el CD117 (24, 48, 49).
Actualmente se acepta categorizar estos tumores como de riesgo bajo, intermedio y alto, con base en la estimación de su capacidad potencial de producir recurrencia o metástasis, más que dividirlos en malignos o benignos por la detección de metástasis, diseminación peritoneal o invasión a órganos vecinos. En abril de 2001 se realizó un consenso-taller de Institutos Nacionales de Salud del Reino Unido, donde se diseño un algoritmo (cuadro 2) de evaluación del riesgo de malignidad.

La cirugía es el tratamiento inicial estándar para los TEGI no metastáticos; se recomienda la resección completa con bordes libres de tumor y en lo posible márgenes cuya dimensión no se encuentra definida; cuando hay compromiso multiorgánico se indican las resecciones en bloque, que claramente aumentan la morbilidad postoperatoria. Se debe evitar la ruptura espontánea de la pieza o por manipulación durante el procedimiento, causa aceptada de diseminación peritoneal (50). No hay evidencia de beneficio con la disección y resección ganglionar, por lo cual no se recomienda (41, 51).
Ese objetivo quirúrgico se cumplió en nuestros pacientes candidatos a resección, con excepción de uno por considerarlo no pertinente en el transoperatorio teniendo en cuenta su alto riesgo quirúrgico por comorbilidad.
En los pacientes con recidiva o enfermedad metastásica no se considera la cirugía de rescate, puesto que no hay diferencia sustancial en su sobrevida (52); se indica paliativamente en casos complicados con obstrucción o sangrado, situación en la que se ha usado el imatinib (STI571) que se ha constituido en el medicamento de elección, con respuestas parciales al tratamiento del 40-69% (53-54); lo cual es de recalcar en un cáncer resistente a la quimioterapia convencional (53). Actualmente la radioterapia no forma parte del tratamiento complementario de estos pacientes por no encontrarse útil (59), excepto en paliación; además, ésta ha fracasado universalmente en lograr respuesta favorable (51).
El imatinib es un inhibidor competitivo de la tirosina cinasa, que se absorbe oralmente, se metaboliza en el hígado en el citocromo P450 isoenzima CYP3A4, sus metabolitos se excretan en la bilis al intestino, tiene una vida media de 20 horas (56, 57), y a dosis de 400- 600 mg ha demostrado ser efectivo en el tratamiento de los TEGI metastásicos con seguimiento de seis meses (57). Las mutaciones del c-Kit modifican su efectividad (58), su toxicidad se incrementa con dosis de 800 mg/día por espacio de ocho semanas (59), sin que haya diferencia en la respuesta terapéutica usando dosis menores (evidencia no conclusiva) (57). No se ha establecido el tiempo de tratamiento ideal; se sugiere en varios meses a pocos años. Su efecto colateral predominante es el edema periorbitario y de miembros inferiores, que se maneja con diuréticos. Su indicación absoluta es para tumores metastáticos y/o irresecables, aunque se plantea controversia en su uso como manejo complementario en tumores malignos completamente resecados, o con metástasis subclínicas probables por agresividad del tumor primario, o en neoadyuvancia en tumores con compromiso multiorgánico, en los que la resección quirúrgica supone importante pérdida de función orgánica.
En nuestra opinión, y teniendo en cuenta que la recurrencia en los TEGI de bajo crecimiento puede ocurrir entre los cinco y diez años y que la sobrevida a cinco años de los tumores malignos oscila entre el 28-60%, con empeoramiento importante ante la presencia de metástasis (5), consideramos que el uso del imatinib no sólo debe limitarse exclusivamente al manejo de los pacientes con enfermedad metastásica o irresecable, sino implementarse en el tratamiento complementario de aquellos con tumores de alto riesgo (cuadro 2), o en quienes quede patología residual macroscópica.
Referencias
1. Mazur MT, Clark HB. Management of malignant gastrointestinal stromal tumors. Lancet Oncol 2002; 3: 655-662. [ Links ]
2. Hirota S, Isozaki K, Moriyama Y, et al. Lancet Oncol 2002; 3: 655-662. [ Links ]
3. Lecoin L, Gabella G, Le Douarin N. Origin of the c-kit-positive interstitial cells in the avian bowel. Development. 1996; 122 (3): 725-733. [ Links ]
4. Maeda H, Yamagata S, Nishikawa S, et. Al. Requirement of c-kit for development of intestinal pacemaker system. Development. 1992; 116: 369-374. [ Links ]
5. Young HM, Ciampoli D, Southwell BR, Newgreen DF: Origin of interstitial cells of Cajal in the mouse intestine. Dev Biol 1996, 180:97-107. [ Links ]
6. Kinblom LG, Remotti HE, Aldenborg F. Lancet Oncol 2002; 3: 655-662. [ Links ]
7. Alvarado CI, Ramírez BL, et al. Tumor estromal gástrico con degeneración mixoide. Rev. Gastroenterol Mex 2000; 65(1): 22-25. [ Links ]
8. Vliagoftis H, Worobec AS, Metcalfe DD. The protooncogene c-kit and c-kit ligand in human disease. J Allergy Clin Immunol 1997;100:435-440. [ Links ]
9. De Silva CM, Reid R, et al. Gastrointestinal stromal (GIST): C-Kit mutations, CD 117 expression, differential diagnosis and targeted cancer therapy with imatinib. Pathol Oncol Res 2003; 9. [ Links ]
10. Hirota S, Isozaki K, Moriyama Y, et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science 1998; 279: 577-580. [ Links ]
11. Miettinen M, Furlong M, Sarlomo-Rikala M, et al. Gastrointestinal stromal tumors, intramural leiomyomas and leimyosarcomas in the rectum and anus. A clinicopathologic, immunohistochemical and molecular genetic study of 144 cases. Am J Surg Pathol 2001; 25: 1121-1133. [ Links ]
12. Nakahara M, Isozaki K, Hirota S, et al. A novel gain-of-function mutation of c-kit gene in gastrointestinal stromal tumors. Gastroenterology 1998; 115: 1090-1095. [ Links ]
13. Hasegawa T, Matsuno Y, Shimoda T, et al. Gastrointestinal stromal tumors. Am J Clin Pathol 1995; 103: 41-47. [ Links ]
14. De Silva CM, Reid R, et al. Gastrointestinal stromal (GIST): C-Kit mutations, CD 117 expression, differential diagnosis and targeted cancer therapy with imatinib. Pathol Oncol Res 2003; 9. [ Links ]
15. Miettinen M, Lasota J. Management of malignant gastrointestinal stromal tumors. Lancet Oncol 2002; 3: 655-662. [ Links ]
16. Heinrich MC, Blanke CD, Druker BJ, et al. Management of malignant gastrointestinal stromal tumors. Lancet Oncol 2002; 3: 655-662. [ Links ]
17. Hornick JL, Fletcher CDM. Management of malignant gastrointestinal stromal tumors. Lancet Oncol 2002; 3: 655-662. [ Links ]
18. Miettinen M, El-Rifai W, Sobin L, Lasota J. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: A review. Human Pathology. 2002; 33 (5): 478-483. [ Links ]
19. Joensuu H, Fletcher Ch, Dimitrijevic S, Silberman S, Roberts P, Demetri G. Management of malignant gastrointestinal stromal tumours. Lancet Oncol 2002; 3: 655-64. [ Links ]
20. Reith J, Goldblum J, Lyles R, Weiss S. Extragastrointestinal (soft tissue) stromal tumors: an analysis of 48 cases with emphasis on histologic predictors of outcome. Mod Pathol. 2000; 13 (5): 577-585. [ Links ]
21. Miettinen M, Lasota J. Management of malignant gastrointestinal stromal tumors. Lancet Oncol 2002; 3: 655-662. [ Links ]
22. Miettinen M, Sarlomo-Rikala M, Lasota J. KIT expression in angiosarcomas and fetal endotelial cells: lack of mutations of exon 11 and exon 17 of C-kit. Mod Pathol. 2000; 13 (5): 536-541. [ Links ]
23. Sánchez FP, Martínez JL, Blanco B. Tumor del estroma gastrointestinal con afección a estómago. Presentación de un caso y revisión de la literatura. Rev Gastroenteral Mex 1999; 64: 139-142. [ Links ]
24. Fletcher CDM, Berman JJ, Corless C, et al. Management of malignant gastrointestinal stromal tumors. Lancet Oncol 2002; 3: 655-662. [ Links ]
25. Emory TS, Sobin LH, Lukes L, et al. Management of malignant gastrointestinal stromal tumors. Lancet Oncol 2002; 3: 655-662. [ Links ]
26. Fletcher C, Berman J, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. International Journal of Surgical Pathology. 2002; 10 (2): 81-89. [ Links ]
27. Miettinen M, Furlong M, Sarolomo-Rikala M, et al. Gastrointestinal stromal tumors, intramural leiomyomas in the rectum and anus: a clinicopathologic, inmunohistochemical and molecular genetic study of 144 cases. Am J Surg Pathol. 2001; 25: 1121-1133. [ Links ]
28. Ueyama T, Guo K-J Hashimoto H, et al. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Human Pathol 2002; 33: 478-481. [ Links ]
29. Emory TS, Sobin LH, Lukes L, et al. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Human Pathol 2002; 33: 478-481. [ Links ]
30. Goldblum JR, Appelman HD. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Human Pathol 2002; 33: 478-481. [ Links ]
31. Brainard JA, Goldblum JR. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Human Pathol 2002; 33: 478-481. [ Links ]
32. Tworek JA, Appelman HD, Singleton TP, et al. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Human Pathol 2002; 33: 478-481. [ Links ]
33. Miettinen M, Furlong M, Sarlomo-Rikala M, et al. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Human Pathol 2002; 33: 478-481. [ Links ]
34. Miettinen M, Monihan JM, Sarlomo-Rikala M, et al. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Human Pathol 2002; 33: 478-481. [ Links ]
35. Hirota S, Isosaki K, Moriyama Y, et al. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Human Pathol 2002; 33: 478-481. [ Links ]
36. Miettinen M, Lasota J. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Human Pathol 2002; 33: 478-481. [ Links ]
37. Kindblom LG, Remotti HE, Aldenborg F, et al. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Human Pathol 2002; 33: 478-481. [ Links ]
38. Miettinen M, Sobin LH, Sarlomo-Rikala, et al. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Human Pathol 2002; 33: 478-481. [ Links ]
39. Emory TS, Derringer GA, Sobin LH, et al. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Human Pathol 2002; 33: 478-481. [ Links ]
40. De Silva C, Reid R. Gastrointestinal stromal tumors (GIST): C-kit mutations, CD117 expression, differential diagnosis and targeted cáncer therapy with Imatibin. Pathol Oncol Res. 2003; 9 (1): 13-19. [ Links ]
41. Pidhrecky J, Cheney RT, Kraybill WG, et al. Management of malignant gastrointestinal stromal tumors. Lancet Oncol 2002; 3: 655-662. [ Links ]
42. Ishida T, Wada I, Horiuchi H, et al. Management of malignant gastrointestinal stromal tumors. Lancet Oncol 2002; 3: 655-662. [ Links ]
43. Miettinen M, Monihan JM, Sarlomo-Rikala M, et al. Management of malignant gastrointestinal stromal tumors. Lancet Oncol 2002; 3: 655-662. [ Links ]
44. Cooper PN, Quirke P, Hardy GJ, et al. Gastrointestinal stromal tumors (GIST): C-Kit mutations, CD 117 expression, differential diagnosis and targeted cancer therapy with imatinib. Gastrointestinal stromal tumors 2003; 9: 13-18.
45. Cunningham RE, Federspiel BH, McCarthy WF, Sobin, LH, O'Leary TJ. Predicting prognosis of gastrointestinal smooth muscle tumors. Role of clinical and histologic evaluation, flow cytometry, and image cytometry. Am J Surg Pathol. 1993 Jun;17(6):588-594. [ Links ]
46. Miettinen M, Sarlomo-Rikala M, Sobin. Gastrointestinal stromal tumors and leiomyosarcomas in the colon: a clinicopathologic, immunohistochemical, and molecular genetic study of 44 cases. Am J Surg Pathol 2000; 24(10):1339-52. [ Links ]
47. Bravo M, Adrada A, Sandoval J. Tumor estromal epiteloide quístico de crecimiento exogástrico. Rev Colomb Cir 2001; 106-110, Ilus. [ Links ]
48. Miettinen M, Sarlomo-Rikala M, Lasota J. Management of malignant gastrointestinal stromal tumors. Lancet Oncol 2002; 3: 655-662. [ Links ]
49. Michael C, Heinrich MC, Brian P, et al. Biology and genetic aspects of gastrointestinal stromal tumors: kit activation and cytogenetic alterations. Human Pathol 2002; 33: 484-493. [ Links ]
50. Ng EH, Pollock RE, Munsell MF, et al. Prognostic factors influencing survival in gastrointestinal leiomyosarcomas. Ann Surg 1992; 215: 68-77. [ Links ]
51. DeMatteo RP, Heinrich MC, El-Rifai W, et al. Clinical management of t gastrointestinal stromal tumors. Lancet Oncol 2002; 3: 655-662. [ Links ]
52. Mudan SS, Conlon KC, Woodruff JM, et al. Management of malignant gastrointestinal stromal tumors: before and after STI571. Human Pathol 2002; 33: 466-477. [ Links ]
53. Joensuu H, Roberts PJ, Sarolo-Rikala M, et al. Effect of tyrosine kinase inhibitor STI-571 in a patient with a metastatic gastrointestinal stromal tumor. N Engl J Med 2001; 344: 1052-1056. [ Links ]
54. Appelman HD. Mesenchymal tumors of the gut: histological perspectives new approaches, new results, and does it make any different. Monogr Pathol 1990; 31: 220-246. [ Links ]
55. Crosby JA, Catton CN, Davis A, et al. Malignant gastrointestinal stromal tumors of the small intestine: a review of 50 cases from a prospective detabase. Ann Surg Oncol 2001; 8: 50-59. [ Links ]
56. Druker BJ, Talpaz M, Resta DJ, et al. Efficacy and safety of a specific inhibitor of the BCR-ABL, tyrosine kinase in chorinc myeloid leukemia. N Engl J Med 2001; 344: 1031-1037. [ Links ]
57. Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 2002; 347: 472-480. [ Links ]
58. Heinrich MC, Coless CL, Blanke C, et al. Kit mutations status predicts clinical response to STI571 in patients with metastatic gastrointestinal stromal tumors (GISTs). Proc Am Clin Oncol 2002; 21: (2a) abstr. [ Links ]
59. Van Ossterom AT, Judson I, Wermeij J, et al. safety and efficacy of imatinib mesylate (STI571) in metastatic gastrointestinal stromal tumors: a phase I study. Lancet 2001; 358: 1421-1423. [ Links ]














