Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Cirugía
versión impresa ISSN 2011-7582versión On-line ISSN 2619-6107
rev. colomb. cir. v.20 n.1 Bogotá ene./mar. 2005
(1) Grupo de Gastrohepatología y nutrición. Universidad de Antioquia. Medellín, Antioquia.
Correspondencia: Rodrigo Castaño Llano, MD. Medellín, Colombia. rcastanoll@epm.net.co
Fecha de recibo: Enero 15 de 2005. Fecha de aprobación: Febrero 5 de 2005.
Resumen
El manejo de la obstrucción maligna gastrointestinal representa un gran reto. La mayoría de los pacientes se encuentran en un avanzado estado de descompensación por su tumoración de base y no son buenos candidatos para procedimientos quirúrgicos mayores. Recientemente, las prótesis metálicas autoexpandibles han emergido como una alternativa efectiva y segura, con menor invasión para el tratamiento de la obstrucción maligna esofágica y gastroduodenal. El presente estudio evalúa en forma prospectiva la experiencia con 99 stents esofágicos y 60 gastroduodenales en los últimos 4 años, con una revisión de la literatura. El éxito técnico y clínico fue del 96 y 85% respectivamente. La mayoría de los pacientes toleraron la dieta oral a las 36 horas de la colocación del stent. No hubo complicaciones mayores como sangrado, perforación o muertes. En 13 pacientes hubo manifestaciones de obstrucción del stent que se manejaron endoscópicamente. Nuestro estudio confirma la eficacia de los stents en la paliación de la obstrucción maligna gastroduodenal y esofágica con unos índices de complicación bajo.
Palabras clave: prótesis, cáncer de esófago, cáncer de estomago, endoscopia gastrointestinal.
Abstract
Management of malignant obstruction of the gastrointestinal tract constitutes a major challenge. Most patients are in a state of profound depletion due to the underlying malignancy and are not ideal candidates for major operative procedures. In recent years, self-expandible metal stents have shown to be an effective and safe, less invasive alternative in the treatment of malignant esophageal and gastroduodenal obstruction.
We hereby report a prospective study of 99 esophageal and 60 gastroduodenal stents placed over the past four years, together with a literature review.
Technical and clinical success rates were 96% and 85%, respectively. The majority of patients tolerated oral feeding within the first 36 hours following placement of the stent. There were no major complications, such as bleeding or perforation, and there were no deaths. Thirteen patients developed signs of obstruction of the stent, and they were successfully managed by endoscopy. Our data confirm the efficacy of the stent in the palliation of malignant esophageal and gastroduodenal obstruction and the method is associated with low complications rates.
Key words: prosthesis and implants, esophageal neoplasms, stomach neoplasms, endoscopy gastrointestinal.
Introducción
El tratamiento paliativo en el cáncer gastrointestinal alto está dirigido principalmente al alivio de la obstrucción, causa frecuente de desnutrición y morbimortalidad; además, debe ser rápidamente efectivo, seguro y bien tolerado. El uso de endoprótesis metálicas autoexpandibles (EMA) ha revolucionado la paliación de las obstrucciones malignas del tracto gastrointestinal y biliar, que a menudo enfrenta el cirujano en pacientes con alto riesgo quirúrgico. En la actualidad hay varias opciones para la elección de la endoprótesis más adecuada, la cual se debe fundamentar en las propiedades biofísicas, interacción con los tejidos vecinos, características anatómicas de cada paciente y, por supuesto, costos y disponibilidad en el medio.
Una característica común de las EMA radica en su capacidad para ser colapsadas en un sistema introductor de diámetro pequeño, lo cual facilita su ubicación a través de las estenosis orgánicas. Las características del material de fabricación de las EMA, así como su diseño geométrico determinan la fuerza de expansión, como también el grado de acortamiento una vez colocada. Las ventajas de las EMA incluyen alta efectividad por su adecuado lumen interno, fácil colocación con bajo índice de complicaciones, utilización de sedación únicamente como un procedimiento ambulatorio y buena tolerancia por el paciente por lo pequeño de los sistemas introductores. A pesar de una amplia experiencia en el ámbito mundial, el uso de las prótesis en general en nuestro medio ha estado restringido por los altos costos de las mismas y de los sistemas introductores.
En esta revisión se evalúan las características de la interacción de las endoprótesis con los tejidos, las indicaciones para su uso, aspectos técnicos y los resultados con el uso de las EMA en la obstrucción maligna esofágica y gastroduodenal, también se destaca la experiencia con el uso de una prótesis de nitinol desarrollada localmente.
Biomateriales y biodisponibilidad
Las características de la expansión o la elasticidad de las EMA dependen de la amalgama de los metales utilizados, lo que también influye en la fuerza de expansión una vez colocadas. Las EMA tejidas con un solo filamento tienen un mayor grado de acortamiento que las articuladas (figuras 1 y 2).
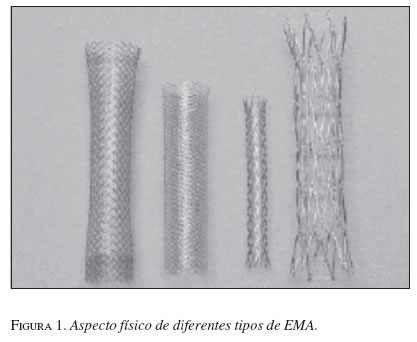
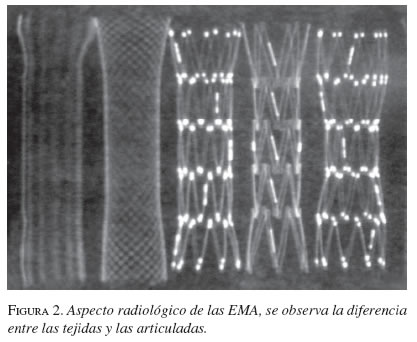
A partir de los años ochenta se han presentado modificaciones en las características del material utilizado; inicialmente se implementó el elgiloy (Wallstent, Boston Scientific, Natick, MA), una mezcla en la que predominaba el cobalto, y que fue remplazado por el acero (Z stent, Wilson Cook, Winston-Salen, NC) y más recientemente por el nitinol, mezcla de níquel y titanio (McIntee, 1999) (tabla 1).
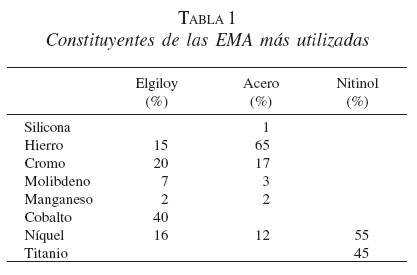
El nitinol es el elemento con el que se han construido las EMA localmente desde 1999 (Medellín, Tecnostent), fabricación que cuenta con el aval y el soporte técnico de la casa matriz en Corea (Stentech). Otras EMA de nitinol son el Ultraflex (Boston Scientific), Diamond (Boston Scientific), Za (Wilson Cook Medical, Winston-Salen, NC) y el Memotherm (CR Bard, Inc, Billerica, MA). Las EMA de nitinol de Ultraflex como las de Tecnostent tienen una fabricación similar a partir de un monofilamento trenzado, con un porcentaje de acortamiento tras su liberación del 30-40%. En la variedad Diamond, con la construcción de las celdas en diamante y su distribución intercalada en la prótesis, se previene este acortamiento durante su liberación (Nelson, 2001).
Fuerza radial y flexibilidad axial
La fuerza radial de las EMA para obtener su máxima expansión debe sobrepasar las fuerzas compresivas de la causa de la estenosis. Aunque los estudios experimentales en el laboratorio se pretenden extrapolar a la práctica in vivo con las EMA, debe tenerse en cuenta que in vivo los puntos de presión son asimétricos y en condiciones de temperatura y movimiento no previstas. En dos estudios (Chan, 1999 y Moon, 2001) se demuestra que la fuerza de expansión del Wallstent es mayor al Z stent, el cual a su vez es superior al Ultraflex. La cifra óptima de la fuerza radial o expansiva no se conoce.
La flexibilidad axial también se ha evaluado y hace referencia a la capacidad de tolerar las angulaciones, permitiendo un radio interno apropiada sin colapsarse. El estudio de Chan (1999) demostró al Wallstent como el más flexible, seguido por el Ultraflex y por último el Z stent. La flexibilidad axial es un factor importante para considerar cuando se pretende paliar una estenosis muy tortuosa o angulada.
Recubrimientos
Generalmente las EMA para el esófago tienen una cubierta externa, mientras que las usadas en la vía biliar y colon son descubiertas; las prótesis tipo Wallstent y la Ultraflex vienen en las dos presentaciones. Otra variación son las prótesis valvuladas para situaciones en que se franquea la unión gastroesofágica, para evitar el reflujo gastroesofágico: las de Wallstent tienen una prolongación de 8 cm del poliuretano que las recubre y la presión intraabdominal colapsa el mecanismo valvular impidiendo el reflujo.
En los casos de fístulas esofagorrespiratorias es mandatorio el uso de prótesis recubiertas, para ocluir la fístula. Las EMA recubiertas impiden la colonización tumoral, causa frecuente de oclusión tardía; sin embargo, interrumpen la incorporación del tejido a la prótesis, lo que facilita la migración, según Kosarek (1996). Para balancear estas opciones, la mayoría de las EMA tiene un segmento descubierto en cada extremo para prevenir las migraciones, con una significativa menor migración y colonización. Vakil (2001).
Los materiales usados para este recubrimiento son el poliuretano, teflón, silicona y polietileno. Nelson (2001).
Sistema introductor
Los sistemas introductores de las EMA incorporan un mecanismo para constreñir la prótesis dentro del mismo y dejar la prótesis en posición. Al remover este sistema introductor, la prótesis es liberada. El sistema más común es una cubierta externa que es retraída o removida, lo que le permite a la prótesis expandirse de distal a proximal. Otros sistemas son el Ultraflex que trae una sutura que cubre la prótesis y se retira al liberarla; viene en las dos formas, de distal a proximal o al contrario. El Z stent no viene premontado, y el usuario debe cargarlo manualmente en el catéter introductor. En la prótesis producida en nuestro medio, el sistema introductor se fabrica con un tubo de politetrafluoroetileno con un diámetro externo de 6 mm y el “pusher” o empujador con teflón, con un diámetro de 4 mm. La punta del introductor es una pieza de nailon que semeja una bala con la punta aguzada suavemente. El sistema se debe avanzar sobre una guía de 0,038 pulgadas (figura 3).

Respuesta tisular o biodisponibilidad
Bethge y Vakil (1996) postularon una secuencia de eventos una vez es liberada la EMA. Inicialmente, la EMA se expande y presiona la estenosis y el tejido normal. Al continuarse la presión el tejido subyacente a la prótesis sufre necrosis secundaria a la presión y se produce migración de la prótesis a las capas más profundas del tumor o del tejido normal (figura 4).
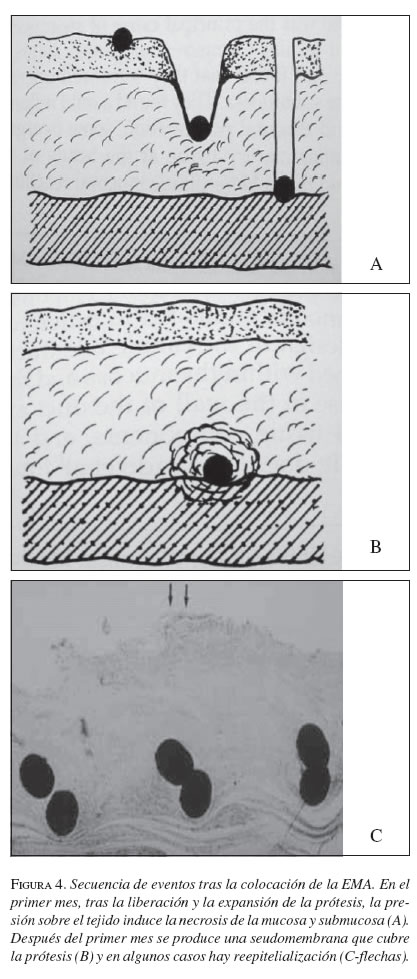
Una reacción inflamatoria crónica ocurre en la mucosa y submucosa, se produce colágeno y fibrosis y la EMA se involucra en medio de este tejido reactivo. La regeneración epitelial puede darse en algunos casos y cubrir la EMA; en otros, es cubierta por material colágeno evitando el contacto de la prótesis con la luz intestinal e incluso ocultándola a la visualización endoscópica.
Incorporación tisular
Silvis (1994) en estudios de prótesis metálicas no cubiertas en colédocos caninos demostró la penetración a mucosa y submucosa, y ocasionalmente proximidad a la serosa. Las prótesis cubiertas no muestran esta imbricación al tejido. Un estudio de Cwikiel (1993) con prótesis descubiertas en esófagos de cerdo inicialmente demostró necrosis por la presión a la mucosa, con penetración progresiva hasta incluso la muscular propia, esto se acompañó de la progresión de la fibrosis.
Una secuencia similar se presentó en una serie descrita por Hausegger (1992) en 15 pacientes estudiados post mortem, con paliación de la obstrucción biliar maligna con EMA descubiertas, por 5 días hasta 21 meses. Con la progresión del tiempo se incrementó la incorporación de la prótesis al tejido y la fibrosis local, lo cual sirve para fijar la prótesis y prevenir su migración (figura 5).

Hiperplasia mucosa benigna
Diferentes estudios del comportamiento de las EMA en la vía biliar (Maccioni, 1992 y Veis, 1994) demuestran una evolución diferente para las estenosis malignas con respecto a las benignas; en las últimas más frecuentemente hay obstrucción producida por hiperplasia benigna mucosa demostrada en estudios que confirman histológicamente la misma. Una explicación a esta diferencia es dada por el mayor tiempo de interacción de las prótesis con los tejidos vecinos en los casos de obstrucciones benignas, lo que no sucede en las malignas. (Cwikiel, 1993; Chen, 2000; Mayoral, 2000) (figuras 6 y 7).
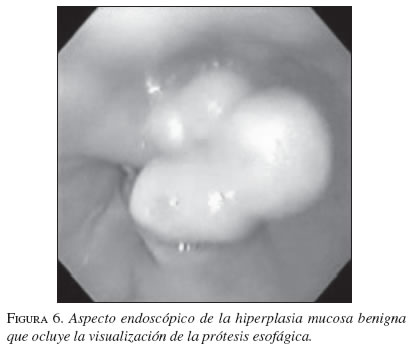
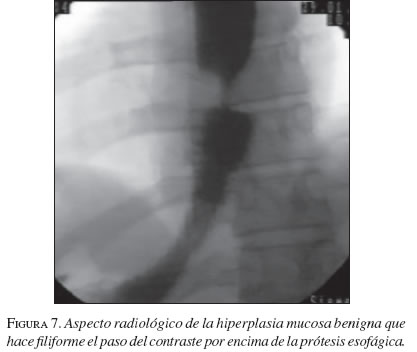
Los hallazgos histológicos muestran tejido de granulación, células gigantes de cuerpo extraño, fibrosis o hiperplasia reactiva. El desarrollo de esta obstrucción no maligna no parece relacionarse con el tipo de EMA, o al recibir quimiorradioterapia antes o después de su colocación.
Compatibilidad con la resonancia magnética nuclear
Según McIntee (1999), los Wallstent han sido evaluados en resonancia magnética y son considerados seguros y con mínima degradación de la imagen. Las EMA de nitinol también han sido estudiadas y se consideran no magnéticas. Según Taal (1997), sólo las prótesis con acero han mostrado artificios con la resonancia magnética.
Compatibilidad con la quimiorradioterapia
Kinsman (1996) y Siersma (1999) sugieren que las EMA colocadas después que el esófago ha recibido quimio y radioterapia tienen mayor índice de complicaciones, que las colocadas en un esófago normal. Estas complicaciones consisten en fístulas esófago-respiratorias, necrosis del esófago, y erosiones de la aorta. También se han descrito exclusivamente con la radioterapia. Raijman (1998) no ha demostrado esta mayor incidencia de complicaciones. Bethge (1997) encontró que las dosis de radiación fueron similares para quienes presentaban o no complicaciones fatales con las EMA.
Chowhan (1990) describió detalladamente los efectos de la quimio y radioterapia sobre el esófago. En las etapas iniciales, la radioterapia induce ulceración y descamación de la mucosa, que se puede extender a capas más profundas. Con el tiempo suele aparecer fibrosis, la cual puede comprometer la capa muscular del órgano. La ulceración y necrosis de un tumor esofágico que compromete la aorta puede precipitar una hemorragia mortal o el desarrollo de fístulas mediastinales. Vakil (1999) afirma que las fibras metálicas de una EMA en un tejido desvitalizado pueden migrar a través de la pared al mediastino. Sin embargo, estudios más recientes de seguimiento en pacientes con tumores de esófago sometidos a quimio y radioterapia antes (Sumiyoshi, 2003) y después (Yu, 2004) de la colocación de las EMA, no mencionan complicaciones.
Prótesis en esófago
Según Ahmedin (2003), más del 50% de los pacientes con carcinoma esofágico obstructivo son inoperables al momento del diagnóstico, incluso sólo el 18% sobrevive más de un año. El tratamiento paliativo está dirigido principalmente al alivio de la obstrucción, la cual es causa frecuente de desnutrición y morbimortalidad. Para Gukovsky-Reicher (2003), la meta más realista es proveer alivio de la disfagia u obstrucción, que puede a su vez mejorar el estado nutricional, maximizar la tolerancia a la quimiorradioterapia, dar sensación de bienestar y una mejoría significativa en la calidad de vida. Adicionalmente, este es el tratamiento de elección para la oclusión o sellamiento de las fístulas esófago-respiratorias. Castaño (2003).
Fabricación de la EMA
La EMA se fabrica en un laboratorio de biomateriales (Tecnostent SA, Medellín, Colombia). Inicialmente se implementaron las prótesis tipo Z (los 22 primeros casos), las cuales se compararon con las de nitinol que actualmente se producen con mayor respaldo en la literatura mundial (figura 8).

La producción de la prótesis de nitinol tiene el aval de la casa matriz en Corea (Stentech) donde los médicos pioneros de su fabricación recibieron información para la prótesis de nitinol desarrollada localmente. Hoy en día se cuenta con un intercambio directo de información con la casa matriz.
La EMA consiste en un alambre de nitinol de 0.22 mm, el cual es trenzado y cubierto con una capa de poliuretano (Biospan), en el centro mide 16 mm, y los extremos superior e inferior 22 mm cada uno en su diámetro máximo. En la parte superior de la prótesis hay un asa de nailon para facilitar la retirada o reposición endoscópica o fluoroscópica. El sistema introductor consiste en un tubo de politetrafluoroetileno, el empujador y una bala desprendible con marca radioopaca.
Colocación de la EMA
Antes de la colocación de la prótesis se realiza un estudio baritado; la razón para esto es delinear el sitio de la estenosis, evaluar la gravedad y longitud de ésta y verificar la presencia de fístula (esófago-respiratoria, etc.) Con base en esta información se selecciona la longitud de la EMA cubierta que se debe colocar. La faringe se anestesia utilizando xilocaína en aerosol, el paciente se coloca en decúbito lateral izquierdo o posición semiprona. El procedimiento se practica bajo sedación leve con una combinación de midazolan y meperidina. Todos los pacientes son monitorizados con oximetría, presión arterial no invasiva, frecuencia respiratoria y ritmo cardíaco durante todo el procedimiento.
Se coloca un protector bucal y por vía oral se avanza el endoscopio hasta franquear el tumor. Una vez distal a la lesión tumoral se pasa una guía. Se identifica el margen superior e inferior de la lesión para lo cual existen tres opciones:
1. Se colocan marcadores metálicos en la piel del paciente.
2. Se inyecta el margen proximal y distal del tumor con una aguja de endoscopia, utilizando material de contraste radiológico hidrofílico, o en su defecto.
3. Se utilizan marcas anatómicas como el diafragma o los cuerpos vertebrales o la persistencia del material de contraste usado en el esofagograma inicial.
La guía sugerida es la del conjunto de dilatadores Savary-Guillard (Wilson-Cook Medical Inc. Winston-Salem, NC) o en su defecto, la Amplatz super-rígida de 260 cm de longitud (Meditech/Boston Scientific, Watertown, MA), la cual se deja en el estómago o duodeno.
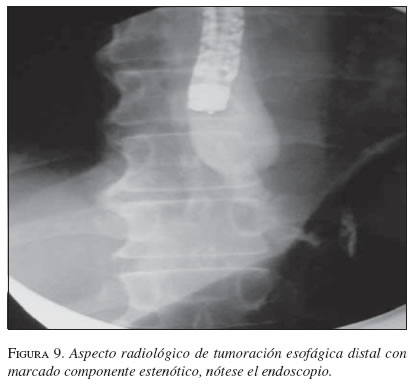
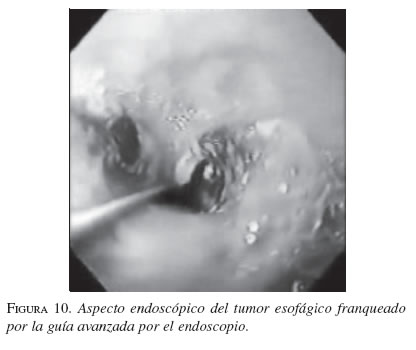
Sí la estenosis no permite el paso fácil del equipo y hay exceso de masa tumoral se puede predilatar hasta 12,8 mm (39 Fr) con la bujía de Savary-Guillard (Wilson-Cook Medical Inc., Winston-Salem, NC) o un balón neumático (Boston, Scientific, Watertown, MA). Después de seleccionar la longitud apropiada de la EMA de nitinol (extensiones disponibles de 8, 10 y 12 cm), la cual debe ser por lo menos 4 cm mayor a la longitud de la estenosis, ésta se introduce sobre la guía rígida bajo guía fluoroscópica. La presencia de marcadores metálicos conjuntamente con las marcas anatómicas facilita la colocación de la prótesis a través de la estenosis maligna con gran precisión. En la actualidad la mayoría de las EMA en esófago se coloca sin la visión fluoroscópica, siempre y cuando sea fácil el paso de la guía a través de la estenosis. Luego de la inserción de la prótesis se hace un esofagograma con bario para evaluar la colocación y el funcionamiento de ésta. Si el procedimiento fue exitoso se comenzarán líquidos claros y si son tolerados se avanzará a dieta licuada.
En la secuencia gráfica de las figuras 9, 10, 11, 12, 13 y 14 se demuestran los pasos en la liberación de la EMA en el esófago.
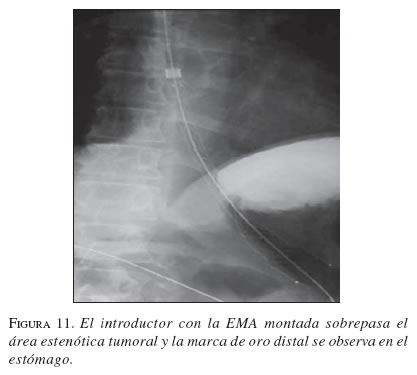
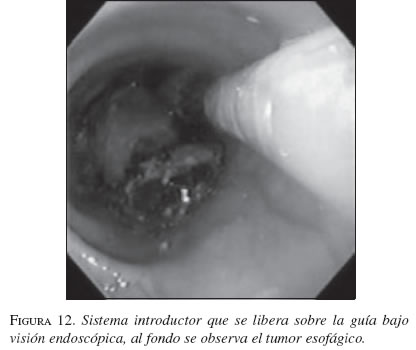
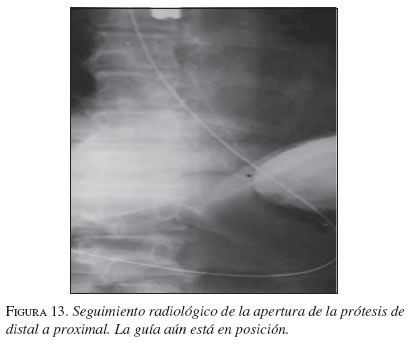
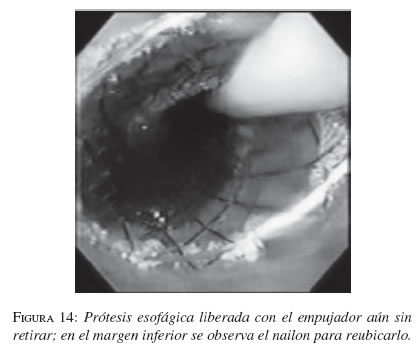
Resultados
En el servicio de Gastrohepatología de la Universidad de Antioquia, Hospital San Vicente de Paúl y el Hospital Pablo Tobón Uribe entre los años 1999 y 2004 se colocaron 99 EMA en 94 pacientes.
Evaluación técnica y clínica
Durante la colocación de las prótesis no hubo problemas técnicos o complicaciones. A todos los pacientes se les puso la prótesis, pero el éxito técnico fue del 97% (91/94). Una vez colocada la EMA, ésta se expande progresivamente hasta el tercer día de ubicada.
La totalidad de los pacientes reportó el alivio de la disfagia, con mejoría de la puntuación de un promedio de 3 antes de la endoprótesis, a 1,6 luego de la misma (p < 0.01). El control radiológico mostró expansión total de la prótesis en todos los pacientes y no se requirió de otras intervenciones como dilataciones con balón o reubicación.
La tabla 2 muestra las características demográficas de los pacientes sometidos a las EMA en el esófago.
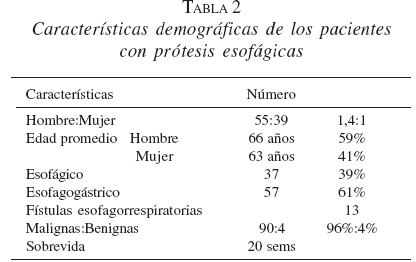
Complicaciones
No se presentaron complicaciones severas tempranas como sangrado masivo que ameritara transfusión urgente, perforación o migración. Un problema menor observado en la primera semana fue el dolor retrosternal en once pacientes, e incluso sensación transitoria de cuerpo extraño en uno con una prótesis más proximal (a 23-24 cm de la arcada dentaria) (tabla 3).
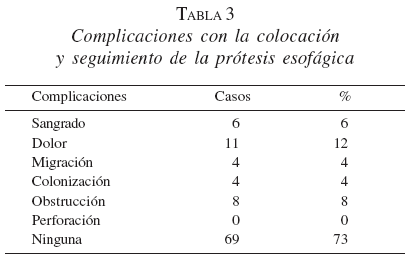
Además de las tres EMA que se colocaron por migración de las primeras, se pusieron dos coaxiales (una prótesis dentro de otra prótesis) cuando el tumor inicial era muy largo y se necesitaba de otro para franquear la totalidad de la extensión del tumor (figura 15).
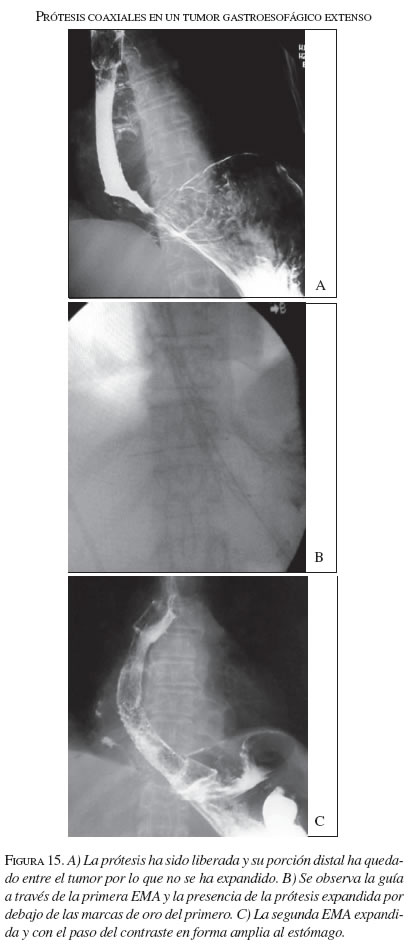
Seguimiento
El seguimiento se hizo en la Consulta de Cirugía Oncológica del Hospital Pablo Tobón Uribe y la Universidad de Antioquia en el Hospital San Vicente de Paúl y por vía telefónica. Se realizó endoscopia en caso de oclusión de la EMA producida por ingesta de material cárnico y sobrecrecimiento tumoral que fue manejado con inyecciones de alcohol absoluto. El problema más frecuente fue el reflujo gastroesofágico en las EMA que cruzaban el cardias. Al principio de la serie se intentó implementar una válvula antirreflujo de látex, pero desencadenó obstrucción y su uso no se hizo rutinario. Los pacientes con prótesis en la región inferior del esófago fueron tratados rutinariamente con medidas posturales antirreflujo e inhibidores de la bomba de protones.
La sobrevida promedio de los pacientes luego de la colocación de la prótesis es de 20 semanas; es importante destacar que se encontró una diferencia significativa (p=0,02) si la ubicación de la EMA era esofágica neta (18 semanas) o transcardial (21 semanas). Esta diferencia se explica por la presencia de trece pacientes con prótesis esofágicas y con fístulas esofagobronquiales.
En las tablas 4 y 5 se compara nuestra experiencia con el uso de EMA en la obstrucción maligna del esófago con la de otras series de la literatura.
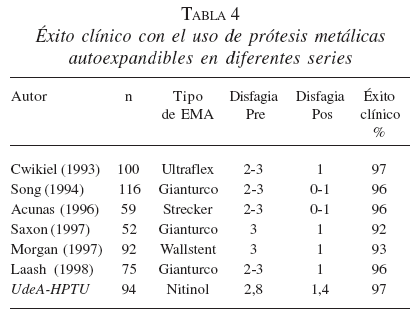
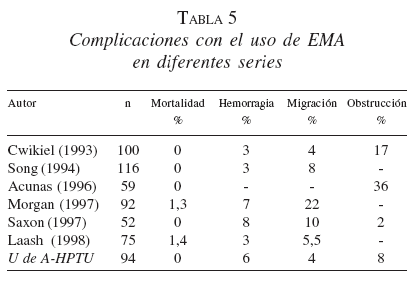
Fístulas esofagorrespiratorias
Las fístulas esofagorrespiratorias son una complicación grave y mortal de las enfermedades malignas del tracto respiratorio y esofágico. Su manejo es difícil y la mortalidad es muy alta por complicaciones pulmonares, sepsis e inanición. Se presentan en 5 a 10% de los pacientes con cáncer de esófago. (Castaño, 2003 y Duranceau, 1984).
Según Martini (1970) la mayoría de estos pacientes no sobrevive más de un mes sin ningún tratamiento específico. Campion (1983) y Conlan (1984) demuestran que la paliación con el tratamiento quirúrgico tiene elevada mortalidad. Binmoeller (1992) describe que las prótesis de plástico son rígidas de difícil inserción alta incidencia de complicaciones; en ocasiones no ocluyen las fístulas completamente.
Con base en las limitaciones en el tratamiento de las fístulas esofagorrespiratorias con los métodos ya mencionados, numerosos investigadores encontraron que el método más satisfactorio es el tratamiento con EMA; son fáciles de colocar, se asocian con menor incidencia de complicaciones y, lo más importante, con una mejoría significativa en la calidad de vida.
Más recientemente Van de Bongard (2002) promovió la colocación de prótesis paralelas en la vía aérea y digestiva para un mejor control de las fístulas, pero esta opción terapéutica no se debe considerar en forma rutinaria, sino para los pacientes en que prime el componente estenótico respiratorio, en cuyo caso se preferirá inicialmente la colocación de la prótesis de la vía aérea. Nomori (2000).
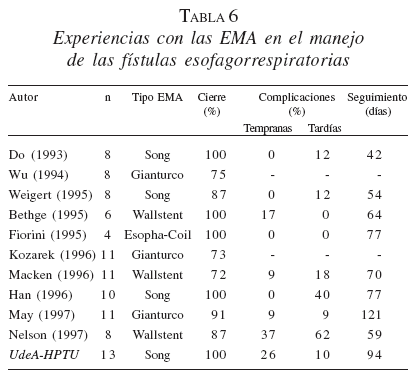
En la tabla 6 se actualiza nuestra experiencia ya publicada (Castaño, 2003) en el manejo de las fístulas esofagorrespiratorias con las EMA y se compara con otras series de la literatura.
Prótesis en la obstrucción maligna gastroduodenal
La obstrucción maligna del tracto de salida gástrico o duodenal, primaria o metastásica, es una enfermedad grave encontrada en pacientes con lesiones neoplásicas avanzadas. Sus síntomas incluyen náuseas, vómitos y distensión abdominal con deterioro clínico progresivo del paciente y de su calidad de vida. Tradicionalmente, la paliación ha sido quirúrgica, pero por el carácter invasivo de la intervención y la pobre condición general de estos pacientes, Weaver (1987) y Potts (1990) han encontrado una tasa de morbilidad de 20-30%. La paliación de estas obstrucciones con las EMA ha sido reportada con resultados prometedores. (Castaño, 2004; Lopera, 2001).
Técnica de colocación de las EMA
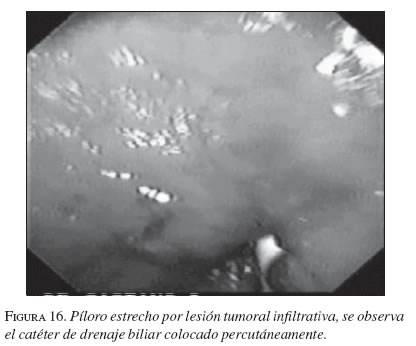
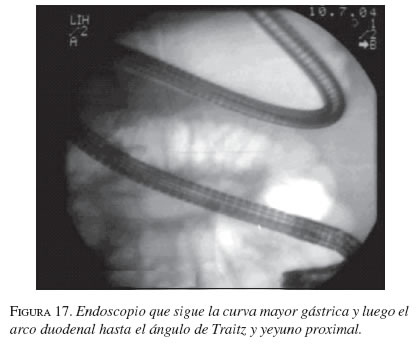
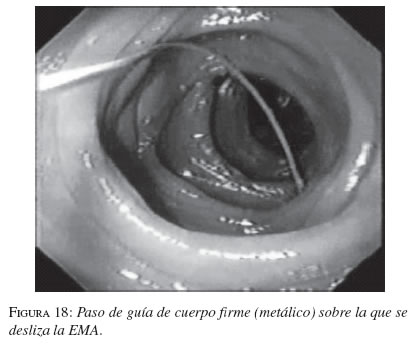
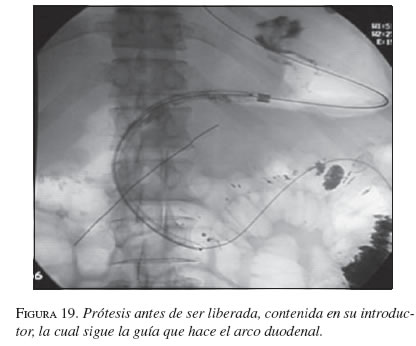
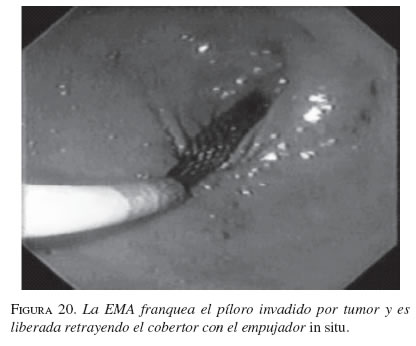
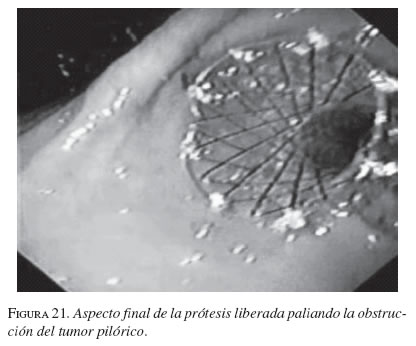
La serie gastroduodenal superior sirve para evaluar la longitud y localización de la estenosis en todos los pacientes. En los casos necesarios se dejó la noche anterior una sonda nasogástrica de descompresión y no se utilizaron antibióticos profilácticos de rutina. El procedimiento se ejecutó bajo sedación consciente, con la cual no se presentaron complicaciones. Con el endoscopio diagnóstico (GIF-P30; Olympus, Tokio) y con anestesia faríngea con xilocaína en aerosol, se visualizó la lesión y cuando era posible se franqueaba con el endoscopio. Se aplicó el material de contraste y el extremo proximal y distal de la estenosis se marcó con infiltración submucosa del contraste o en la piel del paciente con grapas metálicas. Cuando no se pudo franquear la estenosis con el endoscopio, se usó una guía super-stiff de 470 cm (Boston Scientific/Medi-tech) para atravesar la estenosis y dejarla lo más distal posible en el yeyuno. Se seleccionó una prótesis 4 cm más larga que la estenosis para prevenir el crecimiento y obstrucción tumoral en los extremos. Luego de la lubricación con xilocaína, y bajo visión fluoroscópica se colocó a través de la estenosis, el sistema introductor con la prótesis montada. Para la liberación de la EMA, el tubo introductor se retiró mientras el catéter empujador se dejó in situ. Esta maniobra liberó la EMA. La bala plástica se deja dentro del paciente y es expulsada después. No se hizo dilatación con balón ni antes ni después de colocar la prótesis. El seguimiento endoscópico o con fluoroscopia y medio de contraste se hizo para evaluar la permeabilidad y ubicación de la endoprótesis. A los pacientes se les restringió la ingesta a sólo líquidos el primer día, con progresión a dieta líquida completa, blanda o regular según su tolerancia (figuras 16, 17, 18, 19, 20 y 21).
Resultados
Los pacientes ingresaron al servicio de Gastrohepatología del Hospital Pablo Tobón Uribe y el Hospital San Vicente de Paúl, Universidad de Antioquia entre junio de 1999 y junio de 2004. Se consideraron como inoperables los que mostraban pobre condición física, edad avanzada y extensión regional o a distancia del tumor, o una combinación de estas opciones. Las indicaciones para la colocación de las EMA se presentan en la tabla 7.
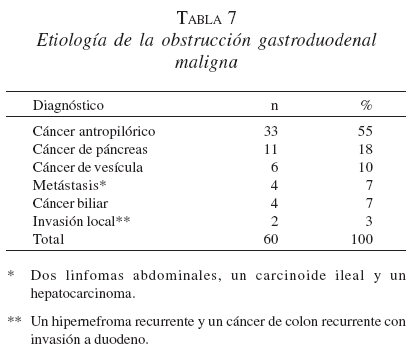
Hubo sólo tres fallas técnicas causadas por la longitud inadecuada del sistema introductor o la carencia de una guía de las características descritas en pacientes con estómago marcadamente dilatado que fueron sometidos a gastroyeyunostomías. En cuanto a los síntomas obstructivos previos a la colocación de la EMA, de los nueve pacientes que no toleraban ningún tipo de vía oral, siete mejoraron con la colocación de la misma.
De los dos pacientes que no toleraban la vía oral a pesar de la EMA, El seguimiento radiológico mostró unas prótesis permeables con adecuado paso del medio de contraste a la región distal del duodeno. Estos pacientes estaban en muy mala condición clínica y fueron manejados con alimentación parenteral y medidas paliativas hasta su muerte una semana más tarde. Tres pacientes tenían estenosis muy largas, por lo que requirieron de dos prótesis (una dentro de otra o coaxial).
La migración proximal de la prótesis se observó en tres de las siete totalmente cubiertas, entre uno y cinco días después de su colocación. Estos pacientes presentaron recidiva de sus síntomas obstructivos gastroduodenales. La remoción endoscópica se hizo con un asa de polipectomía de 25 mm (Microvasive Endoscopy; Boston Scientific/medi-tech), seguida por la colocación de una nueva EMA descubierta peroral. Además, de 50 pacientes con prótesis parcialmente cubiertas, dos presentaron migración.
La colonización se observó en dos de las tres EMA descubiertas y en una prótesis parcialmente cubierta dentro de otra en el paciente con mayor seguimiento (96 semanas). Los dos primeros casos con colonización tumoral tenían EMA descubiertas para paliar la obstrucción luego de la migración de las prótesis totalmente cubiertas. El primer paciente tenía una historia de sangrado por el tumor, con oclusión de la EMA por coágulos cuatro semanas después de su colocación. La endoscopia mostró colonización tumoral y el sangrado se manejó con embolización de la arteria gastroduodenal con mejoría. El segundo paciente presentaba síntomas recurrentes de obstrucción gastroduodenal 40 semanas después de la colocación, el estudio baritado de seguimiento reveló estrechez de la EMA por el crecimiento tumoral.
En vista de la condición terminal de ambos pacientes, el manejo fue conservador; ambos toleraron la dieta líquida durante uno y dos meses hasta su muerte. Todos los pacientes fallecieron como consecuencia de sus lesiones tumorales primarias entre 1 y 96 semanas después de la colocación de la EMA (supervivencia promedio de 17,7 semanas).
La sobrevida promedio de los pacientes en quienes no se les pudo colocar la EMA fue de 2,6 semanas, diferencia estadísticamente significativa (p=0,021), comparada con el grupo al que se le colocó la prótesis. El paciente con mayor sobrevida tenía un hipernefroma recurrente, con tres cirugías previas, las dos últimas fallidas; presentó invasión del arco duodenal que se manejó con una prótesis en otra (parcialmente cubiertas) por lo largo de la estenosis, con colonización de la prótesis proximal. Requirió intervención quirúrgica (gastroyeyunostomía), y falleció en el postoperatorio inmediato.
Seguimiento
Al día siguiente del procedimiento a los pacientes se les practicó un esófago-estómago-duodeno, para evaluar la descompresión gástrica y la colocación de la EMA.
Los pacientes fueron controlados a través de llamadas telefónicas semanales y en la consulta externa cada mes, para evaluar la tolerancia a la dieta y la aparición de náuseas, dolor o vómitos. Se practicaron estudios radiológicos con bario o endoscopias en presencia de síntomas sugestivos de recurrencia de la obstrucción. Se determinó el éxito técnico si se colocaba la EMA en el sitio de mayor obliteración por la estenosis. El éxito clínico se definió como la mejoría de los síntomas obstructivos y de la ingesta oral sin necesidad de paliación quirúrgica.
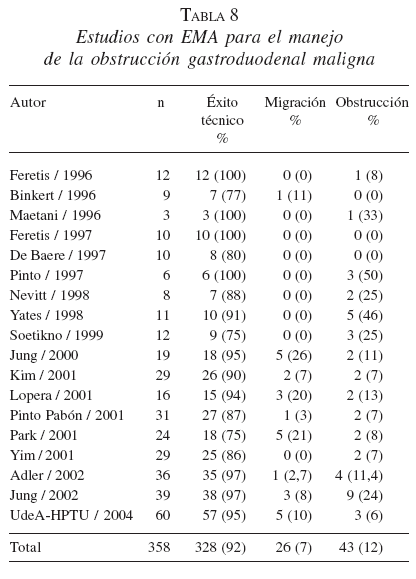
En la tabla 8 se recoge la experiencia publicada con las EMA en el manejo de la obstrucción gastroduodenal maligna.
Referencias
1. Acunas B, Rozanes I, Akpinar S, Tunaci A, Tunaci M, Acunas G. Palliation of malignant esophageal strictures with self-expanding nitinol stents: drawbacks and complications. Radiology 1996;199:648-52. [ Links ]
2. Adler DG, Baron TH. Endoscopic palliation of malignant gastric outlet obstruction using self-expanding metallic stents: experience in 36 patients. Am J Gastroenterol 2002;97:72-78. [ Links ]
3. Bethge N, Sommer A, Gross U. Treatment of esophageal fistulas with a new polyurethane-covered, self-expanding mesh stent: a prospective study. Am J Gastroenterol 1995;90:2143-2146. [ Links ]
4. Bethge N, Sommer A, Vakil N, et al. Human tissue responses to metal stents implanted in vivo for the palliation of malignant stenoses. Gastrointest Endosc 1996;43:596-602. [ Links ]
5. Bethge N, Sommer A, Vakil N. A prospective trial of self-expanding metal stents in the palliation of malignant esophageal strictures near the upper esophageal sphincter. Gastrointest Endosc 1997; 45: 300-303. [ Links ]
6. Bezzi M, Orsi F, Salvatori FM, Maccioni F, Rossi P. Self-expandable nitinol stent for the management of biliary obstruction: long-term clinical results. J Vasc Interv Radiol 1994;5:287-293. [ Links ]
7. Binkert CA, Jost R, Steiner A, Zollikofer CL. Benign and malignant stenoses of the stomach and duodenum: treatment with self-expanding metallic endoprostheses. Radiology 1996; 199:335–338. [ Links ]
8. Campion JP, Bourdelat D, Launois B. Surgical treatment of malignant esophagotracheal fistulas. Am J Surg 1983;146:641-6. [ Links ]
9. Castaño R, Ruiz M, Sanín E. Stent esofágico de nitinol en el manejo de las fístulas esofagorrespiratorias malignas. Revista Col de Gastroenterol 2003, 18 (2): 78-82 [ Links ]
10. Castaño R, Ruiz M, Juliao F, Sanín E, et al. Eficacia de un nuevo stent de nitinol fabricado localmente, en el tratamiento de la obstrucción maligna esofágica. Rev Colom Gastroenterol 2003;18:211-221. [ Links ]
11. Castaño R, Álvarez O, Ruiz M, Juliao F, Sanín E, Erebrie F. Nitinol autoexpandable stent in malignant gastric outlet obstruction. Endoscopy 2004;36 (Suppl I):A242. [ Links ]
12. Chan AC, Shin FG, Lam YH, et al. A comparison study on physical properties of self-expandable esophageal metal stents. Gastrointest Endosc 1999;49:462-465. [ Links ]
13. Chen JS, Luh SP, Lee F, Tsai CI, Lee JM, Lee YC. Use of esophagectomy to treat recurrent hyperplastic tissue obstruction caused by multiple metallic stent insertion for corrosive stricture. Endoscopy 2000;32:542-545. [ Links ]
14. Chowhan NM. Injurious effects of radiation on the esophagus. Am J Gastroenterol 1990;85:115-120. [ Links ]
15. Conlan AA, Nicolaou N, Delikaris PG, Pool R. Pessimism concerning palliative bypass procedures for established malignant esophagorespiratory fistulas: a report of 18 patients. Ann Thorac Surg 1984;37:108-110. [ Links ]
16. Cwikiel W, Willen R, Stridheck H, Lillo-Gil R, Von Holstein CS. Self expanding stent in the treatment of benign esophageal strictures: experimental study in pigs and presentation of clinical cases. Radiology 1993;187:667-71 [ Links ]
17. De Baere T, Harry G, Ducreaux M, et al. Self-expanding metallic stents as palliative treatment of malignant gastroduodenal stenosis. AJR Am J Roentgenol 1997;169:1079-1083. [ Links ]
18. Do YS, Song HY, Lee BH, et al. Esophagorespiratory fistula associated with esophageal cancer: treatment with a Gianturco stent tube. Radiology 1993;187:673-677. [ Links ]
19. Duranceau A, Jamieson GG. Malignant tracheoesophageal fistula. Ann Thorac Surg 1984;37:346-354. [ Links ]
20. Feretis C, Benakis P, Dimopoulos C, et al. Palliation of malignant gastric outlet obstruction with self-expanding metal stents. Endoscopy 1996;28:225-228. [ Links ]
21. Feretis C, Benakis P, Dimopoulos C, Manouras A, Tsimbloulis B, Apostolidis N. Duodenal obstruction caused by pancreatic head carcinoma: palliation with self expandable endoprostheses. Gastrointest Endosc 1997;46:161-165. [ Links ]
22. Fiorini AB, Goldin E, Valero JL, et al. Expandable metal coil stent for treatment of broncho-esophageal fistula. Gastrointest Endosc 1995;42:81-83. [ Links ]
23. Gukovsky-Reicher S, Lin RM, Sial S, Garrett B, Wu D, Lee T, Lee H, et al. Self-expandable metal stents in palliation of malignant gastrointestinal obstruction: review of the current literature data and 5-year experience at Harbor-UCLA Medical Center. Med Gen Med 2003;10;5:16. [ Links ]
24. Han YM, Song HY, Lee JM et al., Esophagorespiratory fistula due to esophageal carcinoma: palliation with a covered Gianturco-Stent. Radiology 1996;199:65-79. [ Links ]
25. Hausegger KA, Kleinert R, Lammer J, et al. Malignant biliary obstruction: histologic findings after treatment with self-expandable stents. Radiology 1992;185:461-464. [ Links ]
26. Jemal A, Murray T, Samuels A, Ghafoor A, Ward E, Thun JM. Cancer Statistics, 2003 CA. 2003;53:5-26. [ Links ]
27. Jung GS, Song HY, Kang SG, et al. Malignant gastroduodenal obstructions: treatment by means of a covered expandable metallic stent-initial experience. Radiol 2000;216:758-763. [ Links ]
28. Jung GS, Song HY, Seo TS, Park SJ, Koo JY, Huh JD, Cho YD. Malignant gastric outlet obstructions: treatment by means of coaxial placement of uncovered and covered expandable nitinol stents. J Vasc Interv Radiol 2002;13:275-283. [ Links ]
29. Kim JH, Yoo BM, Lee KJ, et al. Self-expanding coil stent with a long delivery system for palliation of unresectable malignant gastric outlet obstruction: a prospective study. Endoscopy 2001;33:838-842. [ Links ]
30. Kinsman KJ, De Gregorio BT, Katon RM, et al. Prior radiation and chemotherapy increase the risk of life-threatening complications after insertion of metallic stents for esophagogastric malignancy. Gastrointest Endosc 1996; 43:196-203 [ Links ]
31. Kozarek RA, Raltz S, Brugge WR et al. Prospective multicenter trial of esophageal Z-stent placement for malignant dysphagia and tracheoesophageal fistula. Gastrointest Endosc 1996; 44: 562-567 [ Links ]
32. Laasch HU, Nicholson DA, Kay CL, et al. The clinical effectiveness of the Gianturco esophageal stent in malignant esophageal obstruction. Clin Radiol 1998;53:666-672. [ Links ]
33. Lopera J, Alvarez O, Zúñiga-Castañeda A, Castaño R. Initial Experience with Song´s covered duodenal stent in the treatment of malignant gastroduodenal obstruction. J Vasc Interv Radiol 2001;12:1297-1303. [ Links ]
34. Macken E, Gevers A, Hiele M, et al. Treatment of esophagorespiratory fistulas with polyurethane-covered self-expanding metallic mesh stent. Gastrointest Endosc 1996;44:324-326. [ Links ]
35. Maccioni F, Rossi M, Salvatori FM, Ricci P, Bezzi M, Rossi P. Metallic stents in benign biliary strictures: three-year follow-up. Cardiovasc Intervent Radiol 1992;15:360-366. [ Links ]
36. Maetani I, Inoue H, Sato M, Ohashi S, Igarashi Y, Sakai Y. Peroral insertion techniques of self- expanding metal stents for malignant gastric outlet and duodenal stenosis. Gastrointest Endosc 1996;44:468-471. [ Links ]
37. Martini N, Goodner JT, D’Angio GJ, et al. Tracheo-esophageal fistula due to cancer. J Thorac Cardiovasc Surg 1970;59:319-324. [ Links ]
38. Mayoral W, Fleischer D, Salcedo J, Roy P, Al-Kawas F, Benjamin S. Nonmalignant obstruction is a common problem with metal stents in the treatment of esophageal cancer. Gastrointest Endosc 2000;51:556-559. [ Links ]
39. May A, Ell C. Palliative treatment of malignant esophagorespiratory fistulas with gianturco-z stents a prospective clinical trial and review of the literature on covered metal stents. Am J Gastroenterol 1998;93:532-535. [ Links ]
40. McIntee BE. The wallstent endoprostheses. Gastrointest Endosc Clin N Am 1999;9:373-381. [ Links ]
41. Moon T, Hong D, Chun HJ, Jeen YT, Hyun JH, Lee KB. New approach to radial expansive force measurement of self expandable esophageal metal stents. ASAIO J 2001;47:646-650. [ Links ]
42. Morgan RA, Ellul JPM, Denton ERC, Glynos M, Mason RC, Adam A. Malignant esophageal fistulas and perforations: management with plastic-covered metallic endoprostheses. Radiol 1997;204:527-532. [ Links ]
43. Nelson DB, Axelrad AM, Fleischer DE, et al. Silicone covered Wallstent prototypes for palliation of malignant esophageal obstruction and digestive respiratory fistulas. Gastrointest Endosc 1997;45:31-37. [ Links ]
44. Nelson DB. Expandable metal stents: physical properties and tissue responses. Techn Gastrointest Endosc 2001;3:70-74. [ Links ]
45. Nevitt AW, Vida F, Kozarek RA, Traverso LW, Raltz SL. Expandable metallic prostheses for malignant obstructions of gastric outlet and proximal small bowel. Gastrointest Endosc 1998;47:271-276. [ Links ]
46. Nomori H, Horio H, Imazu Y, Suemasu KC. Double stenting for esophageal and tracheobronchial stenoses. Ann Thorac Surg 2000;70:1803-1807. [ Links ]
47. Park HS, Do YS, Suh SW, et al. Upper gastrointestinal tract malignant obstruction: initial results of palliation with a flexible covered stent. Radiology 1999;210:865-870. [ Links ]
48. Pinto IT. Malignant gastric and duodenal stenosis: palliation by peroral implantation of a self-expanding metallic stent. Cardiovasc Intervent Radiol 1997; 20:431-434. [ Links ]
49. Pinto Pabón IT, Díaz LP, Ruiz De Adana JC, López Herrero J. Gastric and duodenal stents: follow-up and complications. Cardiovasc Intervent Radiol 2001;24:147-153. [ Links ]
50. Potts JR, Broughan TA, Hermann RE. Palliative operations for pancreatic carcinoma. Am J Surg 1990;159:72-78. [ Links ]
51. Raijman I, Siddiqui I, Ajani J, Lynch P. Palliation of malignant dysphagia and fistulae with coated expandable metal stents: experience with 101 patients. Gastrointest Endosc 1998; 48:172-179. [ Links ]
52. Saxon RR, Barton RE, Katon RM, et al. Treatment of malignant esophagorespiratory fistulas with silicone-covered metallic Z stents . J Vasc Interv Radiol 1995;6:237-242. [ Links ]
53. Siersma PD, Hop WCJ, Dees J, et al. Coated self-expanding metal stent versus latex prostheses for esophago-gastric cancer with special reference to prior radiation and chemotherapy: a controlled prospective study. Gastrointest Endosc 1998;47:113. [ Links ]
54. Silvis SE, Sievert CE, Vennes JA, et al. Comparison of covered versus uncovered wire mesh stents in the canine biliary tract. Gastrointest Endosc 1994;40:17-21. [ Links ]
55. Soetikno RM, Carr-Locke DL. Expandable metal stents for gastric-outlet, duodenal, and small intestinal obstruction. Gastrointest Endosc Clin N Am 1999;9:447-458. [ Links ]
56. Song HY, Do YS, Han YM, et al. Covered expandable esophageal metallic stent tubes: experiences in 119 patients. Radiology 1994;193:689. [ Links ]
57. Sumiyoshi T, Gotoda T, Muro K, Rembacken B, Goto M, Sumiyoshi Y, Ono H, Saito D. Morbidity and mortality after self-expandable metallic stent placement in patients with progressive or recurrent esophageal cancer after chemoradiotherapy. Gastrointest Endosc 2003; 57:882-885. [ Links ]
58. Van den Bongard HJ, Boot H, Baas P, Taal BG. The role of parallel stent insertion in patients with esophagorespiratory fistulas. Gastrointest Endosc 2002;55:110-115. [ Links ]
59. Vakil N, Gross U, Bethge N. Human tissue responses to metal stents. Gastrointest Endosc Clin N Am 1999;9:359-365. [ Links ]
60. Vakil N, Morris AI, Marcon N, Segalin A, et al. A prospective, randomized, controlled trial of covered expandable metal stents in the palliation of malignant esophageal obstruction at the gastroesophageal junction. Am J Gastroenterol 2001;96:1791-1796. [ Links ]
61. Weaver DW, Wiencek RG, Bouwman DL, Walt AJ. Gastrojejunostomy: is it helpful for patients with pancreatic cancer? Surgery 1987;107:608-612. [ Links ]
62. Weigert N, Neuhaus H, Rösch T, et al. Treatment of esophagorespiratory fistula with silicone-coated self-expanding metallic stents. Gastrointest Endosc 1995;41:490-496. [ Links ]
63. Wu WC, Katon RM, Uchida T et al., Silicone-covered self-expanding metallic stents for the palliation of malignant esophageal obstruction and esophagorespiratory fistulas: experience in 32 patients and a review of the literature. Gastroint Endosc 1994;40:22-33. [ Links ]
64. Yates MR, Morgan DE, Baron TH. Palliation of malignant gastric and small intestinal strictures with self-expandable metal stents. Endoscopy 1998; 30:266-272. [ Links ]
65. Yim HB, Jacobson BC, Saltzman JR, Johannes RS, Bounds BC, Lee JH, Shields SJ, et al. Clinical outcome of the use of enteral stents for palliation of patients with malignant upper GI obstruction. Gastrointest Endosc 2001;53:329-332. [ Links ]
66. Yu YT, Yang G, Liu Y, Shen BZ. Clinical evaluation of radiotherapy for advanced esophageal cancer after metallic stent placement. World J Gastroenterol 2004;10:2145-2146. [ Links ]














