Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Cirugía
versão impressa ISSN 2011-7582versão On-line ISSN 2619-6107
rev. colomb. cir. v.20 n.3 Bogotá jul./set. 2005
Un nuevo concepto, una nueva técnica quirúrgica
A new concept, a new surgical techique
(1) Cirujanos oncólogos - Mastólogos de la Clínica de Seno de la Clínica del Country. Bogotá, D.C., Colombia.
Correspondencia: José Joaquín Caicedo, MD. Bogota, D.C., Colombia. jocaiced@hotmail.com
Fecha de recibo: Enero 31 de 2005. Fecha de aprobación: Junio 20 de 2005.
Resumen
La disección del ganglio centinela se ha convertido en el estándar de manejo en estados tempranos de cáncer mamario y melanoma principalmente. Se requiere curva de aprendizaje y validación de la técnica por parte de cirujanos, médicos nucleares y patólogos en cada centro especializado, antes de abandonar definitivamente el vaciamiento ganglionar. El objetivo de esta técnica es racionalizar la linfadenectomía axilar y así disminuir la morbilidad.
Para la detección del ganglio centinela se utilizan colorantes como el azul patente, azul de isosulfán, y en nuestro medio el azul de metileno. Igualmente técnicas de medicina nuclear que emplean la inyección de sulfuro coloidal marcado con Tc 99 en el seno, asociado al uso de gammasondas intraoperatorias. Se debe lograr cifras de detección del ganglio centinela superiores al 90%, con un índice de falsos negativos cercano al 5%.
Se presenta la revisión de la literatura y la recopilación de nuestra experiencia en la Clínica de Seno de la Clínica del Country, Bogotá, Colombia, en donde manejamos 82% de casos en estados tempranos. Nuestro informe se basa en la experiencia adquirida en una serie de 277 casos recolectados entre enero de 1998 y enero de 2005, con una detección actual del ganglio centinela de más del 98% y una tasa de falsos negativos de 7%. Se evita el vaciamiento en 87% de las pacientes con carcinoma mamario invasivo en estados tempranos de la enfermedad. Esta nueva técnica se convierte en nuestro estándar de manejo en pacientes con carcinoma de seno con axilas clínicamente negativas.
Palabras clave: cáncer de mama, melanoma, biopsia del módulo linfático, centinela, disección del módulo linfático, inmunocintografía radiomarcada.
Abstract
Dissection of the sentinel lymph node has become a standard procedure in the management of early-stage breast cancer and melanomas. A learning-curve is required, together with the proper validation of the technique by surgeons, nuclear medicine specialists, and pathologists before abandoning the orthodox lymph node dissection. The aim of this technique is the rationalization of the axillary lymph node dissection and thus diminishing morbidity.
Several vital stains, such as patent blue, isulphan blue, and, among us, methylene blue, are utilized for the detection of the sentinel node. Also, the radiolocalization techniques of nuclear medicine by means of the injection of colloidal sulphur labelled with 99Tc and the intraoperative use of a gamma probe. All techniques should yield a detection rate superior to 90%, with a false-negative rate below 5%.
We hereby report a literature review together with our experience at the Breast Clinic of Clínica del Country, Bogotá, Colombia, where 82% of our cases present with breast cancer in the early stages. Our report is based on the experience with 277 cases collected between January 1998 and January 2005. Our annual rate of detection of the sentinel lymph node is above 98%, with a false negative rate of 7%. We have avoided the axillary dissection in 87% of our patients with early-stage invasive breast carcinoma. This novel technique has become the standard procedure in the management of early stage breast carcinoma and a clinically negative axilla.
Key words: breast neoplasms, melanoma, sentinel lymph node biopsy, lymph node dissection, radionuclide imaging.
Introducción
Las innovaciones en las técnicas quirúrgicas no ocurren muy frecuentemente. Estamos acostumbrados a aprender basados en métodos descritos mucho tiempo atrás. Cambios de paradigma como los observados con el advenimiento de la cirugía laparoscópica en el contexto de la cirugía general, permiten efectuar los mismos procedimientos con menor morbilidad para el paciente, siempre y cuando tenga un entrenamiento adecuado en las nuevas modalidades terapéuticas.
Lo mismo ha sucedido con el concepto del ganglio centinela (GC), que busca evitar un vaciamiento ganglionar (VG) innecesario en pacientes con cáncer en estados tempranos de la enfermedad. Desde su descripción en el tratamiento del melanoma, en 1992, y en carcinoma mamario, en 1994, se han llevado a cabo muchos estudios clínicos de validación de la nueva técnica quirúrgica, demostrando que en manos experimentadas y centros especializados en patología oncológica, esta nueva técnica disminuye la morbilidad a corto y largo plazo y racionaliza el VG en casos seleccionados.
Aspectos históricos
El concepto de GC es básicamente anatómico y fisiológico. En 1653, Bartholin describe la anatomía linfática y más tarde, en el siglo XIX, Virchow (1) sugiere que los ganglios linfáticos funcionan como un filtro, lo que se refuerza posteriormente con las observaciones realizadas por Halsted en 1886 (2, 16), cuando informa la técnica de la mastectomía radical en monobloque, tratando de controlar lo que se consideraba una enfermedad locorregional. Sus preceptos perduran cerca de 75 años, hasta mediados del siglo pasado, cuando Bernard Fisher (3) desafía estas ideas y demuestra que el cáncer de mama es una enfermedad sistémica y que el compromiso de los ganglios representa tan sólo el potencial de compromiso sistémico de la misma enfermedad.
En 1951, Gould (4) describe el análisis intraoperatorio de un ganglio linfático durante una parotidectomía, que resultó comprometido por el tumor, lo que lo condujo a practicar vaciamiento radical de cuello. Lo anterior se podría considerar como el primer caso de GC, aunque el concepto como tal no se había comprendido.
Ramón Cabañas (5), urólogo paraguayo, describe en 1977 el drenaje linfático del pene a través de estudios de linfografía, con el fin de orientar la linfadenectomía radical en el tratamiento del cáncer de este órgano. Más adelante, Kett y Christensen (6, 7) reportan el drenaje axilar en lesiones mamarias y Haagensen estudia la ruta de las metástasis en el cáncer de mama.
Morton trabajaba el concepto de drenaje linfático del melanoma desde 1977 y fue su grupo de trabajo en el John Wayne Cancer Institute el que, en 1992 (9), describe la utilización de la disección de ganglio centinela (DGC) en el manejo de esta enfermedad. Insiste en la importancia de encontrar el punto de entrada del conducto linfático al GC para orientar al patólogo sobre el lugar donde más posiblemente se detecten las micrometástasis.
El concepto del GC admite que existe un orden anatómico en el drenaje linfático y que sirve como filtro efectivo de células metastásicas. Morton introdujo la aplicación del colorante (azul de isosulfán) para la detección de este ganglio. Su primer trabajo se presentó en la Segunda Conferencia Internacional sobre Melanoma de la WHO (Organización Mundial de la Salud) en 1989 (10), pero la respectiva publicación se llevó a cabo sólo tres años más tarde, en 1992.
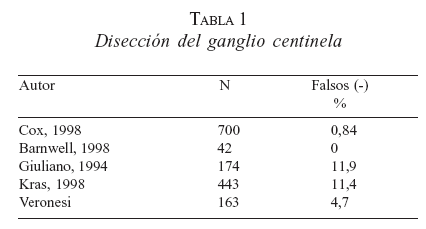
Armando Giuliano, en el John Wayne Cancer Institute en Santa Mónica, California, inicia en 1991 los trabajos de detección de GC en carcinoma de seno, para lo cual también empleó el azul de isosulfán (11). Krag (12) y posteriormente Veronesi describen la utilización del radiocoloide para la identificación del GC. Múltiples publicaciones describen el empleo de cada técnica por separado, así como la combinación de ambas, reportando diferentes tasas de detección, predicción y falsos negativos (tabla 1).
En la primavera de 2001 se lleva a cabo una reunión de consenso en Filadelfia, que reúne a estos pioneros y otros expertos en el tema (15). Sus conclusiones se basan en la experiencia derivada del manejo de más de 10.000 pacientes, informadas en cerca de 70 estudios publicados.
Fase de validación
Antes de abandonar las linfadenectomías en el tratamiento del cáncer es necesario que cada centro efectúe una fase de validación de la técnica que establezca cuál es su tasa de falsos negativos. En la serie de Morton sobre 194 casos de DGC en melanoma, se reportan 40 linfadenectomías positivas, con 5% de falsos negativos. Esta cifra representa un límite aceptable. Por otra parte, la tasa de identificación o detección de GC debe ser superior al 90%, según lo revelado por la mayoría de los estudios de validación.
La fase de validación implica realizar la disección del ganglio, seguida de linfadenectomía axilar o inguinal con base en el tipo de tumor. Esto permite el cálculo de la tasa de falsos negativos y la determinación del porcentaje de detección (17).
Giuliano, en sus trabajos iniciales, reporta una tasa de falsos negativos de 12%, mientras que en su segunda serie, tras acumular mayor experiencia informa 0%. La tabla 1 muestra algunas casuísticas internacionales.
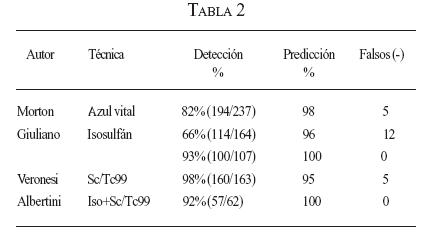
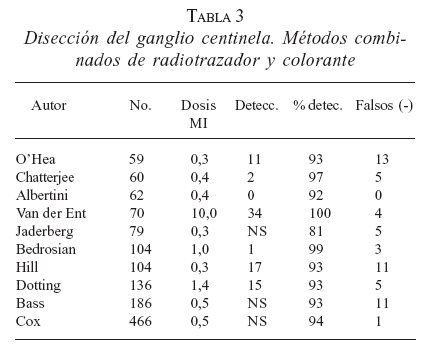
La combinación de técnicas que emplean radiocoloide y colorante, sumado a la utilización de la gammasonda intraoperatoria, permite altos niveles de DGC con bajas tasas de falsos negativos (tablas 2 y 3).
Justificación
Con base en lo ya expresado se concluye que la DGC se justifica en pacientes con estados tempranos de la enfermedad, en quienes es baja la posibilidad de compromiso ganglionar regional. Tiene por objetivo racionalizar el empleo de linfadenectomías, las cuales conllevan una importante morbilidad (tabla 4). Brinda información pronóstica al predecir la condición de los demás ganglios y evita vaciamientos en más de 70% de estados tempranos.

Curva de aprendizaje
La implementación de esta tecnología requiere curva de aprendizaje. Morton recomienda practicar entre 60 y 80 linfadenectomías de validación como curva de aprendizaje. El Colegio Americano de Cirujanos (ACS) aconseja entre 20 y 30 casos de linfadenectomías de validación. La meta de una curva de aprendizaje es alcanzar niveles de detección de más de 90%, con falsos negativos lo más cercanos al 5%. Se requiere que el número de casos con enfermedad temprana diagnosticado por el grupo que incursiona en esta técnica sea elevado (18-20). Esto suele darse en el contexto de una institución o grupo supraespecializadas (21).
La curva de aprendizaje incluye al personal de medicina nuclear y al grupo de patología. Este último requiere entrenamiento en técnicas de citología diagnóstica intraoperatoria, biopsia por congelación de los ganglios disecados y coloraciones de inmunohistoquímica (28).
Definición e indicaciones
El GC es aquel que primero capta el drenaje linfático de determinado territorio del organismo y debe ser representativo de los demás ganglios. Cuando el tumor se localiza en seno o en miembros superiores habitualmente el GC se localiza en la axila. Si el tumor está ubicado en miembros inferiores, éste generalmente se encuentra en la región inguinal. En tumores localizados en el tronco, el drenaje linfático puede tener diferentes direcciones, lo que obliga en todos los casos a realizar un mapeo linfático previo a la DGC mediante el empleo de la linfogammagrafía.
Es posible detectar más de un GC. También se ha observado que en casos de compromiso de éste, en 60% de los casos es el único afectado (19).
La DGC está indicada en tumores tempranos de la enfermedad cuando no se sospeche compromiso regional. Su utilización se ha descrito en los siguientes casos:
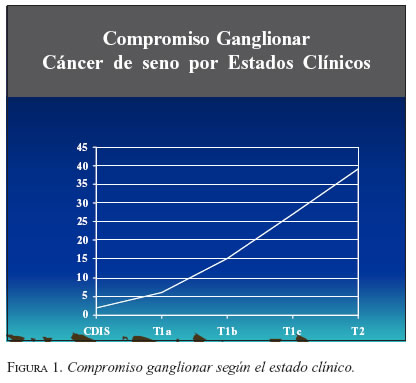
a) Cáncer de seno. Se considera indicada en estados tempranos de la enfermedad (estados I con T1a, b y c, estados II con N0 y estados III con N0), siempre con axila clínicamente negativa, en donde la posibilidad de encontrar metástasis axilares es menor (figura 1). No se considera adecuada en pacientes bajo tratamiento neoadyuvante, salvo que estén participando en protocolos de investigación (20). Algunos grupos han analizado la DGC en este contexto, pero han observado niveles de detección más bajos de 90%, con falsos negativos elevados (tabla 5).
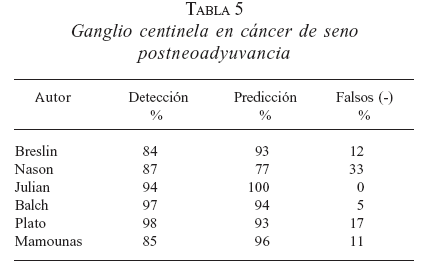
Se ha planteado la posibilidad de practicar la DGC en pacientes con tumores voluminosos y axila clínicamente negativa antes de la neoadyuvancia, para determinar el estado patológico inicial de la axila (22).
También está indicada en los casos de carcinoma in situ extenso o cuando estas pacientes vayan a ser sometidas a mastectomías. La sospecha de multicentricidad se considera una contraindicación relativa para esta técnica. No hay claridad sobre su utilización en embarazadas. Existen algunos reportes de DGC en carcinoma de mama en el hombre (21).
Las contraindicaciones para la DGC incluyen la presencia de adenopatías sospechosas en alguno de los territorios ganglionares de la mama, los estados avanzados de la enfermedad y el antecedente de cirugías previas con transgresión del drenaje linfático de la mama.
b) Melanoma. Se indica en pacientes con tumores que presenten medición de Breslow mayor de 1 mm, o Clark mayor o igual a III. En las extremidades se buscará el sitio de drenaje correspondiente. En el tronco es obligatoria la linfogammagrafía previa, ya que se han descrito casos de drenaje directo a mediastino, o a la región paralumbar.
c) Carcinoma escamocelular (de tronco o extremidades). Con esta indicación existe poca experiencia reportada en la literatura. Parece aun más importante en el caso del escamocelular, por los altos falsos positivos en la clínica, debido a la frecuente sobreinfección que acompaña a estos tumores.
Técnica
Varios autores, entre ellos Morton y Giuliano, han descrito la técnica utilizando el colorante azul de isosulfán al 1%. También se ha empleado el azul patente y según publicaciones recientes el azul de metileno en concentraciones del 1% (27). En nuestro medio hemos preferido este último por su fácil disponibilidad.
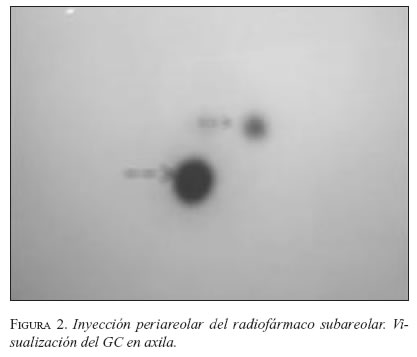
El sitio de inyección del colorante o el radiocoloide ha sido tema de discusión. Inicialmente se recomendaba peri o intratumoral, pero planteaba un problema para las lesiones no palpables del seno, pues requerían de técnica esterotáxica o guía por ultrasonido para la inyección del compuesto. El conocimiento de las redes linfáticas de Sapey que demuestran que el drenaje linfático de la mama se dirige inicialmente hacia la región peri y retroareolar ha permitido el desarrollo de experiencias con inyección dérmica o subdérmica en esta localización. Este método se impone cada vez más y es el que utilizamos, tanto para la inyección del colorante como para el radiofármaco (24) (figura 2).
En medicina nuclear se manejan macro y microagregados; en general se utiliza el sulfuro coloidal y la albúmina marcada con Tc 99, siendo el primero el que más usamos comúnmente en nuestro centro. Se emplea una de 1-2 mCi; ésta no representa ningún peligro para el paciente ni para los médicos que intervienen. Por lo regular la inyección se aplica en forma subareolar, subdérmica y en caso de resecciones previas, en forma perilesional. Cuando se pretende determinar si el GC está localizado en la cadena mamaria interna se prefiere la inyección intra o retrotumoral. El significado de la disección de la cadena mamaria interna no es claro. La mayor experiencia en la detección y disección del GC en cadena mamaria interna ha sido reportada por el grupo del profesor Veronesi del Instituto Europeo de Oncología (23).
Utilizamos la inyección de una dosis de 1-2 cm de azul de metileno al 1% en localización subdérmica periareolar tres a cinco minutos antes de practicar la incisión axilar (figura 3). Previamente la paciente ha recibido la administración del radiofármaco cuatro a doce horas antes del acto operatorio. Cuando empleamos la técnica combinada contamos con una gammasonda intraoperatoria (Navigator o Neoprobe), que permite indicar el sitio exacto de la incisión. Si sólo se dispone del colorante, la incisión en la axila se practica en la base de la misma, a 2 cm por debajo de la línea de implantación del vello, o en la región inguinal hacia el vértice del triángulo de Scarpa La técnica ideal contempla el uso de los dos métodos de detección, particularmente en la fase de curva de aprendizaje.
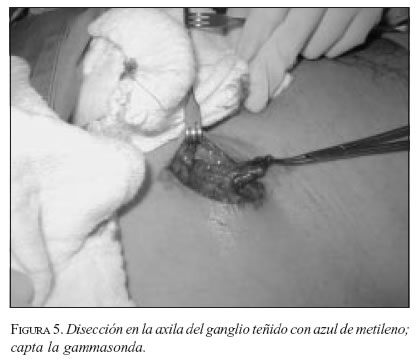
Una vez inyectado el colorante se debe practicar un masaje sobre la zona, suave, tratando de no interferir con el drenaje del material; se realiza la incisión después de tres a cinco minutos, teniendo cuidado con la hemostasia, y no lesionar los vasos linfáticos. Guiados por la sonda, se diseca el tejido hasta localizar el o los GC; se puede observar el colorante con un color azul-verdoso en el linfático aferente al ganglio (figura 4). El (los) ganglio(s), se diseca(n) y extirpa(n) (figura 5), comprobando la alta medición con la gammasonda ex vivo; (figura 6). Se debe practicar una cuidadosa palpación con el dedo índice, para asegurar que no existen ganglios palpables en esa zona, que podrían considerarse como potenciales centinelas; en estos casos, si el verdadero centinela se encuentra bloqueado por un extenso compromiso tumoral, el medio colorante o radiactivo se localizará en un ganglio vecino. Tras la excisión del GC se practica rastreo con la gammasonda en el territorio ganglionar para asegurar que no existan otros ganglios que capten la radiación. Se practica hemostasia y cierre sin dejar drenaje alguno.

El GC disecado se somete a evaluación patológica intraoperatoria, que incluye impresiones o improntas en láminas portaobjeto (in-prints) de los cortes del ganglio y/o biopsia por congelación del ganglio (figura 7). Si el patólogo observa células tumorales en estos especímenes, el cirujano continúa con la linfadenectomía dentro del mismo tiempo quirúrgico. Generalmente llevamos a cabo primero la disección del GC, y mientras esperamos el resultado de patología (que usualmente toma entre 20 a 30 minutos en nuestra institución) practicamos la cirugía sobre el tumor. En los centros sin experiencia en el procesamiento intraoperatorio del GC será necesario esperar los reportes definitivos obtenidos en bloques de parafina.

En forma diferida los patólogos, bajo un estricto protocolo, practican múltiples cortes al(los) ganglio(s) centinela(s) (figura 8). En la Clínica de Seno de la Clínica del Country, se acogió el protocolo del MDACC (MD Anderson Cancer Center) modificado, que resulta en la obtención de cerca de 100 cortes definitivos. Se recomienda practicar coloraciones de hematoxilina-eosina, y sólo en caso de dudas utilizar la inmuno-histoquímica, que puede detectar células tumorales aisladas (CTA), cuyo verdadero significado no se conoce.
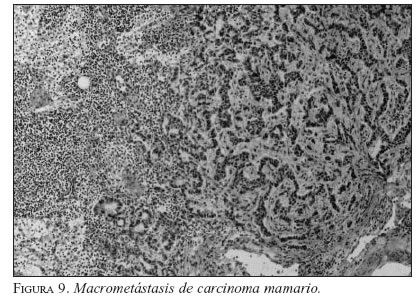
Es importante distinguir entre macrometástasis, micrometástasis y de CTA. La macrometástasis mide más de 2 mm (figura 9); la micrometástasis mide entre 0,2-2 mm (figura 10), y la presencia de metástasis de 0,2 mm se considera CTA; por ahora no indica ningún cambio en el manejo. En el caso de las macro y micrometástasis, se debe continuar con el vaciamiento ganglionar (VG).

En la actualidad se adelantan estudios prospectivos que evalúan la seguridad y diferencia de morbilidad entre la DGC y el vaciamiento axilar (VA). El grupo del NSABP diseñó el estudio B 32 que aleatoriza pacientes con carcinomas tempranos de la mama a recibir DGC seguida de linfadenectomía axilar frente a DGC sin linfadenectomía. Las pacientes con GC positivo reciben linfadenectomía formal. Aquellas con GC negativo son sometidas a observación clínica El punto final de este estudio es determinar diferencias en sobrevida global estableciendo así la seguridad de esta técnica. El estudio Z0010 del ACS recluta pacientes con carcinomas en estados I-IIA, las somete a cirugía conservadora, disección de GC y aspirado de médula ósea. Aquellas con GC negativo son seguidas clínicamente. Quienes tienen GC positivo son invitadas a participar en el protocolo Z0011 que aleatoriza pacientes con GC positivo a seguimiento clínico frente a linfadenectomía axilar formal. Recientemente se reportaron los primeros resultados del estudio ALMANAC del Reino Unido, cuyos participantes tuvieron una curva de aprendizaje en promedio de 40 procedimientos cada uno, teniendo que obtener una predicción de más del 90% y falsos negativos cercanos al 5%; en la fase de aleatorización demostraron resultados similares en cuanto a la cantidad de cirugía conservadora o radical en ambos grupos, con falla de detección menor al 2%, y con menos morbilidad en el grupo sometido a DGC sobre el grupo de VA.
En la primavera del 2001 se lleva a cabo en Filadelfia la primera reunión de consenso sobre GC, que reunió autoridades mundiales sobre el tema como Schwartz, Giuliano y Veronesi (23, 25) entre otros, recopilando la experiencia de más de 10.000 casos de DGC. Las conclusiones de esta reunión se publicaron en las revistas Cáncer de mayo de 2002 y en Breast Journal del mismo año, que resumimos a continuación:
1. La DGC ya no se considera una técnica experimental.
2. No se necesitan más estudios de validación y se esperarán los resultados de los estudios prospectivos para conocer efectos a largo plazo.
3. Se consideran contraindicaciones los ganglios palpables en axila, estados avanzados, y se interroga la utilidad después de quimio u hormona neoadyuvante, cuando se negativiza la axila clínicamente; también el embarazo y los tumores multicéntricos. Una contraindicación relativa es el antecedente previo de cirugías, en especial plásticas extensas.
4. El carcinoma in situ, es candidato para DGC, siempre y cuando sea extenso (componente comedo) o tenga dudas de microinfiltración; también cuando las pacientes vayan a ser sometidas a mastectomía total, pues posteriormente sería imposible realizarla por la interrupción quirúrgica del drenaje linfático.
5. Se considera que el análisis patológico intraoperatorio se debe realizar centros especializados y sólo utilizar de rutina la coloración de hematoxilina-eosina, dejando la inmunohis-toquímica sólo para casos seleccionados.
6. Sólo se debe tomar conducta con base en resultados de macro y micrometástasis; el hallazgo de CTA por ahora no debe modificar la conducta quirúrgica o médica.
Experiencia propia
En la Clínica de Seno de la Clínica del Country trabajamos esta técnica desde el año 1998. Inicialmente con un grupo de 3 mastólogos desarrollamos la experiencia y recopilamos los datos. Presentamos la experiencia de dos de nosotros (Robledo JF, Caicedo JJ).
Se llevó a cabo una fase de validación inicial con 65 casos en los cuales se efectuó DGC y VA; iniciamos nuestra experiencia con azul de isosulfán y azul de metileno para la detección del GC. Obtuvimos mejores resultados cuando incorporamos la técnica del radiocoloide, alcanzando una cifra de falsos negativos de 7% (uno de trece casos), con una identificación de más de 90% de los casos; esto nos permitió abandonar el VA (reuníamos los estándares mundiales) y pasar a la práctica rutinaria de la DGC.
Hasta enero de 2005, habíamos realizado 277 procedimientos; sin tener en cuenta la fase de validación inicial, el porcentaje de detección está en más de 98%. En la mayoría de los casos hemos combinado el azul de metileno con la albúmina sérica marcada con Tc 99 con buenos resultados (tabla 6).

Casi todas las lesiones fueron no palpables, las cuales se combinaron con marcación con alambre o últimamente con marcación con ROLL (Radioguided Occult Lesion Localization), que se traduce como localización radioguiada de lesiones no palpables; este último procedimiento utiliza una macromolécula de albúmina marcada con Tc 99, que tiene la ventaja de no migrar, por lo tanto, la lesión se puede detectar con la sonda y hacer una extirpación de la lesión con menos cantidad de tejido alrededor, y más centrada de lo que se logra con el alambre (tabla 7). Esta técnica fue desarrollada especialmente por el grupo de Milán e introducida en nuestro país por Fabio Torres (28).

Se identificó el tumor en todos los casos con el radiotrazador. El 67% de los casos demostró ser un carcinoma; en el resto de lesiones se trataba de papiloma o de hiperplasia epitelial atípica, y en el caso de microcalcificaciones benignas de adenosis.
Se identificó GC como positivo en 12,3% de los casos, siendo el único positivo en 44% de las pacientes; el promedio de ganglios resecados como centinela fue de 1,4 y finalmente se evitó el VG en 88% de las pacientes (tabla 8).

En siete casos la consulta intraoperatoria informó GC negativo pero en el informe final de anatomía patológica se informaron micrometástasis en cinco de ellos y macrometástasis en dos (de 3 y 4 mm). Tres de estas pacientes fueron reintervenidas; se practicó linfadenectomía axilar. Las otras recibieron radioterapia sobre la axila.
Las complicaciones del procedimiento fueron pocas: cinco casos de seromas postquirúrgicos menores de 10 cc resueltos mediante drenaje por punción. Una paciente presentó hematoma agudo postquirúrgico en la axila que requirió drenaje abierto. Dos casos de necrosis cutánea en el sitio de inyección del azul de metileno posiblemente por inyección muy superficial del medio.
Consideramos que esta es una buena experiencia y coincide con la experiencia del primer año de funcionamiento de la Clínica de Seno, en donde 82% de las pacientes sometidas a cirugía son en estados tempranos de la enfermedad (figura 10). En los casos de carcinoma escamocelular infiltrante de extremidades, creemos se debe convertir en el estándar debido a la alta tasa de infección de estos tumores; produce adenomegalias que clínicamente podrían confundirse con metastásicas. En los dos casos que informamos el GC fue negativo y así evitamos el VG.
Es el primer informe en la literatura colombiana sobre la aplicación de esta nueva técnica quirúrgica, con aporte de nuestra experiencia.
Conclusión
La técnica de DGC, se ha convertido en el estándar en centros mundiales de manejo del cáncer mamario y melanoma en estados tempranos, especialmente en países desarrollados. En Colombia el VA sigue siendo la rutina en pacientes con carcinomas infiltrantes de mama y melanoma infiltrante con Breslow mayor a 1 mm.
En centros especializados como el nuestro (Clínica de seno del Country) en donde detectamos la mayoría de la patología mamaria en estados tempranos, hemos abandonado el VA y lo remplazamos por la DGC, después de haber hecho una curva de aprendizaje en conjunto con el grupo de patología y medicina nuclear de la Clínica de Seno.
Hemos realizado 277 procedimientos de GC y evitado el VA en 88% de las pacientes, por lo tanto disminuyendo la morbilidad. Realizamos 51 casos de ROLL, el 50% de ellos simultáneamente con la DGC.
Consideramos en nuestra práctica actual estas técnicas como manejo estándar en casos de cáncer temprano de seno, melanoma y carcinoma escamocelular de extremidades.
Referencias
1. Gilchrist RK. Fundamental factors governing lymphatic spread of carcinoma. Ann Surg 1940; 111: 630-639. [ Links ]
2. Halsted WS. The results of operations for the cure of cancer of the breast performed at the Johns Hopkins Hospital from June 1889 to January 1894; Johns Hopkins Hosp Bull 1894; 4: 297-323. [ Links ]
3. Fisher B, Fisher ER. Barrier function of lymph node to tumor cells and erythrocytes. Cancer 1967; 20: 1907-1913. [ Links ]
4. Gould EA, Winship T, Philbin PH, Kerr HH. Observations on a ‘sentinel node’ in cancer of the parotid. Cancer 1960; 13: 77-78. [ Links ]
5. Cabañas RM. An approach for the treatment of penile carcinoma. Cancer 1977; 39: 456-466. [ Links ]
6. Kett K, Varga G, Lukács L. Direct lymphography of the breast. Lymphology 1970; 1: 3-12. [ Links ]
7. Christensen B, Blichert-Toft M, Siemssen OJ, Nielsen SL. Reliability of axillary lymph node scintiphotography in suspected carcinoma of the breast. Br J Surg 1980; 67: 667-668. [ Links ]
8. Haagensen CD, Feind KR, Herter FP, Slanetz CA, Weinberg JA. The lymphatics in cancer. Philadelphia. WB Saunders Company, 1972. [ Links ]
9. Morton DL, Wen DR, Wong JH, Economou JS, Cagle LA, Storm FK, Foshag LJ, et al. Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg 1992; 127: 392-399. [ Links ]
10. Morton DL, Wen DR, Cochran AJ. Pathophysiology of regional lymph node metastases in early melanoma studied by intraoperative mapping of the cutaneous lymphatics (abstract). Second International Conference on Melanoma 1989; 131. [ Links ]
11. Giuliano AE, Kirgan DM, Guenther JM, Morton DL. Lymphatic mapping and sentinel lymphadenectomy for breast cancer. Ann Surg 1994; 220: 391-398. [ Links ]
12. Krag DN, Weaver DL, Alex JC, Fairbank JT. Surgical resection and radiolocalization of the sentinel lymph node in breast cancer using a gamma probe. Surg Oncol 1993; 2: 335-339. [ Links ]
13. Giuliano AE. Mapping a pathway for axillary staging: a personal perspective on the current status of sentinel lymph node dissection for breast cancer. Arch Surg 1999; 134: 195-199. [ Links ]
14. Turner RR, Ollila DW, Krasne DL, Giuliano AE. Histopathologic validation of the sentinel lymph node hypothesis for breast carcinoma. Ann Surg 1997; 226: 271-278. [ Links ]
15. Patiño Restrepo JF. Seno. Lecciones de cirugía, Bogotá, Editorial Médica Panamericana, 2000; 325-402. [ Links ]
16. Abaúnza H. Cáncer mamario, 2ª ed. Sociedad Colombiana de Cirugía, 1997; 143-183. [ Links ]
17. Cody HS, Borgen PI. State-of-the-art approaches to sentinel node biopsy for breast cancer: study design, patient selection, technique, and quality control at Memorial Sloan-Kettering Cancer Center. Surg Oncol 1999; 8: 85-91. [ Links ]
18. Morrow M, Rademaker AW, Bethke KP, Talamonti MS, Dawes LG, Clauson J, Hansen N. Learning sentinel node biopsy: results of a prospective randomized trial of two techniques. Surgery 1999; 126: 714-722. [ Links ]
19. Cox CE, Salud CJ, Cantor A, et al. Learning curves for breast cancer sentinel lymph node mapping based on surgical volume analysis. J Am Coll Surg 2001; 193: 593-600. [ Links ]
20. Dupont E, Cox C, Shivers S, Salud C, Nguyen K, Cantor A, Reintgen D. Learning curves and breast cancer lymphatic mapping: institutional volume index. J Surg Res 2001; 97: 92-96. [ Links ]
21. Krag D, Weaver D, Ashikaga T, Moffat F, Klimberg VS, Shriver C, Feldman S, et al. The sentinel node in breast cancer - a multicenter validation study. N Engl J Med 1998; 339: 941-946. [ Links ]
22. Xing Y, Ding M, Cox D, Ross MI, Hunt KK, Cormier JN. Meta-analysis of sentinel lymph node biopsy following preoperative chemotherapy in patients with operable breast cancer. ASCO Annual Meeting Proceedings (Post-Meeting Edition). Journal of Clinical Oncology 2004; 22(14S): 561. [ Links ]
23. Veronesi U, Paganelli G, Galimberti V, Viale G, Zurrida S, Bedoni M, Costa A, et al. Sentinel node biopsy to avoid axillary dissection in breast cancer with clinically negative lymph-nodes. Lancet 1997; 349: 1864-1867. [ Links ]
24. Kern KA. Sentinel lymph node mapping in breast cancer using subareolar injection of blue dye. J Am Coll Surg 1999; 189: 539-545. [ Links ]
25. Gordon F, Schwartz MBA, Giuliano AE, MD, Veronesi U. The Consensus Conference Committee. Proceedings of the Consensus Conference on the Role of Sentinel Lymph Node Biopsy in Carcinoma of the Breast April 19-22, 2001, Philadelphia, PA, USA. [ Links ]
26. McMasters KM, Wong SL, Chao C, Woo C, Edwards MJ. Defining the optimal surgeon experience for breast cancer sentinel lymph node (SLN) biopsy. A model for implementation of new surgical technique. Ann Surg 2001; 234: 292-300. [ Links ]
27. Ashraf Nour. Efficacy of methylene blue dye in localization of sentinel lymph node in breast cancer patients. The Breast Journal, September 2004; 10, Issue 5, 388. [ Links ]
28. Torres F. Tratamiento de las lesiones no palpables del seno. Rev Col Cir 2004; 19: 38-42. [ Links ]














