Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582On-line version ISSN 2619-6107
rev. colomb. cir. vol.21 no.2 Bogotá Apr./June 2006
(1) Servicio de Cirugía General, Unidad de Cuidado Intensivo Adultos, Fundación Valle del Lili, Cali, Colombia.
(2) Servicio de Cirugía General, Fundación Valle del Lili, Cali, Colombia.
(3) Unidad de Cuidado Intensivo Adultos, Fundación Valle del Lili, Cali, Colombia.
(4) Instituto de Investigaciones Clínicas de la Fundación Valle del Lili, Cali, Colombia.
(5) Servicio de Urgencias, Fundación Valle del Lili, Cali, Colombia.
(6) Residente Cirugía General Universidad del Valle
(6) Residente de Cuidado Intensivo Universidad del Valle, Fundación Valle del Lili, Cali, Colombia
(6) Residente de Cardiología, Universidad del Valle, Fundación Valle del Lili, Cali, Colombia.
Correspondencia: Carlos Alberto Ordóñez Delgado, MD. Correo electrónico: carlosordonez@telecom.com.co - Cali, Colombia.
Fecha de recibo: Marzo 18 de 2006. Fecha de aprobación: Junio 15 de 2006.
Resumen
Introducción: El tratamiento quirúrgico ideal de la peritonitis secundaria severa complicada (PSSC) aun no es claro. El objetivo es mostrar los resultados clínicos donde la técnica quirúrgica escogida fue relaparotomias planeada en el manejo de PSSC.
Material y métodos: Entre 1995-2004, todos los pacientes con diagnóstico de PSSC fueron manejados con la técnica de relaparotomías planeadas, luego de controlado el proceso infeccioso se cerró la pared abdominal. El desenlace principal fue mortalidad hospitalaria. A partir del año 2000, se disminuye la frecuencia de las relaparotomías porque se considera el esquema de hacerla planeada, restringiendo las reintervenciones. Se realizó un análisis multivariado. El IRB institucional aprobó la realización de este estudio.
Resultados: Se incluyeron 267 pacientes, edad promedio: 52.2 años, el 62.5% hombres, la estancia promedio en UCI:15.8 días, el promedio de relaparotomias planeadas fue de 4 ± 3 con mediana de 3. La tasa de mortalidad global fue 19.9%, antes del año 2000 fue de 28.4% y después del 2000 de 14.5%. El análisis multivariado mostró que relaparatomías no fue predictor independiente de muerte (OR:1.98 IC95%0.78-3.41,p=0.3), como si lo fueron edad>50 años, choque y APACHE II>25. Las complicaciones más frecuentes fueron: fístulas intestinales (15.3%), shock séptico (54%), y SDRA (30%).
Conclusión: La mortalidad global actual en pacientes con peritonitis secundaria severa fue menor del 20%. Los predictores independientes de muerte en este grupo fueron edad>50 años, choque y APACHE II>25.
Palabras clave: peritonitis, sepsis, laparotomía, complicaciones postoperatorias, cuidados intensivos.
Abstract
Introduction: The ideal treatment of severe complicated secondary peritonitis (SCSP) remains unclear. The purpose of this paper is the presentation of the clinical results of the surgical policy of planned relaparotomy in the management of SCSP.
Material and methods: All patients with SCSP were managed with planned relaparotomy in the period 1995-2004; the abdominal wall was closed once the infectious process had been controlled. The main outcome was hospital mortality. After the year 2000 we registered descent of the rate of relaparotomy because the policy change to planned intervention, which restricted the number of reinterventions. A multivariate analysis was carried out. The hospital committee of bioethics approved the implementation of the study.
Results: The study population included 267 patients with average age of 52.2 years; 62.5 were male; mean ICU stay was15.8 days, the rate of planned relaparotomies was 4 ± 3 with a median of 3. The global mortality rate was 19.9%; before the year 2000 the rate was 28.4%, and after the year 2000 the rate came down to 14.5%. The multivariate analysis showed that relaparotomy was not an independent predictor of mortality (OR: 1.98, CI 95% 0.78-3.41, p=0.3). but age >50 years, shock, and APACHE II score >25 were independent predictors. Most common complications were intestinal fistulae (15.3%), septic shock (54%), and ARDS (30%).
Conclusion: Global mortality rate in patients with severe secondary peritonitis was less than 20%. The independent predictors of mortality in the study group were age>50 years, shock, and APACHE II score >25.
Key words: peritonitis, sepsis, laparotomy, postoperative complications, intensive cares.
Introducción
La sepsis intraabdominal y la peritonitis secundaria severa aún son una de las patologías más frecuentes y de mayor controversia en el manejo.
El éxito terapéutico en el manejo de esta patología se traduce en disminución de la mortalidad (1-4). Muchos pacientes mueren a causa de la infección si no se operan a tiempo y cuando no se reoperan en el momento adecuado. El tratamiento estándar incluye control de la fuente y lavado intraabdominal (5). En la peritonitis avanzada la fuente de la infección puede ser difícil de erradicar con una sola operación, hay exceso de pus y material necrótico diseminado en todo el peritoneo que no se remueve en un solo procedimiento. Adicionalmente, la peritonitis causa edema, que asociado con la reanimación dinámica que requieren estos pacientes, producen aumento de la presión intraabdominal que puede empeorarse con cierre prematuro de la pared abdominal. Todo esto llevó a Wittmann a proponer el STAR (reparo abdominal por etapas) (6,7). Esta estrategia supone que permite mejor eliminación de la fuente de infección, descompresión de la presión intraabdominal, con eliminación de los efectos deletéreos de este síndrome compartimental (8-15).
Sin embargo, en los últimos años se ha discutido qué técnica es mejor, dada la morbilidad importante que la técnica STAR presenta, por lo cual se ha discutido si la laparotomía por demanda es mejor o no que la relaparotomía planeada (16, 17).
En nuestra unidad de cuidados intensivos (UCI), en diez años se ha consolidado un grupo multidisciplinario de trabajo; en la PSSC la indicación de relaparotomía por demanda o por etapas también ha cambiado en el tiempo en nuestro contexto. Aunque la técnica quirúrgica ha sido la misma durante este período, se quiere evaluar el impacto sobre la morbilidad y mortalidad de la relaparotomía planeada en los pacientes que ingresaron con diagnóstico de PSSC y que en dos períodos diferentes ha cambiado la frecuencia de relaparotomías para lavado de la cavidad abdominal, según la tendencia de la literatura mundial.
Material y métodos
Pacientes
En un estudio de cohorte retrospectiva, se incluyeron pacientes consecutivos con diagnóstico de PSSC manejados con la técnica de relaparotomías planeadas entre enero de 1995 y septiembre de 2004 ingresados a la UCI de la Fundación Valle del Lili de Cali, Colombia.
Protocolo de manejo
Drenaje del foco séptico, retiro de material necrótico y control de la contaminación posterior, dejando el abdomen abierto y con una malla de velcro para permitir el manejo por etapas cada 24 horas hasta el control de la peritonitis; adicionalmente se permitía la descompresión de la presión intraabdominal. Luego de controlado el proceso infeccioso se cerró la pared abdominal. Todos los pacientes tuvieron el soporte necesario en la UCI.
Análisis estadístico
Se recolectaron variables demográficas, clínicas y datos quirúrgicos en una base de datos en Fox Pro® y se procesó en EPI INFO v3.2 y STATA 8. Las variables continuas se expresan en promedios y desviación estándar, mediana y rango intercuartílico; las variables categóricas en proporciones. Las comparaciones se realizaron con t de Student y chi cuadrado, según fuera el caso. Adicionalmente se efectuó un análisis bi y multivariado acerca de los predictores de muerte en este grupo de pacientes. Se hizo cálculo de riesgo relativo indirecto como medida de asociación. Para el modelo de regresión logística se incluyeron las variables que en el análisis bivariado (que comparó muerte con sobrevivientes), hubiesen tenido un valor de p<0,20. Se siguió el método parsimonioso para crear el modelo. Se consideró significancia estadística con valores de p<0,05.
Resultados
Datos demográficos
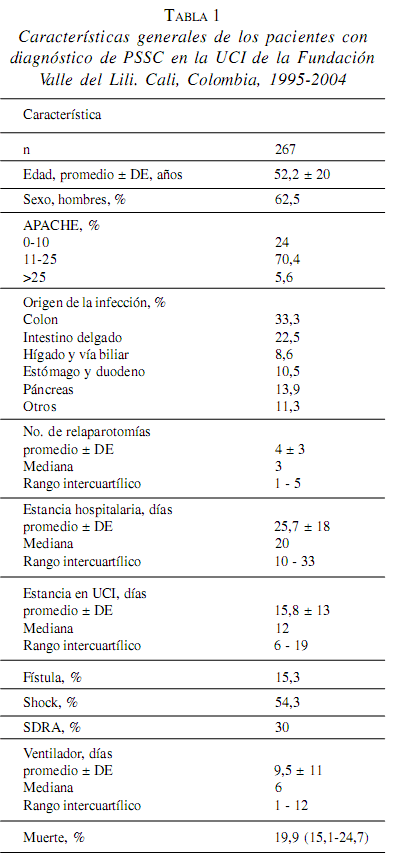
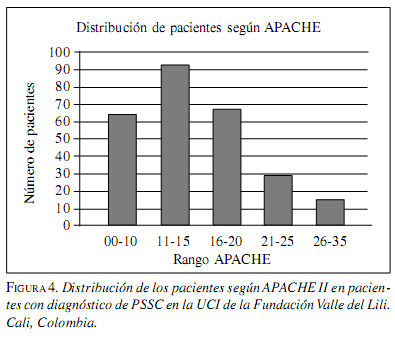
En total se estudiaron 267 pacientes, cuya edad promedio fue de 52,2 ± 20 años, 167 (62,5%) fueron hombres, la estancia promedio en la UCI fue de 15,8 ± 13 días, la estancia hospitalaria fue de 25,7 ± 18 días y los días de ventilación mecánica de 9,5 ± 11. La mediana en el APACHE es de 14 (rango 1-32).
Morbilidad
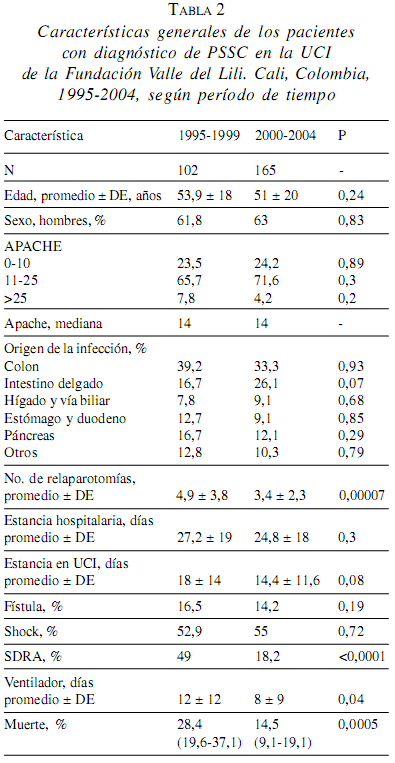
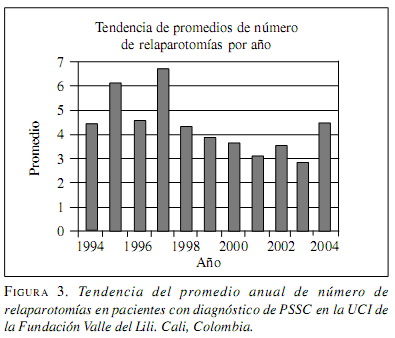
Las fístulas intestinales se presentaron en 15,3%, shock séptico en 54% y el síndrome de dificultad respiratoria aguda (SDRA) en 30% de los pacientes. La tabla 1 resume las características de este grupo. El promedio de relaparotomías planeadas en todos los pacientes fue 4 ± 3 con mediana de 3; su frecuencia ha cambiado de manera significativa, en el período 1995 y 1999 fueron 4,9 ± 3.8 en promedio y entre 2000 y 2004, de 3,4. ± 2,3 (p=0,00007) (tabla 2).
El origen de la infección lo ocasionó el colon en 33% de los casos, intestino delgado en 22,5%, páncreas en 13,9%, hígado y vías biliares en 8,5%, estómago y duodeno en 10,5%, apéndice en 5% y otros 6%.
A todos los pacientes se les realizó toma de cultivos de la cavidad abdominal en el primer procedimiento y otro cultivo en algún momento posterior de la evolución. En 25% de los cultivos iniciales no crecieron gérmenes. En 23% se encontró E. coli, enterococo en 11,6%, Pseudomonas en 7,7%, Klebsiella en 6%, estafilococo en 5,1% y otros gérmenes en 21%. El régimen de antibióticos escogido para el manejo de estos pacientes fue metronidazol-cefotaxima en 43% de los casos, imipenem en 11,3%. Como segunda línea los antibióticos seleccionados fueron carbapenem en 20,6% y carbapenem más fluconazol y/o vancomicina en 8,6% de los casos.
Mortalidad
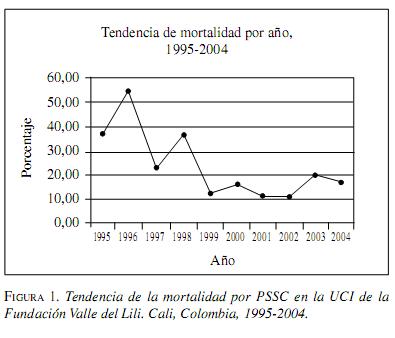
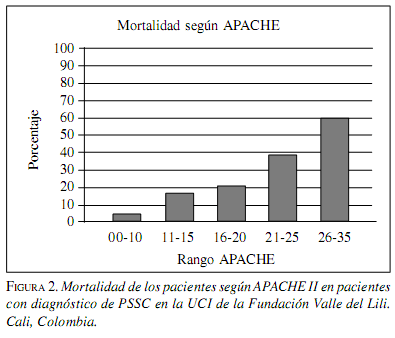
La tasa de mortalidad global fue 19,9%, (IC95%15,1-24,7), en el período antes del año 2000 fue 28,4% (IC95% 19,6-37,1) y después del año 2000 de 14,5% (IC95% 9,1-19,1) (tablas 1 y 2). La figura 1 ilustra la tendencia de la mortalidad por peritonitis en el tiempo.
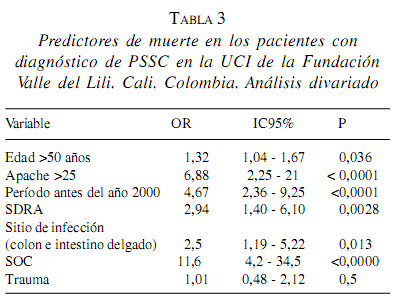
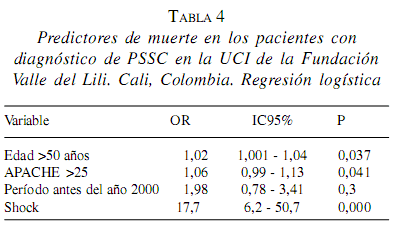
En cuanto a los predictores de muerte, el análisis univariado mostró asociación significativa con APACHE II >25, SDRA, edad>50 años, período de tratamiento; la tabla 3 presenta el respectivo riesgo relativo indirecto. En cuanto al punto de corte de APACHE II, se considera que el grupo de mayor severidad es el que tenga un valor > 25 y con el que se comparan todas las demás categorías. En cuanto al valor del APACHE II en relación con mortalidad, la figura 4 muestra que a mayor valor, mayor es la tasa de mortalidad. En el análisis multivariado, el predictor independiente fuertemente asociado con muerte fue el choque, le siguieron edad >50 años y APACHE II >25. La tabla 4 presenta la magnitud de estas asociaciones.
Discusión
La laparotomía por demanda consiste en reoperar al paciente en una forma no programada dependiendo de la evolución clínica en el posoperatorio inmediato (18).
Cuando el problema continúa o se agrava el cuadro séptico puede ser debido a peritonitis persistente, ya sea por mala eliminación y reacumulación del pus, por una posible translocación bacteriana secundaria a inmunosupresión o por patógenos nuevos. El equipo quirúrgico debe estar muy alerta y detectar los signos y síntomas clínicos de la peritonitis persistente para realizar una nueva reintervención por demanda (19, 20).
La presentación clínica del problema se puede manifestar como un posoperatorio anormal con dolor abdominal severo, íleo prolongado, defensa y distensión abdominal con intolerancia a la nutrición enteral, concomitante con fiebre y leucocitosis casi desde el posoperatorio inmediato (21-25). El cirujano debe realizar el diagnóstico en las primeras 48 horas de iniciado este cuadro y tomar la decisión de reoperar y no esperar hasta el día 5 ó 7, que según muchos textos son los días cuando se producen la filtración y la dehiscencia de las anastomosis. Koperna demostró que las reoperaciones practicadas después de 48 horas de la intervención inicial, cursan con una tasa de mortalidad significativamente mayor (76,5% frente a 28%; p = 0,001) (17).
También es posible otra forma de presentación no abdominal. Se puede manifestar como insuficiencia respiratoria, en cuyo caso habría que descartar otras patologías como atelectasias, neumonía, SDRA del adulto falla renal y demanda de más ventilación mecánica. El dilema es definir si es un síndrome de respuesta inflamatoria sistémica (SIRS) secundario o si realmente tiene foco intraabdominal (26).
La decisión de reoperar es extremadamente difícil y se debe hacer en conjunto entre el cirujano, el grupo de cuidado intensivo y los radiólogos; éstos últimos aportan una valiosa ayuda. La TAC es difícil de interpretar, ya que después de la laparotomía hay distorsión de los planos y tejidos, espacios con líquidos que pueden ser sangre, suero, solución salina, líquido intestinal o pus, lo cual dificulta más el diagnóstico (27, 28). Además, el transporte de un paciente crítico a radiología puede producir hasta 76% de cambios y trastornos fisiológicos. El ECO tiene grandes dificultades en los pacientes de cuidado intensivo y su valor predictivo no es muy alto; sin embargo, presta valiosa ayuda, pues se realiza en la cama del paciente y las colecciones líquidas se puncionan, estudian y es posible realizar un diagnóstico y tratamiento oportuno. Se debe tener en cuenta que se pueden puncionar colecciones superficiales no infectadas y existir colecciones profundas complicadas. Por lo tanto, la decisión de reoperar no es fácil y se debe tomar en conjunto (29).
De otro lado y debido a las dificultades para definir cuándo se reopera un paciente, surgió la técnica de la relaparotomía planeada. Si el cirujano considera que en la primera reintervención no es posible cumplir los requisitos (prevenir la reacumulación del pus y desbridar totalmente el tejido necrótico), puede decidir realizar una cirugía programada por etapas (relaparotomía planeada) con abdomen abierto (1, 5, 7, 8, 16, 30-33). Para el efecto, es necesario dejar una malla en la pared abdominal, programando al paciente cada 24 horas para revisión, lavado y drenaje de la cavidad peritoneal hasta lograr controlar el foco séptico, desbridar totalmente el tejido necrótico y prevenir la acumulación del material purulento. A este procedimiento Wittmann lo denomina STAR (Staged Abdominal Repair) (6). Se debe lograr este objetivo en el manejo de la peritonitis secundaria, con dos a tres reintervenciones programadas cada 24 horas, acompañadas con el manejo integral en la UCI, soporte ventilatorio, hemodinámico, nutricional y antibióticos (34-36); de esta manera el paciente controlará su problema bajo un plan de relaparotomías planeada (37-41) figura 2.
Las siguientes son las ventajas del manejo de laparotomía planeada por etapas con abdomen abierto con malla:
1. Se limpia y drena el peritoneo como si toda la cavidad peritoneal fuera un gran absceso.
2. Se reduce al mínimo las relaparotomías por demanda, evitando el daño de la pared abdominal.
3. Se evita la hipertensión intraabdominal y el síndrome de compartimiento abdominal.
4. Se puede revisar la cavidad abdominal cuantas veces sea necesario.
El inconveniente con esta técnica son las reexploraciones programadas que requieren mayor demanda de anestesia, más manipulación de las vísceras con posibilidad alta de fístulas, mayor atención del grupo quirúrgico y posiblemente ventilación mecánica más prolongada (42-44).
La técnica del abdomen abierto con malla (relaparotomía planeada) fundamentalmente consiste en reoperar al paciente abriendo la malla cada 24 horas (8, 10, 30) retirar todo el material purulento, desbridar el tejido necrótico y hacer un lavado completo de la cavidad abdominal hasta que se controle la sepsis abdominal y se observe la cavidad limpia, con formación de tejido sano adherente de granulación. Además, se espera que la respuesta inflamatoria sistémica ceda o no se presente después de cada procedimiento. Cuando la cavidad abdominal se encuentra limpia, con tejido de granulación y no hay respuesta sistémica, se suspenden los lavados y se retira la malla (ya sea de velcro o malla de cierre con cremallera) para permitir que la herida quirúrgica complete la granulación y se contraiga. Después se coloca una bolsa de viaflex (bolsa de Bogotá) sobre la herida de la laparostomía hasta que el tejido de granulación cierre completamente la herida (45, 46).
Las complicaciones más frecuentes descritas con abdomen abierto son fístulas intestinales, ventilación mecánica prolongada y formación de eventración posterior.
Los trabajos publicados revelan que la técnica ha tenido buenos resultados. Con el APACHE II entre 10 y 25 utilizado como índice de severidad, la mortalidad disminuyó (7) y con el APACHE II mayor de 26 ésta se elevó de manera dramática independiente del manejo empleado; con el APACHE II por debajo de 10 se reporta en varios trabajos que no hay diferencia significativa cuando se hace un manejo de laparotomía por demanda o relaparotomía planeada. Lo anterior sugiere que los pacientes con APACHE II de rangos medios 10-25 son los que más se benefician con el uso de la técnica de laparotomía planeada por etapas con abdomen abierto con malla (figura 3 y 4).
El cierre definitivo del abdomen se decide en el último lavado cuando se retira la malla. Debe haber buen tejido de granulación y estar casi o completamente bloqueada la cavidad abdominal. En este momento se pueden realizar las siguientes opciones (3, 7, 37):
1. Colocar un plástico sobre la cavidad abdominal, fijándolo con algunos puntos a la pared y dejar que el paciente evolucione unos días más hasta que complete el tejido de granulación y la cavidad abdominal se bloquee totalmente.
2. Retirar la malla, encontrando las asas todavía libres y la fascia con posibilidad de ser afrontada. Se procede al cierre primario de la fascia y afrontamiento de la piel sin suturarla completamente.
3. Si la fascia se encuentra retraída y se decide cerrar la laparostomía, una posibilidad es afrontar la piel con puntos separados cerrando completamente la cavidad, pero dejando una eventración para corregirla en seis a ocho meses.
4. Cuando se ha completado la granulación y no es posible afrontar la fascia ni la piel, la posibilidad de cierre se obtiene con injertos libres de piel colocados sobre la herida de la laparostomía, quedando cerrada con injertos. En el futuro se corrige la eventración.
5. Si la malla usada es de velcro y se fijó a la fascia, se aconseja que a medida que ceda el edema de la pared y de las asas afrontar las hojas de la malla con el propósito de ir estrechando la laparostomía. En algunos pacientes al retirar la malla se logra el cierre de la fascia en forma primaria.
En el momento del cierre no es aconsejable hacer una disección amplia de la fascia, retirando el tejido de granulación para afrontarla, pues todavía hay edema de la pared abdominal y se dificulta el cierre por problemas en la liberación, con posibles complicaciones como fístulas o aumento de la presión intraabdominal. Además, tampoco se recomienda la colocación de una malla definitiva, ya que la pared abdominal aunque no esté infectada puede estar colonizada y posteriormente se puede infectar la malla.
Posterior al cierre de la pared abdominal, el paciente que se encuentre en buenas condiciones puede ser dado de alta y continuar el manejo por consulta externa. Una vez alcanzada la recuperación en aproximadamente seis a ocho meses, se realiza la corrección de la hernia incisional colocando una malla de marlex o prolene definitiva (3, 7, 8, 10, 37).
Conclusiones
El manejo de la PSSC con relaparotomías planeadas es una técnica viable y segura. En este trabajo se muestra una mortalidad de 19,9% IC95% (15, 1-24-7). Disminuyó el número de relaparotomías a 3,4 ± 2,3 desde el año 2000 y concomitantemente se redujo la mortalidad a 14,5% IC95% (9,1-19,1); aunque no logró demostrarse que la reducción en la mortalidad fuese debida en forma independiente a la disminución en el número de procedimientos, en los últimos años la investigación en sepsis ha permitido considerar otros factores concomitantes como cambiar la conducta en el manejo de estos pacientes desde la reanimación (47), control metabólico (48, 49), manejo ventilatorio hasta manipulación inflamatoria o de la coagulación (50), factores muy importantes en el desenlace pero que no fueron medidos en este estudio.
Referencias
1. Holzheimer RG, Gathof B. Reoperation for complicated secondary peritonitis-How to identify patients at risk for persistent sepsis. Eur J Med Res 2003; 8: 125-134. [ Links ]
2. Wittmann DH. Intra abdominal infections: pathophysiology and treatment. Marcel Derrer. New York, 1991. [ Links ]
3. Ordóñez CA, Franco JE. Peritonitis y sepsis intraabdominal. En: Cuidado intensivo y trauma. Bogotá: Editorial Distribuna, 2003; 667-684. [ Links ]
4. Wittmann DH, Walker AP, Condon RE, et al. Peritonitis e infección intraabdominal. En Principios de cirugía, 6 ed. Atampla, México: The McGraw-Hill Companies, 1995; 1493-1528. [ Links ]
5. Chiristou NV, Barie PS, Dellinger EP et al. Surgical infection society intra abdominal infection study: prospective evaluation of management techniques and outcome. Arch Surg 1993; 128: 193. [ Links ]
6. Wittmann DH, Shein M, Condon RE, et al. Management of secondary peritonitis. Ann Surg 1996; 224: 10-18. [ Links ]
7. Wittmann DH. Newer methods of operative therapy for peritonitis: open abdomen, planned relaparotomy or staged abdominal repair (STAR). In: Tellado JM, Christou NV. Intra-abdominal Infections Madrid, España: Harcourt, 2000; 153-192. [ Links ]
8. Ordóñez CA, Ferrada R, Flórez G, Torres E. Abdomen abierto en sepsis intraabdominal. Malla de nylon con cierre. Panam J Trauma 1989; 1: 16-21. [ Links ]
9. Schein M. Re-Laparotomy and laparostomy for infection. In: Schein M. Common sense emergency abdominal surgery. New York. Springer, 2000; 321-332. [ Links ]
10. Ordóñez CA, García A, Flórez G, Ferrada R. Uso de la malla en abdomen abierto, en sepsis intra abdominal. Rev Colomb Cir 1995; 10: 101-108. [ Links ]
11. Schein M, Wittmann, MD, PhD, Medical Collage of Wisconsin. The abdominal compartment syndrome following peritonitis, abdominal trauma, and operations. Complications in Surgery 1996; 15: 1-11. [ Links ]
12. Schein M, Wittmann DH, Aprahamian CC, et al. The abdominal compartment syndrome: the physiologic and clinical consequences of elevated intraabdominal pressure. J Am Coll Surg 1995; 180: 745. [ Links ]
13. Malbrain M, Deerenb D, De Potterc T, et al. Intra-abdominal hypertension in the critically ill: it is time to pay attention. Curr Opin Crit Care 2005; 11: 156-171. [ Links ]
14. Sugrue M. Abdominal compartment syndrome. Curr Opin Crit Care 2005; 11: 333-338. [ Links ]
15. Malbrain M, Chiumello D, Pelosi P, et al. Incidence and prognosis of intraabdominal hypertension in a mixed population of critically ill patients: a multiple-center epidemiological study. Crit Care Med 2005; 33: 315-322. [ Links ]
16. Lamme B, Boermeester A, Reitsma B. Meta-analysis of relaparatomy for secondary peritonitis. Br J Surg 2002; 89: 1516-1524. [ Links ]
17. Koperna T, Schulz F. Relaparotomy in peritonitis: prognosis and treatment of patients with persisting intraabdominal infection. World J Surg 2000; 24: 32-37. [ Links ]
18. Hau T, Ohmann C, Wolmershauser A, et al. Planned relaparotomy vs relaparotomy on demand in the treatment of intra abdominal infections. Arch Surg 1995; 130: 1193. [ Links ]
19. Schein M, Saadia R. Peritonitis: contamination and infection, principles of treatment. In: Schein M, Rogers P (ed.). Schein's Common Sense Emergency Abdominal Surgery. 2nd edition. New York. Springer, 2005; 95-101. [ Links ]
20. León A, Torres M, Montenegro G. Infección intraabdominal. En: Gómez A, Álvarez C, León A (ed.). Enfermedades infecciosas en UCI. Una aproximación basada en la evidencia. Bogotá. Editorial Distribuna, 2004; 293-353. [ Links ]
21. Johnson CC, Baldessarre J, Levison ME, et al. Peritonitis: update on pathophysiology. Clinical manifestations, and management clinical infectious diseases, 1997; 24: 1035-1047. [ Links ]
22. Koperna T, Schulz F. Prognosis and treatment of peritonitis. Arch Surg 1996; 131: 180-186. [ Links ]
23. Wittmann DH. Symposium of intraabdominal infection. World J Surg 1990; 14: 145. [ Links ]
24. Nieto JA. Sepsis abdominal. En: Quintero G, Nieto JA, Lerma C. Infección en cirugía. Bogotá. Editorial Médica Panamericana, 2001; 213-229. [ Links ]
25. Patiño JF, Quintero G, Baptiste S. Infección quirúrgica. En: Patiño JF. Lecciones en cirugía. Bogotá. Editorial Médica Panamericana, 2000; 105-117. [ Links ]
26. Schein M, Marshall J. LIRS, SIRS, sepsis, MODS and tertiary peritonitis. In: Schein M, Rogers P (ed.). Schein's Common Sense Emergency Abdominal Surgery. 2nd edition. New York. Springer; 2005; 415-423. [ Links ]
27. Velmahos G, Kamel E, Berne T, et al. Abdominal computed tomography for the diagnosis of intraabdominal sepsis in critical injured patients. Arch Surg 1999; 134: 831-838. [ Links ]
28. Haaga JR. Imaging intra-abdominal abscesses and nonoperative drainage procedures. World J Surg 1990; 14: 204. [ Links ]
29. Go H, Baarslaga H, Vermeulenb H, et al. A comparative study to validate the use of ultrasonography and computed tomography in patients with post-operative intra-abdominal sepsis. Eur J Radiol 2005; 54: 383-387. [ Links ]
30. Schein M, Saadia R, Rosin D. Re-laparotomy and laparostomy for infection. In: Schein M, Rogers P, (ed.). Schein's Common Sense Emergency Abdominal Surgery. 2nd edition. New York. Springer, 2005; 395-410. [ Links ]
31. Agalar F, Eroglu E, Bulbul M, et al. Staged abdominal repair for treatment of moderate to severe secondary peritonitis. World J Surg 2005; 29: 240-244. [ Links ]
32. Özgüç H, Yilmazlar T, Gürlüler E, et al. Staged abdominal repair in the treatment of intra-abdominal infection: analysis of 102 patients. J Gastrointest Surg 2003; 7: 646-651. [ Links ]
33. Borráez OA. Abdomen abierto. En: Quintero G, Nieto JA, Lerma C. Infección en cirugía. Bogotá: Editorial Médica Panamericana, 2001; 230-237. [ Links ]
34. Meakins JL. Surgical infection in art. Arch Surg 1996; 131: 1289-1295. [ Links ]
35. McClean KL, Sheehan GJ, Harding GK, et al. Intraabdominal infection: a Review Clinical Infectious Diseases 1994; 19: 100-116. [ Links ]
36. Pacelli F, Bauttista G, Alfieri S, et al. Prognosis in intraabdominal infections. Arch Surg 1996; 131: 641-645. [ Links ]
37. Wittmann DH, Aprahamian C, et al. Etappenlavage, advanced diffuse peritonitis managed by planned multiple laparotomies utilizing zippers slide fastener, and Velcro for temporary abdominal closure. World J Surg 1990; 14: 218. [ Links ]
38. Van Goor H, Hulsebos RG, Bleichodt RP. Complications of planned relaparotomy in patients with severe general peritonitis. Eur J Surg 1997; 163: 61. [ Links ]
39. Uribe R. Sepsis abdominal. Tópicos en Medicina Intensiva 2003; 2: 195-203. [ Links ]
40. Nieto JA. Sepsis abdominal. En: Urgencias médico quirúrgicas. Bogotá. Editorial Distribuna, 2002; 189-198. [ Links ]
41. Hutchins R, Gunning P, Nuala Lucas N, et al. Relaparotomy for suspected intraperitoneal sepsis after abdominal surgery. World J Surg 2004; 28: 137-141. [ Links ]
42. Rakic M, Popovic D, Rakic M, et al. Comparison of on-demand vs planned relaparotomy for treatment of severe intra-abdominal infections. Croat Med J 2005; 46: 956-963. [ Links ]
43. Lamme B, Mahler C, van Hill J, et al. Relaparotomie bei sekundärer. Peritonitis programmier te relaparotomie oder relaparotomie on demand? Chirurg 2005; 76: 856-867. [ Links ]
44. Lamme B, Boermeester M, de Vos R, et al. Survey among surgeons on surgical treatment strategies for secondary peritonitis. Dig Surg 2004; 21: 387-395. [ Links ]
45. Lamme B, Boermeester M, Belt E, et al. Mortality and morbidity of planned relaparotomy versus relaparotomy on demand for secondary peritonitis. Br J Surg 2004; 91: 1046-1054. [ Links ]
46. Borráez OA. Peritonitis terciaria. En: Quintero G, Nieto JA, Lerma C. Infección en cirugía. Bogotá. Editorial Médica Panamericana, 2001; 238-244. [ Links ]
47. Rivers E, Nguyen B, Havstad S, et al: Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001; 345: 1368-1377. [ Links ]
48. Van den Berghe G, Wouters P, Weekers F, et al. Intensive Insulin Therapy In Critically Ill patients. N Engl J Med 2001; 345: 1359-1367. [ Links ]
49. Annane D, Sebille V, Bellissant E. Corticosteroids for patients with septic shock. JAMA 2003; 289: 43-44. [ Links ]
50. Bernard GR, Vincent J-L, Laterre P-F, et al. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med 2001; 344: 699-709. [ Links ]














