Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582On-line version ISSN 2619-6107
rev. colomb. cir. vol.22 no.1 Bogotá Jan./Mar. 2007
(1) Cirujano oncólogo, epidemiólogo clínico, profesor titular del Departamento de Cirugía. Universidad del Valle, Hospital Universitario del Valle, Cali, Colombia.
(2)Cirujano general, Hospital Universitario del Valle, Cali, Colombia.
Correspondencia: Mauricio Velásquez, MD. Cali, Colombia. Correo electrónico: mauriciovelasq@yahoo.com
Fecha de recibo: Julio 5 de 2006. Fecha de aprobación: Noviembre 1 de 2006
Resumen
El cirujano que atiende pacientes con sintomatología gástrica debe tener un conocimiento profundo de los diferentes aspectos que puede reportar una endoscopia digestiva superior, entre ellos la presencia de atrofia y de metaplasia intestinal gástrica. Lo anterior es más importante todavía si se tiene en cuenta que Colombia es un país de alta prevalencia de cáncer gástrico.
Se hizo una revisión de la literatura sobre el proceso de atrofia, metaplasia y cáncer gástrico, tratando de buscar la mejor evidencia disponible que soporta la ocurrencia de esta secuencia de eventos, evaluando el papel del Helicobacter pylori y tratando de encontrar cómo debe ser el seguimiento de estos pacientes, con el objetivo de hacer un diagnóstico temprano del cáncer gástrico y finalmente dar unas recomendaciones de manejo.
Palabras clave: cáncer de estómago, cáncer gástrico, atrofia, metaplasia, medicina basada en evidencia.
Abstract
The surgeon caring for a patient with gastric symptoms must possess a profound knowledge of the different aspects of the upper GI endoscopy reports, among them gastric mucosal atrophy and intestinal metaplasia.This becomes even more important when considering that Colombia is region of high prevalence of gastric cancer.
A literature review was carried out on atrophy, metaplasia, and gastric cancer, searching for the best evidence available supporting the occurrence of this sequence of events, evaluating the role of Helicobacter pylory, and in an attempt to determine how the follow-up should be done so as to achieve an early diagnosis and to provide practical management recommendations.
Key words: gastric cancer, atrophy, metaplasia, evidence-based medicine.
Introducción
El cáncer gástrico es el segundo cáncer en frecuencia a nivel mundial con grandes diferencias geográficas en la distribución. A pesar de la tendencia global a la disminución en la incidencia, esta patología representa 3-10% de las causas de muerte por cáncer en el mundo, y si bien en países como el Japón ha aumentado la supervivencia, no ha ocurrido lo mismo en los Estados Unidos ni en el resto de los países occidentales, a pesar del desarrollo en la técnica quirúrgica y las terapias adyuvantes y neoadyuvantes (1, 2).
El 90% de los tumores gástricos son malignos y el adenocarcinoma representa el 95% de ellos. La terapia curativa incluye resección gástrica oncológica con una supervivencia a los cinco años para todos los que se consideraban resecables de 10-30% (1).
El principal problema del cáncer gástrico es que cerca de 65% de los pacientes se presentan en estados avanzados de la enfermedad, aproximadamente el 85% de ellos con metástasis ganglionares y con alta tasa de recurrencias (40-65%) en los pacientes operados con intención curativa (3-5). Por tanto, algunos autores recomiendan programas de tamizaje en la población asintomática y vigilancia de la población a riesgo, los cuales son necesarios en países de alta incidencia de esta patología como Colombia (1).
La endoscopia se reconoce como el método diagnóstico más sensible y específico para los pacientes con sospecha de cáncer gástrico, pues no sólo permite la visualización directa de las lesiones sino también su localización anatómica y la toma de biopsias para el diagnóstico histológico, el cual es definitivo para el tratamiento, bien sea un adenocarcinoma temprano o invasivo o una gastritis. Sin embargo, todavía no están claros algunos puntos de los pacientes con atrofia/metaplasia intestinal como por ejemplo: el número adecuado de biopsias, la decisión de tomar biopsias de unos sitios predeterminados o solamente de aquéllos con apariencia patológica, la utilidad de la cromografía para evaluar la mucosa gástrica y finalmente la frecuencia y duración del seguimiento endoscópico en los pacientes con lesiones sospechosas (2, 6-11).
En el presente artículo se presenta una revisión de la literatura basada en la evidencia, que permita aclarar la relación de la atrofia/metaplasia intestinal con el cáncer gástrico y presenta unas recomendaciones desde el punto de vista de tratamiento y seguimiento.
Historia natural
Lauren clasificó el cáncer gástrico como tipo intestinal y difuso (12). Pelayo Correa fue el primero en describir la historia natural del cáncer gástrico de tipo intestinal en sus estudios clásicos en la Unión (Nariño, Colombia) (13-15). Según su teoría aceptada mundialmente, el cáncer gástrico de tipo intestinal surge de un proceso que se inicia como gastritis crónica, gastritis crónica atrófica, metaplasia intestinal (madura o inmadura) y finalmente displasia (leve, moderada o severa). Todo este proceso toma, en teoría, entre ocho y diez años, aunque permanece sin aclararse si la metaplasia intestinal es un proceso premaligno o un factor de riesgo para la aparición del cáncer (2,14-22).
La gastritis crónica atrófica se considera el primer paso en la histogénesis del cáncer gástrico y en el Japón se ha encontrado que hasta 80% de los pacientes con Helicobacter pylori tienen gastritis crónica atrófica, mientras que en Europa ésta alcanza una prevalencia hasta de 13% (23). Generalmente la gastritis atrófica se asocia con hiposecreción ácida y bajos niveles de pepsinógeno, lo cual permite la colonización de otras bacterias y la formación de agentes carcinogénicos (11, 23-25).
La metaplasia intestinal es un proceso en el cual la mucosa gástrica se remplaza por un epitelio que histológicamente recuerda la mucosa intestinal y que con frecuencia se asocia con gastritis crónica atrófica (26). Es importante anotar que la metaplasia intestinal no siempre puede ser objetivamente clasificada por los métodos de hematoxilina-eosina; por tanto, se ha trabajado mucho en los métodos de inmunohistoquímica, lo cual ha permitido clasificar de manera más objetiva la naturaleza epitelial de las células en el tracto gastrointestinal; sin embargo, hasta el momento persiste la teoría de que hay una relación entre el cáncer gástrico y el tipo de metaplasia intestinal, por lo cual se desarrolló un sistema de clasificación que permitiera diferenciar los tipos de metaplasia (16, 18, 21, 26, 27):
Metaplasia intestinal completa
Tipo I. Células caliciformes secretoras de sialomucina y células absorptivas no secretoras.
Metaplasia intestinal incompleta
Tipo II. Pocas células absortivas, células columnares secretoras de sialomucina ácida y neutra, células caliciformes secretoras principalmente de sialomucina y ocasionalmente sulfomucina.
Tipo III. Células columnares secretoras principalmente de sulfomucina y células caliciformes secretoras de sialomucina y sulfomucina.
Un estudio (16) que incluyó 79 pacientes no logró encontrar que aquéllos con metaplasia tipo I y II progresaran a metaplasia tipo III, ni tampoco que los con metaplasia tipo III progresaran a displasia y cáncer. Esto también se reportó en otros estudios similares sin que se demostrara la asociación entre los diferentes tipos de metaplasia y el desarrollo de cáncer, ni tampoco que la ausencia de metaplasia, independientemente del tipo, sea una indicación de bajar la guardia en la búsqueda del cáncer gástrico (21, 28, 29). Sin embargo, en un estudio (24) de una cohorte prospectiva en el Japón que incluyó 4.655 pacientes con un seguimiento de 7,7 años, se encontró que la gastritis crónica atrófica y sus cambios tienen un papel importante en el desarrollo del cáncer gástrico y que la progresión de las lesiones y la cantidad de metaplasia hallada, incrementa en forma dramática el riesgo de desarrollar cáncer. En otro estudio de Cassaro y colaboradores (30) realizado en Colombia, se encontró que la metaplasia intestinal que involucraba la curvatura menor desde el cardias hasta el píloro se asociaba con un mayor riesgo de cáncer gástrico que en aquéllos que tenían metaplasia de predominio focal o antral exclusivamente; además, la distribución de la metaplasia y el subtipo histológico fueron predictores de malignidad. Por el contrario, en la revisión de varios estudios realizada por Meining y colaboradores (31) se demuestra que los pacientes con úlcera duodenal y Helicobacter pylori presentan metaplasia intestinal antral y el riesgo de desarrollar cáncer gástrico es bajo. En otro estudio se considera que las lesiones metaplásicas deben ser tenidas como paracancerosas y que el carcinoma gástrico se origina en una célula gástrica pluripotencial no neoplásica (stem cell) sometida a un proceso inflamatorio crónico, en la mayoría de los casos secundario a la infección por Helicobacter pylori, y que se degenera hacia el tipo intestinal y origina el cáncer (22).
La displasia es el siguiente paso en la cascada de carcinogénesis gástrica y de acuerdo con la definición de la Organización Mundial de la Salud se considera como neoplasia gástrica no invasiva y entre mayor sea el grado de displasia mayor es el riesgo de cáncer gástrico (23). Sin embargo, en algunos trabajos se demuestra que la displasia de bajo grado rara vez progresa a displasia de alto grado y que hasta en 50% de los casos esta lesión regresa espontáneamente (25).
El Helicobacter pylori produce gastritis crónica prácticamente en todos los pacientes colonizados por esta bacteria, lo cual al final puede llevar a la pérdida de las glándulas del estómago y a la aparición de gastritis atrófica y metaplasia intestinal que predispone a la aparición de cáncer gástrico (2, 20, 28, 32-37). También se ha establecido que la atrofia bien sea multifocal (que afecta antro y cuerpo gástrico) o de origen autoinmune (que compromete exclusivamente el cuerpo gástrico) puede elevar el riesgo de cáncer gástrico hasta 90 veces (2, 19, 20, 32, 23, 28, 37). Sin embargo, se sabe que no todos los pacientes infectados con Helicobacter pylori desarrollan cáncer gástrico; de hecho la úlcera duodenal y el cáncer gástrico, ambos asociados con la infección crónica por el Helicobacter pylori, se consideran dos puntos finales diferentes en el espectro clínico de la infección por esta bacteria (36). Mientras la úlcera duodenal se caracteriza por gastritis de predominio antral e hipersecreción ácida, el cáncer gástrico se caracteriza por pangastritis de predominio en el cuerpo gástrico e hiposecreción ácida, lo cual podría explicarse por las diferencias genéticas en el huésped y el polimorfismo en las citoquinas proinflamatorias (29). En un ensayo clínico controlado que involucró 1.630 pacientes se observó que la erradicación del Helicobacter pylori disminuyó el riesgo de desarrollar cáncer gástrico en los pacientes sin lesiones precancerosas, en la endoscopia inicial (38). En un ensayo clínico controlado realizado por Correa y colaboradores (39) en 631 pacientes colombianos, se demostró que la curación de la infección por Helicobacter pylori y la administración de medicamentos antioxidantes interfirieron con la progresión de las lesiones precancerosas principalmente por incremento en la tasa de regresión de las mismas, lo que podría ser una estrategia efectiva para la prevención del cáncer gástrico; esto se ha demostrado a través del tiempo con el seguimiento de los pacientes (40). En otro estudio aleatorizado con 795 divididos en tres grupos terapéuticos: tratamiento anti-Helicobacter, tratamiento con betacaroteno o con ácido ascórbico; a los seis años de seguimiento se examinó la presencia de Helicobacter, se trató a los que eran positivos y se hizo un nuevo seguimiento por otros seis años. El estudio concluye que el efecto antioxidante desaparece con el tiempo y que el único efecto que permanece es el logrado con la erradicación del Helicobacter; además que el efecto de la erradicación del Helicobacter fue la regresión de las lesiones precancerosas, el cual fue más fuerte entre más tiempo estuvo el paciente libre de la infección (27).
Resultados similares a los encontrados en Colombia, con respecto a la evolución de las lesiones precancerosas, se reportan en un estudio realizado en la China en el cual a los pacientes se les dio tratamiento para el Helicobacter pylori en forma aleatorizada y se comparó con suplementos vitamínicos y contra suplementos que contenían ajo; concluye que la erradicación del Helicobacter Pylori producía disminución en el riesgo de cáncer gástrico mientras que los suplementos nutricionales no tuvieron tal efecto (41).
En otro ensayo clínico controlado que incluyó 435 pacientes con diagnóstico de infección por Helicobacter pylori repartidos aleatoriamente para recibir omeprazol, claritomicina y amoxacilina contra placebo, con el objetivo de evaluar la progresión de las lesiones consideradas precancerosas, se demostró que 2,3% de los pacientes infectados con Helicobacter pylori desarrollaron cáncer en los cinco años de seguimiento, con un promedio de riesgo anual de cáncer gástrico de 0,46%. Además, se demostró que el riesgo de progresión de la metaplasia intestinal es más bajo en los pacientes con úlcera duodenal y en los que se logró la erradicación del Helicobacter pylori; por el contrario, el riesgo es más alto en los mayores de 45 años, con antecedente de ingesta alcohólica y que beben agua de pozo, identificándolos como un grupo que requiere una vigilancia endoscópica más amplia (29). En el estudio mencionado de Ohata y colaboradores también se concluye que la infección por Helicobacter pylori y los cambios inflamatorios generados por esta bacteria tienen papel fundamental en el desarrollo del cáncer gástrico hasta el punto de afirmar que es extremadamente raro encontrar un cáncer gástrico en un estómago sin Helicobacter pylori (24).
Evaluación clínica
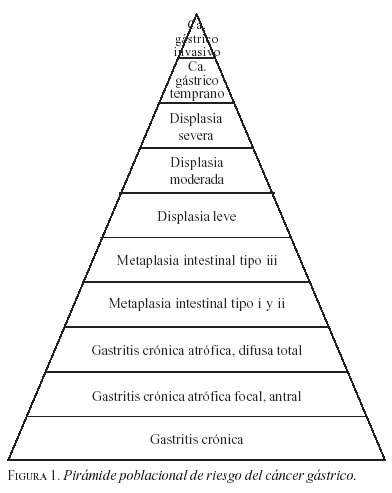
Para el cirujano que atiende pacientes con sintomatología gástrica, es fundamental saber la forma de evaluar clínicamente, dar tratamiento y sobre todo hacer seguimiento cuando la endoscopia digestiva superior reporta atrofia/metaplasia intestinal, en especial en un país de alta incidencia de cáncer gástrico como Colombia, donde, además, la oportunidad de servicios médicos es tan restringida y la posibilidad de prevenir el desarrollo de un cáncer es considerable como se ha demostrado en la literatura (8, 35, 39). Es importante tener un esquema gráfico del problema para entender mejor los estudios y los resultados de los mismos; ello se logra al mirar la figura 1, la cual se fundamenta en la teoría de Pelayo Correa. Esta figura muestra la pirámide poblacional del problema, encontrando cómo gran parte de la población general presenta gastritis crónica, pero el proceso sólo progresa en grupos cada vez menores hasta lograr en cáncer en una pequeña minoría y en un promedio de tiempo entre ocho y diez años, en la medida que persiste o se agregan nuevos factores de riesgo.
En un estudio (41) realizado con 42 pacientes con diagnóstico de gastritis atrófica de predominio en el cuerpo gástrico de primera vez, aunque con limitaciones sobre todo por el número de pacientes, se concluye que el tiempo de seguimiento óptimo no está bien definido pero que antes de cuatro años es innecesario y que este intervalo es satisfactorio para la detección de una lesión potencialmente neoplásica.
En otro estudio (42) realizado con 166 pacientes con diagnóstico de gastritis atrófica, metaplasia intestinal, displasia, pólipos, cambios regenerativos o úlceras gástricas se efectuaron endoscopias anuales durante diez años, aunque con una metodología cuestionable; se encontró que el riesgo de aparición de cáncer en los que tenían metaplasia intestinal o gastritis atrófica alcanzó 10%, pero con la ventaja de que la mayoría se diagnosticaron en estadios I y II con una sobrevida mayor al 50%. Por tanto, recomienda que en los pacientes con diagnóstico endoscópico de gastritis atrófica o metaplasia intestinal se deben realizar endoscopias anualmente.
Otro estudio (25) tomó 38 pacientes con Helicobacter pylori positivo histológica y serológicamente que fueron curados con el tratamiento, 36 que sólo eran positivos serológicamente y que no recibieron tratamiento y 32 que eran negativos para Helicobacter pylori. A estos 106 pacientes se les hizo seguimiento con una media de 6,7 años, demostrando que no hubo cambios en los grados de atrofia ni de la metaplasia intestinal a pesar de la presencia o ausencia del Helicobacter en los tres grupos de estudio; ocho desarrollaron lesiones neoplásicas: uno presentó un adenocarcinoma gástrico, otro un adenoma tubular con displasia de bajo grado y seis desarrollaron displasia de bajo grado sin lesiones evidentes en la endoscopia. Se concluye que la atrofia y la metaplasia intestinal son lesiones persistentes y que los pacientes con atrofia antral y en el cuerpo gástrico tienen mayor riesgo de desarrollar lesiones neoplásicas por lo que se recomienda hacerles seguimiento.
En otro estudio (43), aunque realizado en forma retrospectiva y sin un diseño muy estricto, se encontró una cohorte de 144 pacientes en quienes se practicó como mínimo dos endoscopias con un seguimiento mínimo de un año y riesgo de progresar a displasia de bajo grado de 12% en los que tenían gastritis atrófica, 8% en aquellos con metaplasia intestinal tipo I y 38% en los que tenían metaplasia intestinal tipo II y III, recomendando endoscopias cada dos o tres años para los pacientes con gastritis crónica y metaplasia intestinal tipo I, y endoscopias cada seis o doce meses ayudadas de cromografía en aquellos con metaplasia intestinal tipo III.
En el estudio de Ohata y colaboradores (24) en una cohorte de pacientes y en el que se incluyeron 4.655 hombres trabajadores de una fábrica, sometidos a seguimiento por 7,7 años en promedio, dentro del cual se incluían endoscopia anual y dos pruebas serológicas (anticuerpos contra Helicobacter pylori y niveles de pepsinógeno), se identificó un grupo de riesgo para el desarrollo de cáncer gástrico que fueron los pacientes con positividad en las dos pruebas serológicas y los cuales se correlacionaban positivamente con los hallazgos endoscópicos; por tanto, se recomienda una mayor vigilancia endoscópica para estos pacientes. Además se identificó un grupo de bajo riesgo que son los pacientes con negatividad en las dos pruebas serológicas, lo cual también se correlacionó con la endoscopia, lo que permite espaciar la vigilancia endoscópica en este grupo de pacientes.
También se ha investigado la posibilidad de otros tipos de seguimiento y al respecto recientemente se publicó un trabajo realizado en México donde se demostró que la curación del Helicobacter pylori produce reversión en los cambios de expresión genética de la mucosa gástrica, lo cual en el futuro podría utilizarse como tamizaje para detectar pacientes en riesgo de desarrollar cáncer gástrico (45). En Hong Kong se demostró que la erradicación del Helicobacter pylori producía una reversión en la mutilación de la molécula de adhesión E-caderina y con ello disminuir el riesgo de cáncer gástrico (46).
Al igual que en México y Hong Kong, previamente se había publicado otro estudio en el que la expresión histológica de las mucinas podría servir también como marcador de seguimiento o tamizaje en la detección temprana de los pacientes en riesgo de cáncer gástrico (47).
Evidencia
La cirugía es una de las especialidades médicas donde el enfoque basado en la evidencia es más difícil de obtener debido a restricciones técnicas y éticas de los estudios, al punto de que algunos autores se preguntan si la medicina basada en la evidencia puede ser aplicada a la cirugía y consideran que puede tener varias connotaciones: innecesaria como la colecistectomía laparoscópica, la cual fue declarada patrón oro a pesar de los cerca de 15 ensayos clínicos controlados al respecto. Inapropiado como ocurre cuando se reportan las variables de resultado intermedio. Imposible, debido a problemas éticos; o inadecuado debido a la heterogeneidad de la población (44, 45).
Teniendo en cuenta lo anterior y a pesar de ser más o menos abundante la literatura sobre atrofia/metaplasia intestinal, hay que decir que los estudios se caracterizan por varios problemas metodológicos comunes como por ejemplo:
- Definiciones no estandarizadas de atrofia/metaplasia intestinal (a pesar de reuniones de consenso).
- Cambios en las definiciones con el tiempo.
- Estudios con tamaños de muestra pequeños.
- Estudios con seguimientos muy cortos.
- Estudios sin grupos de control.
- Estudios retrospectivos.
- Estudios con resultados contradictorios.
- Estudios con errores de muestreo, tanto patológicos como estadísticos.
Por tanto, con base en los niveles de evidencia reconocidos mundialmente para el caso de atrofia, metaplasia y cáncer gástrico sólo se puede encontrar evidencia tipo III y IV (tabla 1), permitiendo dar recomendaciones tipo C (basadas en series de casos) o D (que son las recomendaciones dadas por los expertos en el tema) y dentro de las cuales se dan:
1. Tratamiento de Helicobacter pylori sólo cuando se demuestra linfoma gástrico tipo maltoma, úlcera péptica asociada y gastritis crónica atrófica multifocal en paciente con antecedente familiar de riesgo o que va a recibir tratamiento con AINES.
2. Seguimiento endoscópico cada cinco años a los pacientes con gastritis crónica atrófica y metaplasia intestinal incompleta en poblaciones de bajo riesgo o sin antecedente familiar de riesgo.
3. Seguimiento endoscópico cada año a los pacientes con pangastritis atrófica y metaplasia intestinal incompleta en poblaciones de riesgo o con antecedente familiar de riesgo.

Referencias
1. Dicken B, Bigam D, Cass C, Mackey J, Joy A, Hamilton S. Gastric adenocarcinoma, review and considerations for future directions. Ann Surg 2005; 241: 27. [ Links ]
2. Graham D, Shiotani A. The time to eradicate gastric cancer is now. Gut 2005; 54: 735. [ Links ]
3. Doglietto G, Pacelli F, Caprino P, Sgadari A, Crucitti F. Surgery: Independent prognostic factor in curable and advanced gastric cancer. World J Surg 2000; 24: 459. [ Links ]
4. Hundahl S, Phillips J, Menck H. The national cancer database report on poor survival of U.S. gastric carcinoma patients treated with gastrectomy. Cancer 2000; 88: 921. [ Links ]
5. Macdonald J, Smalley S, Benedetti J, Hundahl S, Estes N, Stemmerman G, Haller D, et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001; 345: 725. [ Links ]
6. Karpeh M, Brennan M. Gastric carcinoma. Ann Surg Oncol 1998; 5: 650. [ Links ]
7. Rubio C, Befrits R. Gastric intestinal metaplasia. J Clin Pathol 2004; 57: 894. [ Links ]
8. Melguizo M. Metaplasia intestinal del cardias en pacientes con síntomas de reflujo gastroesofágico con o sin esofagitis. Rev Colomb Cir 2003; 18: 218. [ Links ]
9. Gaviria J, Melguizo M. Gastritis crónica. Correlación de la clasificación de Sydney con el diagnóstico endoscópico. Rev Col Cir 2004; 19: 162. [ Links ]
10. Fennerty MB. Gastric intestinal metaplasia on routine endoscopic biopsy. Gastroenterology 2003; 125: 586. [ Links ]
11. Rugge M, Genta R. Staging and grading of chronic gastritis. Hum Pathol 2005; 36: 228. [ Links ]
12. Lauren P. The two histological main types of gastric carcinoma: diffuse and the so-called intestinal-type carcinoma. Acta Pathol Microbiol Scand 1965; 64: 31. [ Links ]
13. Correa P, Cuello C, Duque E, Burbano L, García F, Bolaños O, et al. Gastric cancer in Colombia. III Natural History of precursor lesions. J Natl Cancer Inst 1976; 57: 1027. [ Links ]
14. Correa P, Haenszel W, Cuello C, Zavala D, Fontham E, Zarama G, Tannenbaum S, et al. Gastric precancerous process in a high risk population: Cohort Follow-up. Cancer Research 1990; 50: 4737. [ Links ]
15. Correa P, Haenszel W, Cuello C, Zavala D, Fontham E, Zarama G, Tannenbaum S, Collazos T, Ruiz B. Gastric precancerous process in a high risk population: Cross-sectional studies. Cancer Res 1990; 50: 4731. [ Links ]
16. El-Zimaity H, Ramchatesingh J, Ali Saeed M, Graham D. Gastric intestinal metaplasia: subtypes and natural history. J Clin Pathol 2001; 54: 679. [ Links ]
17. Correa P. Human gastric carcinogenesis: a multistep and multifactorial process. First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res 1992; 52: 6735. [ Links ]
18. Guindi M, Riddell R. The pathology of epithelial pre-malignancy of the gastrointestinal tract. Best Pract Res Clin Gastroenterol 2001; 12: 191. [ Links ]
19. Genta R, Rugge M. Gastric precancerous lesions: heading for an international consensus. Gut 1999; 45: 5. [ Links ]
20. Jablonská M, Chlumská A. Genetic factors in the development of gastric precancerous lesions - a role of Helicobacter pylori? J Physiol Paris 2001; 95: 477. [ Links ]
21. Conchillo J, Houben G, Bruïne A, Stockbrügger R. Is type III intestinal metaplasia an obligatory precancerous lesion in intestinal-type gastric carcinoma? Eur J Cancer Prev 2001; 10: 307. [ Links ]
22. Houghton J, Wang T. Helycobacter pylori and gastric cancer: a new paradigm for inflammation-associated epithelial cancers. Gastroenterology 2005; 128: 1567. [ Links ]
23. Nardone G, Rocco A, Malfertheiner P. Review article: Helicobacter pylori and molecular events in precancerous gastric lesions. Aliment Pharmacol Ther 2004; 20: 261. [ Links ]
24. Ohata H, Kitauchi S, Yoshimura N, Mugitani K, Iwane M, Nakamura H, Yoshikawa K, et al. Progression of chronic atrophic gastritis associated with Helicobacter pylori infection increases risk of gastric cancer. Int J Cancer 2004; 109: 138. [ Links ]
25. Lahner E, Bordi C, Catarruza M, Iannonnis C, Milione M, Delle Fave G, Annibale B. Long-term follow-up in atrophic body gastritis patients: atrophy and intestinal metaplasia are persistent lesions irrespective of Helicobacter pylori infection. Aliment Pharmacol Ther 2005; 22: 471. [ Links ]
26. Ikeda Y, Nishikura K, Watanabe H, Watanabe G, Ajioka Y, Hatakeyama K. Histopathological differences in the development of small intestinal metaplasia between antrum and boy of stomach. Pathol Res Pract 2005; 201: 487. [ Links ]
27. Mera R, Fontham E, Bravo L, Bravo J, Piazuelo M, Camargo M, Correa P. Long term follow up of patients treated for Helicobacter pylori infection. Gut 2005; 54: 1536. [ Links ]
28. Kuipers E, Siersema P. The aetiology and clinical relevance of gastric intestinal metaplasia. Dig Liver Dis 2004; 36: 501. [ Links ]
29. Leung W, Lin S, Ching J, To K, Ng E, Chan F, Lau J, Sung J. Factors predicting progression of gastric intestinal metaplasia: results of a randomizes trial on Helicobacter pylori eradication. Gut 2004; 53: 1244. [ Links ]
30. Cassaro M, Rugge M, Gutierrez O, Leandro G, Graham D, Genta R. Topographic patterns of intestinal metaplasia and gastric cancer. Am J Gastroenterol 2000; 95: 1431. [ Links ]
31. Meining A, Morgner A, Mielhke S, Bayerdörfer E, Stolte M. Atrophy-metaplasia-dysplasia-carcinoma sequence in the stomach: a reality or merely an hypothesis?. Best Pract Res Clin Gastroenterol 2001; 15: 983. [ Links ]
32. Kokkola A, Sipponen P, Rautelin H, Härkönens H, Kosunen T, Haapiainen R, Polakkainen P. The effect of Helycobacter pylori erradication on the natural course of atrophic gastritis with dysplasia. Aliment Pharmacol Ther 2002; 16: 515. [ Links ]
33. Giuliani A, Caporale A, Demoro M, Benvenuto E, Scarpini M, Spada S, Angelico F. Gastric cancer precursor lesions and Helicobacter pylori infection in patients with partial gastrectomy for peptic ulcer. World J Surg 2005; 29: 1127. [ Links ]
34. Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, et al. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med 2001; 345: 784. [ Links ]
35. Correa P. Is gastric cancer preventable? Gut 2004; 53: 1217. [ Links ]
36. Sierra F. Helicobacter pylori - Estado actual. Rev Colomb Cir 2002; editorial 17 (3). [ Links ]
37. Zhang C, Yamada N, Wu Y, Wen M, Matsuhisa T, Matsukura N. Helicobacter pylori infection, glandular atrophy and intestinal metaplasia in superficial gastritis, gastric erosion, erosive gastritis, gastric ulcer and early gastric cancer. World J Gastroenterol 2005; 11(6): 791. [ Links ]
38. Wong B, Lam S, Wong W, Chen J, Zheng T, Feng R, Lai K, et al. Helicobacter pylori erradication to prevent gastric cancer in a high-risk region of China a randomized controlled trial. JAMA 2004; 291: 187. [ Links ]
39. Correa P, Fontham E, Bravo J, Bravo L, Ruiz B, Zarama G, Realpe J, et al. Chemoprevention of gastric displasia: Randomized trial of antioxidant supplements and anti-Helicobacter pylori therapy. J Natl Cancer Inst 2000; 92: 1881. [ Links ]
40. Fontham E, Correa P, Mera R, Bravo L, Bravo J, Piazuelo M, Camargo C. Duration of exposure, a neglected factor in chemoprevention trials. Cancer Epidemiol Biomarkers Prev 2005; 14 (11): 2465. [ Links ]
41. You W, Brown L, Zhang L, Li J, Jin M, Chang Y, Ma J, et al. Randomized double-blind factorial trial of three treatments to reduce prevalence of precancerous gastric lesions. J Natl Cancer Inst 2006; 98: 974 [ Links ]
42. Lahner E, Caruana P, D´ambra G, Ferraro G, Di Giulio E, Delle Fave G, et al. First Endoscopic-histologic follow-up in patients with body-predominant atrophic gastritis: when should it be done? Gastrointest Endosc 2001; 53: 443. [ Links ]
43. Whiting J, Sigurdsson A, Rowlands D, Hallissey M, Fielding J. The long term results of endoscopic surveillance of premalignant gastric lesions. Gut 2002; 50: 378. [ Links ]
44. Dinis-Ribeiro M, Lopes C, Costa-Pereira A, Guilherme M, Barbosa J, Lomba-Viana H, Silva R, et al. A follow-up model for patients with atrophic chronic gastritis and intestinal metaplasia. J Clin Pathol 2004; 57: 177. [ Links ]
45. Jillian C, Herrera R, Tibshirani R, Yang S, Mohar A, Guarner J, Parsonnet J. Changes of gene expression in gastric preneoplasia following Helicobacter pylori eradication therapy. Cancer epidemiol Biomarkers Prev 2006; 15: 272. [ Links ]
46. Chang A, Peng J, Lai K, Yuen M, Cheung H, Kwong Y, Rashid A, et al. Eradication of Helicobacter pylori infection reverses E-cadherin promoter hypermethylation. Gut 2006; 55: 463. [ Links ]
47. Reis C, David L, Correa P, Carneiro F, Bolos C, García E, Mandel U, et al. Intestinal metaplasia of human stomach displays distinct patterns of mucin (MUC1, MUC2, MUC5A6 and MUC6) expression. Cancer Res 1999; 59: 1003. [ Links ]
48. Lacaine F. Evidence-based medicine in surgical decision making. Worl J Surg 2005; 29: 588. [ Links ]
49. Urschel J. How to analyze an article. Worl J Surg 2005; 29: 557. [ Links ]














