Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Cirugía
versión impresa ISSN 2011-7582versión On-line ISSN 2619-6107
rev. colomb. cir. v.22 n.2 Bogotá abr./jun. 2007
Epidemiología indicaciones y limitaciones
Epidemiology, indications, and limitations
(1) Especialista en cirugía general y cirugía vascular. Cirujano vascular, Clínica General del Norte, Barranquilla.
(2) Jefe del Servicio de Diagnóstico y Terapéutica Endoluminal (DTE) Hospiten Rambla, Santa Cruz de Tenerife, España. Profesor titular, Universidad de Las Palmas de Gran Canaria Full. Profesor, Louisiana University New Orleáns, USA.
(3) Médico adjunto del Servicio de Diagnóstico y Terapéutica Endoluminal (DTE). Hospiten Rambla, Santa Cruz de Tenerife, España.
Correspondencia: Roberto Carlos Fominaya Pardo, MD Calle 90 No 42E -156 Piso 3, Barranquilla, Colombia. Correo electrónico: rfominaya@geo.net.co
Fecha de recibo: Julio 18 de 2006. Fecha de aprobación: Abril 15 de 2007
Resumen
Los aneurismas de la aorta abdominal son una patología frecuente, con alta afinidad hacia la ruptura y muerte. La reparación endovascular es una alternativa al reparo convencional en pacientes de alto riesgo, y el desarrollo tecnológico y el perfeccionamiento de las endoprótesis va a permitir su aplicación en pacientes de buen riesgo para reparo convencional con cirugía abierta. En este artículo se dan las pautas básicas que deben conocer los especialistas en enfermedades cardiovasculares acerca de la epidemiología, indicaciones y limitaciones del reparo endoluminal de los aneurismas de la aorta abdominal.
Palabras clave: aneurisma aórtica abdominal, reparación endoluminal, epidemiología.
Abstract
Abdominal aortic aneurysms constitute a frequent pathology, with high propensity to rupture and death; endovascular repair is an alternative to conventional repair in high-risk patients. The technological development and betterment of endoprosthesis will allow the application of this method in patients considered to be of good risk for conventional open repair. This article presents the basic knowledge that should possess the specialists in cardiovascular diseases in regard to epidemiology and indications and limitations of the endoluminal repair of abdominal aortic aneurysms.
Key words: abdominal aortic aneurysm, endoluminal repair, endovascular repair, epidemiology.
Epidemiología
Los aneurismas de la aorta abdominal (AAA) representan un proceso degenerativo, que a menudo es atribuido a aterosclerosis; sin embargo, su causa es desconocida; la mayoría son esporádicos y hasta un 15% son heredofamiliares; otras causas descritas son infección, trauma, arteritis, necrosis quística de la media, enfermedades del tejido conectivo y disrupción anastomótica (1).
Los AAA son cinco veces más frecuentes en hombres que en mujeres (5-6:1), tienen un pico de incidencia a los 70 años, 3,5 veces más frecuente en caucásicos que en negros, hispanos y asiáticos; tienen una prevalencia de 1,4-3,2% en Estados Unidos de América, 8,2% en el Reino Unido, 8,8% en Italia, 4,2% en Dinamarca y 8,2% en Suiza. Es la decimoquinta causa de muerte, entre todas las causas, en los Estados Unidos de América, con alta propensión a la ruptura y muerte, lo que la convierte en un verdadero problema de salud pública (2, 3).
Las indicaciones para intervenir AAA siguen las normas de la Sociedad Americana de Cirugía Vascular / Sociedad Internacional de Cirugía Cardiovascular:
1. Pacientes sintomáticos por expansión aguda o ruptura independientemente del tamaño.
2. Aneurismas de 5 cm.
3. Aneurismas complicados con embolismos, trombosis o enfermedad vascular periférica sintomática.
4. Aneurismas atípicos (micóticos, saculares, o con disecciones) (4, 5).
La decisión terapéutica debe ser individual y basada en el conocimiento del riesgo de ruptura en función del diámetro del aneurisma, el riesgo del reparación electiva y la expectativa de vida. Se ha propuesto intervenirlos cuando su tamaño es de 5 cm, debido a que el riesgo de ruptura anual (3-15%) sobrepasa el riesgo de la reparación electiva en pacientes sin comorbilidades, que es de 5% (5, 6).
Riesgo de ruptura
Siguiendo la ley de Laplace donde la tensión de la pared de un cilindro es directamente proporcional a la presión y radio e inversamente proporcional al grosor de la pared, la variable que se puede cuantificar más fácilmente es el diámetro. Ya desde el siglo pasado se asociaba el tamaño del aneurisma con ruptura, y los datos de la literatura actual que estiman el riesgo de ruptura en función del diámetro: menores de 4 centímetros: 0% / año, entre 4 y 5 centímetros: 0,5-5% / año, entre 5 y 6 centímetros: 3-15% / año, entre 6 y 7 centímetros: 10-20% / año, entre 7 y 8 centímetros: 40% / año, más de 8 centímetros: 30-50% año; además del tamaño del aneurisma, la enfermedad pulmonar obstructiva crónica y la hipertensión son factores de riesgo independientes de ruptura. Los pacientes con AAA heredofamiliares aunque no se han demostrado ser un factor de riesgo independiente, tienen mayores tasas de ruptura (3, 5).
Riesgo de reparación electiva
La mortalidad electiva es menor de 5%; en un metaanálisis de Steyberg y cols.,(6) se identificaron 7 factores de riesgo independiente después de la reparación electiva: creatinina > 1,8 (OR: 3,3), falla cardíaca congestiva (OR: 2,3), isquemia en el ECG (OR: 2,2), disfunción pulmonar (OR: 1,9), edad avanzada (OR: 1,5), sexo femenino (OR: 1,5) (5, 6).
Expectativa de vida
Con base en estudios poblacionales, la edad es el mejor predictor. En los Estados Unidos, el promedio de vida de un adulto de 60 años portador de un AAA es de 18 años y a la edad de 85 años baja a 5 años; sin embargo, existen comorbilidades que disminuyen de manera significativa la supervivencia, como son: enfermedad coronaria, insuficiencia renal, hipertensión arterial y aterosclerosis periférica (5, 6).
Cuando se conoce el riesgo de ruptura en función del diámetro del aneurisma, el riesgo de reparación electiva y expectativa de vida, se ha propuesto su intervención cuando su tamaño es de 5 cm, o en el seguimiento crecen más de 1 cm/año, debido a que el riesgo de ruptura anual (3-15%) sobrepasa el riesgo de reparación electiva en pacientes sin comorbilidades: éste es 5% (5, 6).
Se denominan aneurismas pequeños los menores de 5 cm de diámetro. Dos estudios grandes aleatorios, United Kingdom Small Aneurysm y The Aneurysm Detection and Management Veterans Affairs Cooperative Study (ADAM) evaluaron su intervención inmediata y el manejo selectivo (cuando alcanzan 5 cm de diámetro, crecen más de 1 cm/año o desarrollan síntomas por expansión aguda o ruptura); las tasas de supervivencia oscilaron entre 60 y 70% en ambos grupos de tratamiento, tasas de ruptura entre 0,5 y 1% / año con el manejo selectivo y la mortalidad operatoria en los primeros 30 días entre 2,7 y 5,6%, mostrando que la cirugía electiva para pequeños aneurismas no mejora la supervivencia a los 6 años de seguimiento, que sólo el 38% en el seguimiento reúnen los criterios de tratamiento; por lo tanto, los aneurismas pequeños deben seguirse con ecografía y manejo selectivo. El problema se ha focalizado en que un porcentaje importante de aneurismas se rompen, aun con diámetro de 4 cm (6%) (7-10).
El ultrasonido es seguro, no invasivo y relativamente barato, pero tiene limitaciones propias del estudio: operador dependiente, interposición de gas y obesidad. Con el ultrasonido la variabilidad interobservador de menos de 5 mm es de 84% y con la tomografía de 91%, lo cual quiere decir que es más exacta la angiotomografía para la determinación precisa del diámetro, que puede tener valor para determinar el tamaño exacto de aneurismas entre 4 y 5 cm y cambiar la conducta terapéutica (7-10).
El objetivo de la vigilancia de aneurismas pequeños es evitar que alcancen un diámetro donde el riesgo de ruptura es alto. Una terapia médica efectiva reduce la tasa de crecimiento en más de un 50%, evitando que un aneurisma de 4 cm llegue a 5 cm en 5 años de seguimiento; el tabaquismo es el único factor de riesgo de expansión de un aneurisma; éste incrementa la tasa de expansión en un 25%. El control de otros factores de riesgo como la hipertensión, dislipidemias y diabetes evitan la progresión de la aterosclerosis, pero no han sido evaluadas en función del diámetro del aneurisma; el propranolol no reduce el crecimiento del aneurisma y puede empeorar la calidad de vida; los suplementos de vitaminas antioxidantes (alfatocoferol, betacaroteno o ambos) no reduce la incidencia de aneurismas o ruptura; la doxiciclina, un antibiótico efectivo contra la Clamidia pneumonie e inhibidor de las metaloproteinasas necesita un estudio grande aleatorio que muestre efectividad en reducir la tasa de expansión de los aneurismas (7-12).
Indicaciones
Basados en ensayos clínicos prospectivos, el manejo endovascular con endoprótesis del AAA es una alternativa a la cirugía convencional. En los Estados Unidos la FDA ha aprobado dos endoprótesis para uso clínico; cada una de estas técnicas tiene sus ventajas y limitaciones (12, 13).
- El tratamiento endovascular del AAA está indicado en pacientes con riesgo para manejo convencional. El Comité de Cirugía Endovascular de la Sociedad Americana de Cirugía Vascular ha definido como paciente de alto riesgo aquel paciente con riesgo de muerte de tres a cuatro veces el riesgo basal, teniendo en cuenta sus enfermedades cardíacas, pulmonares, hepáticas, abdómenes hostiles (cirugías previas y ostomías) e infección (13-15).
- A medida que ha habido un perfeccionamiento en el diseño y fabricación de las endoprótesis, demostrando mayor seguridad, se ha propuesto el reparo endovascular primario en pacientes con riesgo aceptable para el reparo convencional; sin embargo, el paciente debe conocer que los resultados a largo plazo son desconocidos, y que la tasa de fallas son mayores en el seguimiento a mediano plazo, conservando las ventajas de la cirugía mínimamente invasiva: menor dolor posoperatorio, corta estancia en UCI y hospitalaria, y tasas de morbimortalidad menores en los primeros 30 días de seguimiento.
- En aneurismas rotos, la conducta es preferentemente quirúrgica, pero con la excepción de casos muy selectos en la que la técnica endovascular puede ser la alternativa más conveniente.
En la revisión de la literatura actual existen dos estudios recientemente publicados que comparan la reparación convencional y la endovascular: Dutch Randomized Endovascular Aneurysm Management (DREAM), y un estudio del Reino Unido de Greenhalg y cols. (EVAR trial-1), donde se muestra para la reparación endovascular tiene menores tasas de mortalidad (1%), morbilidad, menor estancia hospitalaria y menor tiempo de recuperación a los 30 días, a pesar que con estos resultados no se puede concluir que el manejo endovascular sea mejor que el manejo convencional; sólo se ha evaluado el riesgo asociado a un tipo de reparación pero no el beneficio, y dos grandes ensayos europeos han mostrado tasas de falla de la endoprótesis de 3% / año (2% de conversión a reparación abierta y 1% de ruptura), lo cual es 10 veces la tasa de falla de las prótesis convencionales (0,3%), con tasas de intervención secundarias después de la intervención de 10% por año (15-18).
Ninguna comparación de tratamientos puede ser completa sin considerar los costos. Numerosos estudios han encontrado el tratamiento endovascular más costoso, principalmente debido al costo de las endoprótesis (cerca de 13.000 dólares por paciente); además, el seguimiento requiere una angiotomografía cada año de por vida, la cual puede afectar de manera significativa las ventajas iniciales sobre la cirugía abierta. Finalmente, los autores de EVAR Trial-1 recomiendan: "Los hallazgos encontrados requieren una evaluación científica de la terapia endovascular y no cambia la práctica clínica cotidiana" (15-18). Debe confesarse que las reparaciones abiertas no han sufrido seguimientos rutinarios mediante imágenes y que éstos no están exentos de complicaciones a largo plazo.
Se necesita mayor tiempo de seguimiento en los estudios que comparan la reparación convencional y endovascular, además del DREAM y EVAR Trial-1, otros estudios están realizándose, The Veterans Affaire Open vs. Endovascular Repair (OVER) y el French Aneúrisme de l'aorte abdominale: Chrirurgie vs. Endoprothèse (ACE). Aun si el tratamiento endovascular muestra superioridad por algunos años sobre el reparo convencional, el óptimo tratamiento para pacientes jóvenes es incierto hasta que conozcamos cómo se comporta la reparación endovascular en un seguimiento por décadas (17, 20).
Últimamente ha tomado interés la determinación del pico de estrés máximo en la pared del aneurisma mediante un sofware vascular adaptado a un equipo de angiotomografía. En un reporte reciente se relacionan aneurismas con picos de estrés máximo mayores de 44 dinas/cm2 con ruptura. Esto es un modelo experimental, todavía no aplicable en la clínica, pero posiblemente nos ayudará a predecir qué aneurismas tienen riesgo inminente de ruptura y ameritan tratamiento prioritario (20, 21).
La reparación endovascular de AAA de aneurismas rotos es posible. Veith y su grupo de Montefiore han publicado su experiencia con 36 pacientes con anatomía favorable, con reanimación hipotensiva y utilización selectiva de balón de oclusión en la aorta proximal, siendo posible en 30 de 36, mortalidad operatoria 4 pacientes (11%), lo cual lo convierte en una alternativa en pacientes con AAA roto (18, 19).
Limitaciones
Clínicas
La diferencia de morbimortalidad de la corrección del AAA mediante técnicas endovasculares en contra de la cirugía abierta hace que todas las limitaciones por enfermedades crónicas del paciente, como insuficiencia cardiorrespiratoria, mala función renal, enfermedades mentales, sean motivo de nueva evaluación, puesto que no sólo el acto terapéutico sino las formas de sedación del enfermo y las posibilidades de realización de la técnica sin contraste yodado facilitan su indicación.
Los diferentes tipos de anestesia, como la radicular o local, permiten operar a estos enfermos sin el riesgo de una anestesia general. Hoy en día no debe existir limitación por la edad teniendo en cuenta lo que afecta a un grupo familiar el conocer que un miembro está diagnosticado de AAA y no se le opera por riesgo quirúrgico. Hoy en día con cirugía mínimamente invasiva (CMI) esta limitación no debe existir.
Situación similar ocurre cuando existe una rotura contenida en pacientes de alto riesgo por sus comorbilidades. En esta situación se plantea el no hacer nada en caso que el enfermo sobreviva, pero es difícil que los familiares decidan llevárselo del hospital en estas circunstancias, por lo que debe valorarse la corrección de la rotura (figura 1).
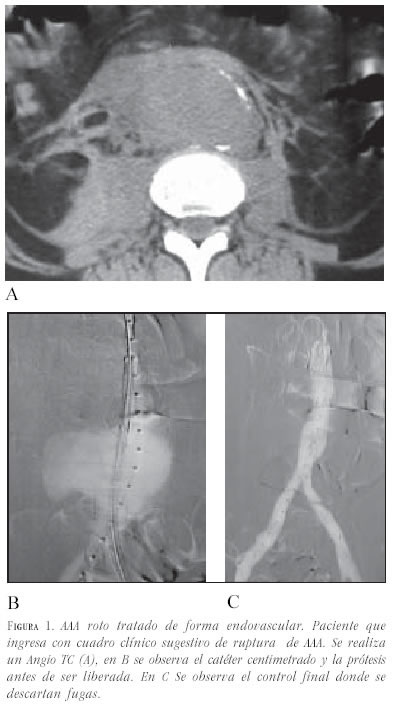
Se está valorando el tratamiento de AAA por debajo de 5 cm7, pero hay que tener en cuenta el estado del paciente en cuanto a su percepción del problema, es decir, si el enfermo limita en algún sentido su vida al tener conocimiento del problema. Habría que replantear las ventajas de un AAA operado en situaciones de fácil manejo por el tamaño y estado general del paciente.
Cuando existen casos de ruptura, las posibilidades de supervivencia ya han sido comentadas con anterioridad, lo que demuestra que llegando al hospital el índice de mortalidad es menor; pero si además se aplica cirugía endovascular, las probabilidades de supervivencia de un AAA roto aumentan considerablemente.
El uso de prótesis bifurcadas o monoilíacas dependerá de las posibilidades técnicas, tanto por experiencia como por disponibilidad de material. En la actualidad las series publicadas hacen mayor referencia al uso de los monoilíacos, sin que se aprecien mejores resultados que con el bifurcado, ya que los tiempos de implante son similares teniendo en cuenta que también obliga a un bloqueo de una de las ramas ilíacas y al posterior puente femorofemoral.
Morfológicas
No todos los AAA son susceptibles de tratamiento endoluminal. Estas limitaciones están relacionadas con la factibilidad de colocación de la endoprótesis, pero fundamentalmente con el mayor riesgo de presentar complicaciones inmediatas y tardías. Las limitaciones deben ser valoradas individualmente teniendo en cuenta la experiencia del grupo operador, los factores de riesgo que presenta el paciente para la cirugía abierta y el riesgo de ruptura del aneurisma. Los mayores determinantes de la posibilidad de reparación endovascular son el diámetro, la longitud del cuello proximal, y las vías de abordaje del sector iliofemoral.
Para su estudio las dividiremos en las limitadas al cuello o proximales y al segmento iliofemoral o distales.
Morfológicas del cuello proximal
La anatomía del cuello proximal determina la efectividad de la exclusión y la durabilidad de la adhesión del dispositivo a la pared. Ello influencia, por tanto, el resultado inmediato y a largo plazo.
Los parámetros a valorar son:
- Longitud: se extiende desde la arteria renal principal más caudal hasta donde comienza el aneurisma. La longitud mínima aceptable para dispositivos de fijación infrarrenal es de 15 mm, aunque algunos comienzan a insistir en la viabilidad de los cuellos de longitud de 10 mm y menores.
- Diámetro: es una medida que va en función del tamaño de las endoprótesis disponibles. Se acepta universalmente que siempre se debe sobredimensionar el tamaño de la prótesis en un 10 a 20% respecto al diámetro del cuello en el lugar de sellado. Hoy en día es factible tratar con éxito cuellos de hasta 30/32 mm de diámetro.
- Angulación: se define como el ángulo formado entre el cuello aórtico proximal y el eje longitudinal principal del aneurisma. El eje del aneurisma se define como la línea que va desde la porción proximal del aneurisma, o extremo distal del cuello proximal, hasta la bifurcación ilíaca. Se clasifica en leve cuando va de 0 a 30°, moderada cuando es de 30-60°, y severa cuando es mayor de 60°. La angulación del cuello proximal puede ser perjudicial cuando supera los 50° y cuando es mayor de 60°, generalmente se considera una contraindicación relativa para el tratamiento endovascular. El Cómite Endoluminal de la Sociedad de Cirugía Vascular / Sociedad Internacional de Cirugía Cardiovascular recomienda angulaciones máximas en el cuello de 120 grados (figura 2).
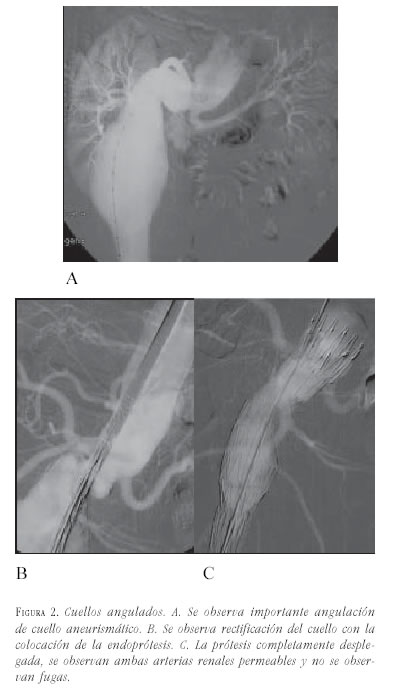
Los cuellos angulados deberán ser sometidos a una serie de pruebas para conocer su comportamiento, mediante la colocación de las guías rígidas y/o introductores para estimar su corrección.
Se recomienda el uso de prótesis de fácil desplazamiento y con fijación suprarrenal. En estos casos es conveniente que el cuello tenga una longitud superior a los 15 mm, porque sin duda se perderá parte del mismo durante las maniobras de soltura al hacerlo de forma asimétrica.
También es muy importante controlar la posición de las arterias renales, porque en estos casos es dificil de visualizar su origen correcto. En general los cuellos tienen dos desplazamientos: anterior o lateral; éstos últimos son más fácilmente corregibles.
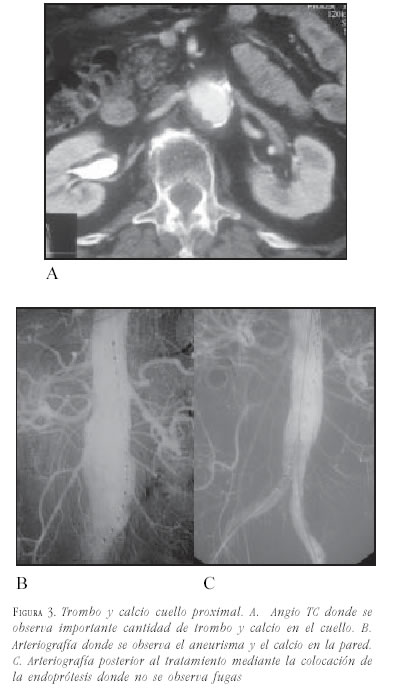
- Trombo mural: la presencia de un trombo mural extenso puede no permitir un sellado seguro a largo plazo en el cuello proximal (12-14). Se debe ser cuidadoso en las maniobras de liberación y dilatación a fin de evitar embolias. De acuerdo con los estándares publicados, se acepta como máximo la presencia de trombo cuyo espesor sea menor de 2 mm y que comprometa menos del 25% de la circunferencia aórtica.
- Calcificación: la presencia de calcificación circunferencial en el cuello se reconoce como un factor pronóstico negativo de adecuado sellado, dejando fugas tipo 1. Se acepta como máximo tolerable sin riesgos la calcificación mural lineal menor del 25% de la circunferencia (figura 3).
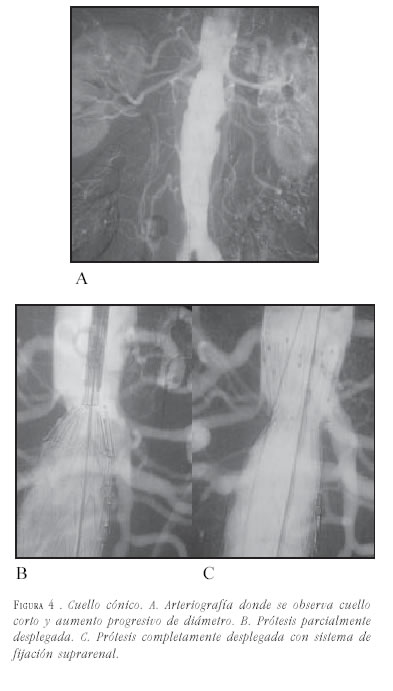
- Cónicos: cuando el cuello se ensancha en sentido distal constituye una contraindicación relativa para el tratamiento endovascular, se considera que la conicidad impide una buena aposición entre la endoprótesis y la pared del vaso, pudiendo predisponer a migraciones y a la presencia de fugas tipo 1. Se considera presente la conicidad en caso de un incremento mayor del 10% en el diámetro del vaso en una longitud de 15 mm en el cuello aórtico proximal.
Los cuellos cónicos tienen difícil tratamiento, y en caso de tratarse, se debe elegir una prótesis que permita una fijación suprarrenal y posteriormente elegir el diámetro de acuerdo con el diámetro más distal al origen de las arterias renales, entre 15 y 20 mm de longitud, recomendados como diámetro de elección de la prótesis, haciendo que ésta se vaya aplicando a la pared conforme se acerca al aneurisma (figura 4).
- Dobles: las limitaciones producidas por cuellos que pueden ser definidos como dobles, están referidas a las posibilidades de sellar el segundo cuello, siempre considerando que el segmento dilatado entre los dos cuellos debería estar recubierto por la prótesis, es decir, el diámetro que se elija debería ser como mínimo el diámetro del segmento indicado.
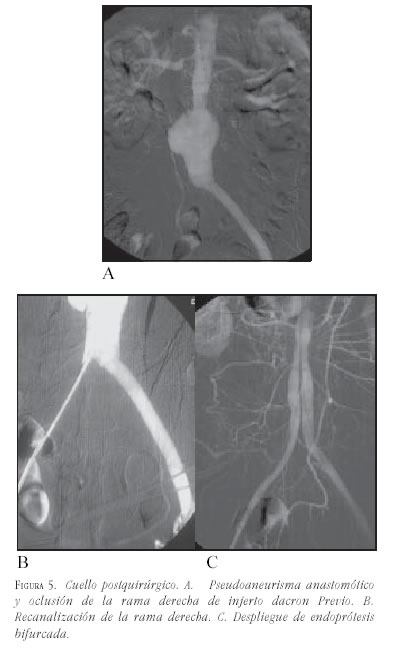
- Posquirúrgico: las dilataciones que se producen entre las arterias renales y una prótesis ya implantada quirúrgicamente en general no tienen cuello, lo cual sería una limitación; pero el sólo recubrimiento de la pared impide que el flujo choque directamente sobre la pared arterial y sí sobre el injerto, hace esto que sea una indicación para evitar la progresión del segmento dilatado (figura 5).
Morfológicas del segmento iliofemoral
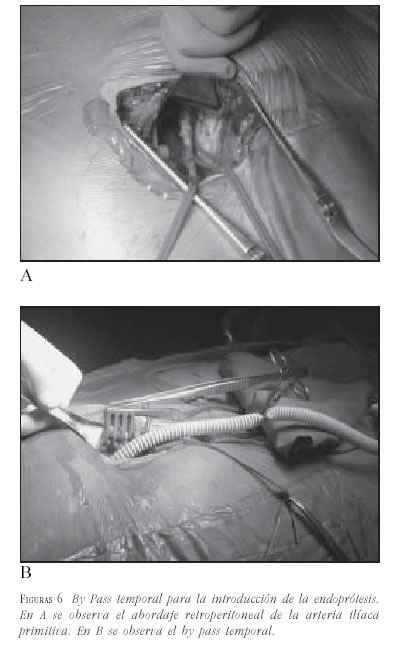
- Diámetro de las arterias ilíacas: se debe evaluar el diámetro de las arterias ilíacas tanto para el paso del transportador de la endoprótesis, como para calcular el diámetro de la rama que asegure el adecuado sellado en el punto de contacto. El diámetro mínimo para el paso del transportador es de 7,5 mm. En casos de diámetro menor a 7,5 mm, estenosis severa u oclusión, deberán ser tratados previamente con angioplastia. Si la gran cantidad de calcio o el pequeño diámetro en toda su longitud impiden el avanzar el transportador, se puede realizar un by pass temporal a la arteria ilíaca, dejando un extremo libre que permita pasar la endoprótesis. Se describe esta técnica más adelante en este artículo.
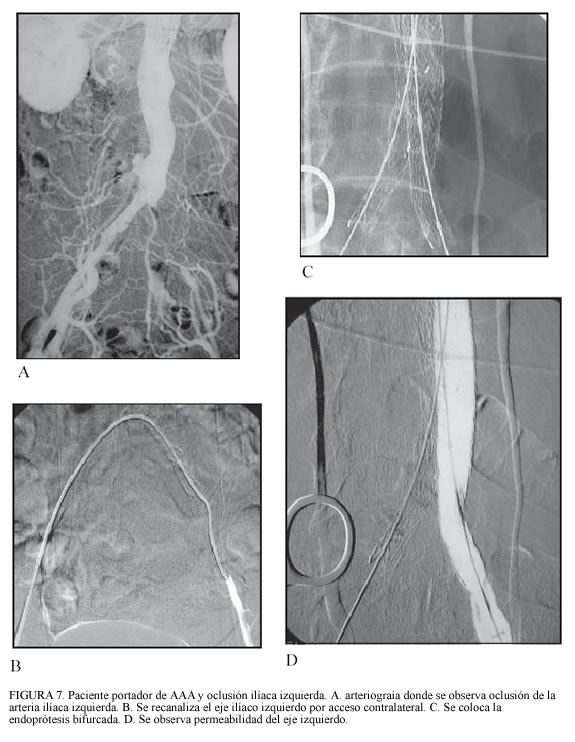
En casos de oclusión completa de un eje ilíaco, se puede intentar su recanalización; cuando ésta resulte infructuosa, se utiliza una endoprótesis monoilíaca y un puente femorofemoral (23).
- Tortuosidad ilíaca: cierto grado de tortuosidad en la arteria ilíaca externa puede ser rectificada mediante el uso de las guías rígidas; pero la tortuosidad severa en la arteria ilíaca común puede ser más difícil de manejar debido a la fijación de este segmento por la bifurcación ilíaca y la arteria hipogástrica. Existe un índice de tortuosidad ilíaca que compara la distancia entre la línea central de la luz de la arteria femoral común y la bifurcación aórtica y una línea recta entre los mismos puntos anatómicos. El ángulo ilíaco es el más agudo en el trayecto entre la femoral común y la bifurcación aórtica. Se cuantifica en una escala de 0 a 3 que combina el índice de tortuosidad y el ángulo más agudo, la angulación máxima recomendada en las ilíacas es de 90 grados (12, 20) (figura 6).
- Aneurismas ilíacos: cuando el aneurisma compromete únicamente la porción proximal de la arteria ilíaca común, se puede tratar de forma endovascular siempre que la zona de contacto distal presente calibre y longitud adecuados en la porción distal de esta arteria.
Cuando el aneurisma compromete la bifurcación ilíaca o la arteria hipogástrica, puede no haber zona de contacto en la arteria ilíaca común. En este caso es pertinente extender la rama de la endoprótesis hasta la arteria ilíaca externa, y es mandatario embolizar la arteria hipogástrica proximal con espirales metálicos para prevenir la perfusión del saco aneurismático por fugas a partir de la arteria ilíaca interna.
- Calcificación ilíaca: la calcificación severa del eje ilíaco puede comprometer la capacidad de la endoprótesis para sellar en el punto de contacto distal y predisponer a las fugas tipo 1. Adicionalmente, la calcificación asociada a tortuosidad puede limitar seriamente la capacidad de estos vasos para servir como acceso para el transportador de la endoprótesis.
- Anatomía de la arteria femoral común: ambas arterias femorales comunes constituyen la puerta de entrada para todos los elementos necesarios para la implantación de la endoprótesis. El calibre mínimo que va del vaso para permitir el paso del transportador es de 7,0 a 7,5 mm, y debe considerarse el punto de entrada libre de calcificación mayores que hagan posible el abordaje, el paso de los instrumentos y la posterior sutura del punto de arteriotomía.
Se puede observar que actualmente muchas de las limitaciones del tratamiento endovascular del AAA están basadas en la experiencia del operador.
- Otras limitaciones: muchas veces se considera como limitación para el uso de la técnicas endovasculares versus las abiertas, el costo de las prótesis y de las tecnologías que se emplean en su implante. No obstante la extensión de los procedimientos, su uso, y la disminución de la estancia, morbilidad, más rápida reintegración social, hacen que el costo sin ser algo de lo que nos podamos sustraer sea cada vez una limitación menor (23).
Referencias
1. Ailawadi G, Eliason JL, Upchurch GR, Jr. Current concepts in the pathogenesis of abdominal aortic aneurysm. J Vasc Surg. 2003; 38: 584-588. [ Links ]
2. Bickerstaff LK, Hollier LH, Peenen HJ Goes, Melton LJ 3rd, Pairolero PC, O´Fallon WM. Abdominal aortic aneurysms: the changing natural history. J Vasc Surg. 1984; 1: 6-12. [ Links ]
3. JL Cronenwett, WC Krupski, RB Rutherford: Abdominal Aortic and Iliac Aneurysm. In: Vascular Surgery. Fifth Ed. 2000; 1246-1280. [ Links ]
4. Ahn SS, Rutherford RB, Johnston KW. Reporting standards for infrarenal endovascular abdominal aortic aneurysm repair. Ad Hoc Committee for Standardized Reporting Practices in Vascular Surgery of The Society for Vascular Surgery/International Society for Cardiovascular Surgery. J Vasc Surg. 1997; 25: 405-410. [ Links ]
5. Hollier LH, Taylor LM, Ochsner J: Recommended indications for operative treatment of abdominal aortic aneurysms. Report of a subcommittee of the Joint Council of the Society for Vascular Surgery and the North American Chapter of the International Society for Cardiovascular Surgery. J Vasc Surg. 1992; 15: 1046-1056. [ Links ]
6. Steyberg EW, Kievit J, Alexander Mol Van, Otterloo JC. Perioperative mortality of elective abdominal aortic aneurysm surgery. A Clinical prediction rule based on literature and individual patient data. Arch Intern Med 1995; 155: 1998-2004. [ Links ]
7. The UK Small Aneurysm Trial Participants Mortality results for randomized controlled trial of early elective surgery or ultrasonographic surveillance for small abdominal aortic abdominal aneurysm. Lancet 1998; 352: 1649-1655. [ Links ]
8. The United Kingdom Small Aneurysm Trial Participants. Long-term outcomes of immediate repair compared with surveillance for small abdominal aortic aneurysms. N Engl J Med 2002; 346: 1445-1452. [ Links ]
9. Lederle FA, Wilson SE, Johnson GR, Reinke DB, Littooy FN, Acher CW, et al. Immediate repair compared with surveillance small abdominal aortic aneurysms. N Engl J Med 2002; 346: 1437-1444. [ Links ]
10. Brady AR, Fowkes FG, Greenhalgh RM, Powell JT, Ruckley CV, Thompson SGl. Risk factors for postoperative death following elective surgical repair of abdominal aortic aneurysm: results from the UK Small Aneurysm Trial. On behalf of the UK Small Aneurysm Trial participants. Br J Surg. 2000; 87: 742-749. [ Links ]
11. Brown PM, Pattenden R, Vernooy C, Zelt DT, Gutelius JR. Selective management of abdominal aortic aneurysms in a prospective measurement program. J Vasc Surg. 1996; 23: 213-20. [ Links ]
12. Parodi JC, Ferreira LM, Garelli G. Endoprótesis en los aneurismas de aorta abdominal. En: Diagnóstico y terapéutica endoluminal. Maynar M y Carreira JM. Ed. Masson 2002. [ Links ]
13. May J, White GW. Endovascular treatment of aortic aneurysm. In: Vascular surgery. Fifth Ed. 2000; 1281-1295. [ Links ]
14. Rutherford RB, Krupski WC. Current status of open versus endovascular stent- graft repair of abdominal aortic aneurysm. J Vasc Surg 2004; 39: 1129-1139. [ Links ]
15. Jordan WD, Alcocer F, Wirthlin DJ, Westfall AO, Whitley D. Abdominal aortic aneurysm. In: "High risk", surgical patients. Comparison of open and endovascular repair. Ann Surg 2003; 237: 623-630. [ Links ]
16. Prinssen M, Verhoeven ELG, Buth J, Cuypers PW, Van Sambeek MR, Balm R et al. A Randomized trial comparing conventinal and endovascular repair of abdominal aortic aneurysms for the dutch randomized endovascular aneurysm management (DREAM) Trial Group*. N Engl J Med 2004; 351: 1607-1618. [ Links ]
17. Lederle F: Editorials abdominal aortic aneurysms - Open vs. Endovascular repair. N Engl J Med 2004; 351: 1676-1679. [ Links ]
18. Veith F, Ohki T, Lipsitz EC. Treatment of ruptured abdominal aneurysms with stent grafts: a new gold standard? Seminars in Vascular Surgery 2003; 16: 171-175. [ Links ]
19. Veith F, Ohki T, Lipsitz EC. Endovascular grafts and other catheter-directed techniques in the management of ruptured abdominal aortic aneurysms. Seminars in Vascular Surgery 2003; 16: 326-331. [ Links ]
20. Greengage RM, Brown LC, Kwong GP, Powell JT, Thompson SG. Comparison of endovascular aneurysm repair with open repair in patients with abdominal aortic aneurysm (EVAR trial 1), 30-day operative mortality results: randomised controlled trial. Lancet 2004; 364: 843-848. [ Links ]
21. Fillinger MF, Marra SP, Baghavan ML, Cronenwett JL, Kennedy FE. Prediction of Rupture Risk. In: Abdominal aortic aneurysm during observation: Wall stress vs. diameter. J Vasc Surg 2003; 37: 724-732. [ Links ]
22. Fillinger MF, Marra SP, Baghavan ML, Cronenwett JL, Kennedy FE. In vivo analysis of mechanical wall stress and abdominal aortic aneurysm rupture risk. J Vasc Surg 2002; 36: 689-697. [ Links ]
23. Maynar M, Zander T, Qian Z, Rostagno R, Llorens R, Zerolo I, Kirsch D, Sorrells L, Castaneda WR. Bifurcated endoprosthesis for treatment of aortoiliac occlusive lesions. J Endovasc Ther. 2005; 12: 22-27. [ Links ]














