Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582On-line version ISSN 2619-6107
rev. colomb. cir. vol.23 no.4 Bogotá Oct./Dec. 2008
(1) Internista, Gastroenterólogo. Departamento de Medicina. Universidad Nacional.
Correspondencia: Martín Gómez, MD, Bogotá, Colombia. Correo electrónico: magomezz@unal.edu.co
Fecha de recibo: 2 de abril de 2008. Fecha de aprobación: 5 de octubre de 2008.
Resumen
La ecoendoscopia es un examen que combina la imagen de endoscopia con la ecográfica para valorar no sólo las lesiones del interior de la luz sino las lesiones que rodean al tubo digestivo. Es fundamental en la valoración de los pacientes con lesiones benignas, como la mayoría de los tumores subepiteliales, y en la de pacientes con coledocolitiasis. Su principal papel es la estadificación de pacientes con cáncer de esófago, gástrico, pulmonar, páncreas y rectal. En la mayoría de los pacientes con cáncer gastrointestinal, con el examen se busca realizar un diagnóstico y un estudio de extensión que permita tomar una conducta endoscópica, quirúrgica o paliativa. En comparación con otros exámenes, como la tomografía computadorizada, con la ecoendoscopia se logra obtener un diagnóstico más rápidamente y costo-efectivo, lo cual permite un enfoque más racional de estos pacientes.
Un servicio de ecoendoscopia es fundamental en un hospital de tercer nivel y sus indicaciones deben ser plenamente conocidas por los médicos, por tal motivo se hizo esta revisión que busca mostrar cuáles son las indicaciones diagnósticas de este examen a la luz de la evidencia actual.
Palabras clave: Ultrasonografía, diagnóstico, esófago, estómago, páncreas, colédocolitiasis.
Abstract
Endoscopic ultrasound -or endosonography, or gastrointestinal endoscopic ultrasound- is a procedure that, by means of a transductor located at the tip of an endoscope, is increasingly utilized for the evaluation of lesions in the gastrointestinal tract and surrounding anatomic spaces. This technology makes possible the evaluation of lesions located not only in the esophagus, stomach, duodenum and rectum, but also in the mediastinum, lung, pancreas, liver gallbladder, adrenal glands, ovaries, etc.
Key words: ultrasonography, diagnosis, esophagus, stomach, pancreas, choledocholithiasis.
Introducción
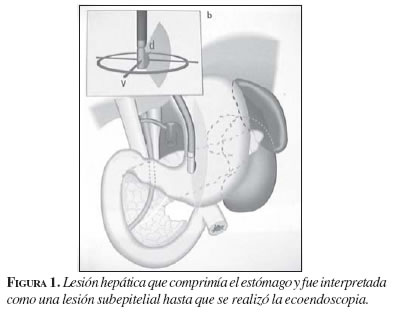
La ecoendoscopia, también denominada ultrasonido endoscópico, endosonografía o ultrasonografía digestiva, es un examen que, mediante un transductor colocado en la punta de un endoscopio, permite evaluar lesiones ubicadas en la pared del tubo digestivo o en los espacios que éste atraviesa. De tal forma, podemos no sólo evaluar las lesiones que hay en esófago, estómago, duodeno y recto, sino también, en mediastino, pulmón, páncreas, hígado, vesícula biliar, glándulas suprarrenales, ovarios, etc. (figuras 1 y 2).

En la ecoendoscopia se utilizan equipos radiales, lineales o minisondas, según las características de la lesión o a las necesidades del examen (figura 3). Los equipos radiales permiten obtener una visión oblicua (la cual dificulta ligeramente la visión endoscópica) y una imagen ecográfica de 360 grados. Los primeros equipos tenían frecuencias de 7,5 y 12 mHz, pero ahora hay equipos que tienen frecuencias de hasta 20 mHz, con el transductor siempre situado en la punta del equipo. El endosonógrafo radial es el más utilizado para los exámenes diagnósticos. Cuando la ecografía con este equipo se realiza con las frecuencias de 7,5 o 12 mHz, divide la pared de todo el tubo digestivo en las siguientes cinco capas (1) (figura 4):

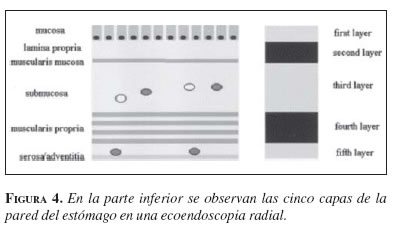
1. primera capa hiperecoica, corresponde a la parte más superficial de la mucosa gástrica;
2. segunda capa hipoecoica, corresponde a la parte profunda de la mucosa que puede correlacionarse con la muscular mucosa;
3. tercera capa hiperecoica, corresponde a la capa submucosa;
4. cuarta capa hipoecoica, corresponde a la muscular propia, y
5. quinta capa hiperecoica, corresponde a la capa serosa o adventicia.
Cuando se utilizan transductores de mayor frecuencia, la resolución es mayor y se pueden observar hasta nueve capas, y se detallan principalmente la capa mucosa y la muscular.
El endosonógrafo lineal sólo trabaja con una frecuencia de 7,5 mHz y permite también una visión endoscópica oblicua, pero la imagen ecográfica es de sólo 160 grados, con el fin de seguir la orientación de la aguja de punción (figura 5). En nuestro concepto, éste es el equipo más completo, ya que permite hacer ecoendoscopia diagnóstica y también terapéutica: con el uso de agujas de 22G o 19G, se pueden tomar biopsias de lesiones de la pared o adyacentes a ella (mediastino, páncreas, glándula suprarrenal, etc.) y también, es posible el drenaje de diferentes colecciones o de la vía biliar (2).

Una minisonda es una especie de catéter que en la punta tiene un transductor de ecografía y que, dado su tamaño, puede introducirse por el canal de trabajo de los endoscopios (idealmente de doble canal); es muy útil para el diagnóstico de lesiones menores de un centímetro que estén en la pared del tubo digestivo.
Recientemente se han introducido equipos electrónicos que tienen una tecnología diferente, con disponibilidad de Doppler arterial y venoso, además de una mejor resolución de la imagen.
La preparación para el examen endosonográfico es similar a la necesaria para la endoscopia digestiva alta. El paciente debe tener un ayuno mínimo de 8 horas y, si se va a someter a un procedimiento terapéutico, el TP y el TPT deben ser normales. El paciente se coloca en decúbito lateral izquierdo, con oxígeno por vía nasal, monitoría de signos vitales y oximetría antes de iniciar la sedación, la cual usualmente se logra con propofol endovenoso o una combinación de fentanilo con midazolam. Es importante anotar que, si el paciente así lo quiere y la ecoendoscopia es de esófago, estómago o recto, puede realizarse sin sedación debido al corto tiempo del examen. La ecoendoscopia de páncres, vías biliares o con punción dura de 30 a 45 minutos, según su dificultad, por lo cual siempre se hace con sedación.
Indicaciones
Cada día las publicaciones sobre la ecoendoscopia son más frecuentes e informan nuevas indicaciones para este examen, lo cual lo convierte en una herramienta indispensable en un servicio de cirugía y de gastroenterología (3). Existen indicaciones diagnósticas, las cuales usualmente se hacen con un equipo radial, e indicaciones terapéuticas, que se hacen con un equipo lineal. En esta revisión nos limitaremos a las principales indicaciones diagnósticas y en una próxima entrega revisaremos las indicaciones terapéuticas. Para propósitos prácticos, evaluaremos cada uno de las indicaciones de acuerdo con los diferentes tipos de ecoendoscopias que se pueden realizar.
I. Ecoendoscopia esofágica
Este examen se solicita para evaluar los siguientes tipos de lesiones:
1. Acalasia
La acalasia es un trastorno motor del esófago. Hay enfermedades estructurales, como los tumores primarios o metastáticos de la unión esófago-gástrica, que pueden producir un cuadro clínico similar a la acalasia, denominado seudoacalasia. La ecoendoscopia permite determinar si el cuadro se debe a una seudoacalasia, al poder evaluar si sólo existe engrosamiento de la capa muscular propia o si hay infiltración por otra alteración. Se han reportado múltiples casos en los cuales inicialmente se pensaba que se trataba de una acalasia primaria del esófago, pero con los estudios se demostró que se trataba de seudoacalasia. Las principales causas reportadas son tumores gastrointestinales, tumores pulmonares y linfoma (4).
2. Tumores submucosos o compresiones extrínsecas
Este examen sirve para determinar si una lesión se debe a una compresión extrínseca del esófago (aorta) o a un tumor de la pared; de igual forma, permite definir la capa de la pared donde asienta la lesión y si se puede resecar por vía endoscópica.
3. Masas o lesiones del mediastino
La ecoendoscopia esofágica permite determinar si hay lesiones o ganglios en el mediastino anterior, a los lados de la tráquea o en el mediastino posterior, y su relación con las estructuras vecinas, así como su composición (sólida, quística, etc.) (5).
4. Estadificación del cáncer pulmonar
El de pulmón es la causa más común de mortalidad relacionada con cáncer en los Estados Unidos, con una incidencia anual de 170.000 casos y 154.000 muertes (6). Las estrategias de manejo se basan en el tipo histológico (carcinoma de células pequeñas y de células no pequeñas) y en la presencia de invasión mediastinal o a distancia del tumor.
La estatificación de la lesión es fundamental, no sólo para establecer el pronóstico, sino para orientar la conducta terapéutica. Usualmente se adopta la clasificación del American Joint Committee on Cancer, la cual se puede resumir así: cuando la lesión no invade el mediastino, se clasifica como estadio I o II y se indica manejo quirúrgico; si hay compromiso de los ganglios ipsilaterales, es un estadio IIIA y su manejo es controversial; algunos grupos dan manejo quirúrgico y otros dan quimiorradioterapia; si hay compromiso de ganglios contralaterales o invasión directa al mediastino, es un estadio IIIB, se indica quimiorradioterapia y tiene una supervivencia a 5 años menor de 5%.
Esta clasificación nos deja ver la importancia de detectar el número y la localización de las adenopatías mediastinales asociadas al cáncer pulmonar (figura 18). Por ello, existen múltiples métodos diagnósticos para estadificar a los pacientes con cáncer pulmonar. Entre otros, está la tomografía axial computadorizada (TC), pero su utilidad para caracterizar el tamaño y la localización de las adenopatías asociadas al tumor es limitada pues tiene una sensibilidad y una especificidad de sólo el 70%. La tomografía por emisión de positrones (PET) tiene una precisión del 85%. Sin embargo, tiene limitaciones por el gran número de falso negativos en tumores que tienen poca actividad metabólica o con ganglios menores de un centímetro. La broncoscopia con biopsia transbronquial es muy segura y bien tolerada, con una sensibilidad de 60% a 70%, pero sólo se puede acceder a los ganglios ubicados en el espacio subcarinal o en el hilio y es incapaz de llegar a la ventana aorto-pulmonar o al mediastino posterior. La mediastinoscopia y la toracoscopia son métodos diagnósticos de estadificación muy precisos, pero son costosos e invasivos y requieren anestesia general (7).
5. Cáncer esofágico
La evaluación por ecoendoscopia de los pacientes con cáncer esofágico es de fundamental importancia, tanto para el de tipo escamoso como para el de tipo adenocarcinoma. Cuando la ecoendoscopia muestra que los tumores están limitados a la capa mucosa, es decir, son tumores tempranos (figura 6), éstos son susceptibles de tratamiento endoscópico mediante mucosectomía endoscópica. No obstante, en los casos de neoplasias avanzadas desde el punto de vista local y regional (estadios IIB y III), la aplicación de tratamiento neoadyuvante mediante la combinación de radioterapia y quimioterapia ha demostrado ser superior a la cirugía aislada o asociada a radioterapia en cuanto a efecto antitumoral, posibilidad de resección, desarrollo de metástasis a distancia y probabilidad de supervivencia libre de enfermedad (8).
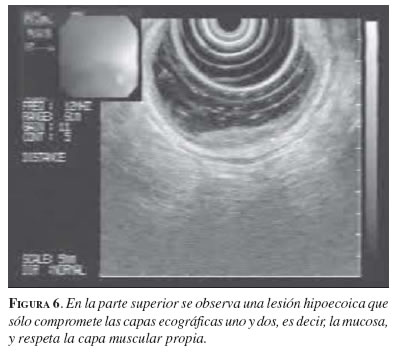
Por lo tanto, para clasificar a cada paciente dentro del grupo de tratamiento que le corresponde, es imprescindible realizar una estadificación lo más correcta posible en el momento del diagnóstico de la neoplasia. Clásicamente, múltiples estudios han demostrado la superioridad de la ecoendoscopia con respecto a la TC no helicoidal en el diagnóstico de extensión local y regional de esta neoplasia. En los últimos años, la aparición de la TC helicoidal ha acortado estas diferencias, aunque más recientemente la posibilidad de realizar punción guiada por ecografía de las adenopatías ha demostrado que esta técnica sigue siendo superior a las técnicas clásicas, incluso en la estadificación N (9). La precisión diagnóstica de la ecoendoscopia para el estadio T es de 75% a 90% y, entre 70% y 80% para el estadio N. Algunos fenómenos, como la inflamación peritumoral, pueden dificultar la correcta valoración del grado de infiltración del tumor y condicionar una supraestadificación T.
II. Ecoendoscopia gástrica
Se utiliza para evaluar pacientes que tienen las siguientes lesiones.
1. Pliegues gástricos engrosados
En caso de engrosamiento de pliegues gástricos, la ecoendoscopia permite identificar claramente las diferentes capas de la pared, evaluar la estructura de cada una de ellas, determinar cuáles están involucradas y complementar los hallazgos de la endoscopia. También puede excluir que el engrosamiento sea de origen vascular y, de esta manera, evitar una biopsia que implicaría un altísimo riesgo de complicaciones hemorrágicas. La Sociedad Europea de Endoscopia recomienda que la ecoendoscopia preceda la toma de biopsias en todos los casos de pliegues gástricos engrosados que puedan sugerir la existencia de vasos subepiteliales grandes.
En los pliegues hiperplásicos y en la enfermedad de Menetrier, usualmente, sólo se engrosa la capa mucosa, mientras que en los procesos malignos, como los linfomas y la linitis plástica, se involucran todas las capas destruyendo la pared.
Si la ecoendoscopia demuestra engrosamiento mucoso, se podrían hacer macrobiopsias para el diagnóstico. Si se encuentran alteraciones sugestivas de malignidad, se podría estar en presencia de linitis plástica y se recomendaría tratamiento quirúrgico (10).
2. Tumores submucosos o compresiones extrínsecas
Existen muchos tipos de lesiones en el tubo digestivo que pueden catalogarse como subepiteliales y cuya etiología depende en gran parte de si la lesión está ubicada en esófago, estómago, duodeno o recto.
El siguiente punto que se debe considerar es si se trata verdaderamente de una lesión de la pared o si es una compresión extrínseca, ya que a lo largo de todo el tubo digestivo hay diferentes estructuras que de manera normal o patológica pueden producir compresión. La estructura normal que más frecuentemente produce compresión en el estómago es el bazo, o los vasos esplénicos, la cual usualmente se identifica en el fondo gástrico. Las alteraciones que producen compresión extrínseca pueden ser los tumores pulmonares, en el esófago, y los tumores pancreáticos, en el estómago o el duodeno. Las lesiones pancreáticas generalmente comprimen la pared posterior del estómago, las hepáticas comprimen la pared anterior del estómago y una vesícula biliar muy dilatada puede causar compresión del antro gástrico o del duodeno.
Todas las lesiones subepiteliales deben ser valoradas por ecoendoscopia. Aunque algunos autores (11) señalan que si una lesión es menor de un centímetro y de coloración amarilla, no amerita ser valorada por la alta probabilidad de que sea un lipoma, en nuestra práctica clínica hemos valorado muchas lesiones de este tipo y han resultado ser tumores carcinoides (observaciones sin publicar).
Cuando se ha determinado que la lesión depende de la pared y no es una compresión extrínseca, es necesario evaluar a qué capa corresponde.
Normalmente no hay lesiones en la capa uno ni en la capa cinco, por lo cual las lesiones sólo se limitan a tres capas y usualmente son hipoecoicas, anecoicas o hiperecoicas.
Capa ecográfica dos
Corresponde a la parte más profunda de la mucosa o a la lámina propia y a la muscularis de la mucosa. Las lesiones que se originan en esta capa son poco frecuentes y, generalmente, son hipoecoicas. La mayoría de los tumores que se originan en esta capa son musculares, usualmente leiomiomas y, generalmente, son benignos (figura 7). También se pueden originar en esta capa los carcinoides que generalmente pueden estar en el fondo gástrico o en el recto. Las lesiones anecoicas de esta capa pueden corresponder a quistes de inclusión o de retención.
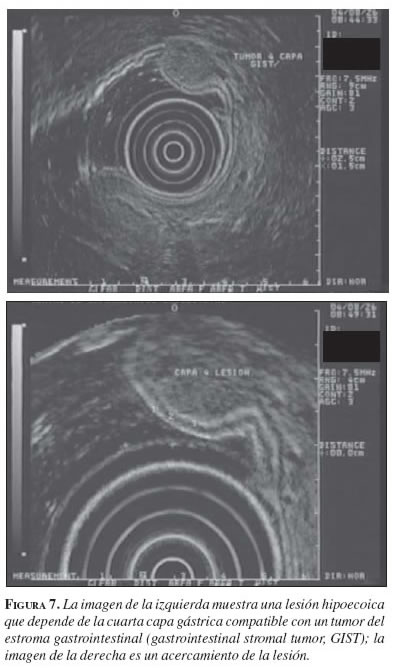
Capa ecográfica tres
Es una banda de tejido que se ve hiperecogénica, en la cual se pueden originar numerosos tumores (12).
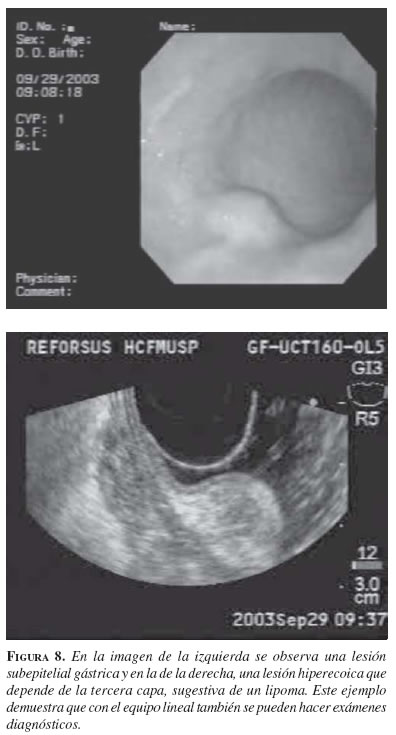
Lesiones hiperecogénicas. La lesión que más frecuentemente se encuentra es el lipoma, el cual se caracteriza por ser hiperecogénico, homogéneo y usualmente tiene el llamado signo de la almohada a la endoscopia (figura 8). Otras lesiones hiperecogénicas que se pueden encontrar en esta capa son: adenoma de las glándulas de Brunner, linfoma gástrico, fibromas granulomas y metástasis.
Lesiones hipoecoicas. Una lesión hipoecoica en esta capa puede corresponder a un páncreas ectópico o aberrante. Usualmente, estas lesiones son heterogéneas y, ocasionalmente, se puede observar una estructura anecoica en el centro que puede corresponder a un conducto; en la endoscopia se puede observar una lesión umbilicada en el antro. También, se pueden encontrar lesiones hipoecoicas que corresponden a tumores carcinoides; usualmente, la lesión se extiende hacia la mucosa.
Los linfomas gástricos también se pueden presentar como lesiones hipoecoicas o hiperecoicas que dependen de la submucosa. Otras lesiones menos frecuentes que son hipoecoicas y que dependen de la tercera capa son tumores de células granulares, neurofibromas y metástasis.
Lesiones anecoicas. Cuando se observan lesiones anecoicas en esta capa, se debe pensar en estructuras vasculares o en quistes. Una forma de diferenciarlos es que, con el movimiento del equipo, los vasos se vuelven de forma tubular y los quistes tienden a aparecer y desaparecer. Otra forma es evaluar si hay flujo, cuando se cuenta con eco-Doppler. Los quistes que se observan dentro de la pared del tubo digestivo, generalmente, son benignos y pueden ser quistes de inclusión, duplicación o retención. Muy raramente se han descrito quistes gástricos malignos.
Capa ecográfica cuatro
Esta capa corresponde a la muscular propia, por lo cual la mayoría de tumores en ella son de origen muscular (13).
Lesiones hipoecoicas. La mayoría de los tumores de esta capa son hipoecoicos y, de estos, la mayoría son tumores del estroma gastrointestinal (gastrointestinal stromal tumor, GIST), si se ubican en el estómago, o leiomiomas, si se ubican en el esófago. Otras lesiones que pueden tener esta apariencia son las metástasis (pulmón o seno) y el tumor del glomus. Los linfomas también pueden comprometer esta capa pero, generalmente, se acompañan de compromiso de las capas más superficiales.
Lesiones hiperecoicas. Son lesiones muy raras, que pueden corresponder a linfomas, tumores neurogénicos o metástasis.
En resumen, si nos enfrentamos a una lesión subepitelial es indispensable la ecoendoscopia. Si la lesión es pequeña y depende de la ecocapa 1, 2 o 3, se puede hacer una resección mucosa, la cual es diagnóstica y terapéutica. Pero, si la lesión es grande, es ideal hacer una punción guiada por ecografía endoscópica. Si se establece que se trata de una lesión benigna, sugiero que puede realizarse un control a los 6 meses; si no ha crecido en este tiempo, no necesitaría más control, pero si ha crecido o se trata de una lesión maligna, se debe dar tratamiento.
3. Linfoma MALT
La ecoendoscopia gástrica es en la actualidad el método de imagen más preciso para la evaluación y estadificación de las lesiones gástricas infiltrativas. Existen en la literatura varios estudios (14,15) que confirman la superioridad de este examen sobre otras técnicas para este propósito, así como para el seguimiento de los pacientes con linfomas tipo MALT (malignant lymphoma of mucosa-associated lymphoid tissue). La sensibilidad, especificidad y precisión diagnóstica del ultrasonido endoscópico es de 89%, 97% y 95%, respectivamente, para evaluar la invasión en profundidad del linfoma (16).
Con la ecoendoscopia este linfoma puede clasificarse como T1m si sólo compromete la mucosa, T1sm si compromete hasta la submucosa y T2 cuando compromete la muscular, T3 cuando compromete la serosa y T4 cuando invade órganos vecinos. Si el linfoma es clasificado histológicamente como tipo MALT de bajo grado de malignidad, las lesiones clasificadas como T1m o T1sm pueden tratarse con los antibióticos para erradicar Helicobacter pylori (17). Las lesiones T2-T4 requieren un tratamiento más agresivo. La ecoendoscopia, además, es útil para el seguimiento de estos pacientes.
4. Cáncer gástrico
Dadas la alta prevalencia del cáncer gástrico en Colombia y la mayor experiencia que hemos ido adquiriendo para detectarlo en estadio temprano, la ecoendoscopia tiene una gran utilidad en su evaluación. Es importante aclarar que no existen datos ecográficos que permitan distinguir con fiabilidad suficiente las lesiones gástricas benignas de las malignas, especialmente si existen ulceraciones, pues los fenómenos inflamatorios pueden tener una imagen idéntica a la infiltración neoplásica. Por lo tanto, el examen endosonográfico sólo debe realizarse después de la confirmación histológica de neoplasia (18). La excepción a esta regla ocurre en los pacientes con linitis plástica, en quienes la imagen endosonográfica es muy sugestiva y las biopsias superficiales suelen ser negativas. Aun en estos casos, debe intentarse la confirmación histológica mediante biopsia sobre biopsia o macrobiopsia.
La ecoendoscopia ha demostrado su superioridad frente a la TC en el diagnóstico de extensión local y regional del cáncer gástrico (aproximadamente, 85% en la estadificación T y 80% en la N) (19); permite diferenciar si estamos ante un paciente con un cáncer gástrico temprano, es decir que la lesión sólo compromete hasta la submucosa sin infiltrar la capa muscular (figura 9), con lo que se puede hacer una mucosectomía endoscópica con curación del paciente. Además, nos proporciona información valiosa, como la afectación de órganos vecinos (páncreas, lóbulo hepático izquierdo) o la existencia de adenopatías metastásicas a distancia que requerirían una gastrectomía D3 (20).

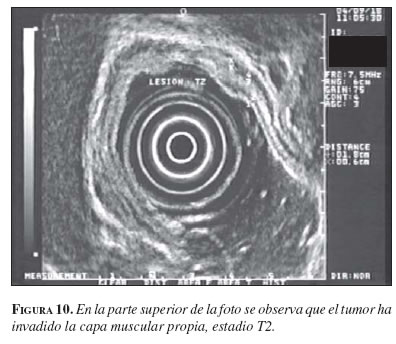
Existen algunas dificultades adicionales para la correcta estadificación de esta neoplasia, tales como la imposibilidad de distinguir entre infiltración de la subserosa (T2) o de la serosa (T3) (figura 10) en la estadificación T y la frecuencia de micrometástasis que aumenta el porcentaje de error en la estadificación N. La existencia frecuente de fenómenos inflamatorios, especialmente en las neoplasias ulceradas, añade dificultad a la exploración, como se ha comentado anteriormente.
¿Qué se puede identificar con la ecoendoscopia en cáncer gástrico que no se identifica con otras técnicas?
1.. Cáncer temprano. La ecoendoscopia es fundamental para establecer si una lesión que es positiva para cáncer gástrico sólo se extiende hasta la submucosa. En estos casos, es necesario utilizar frecuencias de exploración elevadas, del orden de 12, 15 o 20 mHz, o minisondas (31).
2. Cáncer avanzado de esófago proximal. La ecoendoscopia es fundamental para descartar la extensión del tumor a esófago distal, lo que tiene importantes implicaciones terapéuticas, puesto que obliga a realizar una esofaguectomía.
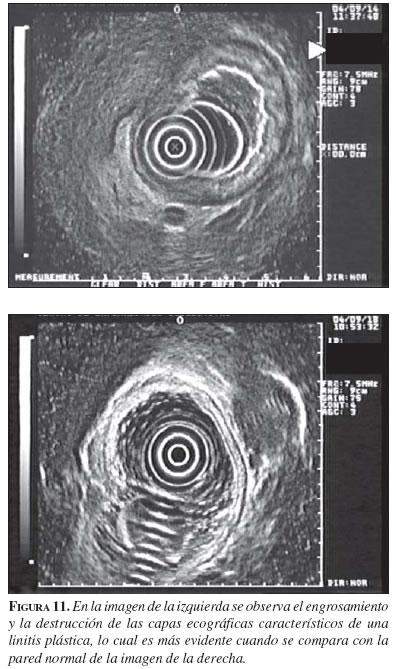
3. Evaluación de los pacientes con sospecha de linitis plástica (figura 11). En la linitis plástica la infiltración neoplásica se caracteriza porque confiere una importante rigidez a la pared gástrica debida a la reacción fibrosa de la capa submucosa, característica que se traduce en dificultad para la distensión con aire (endoscopia) o agua (ecoendoscopia). En esta enfermedad, si la imagen ecoendoscópica es típica, no suele plantear problemas y permite indicar la cirugía, aun en ausencia de confirmación histológica. Se presenta como un importante engrosamiento de la pared gástrica a expensas de todas las capas o, especialmente, de la submucosa. Algunas infiltraciones metastásicas del estómago (neoplasia de mama) adoptan un aspecto como el de la linitis, indistinguible de una neoplasia primaria (22).
III. Ecoendoscopia biliopancreática
Es una de las ecoendoscopias más útiles en cirugía porque nos ayuda a tomar decisiones quirúrgicas.
1. Coledocolitiasis
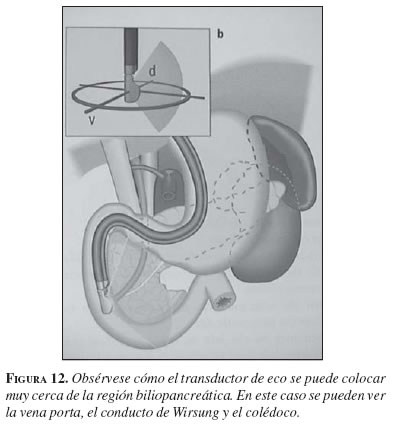
La ecoendoscopia biliopancreática es una de las principales aplicaciones de este examen. Usualmente, la exploración se realiza de forma retrógrada: el transductor se coloca en la tercera porción del duodeno y después se retira de forma progresiva. Si la exploración es completa, la visualización del páncreas y la vía biliar extrahepática es posible, prácticamente, en el 100% de los pacientes (23). Además, la exploración de los grandes vasos adyacentes al páncreas es posible también de forma casi constante. La proximidad de la sonda de ultrasonido al área biliopancreática (figura 12) permite utilizar sondas de frecuencia elevada (7,5 y 12 mHz), con lo que se consigue una excelente definición de esta área. De esta forma, es posible visualizar lesiones parenquimatosas de diámetro inferior a 10 mm (24). Por el contrario, hay limitaciones en la profundidad de campo, por lo que la exploración de la región del hilio hepático sólo es posible en una cuarta parte de los casos.
Existen otros factores que pueden dificultar o, incluso, imposibilitar la realización de la exploración, tales como las estenosis duodenales infranqueables y la presencia de reconstrucciones quirúrgicas (especialmente, gastrectomía total o gastroenteroanastomosis tipo Billroth II). Otra causa de dificultades adicionales es la esfinterotomía previa o la presencia de una prótesis en el interior de la vía biliar que también puede implicar dificultades en la interpretación de las imágenes (aerobilia, sombra acústica producida por la prótesis, etc.).
La ecoendoscopia biliopancreática (figura 13) ha demostrado ser superior, en cuanto a precisión y rentabilidad diagnóstica, a la ecografía convencional y a la TC y, al menos, igual a la colangiopancreatografía retrógrada endoscópica (25). Recientemente, la aparición de la TC helicoidal y de la colangiografía por resonancia magnética han abierto de nuevo la polémica sobre la mayor o menor eficacia de cada una de estas técnicas en el campo de la enfermedad biliopancreática. Por otra parte, las posibilidades ya conocidas de la ecoendoscopia se han visto aumentadas por poderse realizar ecoendoscopiapunción aspiración con aguja fina, así como por la disponibilidad de minisondas que, introducidas por vía transpapilar o transhepática, permiten una exploración de la luz de la vía biliar (26) En el momento actual, la mayor utilidad de una u otra de estas técnicas sigue dependiendo de las condiciones locales, como la experiencia del ecoendoscopista, la disponibilidad de la técnica, etc.
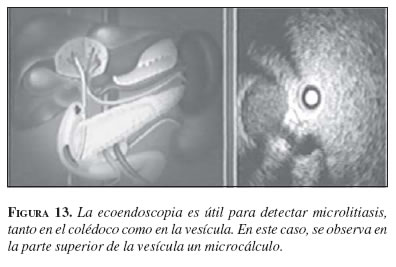
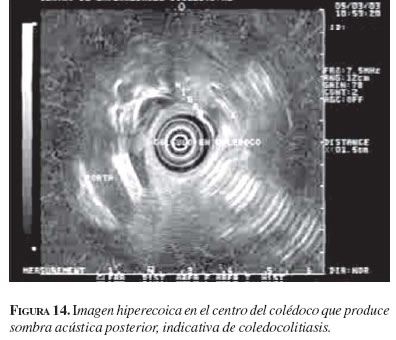
Actualmente, la ecoendoscopia, la colangiografía por resonancia magnética y la colangiografía (colangiopancreatografía retrógrada endoscópica o peroperatoria) son las técnicas que han demostrado una mayor utilidad en el diagnóstico de la coledocolitiasis. En un estudio comparativo entre la ecoendoscopia y la colangiografía por resonancia magnética realizado en un número limitado de pacientes con sospecha de coledocolitiasis, el ultrasonido endoscópico tuvo una especificidad superior a la colangiografía por resonancia magnética (27). De hecho, la ecoendoscopia ha demostrado ser superior tanto a la resonancia magnética (RM) como a la colangiopancreatografía retrógrada endoscópica (28,29) en el diagnóstico de la microlitiasis (figura 14), por lo cual se considera que es la técnica con mayor precisión en el diagnóstico de coledocolitiasis. Además, no hay que olvidar que la ecoendoscopia evita la colangiopancreatografía retrógrada endoscópica no indicada en 87% de los casos, como se demostró en un estudio con seguimiento clínico durante un año (30) Esto es fundamental si se tienen en cuenta las complicaciones de la colangiopancreatografía retrógrada endoscópica que, incluso, han llevado a la muerte a muchos pacientes.
A pesar de que la ecoendoscopia probablemente es la mejor técnica disponible en el momento para esta indicación, el cuadro clínico del paciente debe guiar la elección del examen inicial. Una aproximación general al problema podría ser la siguiente:
1. Se recomienda colangiopancreatografía retrógrada endoscópica como primera opción cuando se considere la práctica de una esfinterotomía independientemente del diagnóstico final, como en el caso de los pacientes con antecedentes de colangitis (31) o pancreatitis agudas biliares graves, o en pacientes de edad avanzada o con riesgo elevado para la cirugía. Por otra parte, los pacientes con antecedentes de esfinterotomía previa son probablemente también candidatos para una colangiopancreatografía retrógrada endoscópica como primera opción, por las dificultades que plantea la aerobilia cuando se hace una exploración ecográfica de la vía biliar y por el menor riesgo en ellos para la esfinterotomía.
2. En aquellos casos de pancreatitis aguda menos grave, es probable que esté indicada la ecoendoscopia como primera opción, reservándose la colangiopancreatografía retrógrada endoscópica para quienes tengan diagnóstico de coledocolitiasis (32). Sin embargo, no hay estudios sobre la eficacia de este abordaje en el manejo de este grupo de pacientes.
3. En caso de que se plantee una colecistectomía, no hay indicación para un examen previo de la vía biliar por ecoendoscopia. Si se encuentra un cálculo en la colangiografía intraoperatoria, se puede hacer la papilotomía endoscópica en el mismo acto quirúrgico con gran éxito, como lo hemos demostrado en el Hospital El Tunal (33).
4. Se debe practicar inicialmente una colangiopancreatografía retrógrada endoscópica en aquellos pacientes con alta probabilidad o diagnóstico ya establecido de coledocolitiasis: cálculo en el colédoco visible por ecografía convencional, antecedente de colangitis, etc. En estos casos, y puesto que la presencia de un cálculo en la vía biliar se confirma en cerca de 60% de los pacientes, no se considera necesaria la ecoendoscopia (34).
5. En los pacientes con riesgo intermedio (clínica o exámenes sugestivos de migración), lo ideal es una ecoendoscopia como examen inicial, seguida de colangiopancreatografía retrógrada endoscópica y esfinterotomía en la misma sesión en caso de demostrarse coledocolitiasis. En este grupo de pacientes, la probabilidad de coledocolitiasis varía de 5% a 20%, por lo cual es probable que las demás estrategias diagnósticas (colangiopancreatografía retrógrada endoscópica sola o colangiografía por resonancia magnética seguida de colangiopancreatografía retrógrada endoscópica) no tengan una clara indicación (35).
6. En pacientes con riesgo bajo de coledocolitiasis (sin elementos clínicos, exámenes de laboratorio ni de imagen sugestivos), no se considera necesario practicar ninguna exploración previa a la cirugía.
2. Vesícula biliar
La ecoendoscopia biliopancreática permite una mejor caracterización de las lesiones de la vesícula biliar al diferenciar los cálculos de los pólipos y la clasificación de estos últimos para descartar que tengan riesgo de malignidad.
3. Tumor de páncreas
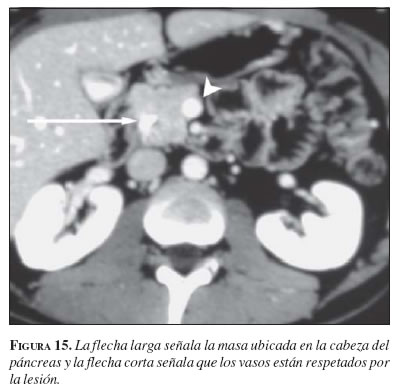
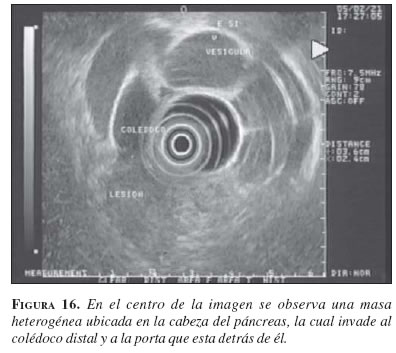
Este tumor tiene un mal pronóstico no sólo por su agresividad sino porque se diagnostica en estadios avanzados debido a su ubicación retroperitoneal, que no está al alcance de la mayoría de los exámenes diagnósticos. Para intentar mejorar su detección temprana se inventó hace más de 20 años la ecoendoscopia, ya que permite colocar el transductor ecográfico más cerca de este órgano y hacer la evaluación de toda clase de tumores pancreáticos (36). La TC abdominal (figura 15) posee también precisión diagnóstica en la evaluación del paciente con sospecha de tumor pancreático, con sensibilidad y especificidad de 83% y 93%, respectivamente, y presenta evidentes ventajas en la estadificación de la lesión (37). No obstante, la ecoendoscopia (figura 16) tiene un rendimiento diagnóstico superior al de la TC, con sensibilidad y especificidad de 94% y 100%, respectivamente (38). Es así como la ecoendoscopia se ha convertido en el examen de elección para la evaluación de pacientes en quienes se sospecha una masa o lesión del páncreas. En nuestra práctica clínica, con la ecoendoscopia hemos encontrado muchas masas de la cabeza del páncreas que no fueron detectadas por la TC, incluso con tomógrafos modernos como los que utilizan técnica helicoidal.
El diagnóstico de cáncer de páncreas idealmente debería tener una confirmación citohistológica antes de tomar una conducta quirúrgica u oncológica. Para ello es necesario obtener una muestra de tejido tumoral, lo cual puede hacerse mediante punción aspiración con aguja fina por vía percutánea o ecoendoscópica, o por biopsia mediante técnica abierta.
En los pacientes con masas pancreáticas o metástasis hepáticas, la punción aspiración percutánea con aguja fina bajo control ultrasonográfico o por TC es la aproximación que proporciona un mayor rendimiento hasta ahora, pero los resultados recientes sugieren que la punción aspiración con aguja fina guiada por ecoendoscopia (figura 17) brinda un mayor rendimiento para la confirmación citológica (39).

Esta técnica está especialmente indicada en las lesiones irresecables para confirmar su naturaleza neoplásica antes de aplicar quimioterapia, radioterapia o ambas, o cuando se sospechan determinadas etiologías, como linfoma, tuberculosis, carcinoides, metástasis, etc. Chang y colaboradores (40), en un estudio multicéntrico llevado a cabo en 164 pacientes con sospecha de neoplasia de páncreas, demostraron unos índices de sensibilidad, especificidad, precisión diagnóstica y valor diagnóstico positivo y negativo para la ecoendoscopia- punción aspiración con aguja fina de 83%, 90%, 85%, 80% y 100%, respectivamente.
Cuando hay alta sospecha de cáncer pancreático, es imprescindible efectuar una correcta estadificación de la lesión con el fin de establecer la opción terapéutica más adecuada. Para ello se pueden utilizar los exámenes tradicionales para el diagnóstico inicial de esta lesión, como son la ecografía o la TC, así como la arteriografía o la ultrasonografía abdominal con registro Doppler para la evaluación de la afectación vascular.
El objetivo fundamental de la estadificación es establecer si el tumor es resecable. En este sentido, se consideran resecables aquellas lesiones que no afectan estructuras vecinas, como grandes vasos (tronco celíaco, origen de la arteria hepática, arteria o vena mesentérica superior, o vena porta), colon y estómago, y que no presenten diseminación metastásica (41). Es importante señalar que no existe ninguna exploración que, por sí sola, sea capaz de predecir si el tumor es resecable con absoluta certeza (42). Así, la mayoría de los autores coinciden en la necesidad de combinar diferentes técnicas que proporcionen información complementaria o que confirmen los datos en caso de discrepancia.
Un estudio prospectivo, en el que se comparó el rendimiento de las diferentes técnicas de imagen en la estadificación del cáncer de páncreas, concluyó que la combinación de la TC abdominal con la ecoendoscopia es la aproximación más útil para predecir la posibilidad de resecar el tumor (43). Cuando ambas exploraciones coinciden en que la lesión no es resecable, la especificidad es de 100%. En este esquema, la utilidad de la arteriografía quedaría limitada a los casos en que exista discrepancia entre las dos pruebas mencionadas.
4. Tumor de papila
La ecoendoscopia biliopancreática muestra si hay lesiones de la papila y permite establecer su infiltración en la pared o con estructuras vecinas, para poder decidir si se puede resecar la lesión de forma endoscópica o quirúrgica.
5. Pancreatitis aguda
La ecoendoscopia biliopancreática ayuda a establecer la causa de la pancreatitis, principalmente, al descartar que sea secundaria a microlitiasis o tumores del páncreas. Debe realizarse en la primera semana del episodio si se sospecha que es de origen biliar, o a la 6 semana si no se conoce cuál es el origen.
6. Pancreatitis crónica
Afortunadamente en nuestro medio la pancreatitis crónica es una enfermedad infrecuente, ya que es difícil de diagnosticar y tratar. La ecoendoscopia biliopancreática ha contribuido ha facilitar su evaluación, al permitir descartar otras causas de dolor abdominal crónico como el cáncer pancreático.
Existen criterios endosonográficos de pancreatitis crónica que se pueden dividir en criterios parenquimatosos y ductales (44) (figura 17).
Criterios del parénquima
1. Disminución de la ecogenicidad
2. Pérdida de la diferencia entre el páncreas ventral y el dorsal
3. Focos hiperecoicos
4. Bandas hiperecoicas
5. Atrofia
6. Formación de contornos lobulados
Criterios de los conductos
1. Dilatación del conducto pancreático principal
2. Pared del conducto pancreático principal hiperecoico
3. Conducto pancreático irregular
4. Conductos pancreáticos secundarios visibles
Cuando el paciente tiene cinco o más criterios y no tiene un episodio de pancreatitis aguda, existe una alta probabilidad de que se trate de un caso de pancreatitis crónica.
IV. Ecoendoscopia rectal
Este tipo de ecoendoscopia es fundamental para tomar decisiones en coloproctología.
1. Pólipos rectales
En pacientes con pólipos rectales gigantes permite establecer si la lesión ha infiltrado la pared y si se puede resecar de forma local o requiere una intervención mayor.
2. Incontinencia fecal
La incontinencia anal es una enfermedad que genera gran incapacidad, no sólo física sino social; además, es muy difícil de evaluar dada sus múltiples etiologías. Hasta hace muy poco no existía ningún examen que pudiera obtener evidencia directa de la lesión estructural de los esfínteres y se recurría a la electromiografía. Este abordaje cambió radicalmente con la aparición de la ecoendoscopia rectal, al demostrarse que es superior a la electromiografía (45,46) para identificar lesiones de los esfínteres. La ecoendoscopia puede describir el esfínter anal interno y el externo con gran precisión, lo cual permite detectar lesiones o alteraciones pararrectales que puedan explicar este síntoma. Múltiples estudios han evaluado la sensibilidad de esta técnica y la han comparado también con la RM (47,48), pero los resultados son contradictorios. En la ecoendoscopia las lesiones del esfínter anal interno se ven hiperecoicas en el anillo hipoecoico normal del esfínter anal interno; en contraste, las lesiones del esfínter externo aparecen como lesiones hipoecoicas en el anillo que normalmente es hiperecoico.
La precisión de la ecoendoscopia para detectar defectos del esfínter anal también se ha comparado con la cirugía (esfinteroplastia) (49,50). En el estudio más grande reportado a la fecha, con 44 pacientes (51), la ecoendoscopia tuvo sensibilidad del 100% para detectar defectos de los esfínteres. La ecoendoscopia también es útil para predecir los resultados de la esfinteroplastia (53).
3. Fístula anorrectal
La ecoendoscopia rectal permite evaluar si la fístula tiene relación con los esfínteres y se asocia a otras lesiones, como abscesos.
4. Cáncer rectal
Con esta técnica se evalúa si la lesión es un cáncer temprano o avanzado y orienta la conducta, endoscópica, quirúrgica u oncológica. El diagnóstico y el manejo del cáncer rectal han evolucionado de forma importante en los últimos años, mejorando el pronóstico de los pacientes. Un aspecto fundamental en el tratamiento de esta neoplasia es una adecuada estadificación de la lesión, dada la importancia del tratamiento neoadyuvante en esta neoplasia (53). Las indicaciones de la ecoendoscopia en otras áreas del colon son escasas debido a la baja incidencia de lesiones subepiteliales y a que, en ausencia de metástasis, la estadificación local y regional del tumor del colon no modifica el manejo terapéutico del paciente.
Los tumores colorrectales se presentan endosonográficamente en forma de una masa hipoecogénica de crecimiento transmural, con afectación de la grasa perirrectal o sin ella (54). Existen numerosos estudios que han demostrado una gran precisión de la ecoendoscopia en el diagnóstico de extensión T-N de los tumores de recto (aproximadamente del 85%, tanto para la estadificación T como para la N) (55,56), superior a otras técnicas de imagen, como la TC (57,58). Si la lesión se clasifica como T1 (figura 18), se aconseja la mucosectomía endoscópica o la resección transanal. Si es T2 (figura 18), se recomienda resección quirúrgica con radioterapia posterior. Si es T3-o T4 (figura 19), se recomienda quimiorradiación preoperatoria (59).

El principal problema de la ecoendoscopia en la interpretación endosonográfica de las imágenes en la neoplasia de recto, procede de los cambios inflamatorios peritumorales que a menudo acompañan a esta neoplasia y que son difíciles de distinguir de la infiltración tumoral (60).
Ecoendoscopia para punción con aguja fina
Por medio de la ecoendoscopia es posible tomar biopsias de todas las lesiones localizadas en la submucosa de la pared del tubo digestivo. De igual forma, se pueden tomar biopsias de todas las lesiones adyacentes al tubo digestivo, como lesiones mediastinales, perigástricas o retroperitoneales, etc.
1. Biopsia de ganglios o masas mediastinales
Esta técnica sirve para evaluar si se trata de una lesión inflamatoria o tumoral y, en el segundo caso, saber si es un cáncer primario o metastásico. La lesión debe estar ubicada en el mediastino anterior donde se ubican los ganglios 2L, 4L, 5, 7 u 8, según la clasificación de la asociación americana del tórax.
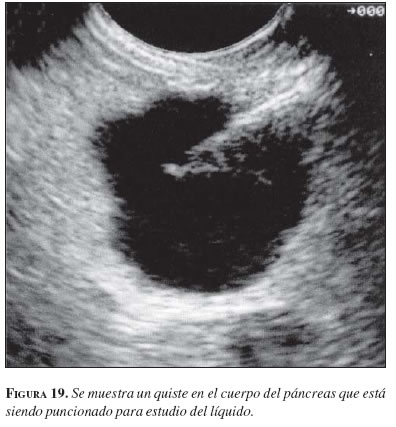
2. Punción de masas o quistes del páncreas
Como anotamos anteriormente, una de la principales aplicaciones de la ecoendoscopia es la estadificación del cáncer de páncreas, para lo cual también es muy importante la punción de las lesiones. Sin embargo, en el páncreas no sólo existen lesiones sólidas sino quísticas. Las lesiones quísticas o cuyo contenido sea principalmente liquido, se pueden encontrar en cualquier sitio del tubo digestivo o de sus órganos adyacentes, como el hígado o el páncreas, pero es en este último órgano donde tienen mayor relevancia clínica (61). Es muy importante diferenciar las lesiones quísticas de los seudoquistes. Estos últimos no tienen pared o epitelio y representan la mayoría de las lesiones que encontramos en la práctica clínica. Los quistes, a su vez, se pueden dividir para propósitos prácticos como sigue (62).
1. Lesiones que no tienen potencial maligno: quistes simples, cistoadenoma serosos, linfangioma, teratoma quístico, hemangioma o paraganglioma.
2. Lesiones que tienen potencial maligno, como cistoadenoma mucinoso, tumor mucinoso y papilar intraductal (intraductal papillary and mucinous tumor, IPMT) y tumor seudopapilar.
3. Lesiones malignas como el cistoadenocarcinoma o tumores neuroendocrinos que pueden tener presentación quística.
La ecoendoscopia permite distinguir cada uno de estos tumores según sus características endosonográficas (figura 19) y con la punción (63) se puede obtener material para estudio del contenido líquido, no sólo de sus marcadores bioquímicos sino de sus marcadores tumorales; el antígeno carcinoembrionario es el principal de ellos, el cual nos permite determinar si la lesión es maligna o tiene un potencial maligno.
Finalmente, podemos anotar que existen muchas indicaciones diagnósticas de la ecoendoscopia, la mayoría respaldadas por resultados sólidos, como lo demostró el Primer Consenso Brasilero de Ecoendoscopia publicado en 2007 (64).
En conclusión, la ecoendoscopia es una herramienta fundamental en la evaluación de los pacientes con cáncer gastrointestinal y enfermedades biliopancreáticas. En mi opinión, es un examen indispensable para un servicio de cirugía y de gastroenterología. Permite una evaluación más adecuada y rápida de los pacientes, disminuye la morbilidad y la mortalidad asociadas con otros exámenes, como la colangiopancreatografía retrógrada endoscópica, y logra una mejor calidad en la atención de este tipo de pacientes.
Referencias
1. Armengol JR, Benjamin S, Binmoeller K, , Hawes R, Buthani M, Rosch T, et al. Consensus Conference. Clinical applications of endoscopic ultrasonography in gastroenterology: state of the art 1993. Endoscopy. 1993;25:358-66. [ Links ]
2. Rösch T, Classen M. Gastroenterologic endosonography. Textbook and Atlas. Thieme, Stuttgart, 1992. [ Links ]
3. American Society for Gastrointestinal Endoscopy. Role of endoscopic ultrasonography. Gastrointest Endosc. 2007;66:425-35. [ Links ]
4. Sackmann M, Morgner A, Rudolph B, Neubauer A, Thiede C, Schulz H, et al. Regression of gastric MALT lymphoma after eradication of Helicobacter pylori is predicted by endosonographic staging. MALT Lymphoma Study Group. Gastroenterology. 1997;113:1087-90. [ Links ]
5. Nick N, Behling C, McClave S, Jones WF,, Schrodt GR, Wiersema MJ, et al. Specific EUS features can identify hypoechoic masses which are not benign stromal cell tumors. Gastrointest Endosc. 1999;49:609. [ Links ]
6. Rösch T, Kapfer B, Will U, Triptrap A, Frimberger E, Allescher HD, et al. Influence of endoscopic ultrasound (EUS) on the management of upper GI submucosal lesions: a prospective study in 150 patients. Gastrointest Endosc. 1999;49:613. [ Links ]
7. De Angelis C, Repici A, Arena V, Pellicano R, Rizzetto M. Preoperative endoscopic ultrasonography in decision making and management for pancreatic endoscrine tumors: a 6 years experience. Endoscopy. 1998;30(Suppl.1):A182-6. [ Links ]
8. Walsh TN, Noonan N, Hollywood D, Kelly A, Keeling N, Hennessy TPJ. A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med. 1996;335:462-7. [ Links ]
9. Giovannini M, Monges G, Seitz JF, Moutardier V, Bernardini D, Thomas P, et al. Distant lymph node metastases in esophageal cancer: Impact of endoscopic ultrasound-guided biopsy. Endoscopy. 1999;31:536-40. [ Links ]
10. Rösch T, Classen M. Gastroenterologic endosonograpy. New York: Thieme Stuttgart; 1992. [ Links ]
11. Catalano MF. Endoscopic ultrasonography in the diagnosis of submucosal tumors: need for biopsy. Endoscopy. 1994;26:788-791. [ Links ]
12. Tio TL, Tytgat GN, den Hartog Jager FC. Endoscopic ultrasonography for the evaluation of smooth muscle tumors in the upper gastrointestinal tract: an experience with 42 cases. Gastrointest Endosc.1990;36:342-50. [ Links ]
13. Fusaroli P, Caletti G. Endoscopic ultrasonography. Endoscopy. 2003;35:127"35. [ Links ]
14. Isaacson PG. Mucosa-associated lymphoid tissue lymphoma. Semin Hematol. 1999;36:139-47. [ Links ]
15. Crump M, Gospodarowicz M, Shapherd FA. Lymphoma of the gastrointestinal tract. Semin Oncol. 1999;126:324-37. [ Links ]
16. Caletti G, Ferrari A, Brocchi E, Barbara L. Accuracy of endoscopio ultrasonography in the diagnosis and staging of gastric cancer and lymphoma. Surgery. 1993;113:14-27. [ Links ]
17. Nagashima R, Takeda H, Maeda K, Ohno S, Takahashi T. Regression of duodenal mucosa-associated lymphoid tissue lymphoma after eradication of Helicobacter pylori. Gastroenterology. 1996;111:1674-8. [ Links ]
18. Siewert JR, Fink U, Sendler A, Becker K, Bottcher K, Feldmann HJ, et al. Gastric cancer. Curr Probl Surg. 1997;34:835-942. [ Links ]
19. Akahoshi K, Misawa T, Fujishima H, Chijiiwa Y, Maruoka A, Ohkubo A, et al. Preoperative evaluation of gastric cancer by endoscopic ultrasound. Gut. 1991;32:479-82. [ Links ]
20. Caletti G, Ferrari A, Brocchi E, Barbara L. Accuracy of endoscopic ultrasonography in the diagnosis and staging of gastric cancer and lymphoma. Surgery. 1993;113:14-27. [ Links ]
21. Grimm H, Hamper K, Maydeo A, Maas R, Noar M, Soehendra N. Accuracy of endoscopic ultrasound and computed tomography in determining local/regional spread in gastric cancer: results of a prospective controlled study. Gastrointest Endosc. 1991;37:229. [ Links ]
22. Taal BG, den Hartog Jager FCA, Steinmetz R, Peterse H. The spectrum of gastrointestinal metastases of breast carcinoma: I. Stomach. Gastrointest Endosc. 1992;38:130-5. [ Links ]
23. International workshop on the clinical impact of endoscopic ultrasound in Gastroenterology. Working Party Report. Endoscopy. 2000;32:549-84. [ Links ]
24. Ugiyama M, Atomi Y. Acute biliary pancreatitis: the roles of endoscopic ultrasonography and endoscopic retrograde cholangiopancreatography. Surgery. 1998;124:14-21. [ Links ]
25. Canto MI, Chak A, Stellato T, Sivak MV Jr. Endoscopic ultrasonography versus cholangiography for the diagnosis of choledocholithiasis. Gastrointest Endosc Clin North Am. 1998;47:439-48. [ Links ]
26. Tamada K, Inui K, Menzel J. Intraductal ultrasonography of the bile duct system. Endoscopy. 2001;33:878-85. [ Links ]
27. De Ledinghen V, Lecesne R, Raymond JM, Gense V, Amouretti M, Drouillard J, et al. Diagnosis of choledocolithiasis: EUS or magnetic resonance cholangiography? a prospective controlled study. Gastrointest Endosc. 1999;49:26-31. [ Links ]
28. Prat F, Amouyal G, Amouyal P, Pelletier G, Fritsch J, Choury AD, et al. Prospective controlled study of EUS and ERC in patients with suspected common bile duct lithiasis. Lancet. 1996;347:75-9. [ Links ]
29. Palazzo L, Girollet PP, Salmeron M, Silvain C, Roseau G, Canard JM, et al. Value of endoscopic ultrasonography in the diagnosis of common bile duct stones: comparison with surgical exploration and ERCP. Gastrointest Endosc. 1995;42:225-31. [ Links ]
30. Napoléon B, Keriven-Souquet O, Pujol B, Souquet JC, Ponchon T. Does normal endoscopic ultrasound really avoid ERCP in patients with suspicion of common bile duct stone? Study in 238 patients [abstract]. Gastrointest Endosc. 1996;43:426. [ Links ]
31. Canto MI, Chak A, Stellato T, Sivak MV. Endoscopic ultrasonography versus cholangiography for the diagnosis of choledocolithiasis. Gastrointest Endosc. 1998;47:439-48. [ Links ]
32. Liu CL, Lo CM, Chan JKF, Poon RTP, Fan ST. EUS for detection of occult cholelithiasis in patients with idiopathic pancreatitis. Gastrointest Endosc. 2000;51:28-32. [ Links ]
33. Arbeláez V, Pineda L, Gonzáles R, Gómez M. Papilotomía endoscópica intraoperatoria durante colecistectomía en el tratamiento de la colecistocoledocolitiasis. Rev Col Gastroenterol. 2002:17:184-9. [ Links ]
34. Mark DH, Flamm CR, Aronson N. Evidence-based assessment of diagnostic modalities for common bile duct stones. Gastrointest Endosc. 2002;56(Suppl.2):S190-4. [ Links ]
35. Wright BE, Freeman ML, Cumming JK, Quickel RR, Mandal AK. Current management of common bile duct stones: is there a role for laparoscopic cholecystectomy plus intraoperative ERCP as a single-stage procedure? Surgery. 2002;132:729-35. [ Links ]
36. Soetikno RM, Chang K. Endoscopic ultrasound-guided diagnosis and therapy in pancreatic disease. Gastrointes Endosc Clin N Am. 1998;8:237-47. [ Links ]
37. Muller MF, Meyenberger C, Bertschinger P, Schaer R, Marincek B. Pancreatic tumors: evaluation with endoscopic US, CT and MR imaging. Radiology. 1994;190:745-51. [ Links ]
38. Rösch T, Braig C, Gain T, Fenerbach S, Siewert JR, Schusdziarra V, et al. Staging of pancreatic and ampullary carcinoma by endoscopic ultrasonography. Gastroenterology. 1992;102:188-99. [ Links ]
39. Suits J, Frazee R, Erikson RS. Endoscopic ultrasound and fine needle aspiration for the evaluation of pancreatic masses. Arch Surg. 1999;134:639-43. [ Links ]
40. Chang KY, Nguyen P, Erikson RA, Durbin TE, Katz KD. The clinical utility of endoscopic ultrasound-guided fine-needle aspiration in the diagnosis and staging of pancreatic carcinoma. Gastrointest Endosc. 1997;45:387-93. [ Links ]
41. Legmann P, Vignaux O, Dousset B, Baraza AJ, Palazzo L, Dumontier I, et al. Pancreatic tumors: comparison of dual-phase helical CT and endoscopic sonography. AJR Am J Roentgenol. 1998;170:1315-22. [ Links ]
42. Muller MF, Meyenberger C, Bertschinger P, Schaer R, Marincek B. Pancreatic tumors: evaluation with endoscopic US, CT, and MR imaging. Radiology. 1994;190:745-51. [ Links ]
43. Soriano A, Ayuso MC, Ayuso JR, De Caralt MT, Gilabert R, Ginès MA, et al. Preoperative staging and tumor resectability assessment in pancreatic cancer. Prospective study comparing endoscopic ultrasonography, compute tomography, magnetic resonance imaging and angiography. Gastroenterology. 2001;120:A760. [ Links ]
44. Bhutani MS. Endoscopic ultrasonography: changes of chronic pancreatitis in asymptomatic and symptomatic alcoholic patients. J Ultrasound Med. 1999;18;455-62. [ Links ]
45. Law PJ, Kamm MA, Bartram CI. A comparison between electromyography and anal endosonography in mapping. Dis Colon Rectum. 1990;33:370-3. [ Links ]
46. Law PJ,Kamm MA, Bartram CI. Anal endosonography in the investigation of faecal incontinence. Br J Surg. 1991;78:312-4. [ Links ]
47. Eckardt VF, Jung B, Fischer B, Lierse W. Anal endosonography in healthy subjects and patients with idiopathic fecal incontinence. Dis Colon Rectum. 1994;37:235-42. [ Links ]
48. Rieger NA, Sweeney JL, Hoffmann DC, Young JF, Hunter A. Investigation of fecal incontinence with endoanal ultrasound. Dis Colon Rectum. 1996;39:860-4. [ Links ]
49. Damon H, Henry L, Valette PJ, Mion F. Incidence of sphincter ruptures in anal incontinence: ultrasound study [in French with English abstract]. Annales de Chirurgie. 2000;125:643-7. [ Links ]
50. Meyenberger C, Bertschinger P, Zala GF, Buchmann P. Anal sphincter defects in fecal incontinence: correlation between endosonography and surgery. Endoscopy. 1996;28:217-24. [ Links ]
51. Deen K, Kumar D, Williams J, Olliff J, Keighley M. Anal sphincter defects. Correlation between endoanal ultrasound and surgery. Ann Surg. 1993;218:201-5. [ Links ]
52. Ternent CA, Shashidharan M, Blatchford GJ, Christensen MA, Thorson AG, Sentovich SM. Transanal ultrasound and anorectal physiology findings affecting continence after sphincteroplasty. Dis Colon Rectum. 1997;40:462-7. [ Links ]
53. Beynon J, McMortensen NJ, Foy DMA, Channer JL, Rigby H, Virjee J. Preoperative assessment of mesorectal lymph node involvement in rectal cancer. Br J Surg. 1989;76:276-9. [ Links ]
54. Catalano MF. Indications for endoscopic ultrasonography in colorrectal lesions. Endoscopy. 1998;30(Suppl.1):A79-84. [ Links ]
55. Beynon J, McMortensen NJ, Rigby HS. Rectal endosonography, a new technique for the preoperative staging of rectal carcinoma. Eur J Surg Oncol. 1988;14:297-309. [ Links ]
56. Glaser F, Schlag P, Herfarth C. Endorectal ultrasonography for the assessment of the invasion of rectal tumors and lymph node involvement. Br J Surg. 1990;77:883-7. [ Links ]
57. Goldman S, Arvidsson H, Norming U, Lagerstedt U, Magnuson I, Frisell J. Transrectal ultrasound and computed tomography in the preoperative staging of lower rectal adenocarcinoma. Gastrointest Radiol. 1991;16:259-63. [ Links ]
58. Rifkin MD, Ehrlich SM, Marks G. Staging of rectal carcinoma: propsective comparison of endorectal US and CT. Radiology. 1989;170:319-22. [ Links ]
59. Heintz A, Bluess G, Frank K, Kreitner K, Junginger JH. Endoluminal sonography in follow-up of rectal carcinoma. Surg Endosc. 1989;3:199-202 [ Links ]
60. Maier AG, Barton PP, Neuhold NR, Herbst F, Teleky BK, Lechner GL. Peritumoral tissue reaction at transrectal US as a possible cause of overstaging in rectal cancer: histopathologic correlation. Radiology. 1997;203:785-9. [ Links ]
61. Lees WR. Endoscopic ultrasonography of chronic pancreatitis and pancreatic pseudocysts. Scand J Gastroenterol. 1986;123:123-9. [ Links ]
62. Lees WR, Vallon AG, Denyer ME, Vahl SP, Cotton PB. Prospective study of ultrasonography in chronic pancreatic disease. BMJ. 1979;1:162-4. [ Links ]
63. Wiersema MJ, Hawes RH, Lehman GA, Kochman ML, Sherman S, Kopecky KK. Prospective evaluation of endoscopic ultrasonography and endoscopic retrograde cholangiopancreatography in patients with chronic abdominal pain. Endoscopy. 1993;25:555-64. [ Links ]
64. Maluf-Filho Fauze, Dotti C, Farias A, Kapski C, Dalton C. I, Everson A.. I Consenso Brasileiro de Ecoendoscopia. Arq Gastroenterol. 2007:44;353-8. [ Links ]














