Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582On-line version ISSN 2619-6107
rev. colomb. cir. vol.24 no.3 Bogotá July/Sept. 2009
(1) Departamento de Cirugía , Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia.
(2) Grupo de Oncología Clínica, Instituto de Oncología, Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia.
(3) Investigador Asociado, Grupo Colombiano para la Investigación Clínica y Molecular del Cáncer (ONCOLGroup), Bogotá, D.C., Colombia.
(4) Departamento de Anestesiología, Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia.
(5) Grupo de Oncología Médica, Investigación Clínica y Translacional, Instituto Catalán de Oncología, Hospital Germans Trias i Pujol, Barcelona, España; Grupo Colombiano de la Colaboración Cochrane, Bogotá, D.C., Colombia.
(6) Departamento de Enfermería, Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia.
(7) Facultad de Medicina, Universidad de Cartagena, Cartagena de Indias, Colombia.
(8) Departamento de Ginecología y Obstetricia, Grupo de Gineco-Oncología, Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia.
(9) Departamento de Epidemiología y Evaluación de Nuevas Tecnologías, Universidad Nacional de Colombia, Bogotá, D.C., Colombia.
(10) Departamento de Cirugía Oncológica, Washington Cancer Institute, Washington, D.C., United States of America.
* Los casos fueron presentados localmente durante el XVII Congreso Colombiano de Cancerología (Cáncer 2008) realizado en Cali, Valle, Colombia entre el 30 de octubre y el 2 de noviembre de 2008.
Correspondencia: Jorge Miguel Otero, MD. Bogotá D.C., Colombia. Correo electrónico: jotero@rocketmail.com
Fecha de recibo: 13 de febrero de 2008. Fecha de aprobación: 16 de mayo de 2009.
Resumen
El pseudomixoma peritoneal es una enfermedad infrecuente caracterizada por ascitis mucinosa acompañada de implantes tumorales peritoneales y sobre el epiplón. La etiología de esta entidad es desconocida y, según la histología, se divide en dos grandes grupos: la adenomucinosis y la carcinomatosis mucinosa peritoneal.
Tradicionalmente, el tratamiento quirúrgico recomendado es la citorreducción parcial que se repite regularmente para controlar los síntomas hasta que no se encuentre ningún beneficio adicional. A pesar de la controversia, en la actualidad, la evidencia favorece la realización de la peritonectomía radical más quimioterapia intraperitoneal hipertérmica, seguidas de quimioterapia intraperitoneal posoperatoria temprana (en los 7 días siguientes al procedimiento).
A continuación se presentan los dos primeros casos tratados con esta técnica en Colombia y se revisa detalladamente la información publicada al respecto.
Palabras clave: seudomixoma; seudomixoma, peritoneo; seudomixoma peritoneal; adenocarcinoma mucinoso; neoplasias del apéndice; neoplasias ováricas; protocolos de quimioterapia combinada antineoplásica; cirugía; cirugía de Sugarbaker.
Abstract
Pseudomyxoma peritonei (PMP) is a rare disease characterized by a large amount of mucinous ascites with peritoneal and omental implants. The etiology of the disease remains unclear; histologically, two main categories have been described: disseminated peritoneal adenomucinosis and peritoneal mucinous carcinomatosis. Traditionally, surgical treatment consisted of debulking that was repeated until no further benefit could be achieved. Although optimum treatment is debatable, now most evidence favors peritonectomy and hyperthermic intraperitoneal chemotherapy followed by early postoperative intraperitoneal chemotherapy within 7 days of surgery. We present the first two cases treated with this technique in Colombia and a review of current literature.
Key words: pseudomyxoma; peritoneum; pseudomyxoma peritonei; adenocarcinoma, mucinous; appendiceal neoplasms; ovarian neoplasms; antineoplastic combined chemotherapy protocols; surgery; sugarbaker procedure.
Introducción
El pseudomixoma peritoneal es una entidad nosológica pobremente estudiada y comprendida, descrita inicialmente por Rokitansky, en 1842 (1). Clínicamente, se manifiesta con ascitis mucinosa relacionada con múltiples implantes tumorales peritoneales y mesentéricos (más del 60% de las lesiones tienen moco sin células malignas) que ocasionan compromiso intestinal mecánico, hernias, masas de los anexos y dolor somato-visceral (2). Menos de 2% de los sujetos con pseudomixoma peritoneal presentan metástasis a los ganglios linfáticos y al hígado, y cerca de 65% de los casos descritos han ocurrido en mujeres (3). En promedio, la edad de presentación del pseudomixoma peritoneal es de 53 años y la incidencia estimada parece estar alrededor de los 2 casos por cada 10.000 laparotomías (aproximadamente, 1 caso por millón de habitantes) (4,5).
Ronnet y colaboradores describieron tres variedades histológicas que permiten determinar, en parte, el pronóstico de la enfermedad (4): la adenomucinosis, la carcinomatosis mucinosa peritoneal y una forma intermedia, o híbrida, que comparte características de las manifestaciones benignas y malignas del síndrome (4).
La mayoría de los pseudomixomas peritoneales provienen de adenomas mucinosos primarios del apéndice; sin embargo, el 55% de los casos descritos en América Latina parecen ser derivados de neoplasias ováricas. Raramente se han reportado lesiones relacionadas con carcinomas de otro origen, incluso de las vías biliares, estómago, páncreas, colon, trompas uterinas, uraco, vejiga, mama y pulmón (5).
En general, por la biología tumoral del pseudomixoma peritoneal, se acepta que la peritonectomía constituye el tratamiento de elección. Varios estudios realizados en el Washington Cancer Institute, por Sugarbaker y colaboradores, sustentan la intervención quirúrgica radical debido al patrón de diseminación local, a la acumulación de las siembras en sitios anatómicamente extirpables, y a la biodisponibilidad de la quimioterapia regional como intervención coadyuvante (6).
No obstante, las limitaciones tecnológicas y económicas de los países en desarrollo condicionan la práctica regular de esta intervención. A partir del Fourth International Workshop on Peritoneal Surface Malignancy, que se llevó a cabo en Madrid en 2004, 132 médicos involucrados en el manejo interdisciplinario del pseudomixoma peritoneal recomendaron crear una guía para homogeneizar el proceso de acreditación y el control de calidad de los grupos interesados en el tratamiento de esta enfermedad (7).
Debido a las restricciones para la realización de la peritonectomía más la administración de la quimioterapia intraperitoneal hipertérmica, seguida de quimioterapia regional y sistémica (técnica de Sugarbaker), dos estudios integrativos valoraron la calidad de los reportes publicados hasta 2004 (8,9). Ambos encontraron que la supervivencia global a 2 años de los sujetos con adenomucinosis tratados con citorreducción quirúrgica más quimioterapia intraperitoneal hipertérmica fue de 86%: 50% para los que tenían carcinomatosis mucinosa peritoneal y 30% para aquéllos manejados con cirugía convencional, es decir, debulking. La morbilidad promedio de la terapia combinada fue de 26%, y la supervivencia global a los 5 y 10 años para esta intervención estuvo entre 75% y 86%, y 60% y 68%, respectivamente (8,9).
Por la ausencia de experimentos clínicos controlados con asignación aleatoria, existe controversia respecto a la aplicabilidad de la técnica de Sugarbaker. De forma similar, un análisis económico completo, realizado a partir de un estudio publicado en Estados Unidos en 1996, determinó que el costo medio del tratamiento era de US$ 166.922 (rango, US$ 72.795 a US$ 185.464) (10). Estos datos no son extrapolables a nuestra población, pero limitarían la realización del procedimiento en el país, a pesar de que en la actualidad representa la mejor opción de manejo para el pseudomixoma peritoneal.
Pensando en ofrecer esta alternativa terapéutica a quienes padecen de este pseudomixoma y otras enfermedades tumorales que afectan la superficie peritoneal, el Departamento de Cirugía y el Instituto de Oncología de la Fundación Santa Fe de Bogotá establecieron un grupo para su manejo, con la intención de constituirse en centro de referencia nacional y regional. A continuación, se presenta un informe detallado de los dos primeros pacientes con pseudomixoma peritoneal tratados en Colombia con la técnica de Sugarbaker. Hasta la fecha de publicación se han realizado 14 procedimientos con resultados satisfactorios.
Descripción de los casos
Primer caso. Se trata de una mujer de 60 años natural de Cartagena y residente en Sincelejo, con antecedentes de fiebre reumática y compromiso valvular que requirió reemplazo mitral mecánico en el año 2005, después de lo cual se evidenció fibrilación auricular crónica con respuesta ventricular controlada como enfermedad cardiovascular residual, para lo cual recibía tratamiento regular con bisoprolol, digoxina y warfarina.
Ingresó al Instituto de Oncología de la Fundación Santa Fe de Bogotá por un cuadro clínico que se inició en marzo de 2007, con incremento progresivo del perímetro abdominal relacionado con dolor somato-visceral de moderada intensidad. En otra institución, se realizó una tomografía computadorizada (TC) de abdomen que documentó ascitis y una masa dependiente del anexo derecho, acompañada de múltiples nódulos peritoneales de aspecto tumoral. Además, se cuantificó el marcador tumoral CA-125 y el antígeno carcinoembrionario que se encontraron ligeramente elevados (43,5 UI/ml y 40 ng/ml, correspondientemente).
Se interpretó como una neoplasia ovárica, localmente avanzada, por lo que un mes después se realizó laparotomía exploratoria que documentó hallazgos indicativos de pseudomixoma peritoneal, como siembras tumorales productoras de moco diseminadas en la cavidad peritoneal, con ascitis oleosa de 2.500 ml, nódulos pélvicos de 5 cm, lesión tumoral apendicular de 4 cm, epiplón extensamente comprometido por el tumor y lesiones accesorias en la cúpula diafragmática derecha.
Se practicó drenaje de la ascitis, apendicectomía, omentectomía gastrocólica parcial, histerectomía, ooforectomía y resección de las lesiones pélvicas y de algunas localizadas sobre la superficie del colon (citorreducción quirúrgica subóptima cercana al 70%). El estudio anatomopatológico reportó un adenocarcinoma mucinoso bien diferenciado.
Luego, recibió seis meses de poliquimioterapia FOLFOX4 (5-fluoruracilo, folinato de calcio y oxaliplatino, administrados en series quincenales), con buena tolerancia; todos se administraron en el Instituto de Oncología, donde se consideró que el tumor primario era de origen apendicular, por lo que se homologó el tratamiento con un carcinoma metastásico de colon. No obstante, al finalizar la terapia citostática en septiembre de 2007, se encontró elevación del antígeno carcinoembrionario hasta 70 ng/ml y aumento del diámetro abdominal, con TC que demostró mayor ascitis y compromiso nodular sobre el mesenterio, especialmente en el cuadrante superior izquierdo detrás de la pared abdominal (figura 1).

Al momento de la progresión, se encontró que la paciente tenía un estado funcional ECOG 1 (Eastern Cooperative Oncology Group), con peso de 84 kg, índice de masa corporal (IMC) de 35,4 kg/m2, distensión y dolor abdominal en el hipocondrio derecho más una pequeña eventración hipogástrica. Se realizó ecocardiograma Doppler a color que mostró una fracción de eyección del ventrículo izquierdo de 68%, con leve dilatación de la aurícula izquierda, adecuado funcionamiento de la prótesis mecánica y ligera esclerosis valvular aórtica con insuficiencia grado I. Además, en la TC de tórax se encontró dilatación de las arterias pulmonares y compromiso nodular del epiplón en el hipocondrio izquierdo; la endoscopia de vías digestivas altas mostró una hernia hiatal de 2 cm y gastritis erosiva del antro; la colonoscopia fue normal, la albúmina estaba en 4 g/dl, y el perfil funcional hepático y el renal fueron normales.
El 2 de noviembre de 2007 se realizó el procedimiento en el que se demostró gran cantidad de líquido serohemático libre en la cavidad peritoneal (aproximadamente 6.000 ml), material mucoide distribuido de forma aleatoria, principalmente a nivel de los diafragmas, con siembras tumorales en el mesenterio, adherencia de las asas intestinales, compromiso de la curvatura menor del estómago, el ángulo esplénico del colon, el epiplón mayor, la pelvis, la válvula ileocecal y la transcavidad de los epiplones (figura 2).
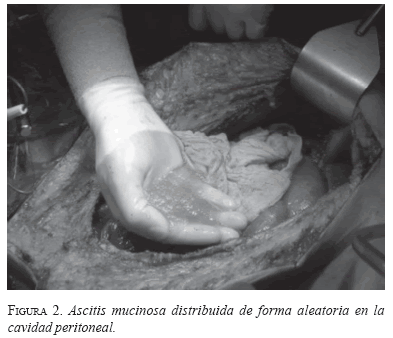
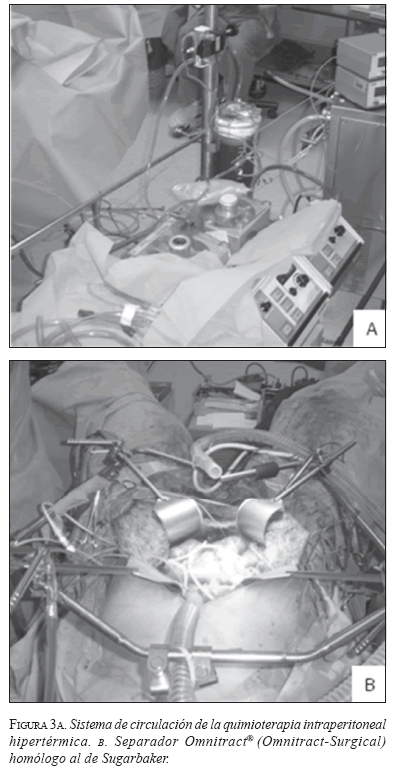
Se practicó peritonectomía radical, previa cuantificación del índice de cáncer peritoneal que fue de 18, seguida de quimioterapia intraperitoneal hipertérmica empleando 28 mg (15 mg/m2) de mitomicina C y 28 mg (15 mg/m2) de doxorrubicina (figuras 3 a y b).
La duración del procedimiento fue de 14 horas y se presentaron complicaciones durante la intervención, entre ellas: hipotensión que requirió soporte con noradrenalina (manejo de la vasodilatación generada por la hipertermia), incremento de la respuesta ventricular relacionada con la fibrilación auricular, e hipertensión abdominal que impidió el cierre de la fascia.
Durante el acto operatorio, presentó un importante recambio de líquidos, con pérdidas por la superficie peritoneal calculadas en 12 litros, por lo que se realizó una estricta vigilancia de los cambios en la temperatura central y periférica, que no afectaron de forma significativa el estado ácido-base. El sangrado se estimó en 2.000 ml, por lo que requirió transfusión de dos unidades de glóbulos rojos empaquetados.
El tiempo de estancia en cuidados intensivos fue de 7 días, el de soporte respiratorio de 5 días, y el hospitalario de 13 días. El índice de cáncer peritoneal posquirúrgico fue de 5, y la puntuación para evaluar la extensión de la citorreducción quirúrgica fue de 3 por un nódulo de 3 cm.
Dentro del modelo de tratamiento bidireccional, recibió quimioterapia intravenosa con 5-fluoruracilo (5-FU) 772 mg (400 mg/m2 durante el período intraoperatorio), más leucovorin, 38 mg (20 mg/m2), sin complicaciones. Cuatro días después del procedimiento de Sugarbaker, se realizó el cierre de la fascia y se inició la quimioterapia intraperitoneal normotérmica temprana con 760 mg de 5-FU a través del catéter intraperitoneal, en infusión rápida, seguida de un periodo de exposición de 23 horas cuando se realizó drenaje durante una hora antes de la siguiente instilación; este procedimiento se repitió por 4 días, tras lo cual se removió el catéter de diálisis peritoneal. Durante la infusión de la quimioterapia, la paciente se mantuvo en decúbito lateral derecho, media hora después se cambió al lado izquierdo y, posteriormente, se continuó con rotación lateral cada media hora hasta completar 6 horas.
El segundo día de quimioterapia intraperitoneal se presentó fiebre cuantificada hasta 38,3ºC, sin foco infeccioso aparente, por lo que recibió tratamiento antimicrobiano empírico con cefepime y vancomicina, previa toma de hemocultivos que fueron negativos después de 72 horas de incubación. Debido a la posibilidad de endocarditis, se obtuvo un ecocardiograma transesofágico que descartó la presencia de vegetaciones y trombos valvulares. De forma complementaria, se inició rehabilitación temprana, ingestión por vía oral 7 días después de la cirugía y recibió nutrición parenteral total por 8 días. Cabe anotar que no requirió tratamiento antiemético en ninguna de las etapas de la quimioterapia y que tampoco presentó toxicidad hematológica a corto o mediano plazo. El reporte definitivo de anatomopatología informó adenomucinosis.
Cincuenta y ocho días después de practicada la cirugía, la paciente presentó cefalea muy intensa con signos de alarma y alteración del estado de conciencia. Ingresó al servicio de urgencias de un centro hospitalario en su ciudad de origen, donde se ordenó una TC cerebral que mostró una hemorragia subaracnoidea Hunt y Hess V que ocasionó muerte cerebral. La paciente falleció por causas no relacionadas con el tratamiento de la enfermedad oncológica.
Segundo caso. Mujer de 60 años natural de Tibaná (Boyacá) y residente en Bogotá, sin antecedentes médicos ni quirúrgicos de importancia, conocida en el Instituto de Oncología por un cuadro clínico de un año de evolución caracterizado por aumento progresivo del perímetro abdominal, disnea clase funcional III y dolor somático de moderada intensidad.
La ultrasonografía abdominal mostró ascitis con múltiples tabiques asociada a siembras tumorales sobre la superficie peritoneal. La radiografía de tórax fue normal y la TC abdominal evidenció ascitis tabicada, una lesión hipodensa de 12,3 mm en el segmento VIII del hígado y una pequeña hernia periumbilical. Posteriormente, se practicaron tres paracentesis con drenaje de escaso material viscoso amarillento de aspecto gelatinoso y citología sugestiva de pseudomixoma peritoneal. Además, la endoscopia de vías digestivas altas fue normal, la colonoscopia reveló varios micropólipos que fueron resecados, el antígeno carcinoembrionario se encontró en 60,4 ng/ml, el CA-125 en 50,7 U/ml y el CA-19,9 en 65,68 UI/ml.
El 28 de diciembre de 2007 se llevó a cabo el procedimiento en el que se encontró abundante moco y siembras sobre toda la extensión del peritoneo visceral y parietal. Se realizó peritonectomía parietal y subdiafragmática izquierda y derecha, omentectomía, hemicolectomía derecha, salpingoooforectomía bilateral, histerectomía, colecistectomía y esplenectomía, más quimioterapia bidireccional como se describió previamente (índice preoperatorio de cáncer peritoneal de 12, postoperatorio de 0, al igual que la citorreducción quirúrgica). El procedimiento duró 12,6 horas; el sangrado se estimó en 1.800 ml; no se necesitó transfusión sanguínea y no se presentaron alteraciones durante la intervención. El estudio de anatomopatología reportó una carcinomatosis mucinosa peritoneal con compromiso de tres ganglios locales y regionales.
La duración del soporte respiratotrio fue de dos días, la estancia en cuidado intensivo de 5 días y el periodo hospitalario de 19 días. Durante el segundo día postoperatorio, en el examen cardiaco se documentó inversión asimétrica de la onda T en la cara inferior y lateral, asociada a elevación transitoria de la creatincinasa (774 U/L) y de la fracción MB (41 U/L), sin cambios en la troponina I (0,339 mcg/L). Posterior al retiro de la noradrenalina (día 3º después de la cirugía), se llevó a cabo un ecocardiograma transtorácico que se informó como normal. Recibió la quimioterapia intraperitoneal normotérmica y presentó como complicación náuseas y emesis grado II, por lo que requirió manejo con ondansetron y dexametasona.
Como hallazgos adicionales, se encontró neutropenia grado I, neumonía intrahospitalaria retrocardíaca tardía, para lo que recibió tratamiento antimicrobiano empírico con piperacilina/tazobactam, y disentería amebiana manejada con metronidazol. En el momento, 14 meses después de la cirugía, la paciente se encuentra en buen estado de salud, libre de enfermedad.
Discusión
Desde 1901 se identificó al pseudomixoma peritoneal por un síndrome caracterizado por la presencia de moco libre en la cavidad abdominal, asociado a una tumoración mucinosa primaria y a implantes sobre el peritoneo y el epiplón. Desde entonces existe cierta disparidad en las opiniones respecto a la benignidad o malignidad de estos tumores, su origen e historia natural, tratamiento y desenlaces (11).
En la anatomopatología, la adenomucinosis se caracteriza por lesiones adherentes no invasoras, constituidas en parte por epitelio benigno, que ocasionan una reacción con fibrosis hialina multifocal con buen pronóstico. Por otra parte, la carcinomatosis mucinosa peritoneal presenta lesiones invasoras con atipias celulares, complejidad arquitectónica y estructural, y masas con histología bien, moderada o pobremente diferenciada; entre estas dos, se encuentra una forma intermedia (2).
La mayoría de los pseudomixomas peritoneales provienen de neoplasias mucinocas primarias del apéndice (65%), que se acompañan en 40% de los casos de masas ováricas (12). La etiología puede diferenciarse utilizando diversos perfiles de inmunohistoquímica, ya que los tumores del ovario suelen ser positivos para la expresión de los marcadores WT1 y CK7, mientras que, los del apéndice, expresan CK7, CK20 y antígeno carcinoembrionario. Además, las lesiones del ciego exhiben de forma difusa N-caderina, vimentina y los marcadores CDX-2, CD44, MUC-2 y MUC-5AC; los dos últimos, se relacionan de forma significativa con la supervivencia y con los niveles de los marcadores tumorales circulantes en sujetos con pseudomixoma peritoneal (13,14).
La ultrasonografía suele ser el procedimiento diagnóstico inicial y, generalmente, reporta ascitis ecogénica inmóvil, masas semisólidas y engrosamiento de los márgenes de las vísceras, especialmente en el hígado y el bazo (15). Con la TC se identifica líquido libre con densidad de grasa en la cavidad peritoneal, desplazamiento central del intestino con engrosamiento del epiplón, lesiones con múltiples tabiques y calcificaciones curvilíneas, hallazgos que permiten diferenciar la adenomucinosis de la carcinomatosis mucinosa peritoneal hasta en 40% de los casos (15). El papel de la resonancia magnética no se ha clarificado; sin embargo, una breve serie informó una alta sensibilidad (mayor de 90%) para determinar la presencia de invasión visceral, datos que no han sido confirmados por lo que su uso es restringido (16). Lo mismo ocurre con la tomografía por emisión de positrones, técnica probada en varios sujetos con pseudomixoma peritoneal para determinar la extensión tumoral sobre el peritoneo y su posible origen; un estudio encontró una sensibilidad de 53,3% para identificar el tumor primario contra 13% de la TC (17).
Los niveles basales circulantes del antígeno carcinoembrionario, el CA-19,9 y el CA-125 tienen una sensibilidad para el diagnóstico de pseudomixoma peritoneal en presencia de ascitis mucinosa, de 72,6%, 58,1% y 58,7%, respectivamente (18). Un CA-125 normal antes de la peritonectomía se asocia con una mayor posibilidad de realizar una citorreducción quirúrgica completa, mientras la elevación preoperatoria del CA-19,9 predice la presencia de un tumor biológicamente más agresivo que cursa con una menor supervivencia global y libre de progresión (18). El diagnóstico puede confirmarse por paracentesis, que se realiza sobre la línea media para evitar las siembras en diferentes trayectos de la pared abdominal que deberán ser resecados durante el procedimiento oncológico. Como alternativa en pacientes con histología no conclusiva, puede realizarse laparoscopia o laparotomía (2,3).
El tratamiento del pseudomixoma peritoneal es controvertido y carece de evidencia apoyada por experimentos clínicos fase III, debido a la rareza y heterogeneidad de la presentación de la enfermedad. El desarrollo de un grupo multidisciplinario especializado en el manejo de esta condición necesita de la formación de un cirujano capacitado para seleccionar los pacientes y realizar la resección de múltiples vísceras y su reconstrucción. En general, se ha estimado que se requieren cerca de 100 a 130 casos para lograr una mortalidad atribuible a la técnica de Sugarbaker inferior al 3% y una morbilidad cercana al 27% (19,20). Además, el grupo debe contar con un oncólogo clínico capacitado en el manejo de los instrumentos necesarios para la administración de la quimioterapia hipertérmica y el control de sus complicaciones.
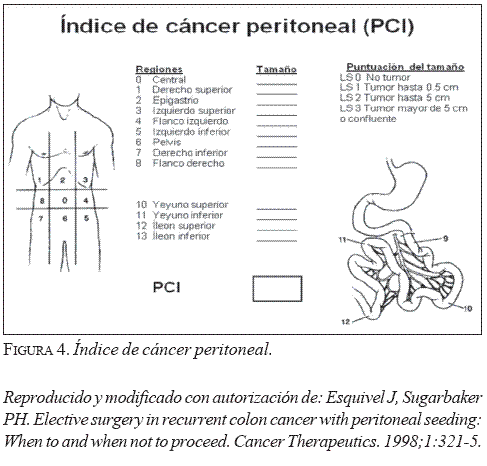
Para optimizar la selección de los pacientes con pseudomixoma peritoneal que van a ser tratados con la técnica de Sugarbaker, se han diseñado varias escalas cuantitativas que sirven también como índices pronósticos. Desde 1994 se encuentran disponibles cinco modelos: el índice para estadificación de Lyon, el índice de cáncer peritoneal, la escala de la Japanese Research Society for Gastric Cancer Carcinomatosis Staging, el índice alemán simplificado para carcinomatosis peritoneal y la puntuación para evaluar la extensión de la citorreducción quirúrgica (21). El grupo multidisciplinario creado en el Instituto de Oncología de la Fundación Santa Fe de Bogotá ha seleccionado el índice de cáncer peritoneal diseñado por Jacquet y Sugarbaker para describir la distribución y las dimensiones de los implantes tumorales en el abdomen y la pelvis. El índice de cáncer peritoneal utiliza 13 regiones, como se muestra en la figura 4; todas se inspeccionan cuidadosamente durante el procedimiento, cuando se mide el diámetro mayor de los implantes distribuidos sobre la superficie del peritoneo. Las lesiones se catalogan entre 0 y 3, usando la menor calificación en ausencia de compromiso del peritoneo visceral y parietal: LS1 cuando se encuentran implantes menores de 0,5 cm, LS2 cuando el diámetro de las lesiones está entre 0,5 cm y 5 cm, y LS3 en presencia de implantes mayores de 5 cm o cuando se evidencia enfermedad en el abdomen y en la pelvis (22). El valor pronóstico del índice de cáncer peritoneal se evaluó en 100 pacientes con carcinomatosis peritoneal por cáncer de colon y se encontró una supervivencia global a 5 años de 50% cuando es inferior a 10%, 20% si está entre 11 y 20 y 0% cuando es superior a 20 (23).
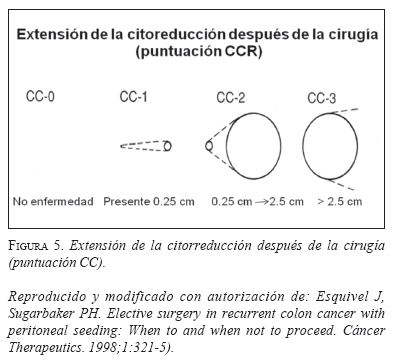
Para precisar la extensión de la citorreducción quirúrgica se diseñó la puntuación de citorreducción quirúrgica, que cuantifica la enfermedad residual como se muestra en la figura 5. Su importancia se demostró en el análisis del registro internacional de pacientes con carcinomatosis peritoneal que evaluó 506 sujetos, el cual demostró que aquéllos con puntuación CC-0 tienen una supervivencia global a 2 años cercana al 80%, mientras que para los procedimientos clasificados como CC-2 a 3 es de 10% (22). En conjunto, los puntajes de los índices de la primera paciente tratada en el Instituto de Oncología de la Fundación Santa Fe de Bogotá permitieron estimar una supervivencia a 3 años inferior al 20%, mientras que para la segunda paciente esta presunción superó el 60%.
Una revisión sistemática no convencional, publicada por el Washington Cancer Institute en 2006, identificó 37 referencias entre las que se seleccionaron 10 estudios observacionales que corresponden a evidencia de nivel IV. Se agrupó la información de 863 sujetos con pseudomixoma peritoneal tratados con peritonectomía radical (resección del peritoneo parietal anterior, omentectomía, peritonectomía subfrénica derecha e izquierda, colecistectomía y esplenectomía) más rectosigmoidectomía, colectomía derecha, histerectomía, ooforectomía bilateral y extracción de algún segmento del intestino delgado según fuera necesario. Todos recibieron quimioterapia intraperitoneal hipertérmica más quimioterapia intraperitoneal normotérmica temprana (en los 7 días siguientes a la cirugía) (24). El estudio encontró un rango para la mediana de supervivencia global entre 51 y 156 meses, y una proporción de sujetos vivos al año, dos, tres y cinco años de 80% a 100%, 76% a 96%, 59% a 96%, y 52% a 96%. La tasa global de morbilidad osciló entre 33% y 56%, la toxicidad hematológica fue hasta del 9%, y el sangrado estuvo entre 2.100 y 8.000 ml. La media de duración de la cirugía fluctuó entre 6 y 12,6 horas, con una proporción máxima de nueva intervención de 21% y una mortalidad secundaria al procedimiento de 0% a 18%. El límite superior de la mediana de la hospitalización fue de 21 días, mayor que lo descrito para los dos primeros casos tratados por nuestro grupo (24).
La revisión no encontró estudios enfocados a evaluar la calidad de vida. No obstante, dos reportes de McQuellon y colaboradores informaron este desenlace en una población de pacientes con afectación tumoral del peritoneo (incluso pseudomixoma peritoneal) tratados con la técnica de Sugarbaker (25,26). Ambos demostraron una disminución de la calidad de vida en el periodo temprano del procedimiento quirúrgico, con posterior mejoría (sobre la evaluación basal) en el tercer mes del mismo. Tras un seguimiento de tres años, se encontró que 90% de los pacientes tenía mínima o ninguna limitación secundaria a progresión del tumor o a efectos adversos del procedimiento, y una actualización de los datos permitió determinar que cerca de 30% de los pacientes presenta algún grado de depresión en los primeros dos años (26,27). A partir de la segunda paciente tratada en la Fundación Santa Fe de Bogotá de Oncología, se inició como procedimiento estándar la medición de calidad de vida mediante la escala QLQ30 de la European Organization for Research and Treatment of Cancer (EORTC) validada en español para Colombia; su puntaje previo a la cirugía fue de 28 y, un mes después, fue de 12.
La quimioterapia intraperitoneal se ha utilizado con éxito en diferentes circunstancias desde la década de 1950, basándose en la relación fisiológica existente entre los espacios peritoneal y plasmático, que facilita la terapia con intensificación regional de la dosis (24,28). Los agentes de alto peso molecular, como cisplatino, doxorrubicina, mitomicina-C, oxaliplatino, melfalan y paclitaxel, son secuestrados por largos periodos en el peritoneo, lo que permite el control de los émbolos tumorales localizados sobre la superficie de las vísceras y la ocupación por los medicamentos de la quimioterapia de los vasos linfáticos, los coágulos y de las redes de fibrina que atrapan las células tumorales viables (28). La hipertermia aumenta la penetración de los agentes de la quimioterapia en los tejidos y posee toxicidad directa sobre la neoplasia, efecto que aumenta con la disminución de la irrigación del tumor. Por otra parte, con el ablandamiento tisular por el calor, se disminuye la presión intersticial de las masas, lo cual favorece la penetración de los medicamentos de la quimioterapia (28).
Para facilitar la administración de los medicamentos en la cavidad peritoneal, se coloca un catéter Tenckhoff (Quinton Curled Peritoneal Catheter, Quinton, Inc., Seattle, WA) y se emplea el separador de Thompson (figura 6a); la quimioterapia intraperitoneal hipertérmica se instila a 41ºC-43°C por un sistema continuo constituido por un circuito cerrado que posee termómetros para controlar los catéteres de entrada y los sitios remotos de flujo localizados en el abdomen y en la pelvis (figura 6b) (28). Para los sujetos con pseudomixoma peritoneal, el Washington Cancer Institute diseñó un esquema bidireccional constituido por dos medicamentos que se utilizan como parte de la quimioterapia intraperitoneal hipertérmica (doxorrubicina y mitomicina C), concomitante con 5-FU y leucovorin endovenosos, más la fluoropirimidina intraperitoneal administrada tempranamente durante el periodo posoperatorio.

La mediana de los costos secundarios a la labor de los profesionales vinculados a la realización de la técnica de Sugarbaker (cirujano, anestesiólogo, radiólogo e intensivista), se estimó, para 1996 en los Estados Unidos, en US$ 41.004 (rango, US$ 13.406 a US$ 57.000), y el costo promedio de la hospitalización extraído a partir de una serie de 26 pacientes fue de US$ 127.838 (rango, US$ 59.389 a US$ 127.838) para el mismo periodo. Esto indica que el costo total de cada procedimiento está cercano a los US$ 160.000; una evaluación indirecta de los costos por paciente tratado con cirugía citorreductora convencional, acompañada de quimioterapia estándar para el manejo de cáncer de colon u ovario y de sus complicaciones, supera ampliamente el monto descrito para la técnica de Sugarbaker (aproximadamente, US$ 900.000), lo cual favorece esta última técnica (29).
Figura 6a. Sistema de Sugarbaker y catéteres para la administración de la quimioterapia intraperitoneal; 6b. Recipiente utilizado para calentar la quimioterapia.
Reproducido y modificado con autorización de: Sugarbaker PH. Heated Intraoperative Intraperitoneal Chemotherapy (HIIC) using the Sugarbaker retractor. In: Sugarbaker PH, editor. Technical handbook for the integration of cytoreductive surgery and perioperative intraperitoneal chemotherapy into the surgical management of gastrointestinal and gynecologic malignancy. 4th edition. Washington, D.C.: Washington Cancer Institute, ed.; 2006;52-3.
En nuestro entorno, no se han realizado valoraciones económicas de la gran mayoría de los tratamientos en cáncer, lo que limita la interpretación de estos datos. El grupo multidisciplinario conformado por la Fundación Santa Fe de Bogotá calcula que el costo de cada intervención en Colombia es de Col$ 140 millones (US$ 70.000), inferior a lo reportado hace 10 años para otras latitudes, lo que hace factible su realización, centralizando su práctica en una sola institución para desarrollar la curva de aprendizaje que permita ofrecer esta intervención a una población estimada de 15 a 20 casos nuevos por año para el país.
Este reporte presenta una descripción detallada de los dos primeros casos de pseudomixoma peritoneal tratados en Colombia con la técnica de Sugarbaker; sólo se encontró un caso adicional reportado en 2004 por miembros del Grupo de Cirugía Gastrointestinal del Instituto Nacional de Cancerología, tratado con cirugía citorreductora después de progresar con 5-FU y leucovorin, que murió en el periodo posoperatorio por complicaciones infecciosas debido a peritonitis secundaria (30).
Agradecimientos
Los autores agradecen el apoyo de los grupos de cuidado intensivo quirúrgico, salas de cirugía, anestesiología y enfermería, y de las directivas de la Fundación Santa Fe de Bogotá. También, a las pacientes incluidas en el presente informe y a sus familias que fueron soporte durante el tratamiento.
Conflictos de interés
Los autores no reportan conflictos de interés.
Referencias
1. Werth R. Klinische und anatomische Untersuchungen zur Lehre von den bauchgeschwullsten und der laparotomie. Arch Gynecol Obstet. 1884;24:100-18. [ Links ]
2. Galani E., Marx GM., Steer CB., Culora G., Harper PG. Pseudomyxoma peritonei: the 'controversial' disease. Int J Gynecol Cancer. 2003;13:413-8. [ Links ]
3. Sugarbaker PH. New standard of care for appendiceal epithelial neoplasms and pseudomyxoma peritonei syndrome? Lancet Oncol. 2006;69-76. [ Links ]
4. Ronnett BM., Zahn CM., Kurman RJ., Kass ME., Sugarbaker PH., Shmookler BM. Disseminated peritoneal adenomucinosis and peritoneal mucinous carcinomatosis. A clinicopathologic analysis of 109 cases with emphasis on distinguishing pathologic features, site of origin, prognosis, and relationship to 'pseudomyxoma peritonei'. Am J Surg Pathol. 1995;19:1390-408. [ Links ]
5. Sherer DM., Abulafia O., Eliakim R. Pseudomyxoma peritonei. A review of current literature. Gynecol Obstet Invest. 2001;51:73-80. [ Links ]
6. Sugarbaker PH. Cytoreductive surgery and peri-operative intraperitoneal chemotherapy as a curative approach to pseudomyxoma peritonei syndrome. Eur J Surg Oncol. 2001;27:239-43. [ Links ]
7. González S. Peritoneal surface oncology: a progress report. Eur J Surg Oncol. 2006;32:593-6. [ Links ]
8. Bryant AJ., Clegg M., Sidhu K., Brodin H., Royle P., Davidson P. Systematic review of the Sugarbaker procedure for pseudomyxoma peritonei. Br J Surg. 2005;92:153-8. [ Links ]
9. National Institute for Clinical Excellence (NICE). Complete cytoreduction for pseudomyxoma peritonei (Sugarbaker technique). Fecha de consulta: 26 de diciembre de 2007. Disponible en: www.nice.org.uk/IP079overview. [ Links ]
10. Sugarbaker PH., Ronnett BM., Archer A., Averbach AM., Bland R., Chang D., et al. Pseudomyxoma peritonei syndrome. Adv Surg. 1996;30:233-80. [ Links ]
11. Fraenkel E. Weder das sogenante pseudomixoma peritonei. Munchen Med Wschr. 1901;48:965-70. [ Links ]
12. Sugarbaker PH. The natural history, gross pathology, and histopathology of appendiceal epithelial neoplasms. Eur J Surg Oncol. 2006;32:644-7. [ Links ]
13. Baratti D., Kusamura S., Nonaka D., Langer M., Andreola S., Favaro M., et al. Pseudomyxoma peritonei: clinical pathological and biological prognostic factors in patients treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC). Ann Surg Oncol. 2007 Nov 28. Epub ahead of print. [ Links ]
14. O'Connell JT., Hacker CM., Barsky SH. MUC2 is a molecular marker for pseudomyxoma peritonei. Mod Pathol. 2002;15:958-72. [ Links ]
15. Seshul MB., Coulam CM. Pseudomyxoma peritonei. computed tomography and sonography. AJR Am J Roentgenol. 1981;136:803-6. [ Links ]
16. Low RN., Barone RM., Lacey C., Sigeti JS., Alzate GD., Sebrechts CP. Peritoneal tumor. MR imaging with dilute oral barium and intravenous gadolinium-containing contrast agents compared with unenhanced MR imaging and CT. Radiology. 1997;204:513-20. [ Links ]
17. Yang QM., Bando E., Kawamura T., Tsukiyama G., Nemoto M., Yonemura Y., et al. The diagnostic value of PET-CT for peritoneal dissemination of abdominal malignancies. Gan To Kagaku Ryoho. 2006;33:1817-21. [ Links ]
18. Baratti D., Kusamura S., Martinetti A., Seregni E., Laterza B., Oliva DG., et al. Prognostic value of circulating tumor markers in patients with pseudomyxoma peritonei treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. Ann Surg Oncol. 2007;14:2300-8. [ Links ]
19. Moran BJ. Establishment of a peritoneal malignancy treatment centre in the United Kingdom. Eur J Surg Oncol. 2006;32:614-8. [ Links ]
20. Smeenk RM., Verwaal VJ., Zoetmulder FA. Learning curve of combined modality treatment in peritoneal surface disease. Br J Surg. 2007;94:1408-14. [ Links ]
21. Gilly FN., Cotte E., Brigand C., Monneuse O., Beaujard AC., Freyer G., et al. Quantitative prognostic indices in peritoneal carcinomatosis. Eur J Surg Oncol. 2006;32:597-601. [ Links ]
22. Sugarbaker PH. Quantitative prognostic indicators. En: Sugarbaker PH, editor. Technical handbook for the integration of cytoreductive surgery and perioperative intraperitoneal chemotherapy into the surgical management of gastrointestinal and gynecologic malignancy. 4th edition. Washington, D.C.: Washington Cancer Institute, ed.; 2006;12-22. [ Links ]
23. Glehen O., Kwiatkowski F., Sugarbaker PH., Elias D., Levine EA., De Simone M., et al. Cytoreductive surgery combined with perioperative intraperitoneal chemotherapy for the management of peritoneal carcinomatosis from colorectal cancer: a multi-institutional study. J Clin Oncol. 2004;22:3284-92. [ Links ]
24. Yan TD., Black D., Savady R., Sugarbaker PH. A systematic review on the efficacy of cytoreductive surgery and perioperative intraperitoneal chemotherapy for pseudomyxoma peritonei. Ann Surg Oncol. 2007;14:484-92. [ Links ]
25. McQuellon RP., Loggie BW., Fleming RA., Russell GB., Lehman AB., Rambo TD. Quality of life after intraperitoneal hyperthermic chemotherapy (IPHC) for peritoneal carcinomatosis. Eur J Surg Oncol. 2001;27:65-73. [ Links ]
26. McQuellon RP., Loggie BW., Lehman AB., Russell GB., Fleming RA., Shen P., et al. Long-term survivorship and quality of life after cytoreductive surgery plus intraperitoneal hyperthermic chemotherapy for peritoneal carcinomatosis. Ann Surg Oncol. 2003;10:155-62. [ Links ]
27. McQuellon RP., Russell GB., Shen P., Stewart JH 4th., Saunders W., Levine EA. Survival and health outcomes after cytoreductive surgery with intraperitoneal hyperthermic chemotherapy for disseminated peritoneal cancer of appendiceal origin. Ann Surg Oncol. 2007 Nov 20 [Epub ahead of print]. [ Links ]
28. Sugarbaker PH. Background and rationale. En: Sugarbaker PH, editor. Technical handbook for the integration of cytoreductive surgery and perioperative intraperitoneal chemotherapy into the surgical management of gastrointestinal and gynecologic malignancy. 4th edition. Washington, D.C.: Washington Cancer Institute, ed.; 2006;4-11. [ Links ]
29. Bryant J., Clegg AJ., Sidhu MK., Brodin H., Royle P., Davidson P. Clinical effectiveness and costs of the Sugarbaker procedure for the treatment of pesudomyxoma peritonei. Health Technol Assess. 2004;8:1-66. [ Links ]
30. Hoyos JC., Muñoz A. Masa post-apendicectomía (pseudomixoma peritoneal). A propósito de un caso. Rev Colomb Gastroenterol. 2004;19: 143-8. [ Links ]














