Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582On-line version ISSN 2619-6107
rev. colomb. cir. vol.24 no.4 Bogotá Oct./Dec. 2009
(1) Residente de primer año en Cirugía General, St. Mary's Hospital, Waterbury, CT, USA.
(2) Médico interno, Hospital Universitario Fundación Santa Fe de Bogotá – Universidad Industrial de Santander; Grupo de Investigación en Cirugía y Especialidades, GRICES, – Universidad Industrial de Santander, Bucaramanga, Santander.
(3)Cirujano general y de tórax; miembro, Comité de Cirugía de Tórax, ACC; coordinador, Departamento de Cirugía, Fundación Oftalmológica de Santander – Clínica Carlos Ardila Lülle (FOSCAL), Floridablanca, Santander.
Correspondencia: Leonidas Tapias Díaz, MD, Floridablanca, Santander. Correo electrónico: ltapias@intercable.net.co
Fecha de recibo: 22 de abril de 2009. Fecha de aprobación: 13 de septiembre de 2009.
Resumen
La miastenia gravis es una enfermedad neuromuscular autoinmune caracterizada por debilidad y fatiga muscular. Ha sido reconocida desde hace más de tres siglos, pero sólo hasta el siglo XX se desarrollaron intervenciones terapéuticas encaminadas a aliviar los síntomas y alterar el curso clínico de la enfermedad. En la fisiopatología, se destaca el papel del timo como órgano central que contiene todos los elementos necesarios para iniciar y montar una respuesta inmune contra antígenos propios, particularmente, el receptor de acetilcolina en la placa motora. Debido a esto, la timectomía extendida aparece como una alternativa terapéutica que logra la remisión completa de la enfermedad hasta en 75% de los pacientes y la mejoría hasta de 99%.
Sin embargo, el abordaje abierto convencional (esternotomía) es bastante agresivo, por lo que, en los últimos años, la cirugía de tórax ha desarrollado técnicas quirúrgicas mediante toracoscopia asistida por video que permiten realizar el mismo procedimiento con menos complicaciones y mejores resultados cosméticos.
Debido al beneficio hasta ahora mostrado, se debe ofrecer el tratamiento quirúrgico a todos los pacientes con miastenia gravis generalizada y a una buena proporción de los que padecen síntomas oculares.
Palabras clave: miastenia gravis; timo; timectomía; cirugía torácica asistida por video.
Abstract
Myasthenia gravis is an autoimmune neuromuscular disease characterized by weakness and fatigability of striated muscle. It was recognized three centuries ago, but therapeutic interventions that decrease symptoms and alter the clinical course of the disease have just been developed until the 20th century. The thymus plays a central role in the physiopathology since it has all the elements required to initiate and mount an immune response against self-antigens, especially the acetilcholine receptor at the motor plate. Because of this, extended thymectomy has arisen as a therapeutic alternative that accomplishes complete remission of the disease in as much as 75% of patients and improvement in 99%. However, conventional open surgical approach (sternotomy) is aggressive, hence in the last decade video-assisted thoracic surgery has developed surgical techniques capable of performing the same procedure but with fewer complications and better cosmetic results. Because of the beneficial effects shown, surgical treatment must be offered to all patients with generalized myasthenia gravis and to a large proportion of those with ocular symptoms alone.
Key words: myasthenia gravis; thymus gland; thymectomy; thoracic surgery, video-assisted.
Introducción
La miastenia gravis es una enfermedad de la placa motora, caracterizada por debilidad y fatiga muscular. El fundamento de esta enfermedad es autoinmune, ya que se producen anticuerpos dirigidos contra el receptor nicotínico de acetilcolina en el músculo estriado. Fue descrita por primera vez en 1672 por Thomas Willis, médico y fisiólogo inglés(1). La miastenia gravis es, sin duda, la enfermedad autoinmune humana más estudiada y entendida, por lo cual ha servido como modelo para aclarar los mecanismos de otras enfermedades autoinmunes(1).
Una excelente revisión sobre miastenia gravis fue publicada por Drachman (1). Su prevalencia se ha determinado en varios estudios entre 27 y 400 casos por millón de habitantes(1-5), es mayor en las mujeres y en pacientes ancianos. La incidencia anual se ha estimado entre 0,25 y 2 por 100.000 habitantes(3,6); sin embargo, depende del sexo y la edad, y presenta un pico, entre la segunda y la tercera décadas de la vida, que afecta, principalmente, a las mujeres, y un segundo pico, entre la sexta y la séptima décadas, que afecta más a los hombres(1,6,7). En China, se encontró un pico máximo entre los 5 y 10 años de edad(8). En Colombia, la prevalencia estimada en la población de Antioquia fue de 27,7 por millón de habitantes, con una proporción hombre/mujer de 1:3,77(9).
Clínicamente, la miastenia gravis se manifiesta como debilidad muscular que se empeora con el ejercicio y mejora con el reposo. Temprano en su curso aparecen ptosis y diplopía en la mayoría de pacientes; la afección exclusiva de los músculos extraoculares y palpebrales ocurre, aproximadamente, en 15% de los casos(1) y se denomina miastenia gravis ocular; en países orientales esta proporción parece ser mayor(8). Luego se afecta la musculatura facial y bulbar, lo cual produce una facies característica y dificultad para masticar y tragar. Finalmente, la miastenia gravis generalizada se presenta en 85% de los pacientes(1,7) y afecta las extremidades, los músculos del cuello y el diafragma; cuando este último se afecta a tal punto que se necesita asistencia respiratoria mecánica, se dice que el paciente se encuentra en una crisis miasténica.
La miastenia gravis puede clasificarse en seropositiva y seronegativa, dependiendo de la presencia o ausencia de anticuerpos contra los receptores de acetilcolina (AchR). El tipo más común es la miastenia gravis seropositiva, que representa, aproximadamente, 85% de los casos de forma generalizada y 50% de los casos de miastenia gravis ocular(1). En 10% a 20% de los pacientes con miastenia gravis no se detectan anticuerpos contra los AchR(1); hasta en la mitad de estos pacientes se han encontrado anticuerpos contra la cinasa de tirosina específica del músculo (MuSK)(2,10).
Aproximadamente, en 60% de los pacientes el diagnóstico se hace dentro del primer año después de la aparición de los síntomas(4). Los estudios de poblaciones han demostrado que el diagnóstico de miastenia gravis basado sólo en la clínica sobreestima la prevalencia cuando se confirma mediante pruebas de laboratorio, y que en las mujeres se tiende a diagnosticarla erróneamente(5). Con un seguimiento promedio de 4,9 años, la proporción de pacientes libres de síntomas fue de 35%: 24% por remisión farmacológica y 11% por remisión sin tratamiento(7).
La tasa de mortalidad por miastenia gravis es de 4%, principalmente en hombres mayores de 40 años con timoma(7). Las causas de muerte en miastenia gravis fueron estudiadas en Noruega para el periodo de 1951-2001(11). Se encontró que los pacientes con miastenia gravis fallecieron más por enfermedades respiratorias y menos por cardiovasculares y procesos malignos, hasta 1995. En Inglaterra, se demostró que, cuando un neurólogo se hace cargo del manejo y tratamiento de los pacientes con miastenia gravis, el resultado es mejor, y se reduce la mortalidad hasta en 69%(12).
Mecanismos de la miastenia gravis
El problema subyacente a la miastenia gravis es la reducción en el número de AchR presentes en las uniones neuromusculares. Esto afecta la contracción muscular, la que depende de la transmisión del impulso dada por la interacción entre la acetilcolina y su receptor. El número reducido de AchR en el músculo produce potenciales de menor amplitud que son incapaces de desencadenar un potencial de acción en todas las fibras(1).
El receptor de la acetilcolina en el músculo es una glucoproteína con un peso molecular aproximado de 250.000 Da, que atraviesa la membrana celular y está constituido por cinco subunidades: dos alpha (α), una beta (β), una gamma (γ) y, finalmente, una delta (δ), en embriones o músculo adulto desnervado, o una epsilon (ε), en músculo adulto inervado(1,13,14); las subunidades a contienen cada una un sitio de unión para la acetilcolina, la cual, luego de unirse, activa un canal iónico(15). Los AchR se cambian y renuevan constantemente, lo cual explica la mejoría en la miastenia gravis luego de que el ataque autoinmune ha cesado.
La miastenia gravis es una enfermedad autoinmune, ya que diferentes investigaciones han demostrado cinco criterios para darle esta denominación(1,13). Primero, hay anticuerpos presentes; como se mencionó arriba, 85% de la miastenia gravis es seropositiva para anticuerpos anti- AchR. La mayoría de los anticuerpos son del tipo IgG1 e IgG3, los cuales activan el complemento(13). Segundo, el anticuerpo interactúa con su objetivo; por medio de microscopía electrónica se han demostrado cúmulos de IgG cerca a los AchR en las uniones neuromusculares. Tercero, la transferencia pasiva de anticuerpos produce signos y síntomas propios de la enfermedad; esto se ha observado al inyectar anticuerpos a ratones o en recién nacidos de madres con miastenia gravis. Cuarto, la inmunización con el antígeno produce un modelo de enfermedad; se ha reproducido el cuadro clínico de la miastenia gravis en diferentes especies luego de inmunizarlas con extractos de AchR. Quinto, la reducción en el título de anticuerpos se correlaciona con una disminución en la gravedad de la enfermedad; cuando se utilizan algunas estrategias terapéuticas que reducen agudamente el número de anticuerpos (plasmaféresis) se observa mejoría clínica en corto tiempo.
Hay que tener en cuenta que los títulos de anticuerpos no se correlacionan con la gravedad al ser comparados entre pacientes, pero sí, como ya se mencionó, en un mismo paciente. Los anticuerpos dirigidos al AchR finalmente van a reducir el número de AchR disponibles mediante: la aceleración de la endocitosis y su degradación; el bloqueo funcional de los sitios de unión de acetilcolina en las subunidades a; y el daño de los receptores mediado por la activación del complemento(1,13). Existe de 10% a 20% de pacientes con miastenia gravis en quienes no es posible demostrar anticuerpos contra AchR; sin embargo, actualmente se han demostrado anticuerpos contra otras estructuras musculares como MuSK(13). Asimismo, se cree que una buena proporción de diagnósticos de miastenia gravis seronegativa se debe a la incapacidad de los radioinmunoensayos para detectar los anticuerpos(1).
Los anticuerpos son producidos por diferentes líneas de clones de linfocitos B una vez activados por los linfocitos T(14). Se han aislado de sangre periférica y, en especial, de timos de pacientes con miastenia gravis, linfocitos T reactivos al AchR(1). Los linfocitos T CD4+ (linfocitos T ayudadores, Th) responden a péptidos procesados por las células presentadoras de antígenos y que son expresados junto a moléculas del complejo mayor de histocompatibilidad (major histocompatibility complex, MHC) clase II(1), e interactúan con los linfocitos B mediante moléculas de superficie y liberación de citocinas(14).
Es posible que las células Th1 jueguen un papel crucial en la iniciación de la enfermedad, mientras que las células Th2 perpetúen la enfermedad al producir factores de crecimiento y diferenciación para los linfocitos B activados(14). Se ha visto que los linfocitos T de pacientes con miastenia gravis responden a más de 30 péptidos diferentes derivados del AchR(1,14). Esta heterogeneidad se traduce en policlonía de linfocitos B, los que producen múltiples anticuerpos contra diferentes epítopos del AchR, que se pueden unir a las varias subunidades del receptor, aunque la mayoría están dirigidos a la subunidad a. Se han encontrado algunas asociaciones genéticas con los antígenos HLA-B8, DRw3 y DQw2(1,13). En los pacientes con miastenia gravis y sus familiares, se han encontrado otras enfermedades autoinmunes como lupus eritematoso sistémico y tiroiditis.
Miastenia gravis y timo
Debido al importante papel de los linfocitos en la patogenia de la miastenia gravis, se propuso que el origen de esta respuesta autoinmune se origina en el timo. Esta hipótesis fue inicialmente postulada por el neurólogo alemán Hermann Oppenheim, en 1901(16). El vínculo entre la miastenia gravis y los tumores mediastinales, especialmente timomas, fue propuesto por primera vez por el patólogo alemán Carl Weigert, en 1901(16,17).
El timo es un órgano linfoide central, en el que las células madre de la médula ósea se diferencian en linfocitos T maduros. Durante el desarrollo de los linfocitos, cualquier exposición a un antígeno resulta en muerte clonal o anergia que garantiza un estado de tolerancia ante este antígeno(14,18). La falta o pérdida de tolerancia a un autoantígeno resulta en autoinmunidad. Al parecer, durante su desarrollo en el timo, se produce una falla que hace intolerantes a los linfocitos al AchR(18,19).
Una gran proporción de pacientes con miastenia gravis presenta anormalidades en el timo; en general, 70% tiene hiperplasia folicular, 15% tiene timomas y el resto tiene timos histológicamente normales(14,16,18). En pacientes jóvenes se observa más frecuentemente hiperplasia, con una razón mujer-hombre de 3 a 1(14); ésta afecta principalmente la médula del timo, donde se observan centros germinales ubicados en los espacios perivasculares que son similares a los encontrados en los ganglios linfáticos, lo cual indica que en estos timos miasténicos ocurre activación y proliferación de linfocitos B(20).
En pacientes con hiperplasia del timo se han encontrado títulos de anticuerpos contra AchR mayores a los de quienes no tienen hiperplasia(14). Al comparar los linfocitos B del timo y los de sangre periférica en un mismo paciente, los primeros producen mayor cantidad de anticuerpos que los últimos(14). Igualmente, en los timos hiperplásicos, se ha encontrado una expresión exagerada de CD23 en los centros germinales, lo cual promueve la diferenciación y la supervivencia de los linfocitos B mediante el aumento de la expresión de bcl-2, que es una proteína que previene la apoptosis(14). En pacientes mayores de 50 años, se ven con mayor frecuencia timomas(1,16,18), los cuales afectan ambos sexos por igual(14). Éstos se derivan del epitelio tímico, son de lento crecimiento y, por lo general, están encapsulados. En estos pacientes la gravedad de la miastenia gravis es mayor, con mayores títulos de anticuerpos, mayores anormalidades electromiográficas y peores respuestas a los tratamientos.
En el timo normal, el AchR es expresado por células tímicas y células mioides y, probablemente, son estas últimas la fuente del antígeno que inicia el proceso autoinmune(14,18), porque son las únicas células fuera del músculo que se conoce que expresan AchR en su forma completa(20). En timos miasténicos hay una concentración mayor de estas células mioides y una mayor relación con células presentadoras de antígenos(16-18,20). Se ha llegado a concluir, entonces, que el timo en casos de miastenia gravis contiene todos los elementos necesarios y suficientes para montar una respuesta inmune dirigida contra el AchR y que, a la vez, es fuente de células inmunes activadas contra este mismo objetivo que emigran y se siembran en tejidos periféricos(14).
Este concepto se ha llamado "la patogénesis intratímica" de la miastenia gravis y lleva, aproximadamente, tres décadas en investigación(14,16,18-20). Se resume así(16-18): en el timo existen células presentadoras de antígenos que toman el AchR derivado de las células mioides, lo procesan y lo expresan asociado a moléculas CMH clase II, lo que permite que los linfocitos T reactivos reconozcan estos fragmentos de péptidos mediante su receptor (TCR), lo cual los activa; estos linfocitos T pueden permanecer en el timo o pueden circular por la periferia. Debido a lo anterior, la timectomía se practica en la miastenia gravis y resulta en la mejoría de muchos pacientes, lo que fortalece aún más la hipótesis del papel crítico del timo en la miastenia gravis(17). Sin embargo, esta teoría aún no se ha probado del todo.
Recientemente, se ha desarrollado un modelo de inflamación en el timo de ratones, el cual busca aclarar el papel desempeñado por esta glándula en el desarrollo de la miastenia gravis(18). Con este modelo, Levinson et al. buscan probar una nueva hipótesis: que una reacción inflamatoria en la médula del timo ante un antígeno cualquiera, facilita la entrada de linfocitos T CD4+ periféricos reactivos contra los AchR, que escaparon durante su desarrollo al proceso de regulación inmune.
El timo también parece tener un papel en la miastenia gravis seronegativa. De estos pacientes, los que presentan anticuerpos MuSK tienen timos histológicamente normales para la edad, mientras que los que no tienen anticuerpos MuSK presentan infiltrados similares a los de la timitis(20).
Diagnóstico y tratamiento
El diagnóstico y los tratamientos médicos de la miastenia gravis no son el objetivo principal de esta revisión. El diagnóstico siempre debe tener un fundamento clínico claro que, posteriormente, se confirma mediante algunas pruebas(21). Existen algunas pruebas que se consideran extensiones del examen neurológico y sobre las cuales no puede basarse únicamente el diagnóstico de miastenia gravis(22). Éstas son la prueba del paquete de hielo y la prueba con edrofonio (Tensilon®), el cual es un inhibidor de la colinesterasa de muy rápido inicio de acción (30 a 45 segundos)(22). Sin embargo, el edrofonio dejó de fabricarse desde febrero de 2008(22), por lo que ya no será parte de los instrumentos diagnósticos en el corto plazo.
Para confirmar definitivamente el diagnóstico, se deben tratar de identificar los anticuerpos con AchR o MuSK en el suero de los pacientes(22). De igual manera, existen las pruebas electrofisiológicas que permiten confirmar el diagnóstico y que serían el único soporte en pacientes con miastenia gravis seronegativa (sin anti- AchR ni anti-MuSK). Se utiliza la estimulación nerviosa repetida y la electromiografía de una sola fibra(22). Asimismo, debido a la asociación de la miastenia gravis con enfermedad del timo, en todo paciente con diagnóstico de miastenia gravis se debe descartar la presencia de timoma, lo cual se logra mediante una tomografía computadorizada (TC) del tórax(22). Los linfomas y los carcinomas de células pequeñas de pulmón pueden desencadenar síndromes paraneoplásicos miasténicos y, en estos casos, la TC es de ayuda(20). Por último, la miastenia gravis se ha encontrado asociada a otras enfermedades autoinmunes, como tiroiditis, artritis reumatoide y lupus eritematoso sistémico(22), por lo que, ante la menor sospecha clínica, deben estudiarse estas condiciones.
Una vez realizado el diagnóstico de miastenia gravis, se debe intentar clasificar clínicamente al paciente. Tradicionalmente se ha utilizado la clasificación de Osserman: grado 0, asintomático; grado 1, enfermedad focal restringida a los músculos extraoculares; grado 2, enfermedad generalizada leve; grado 3, enfermedad generalizada moderada; y grado 4, enfermedad generalizada gravis, falla respiratoria o ambas. Sin embargo, la falta de datos específicos y la aparición de varias modificaciones de esta escala la hacen poco útil en la realización de investigación. Es por lo anterior, que la Myasthenia Gravis Foundation of America (MGFA) ha propuesto una nueva clasificación clínica y una clasificación del estado posterior a la intervención que busca unificar criterios de evaluación que lleven a la acumulación de investigación clínica con resultados comparables(23). La MGFA clasifica en grado I, la enfermedad ocular aislada, y en grado II, III y IV, la debilidad leve, moderada o gravis, respectivamente, que afecta otros músculos diferentes a los oculares. Para estos grados existe una subclasificación en "a" (si se afectan principalmente la musculatura axial y apendicular) y "b" (si se afecta principalmente la musculatura orofaríngea o respiratoria). Finalmente, el grado V se reserva para los pacientes que requieren ser intubados, con asistencia respiratoria mecánica o sin ella.
Las bases del tratamiento de la miastenia gravis son mejorar la neurotransmisión en la placa motora y reducir el número de anticuerpos circulantes. Lo primero, que corresponde a la primera línea del tratamiento, se logra con la administración de piridostigmina, un inhibidor de la colinesterasa, en dosis de 1 a 3 tabletas de 60 mg cada 3 a 4 horas mientras se está despierto(21). Su uso como monoterapia se ve limitado por el perfil de efectos adversos (cólicos abdominales, diarrea, aumento en las secreciones, diaforesis) y por su incapacidad para alterar el curso natural de la enfermedad(21).
Sobre el uso de inhibidores de la colinesterasa, actualmente solamente existe el protocolo para la realización del metanálisis sobre su uso en miastenia gravis(24). Con el fin de reducir el número de anticuerpos se busca modular la respuesta autoinmune, para lo cual los primeros que se usan son los corticoides como la prednisona. Sin embargo, un metanálisis concluyó que hay un par de ensayos clínicos controlados con placebo que demuestran un beneficio ligero de los corticoides a corto plazo(25). Además, hasta 50% de los pacientes bajo este tratamiento experimentan una exacerbación inicial que, incluso, puede llegar a ser una amenaza contra la vida(21).
Otros inmunosupresores utilizados en la miastenia gravis son la azatioprina, la cual demora en su inicio de acción hasta tres meses y tiene efectos indeseables gastrointestinales y de supresión de la médula ósea(21), y la ciclosporina, cuyo uso a largo plazo produce lesión vascular renal, insuficiencia renal, hipertensión arterial y fibrosis intersticial(21). También se han utilizado ciclofosfamida, micofenolato y tacrolimus(26). Un metanálisis concluyó que los pocos ensayos clínicos controlados sugerían que la ciclosporina, como monoterapia o en combinación con corticoides, o la ciclofosfamida con corticoides, mejora significativamente la miastenia gravis(26).
Para alcanzar una rápida reducción en el número de anticuerpos circulantes, se cuenta con la plasmaferesis, el intercambio de plasma y la inmunoglobulina intravenosa. Son de especial utilidad cuando se presentan exacerbaciones, crisis, aquéllos que están bajo otros tratamientos pero que esperan el inicio de su efecto terapéutico o en la preparación preoperatoria para la timectomía(21). Metanálisis recientes(27,28) evidencian que la inmunoglobulina intravenosa es eficaz en los pacientes con exacerbaciones y que no es superior al intercambio de plasma. A través de la historia, las diferentes intervenciones descritas arriba, sumadas al tratamiento quirúrgico y al mejoramiento de los conocimientos de cuidado crítico, han reducido notablemente la mortalidad producto de la miastenia gravis, aun cuando su prevalencia ha ido en aumento(29) (tabla 1).

Timectomía
La timectomía en el tratamiento de los pacientes con miastenia gravis es una práctica ya establecida. El primer registro de una cirugía sobre el timo para afectar el curso de la miastenia gravis, se remonta a 1911, cuando fue realizada por el cirujano alemán Ernst Ferdinand Sauerbruch(16,30). Se trataba de una paciente de 20 años, con clínica de hipertiroidismo y miastenia gravis; se realizó una timectomía cuya pieza quirúrgica reveló hiperplasia del timo y la paciente mostró evidente mejoría de la miastenia gravis.
Estas primeras timectomías se realizaron mediante un abordaje cervical. Fue sólo hasta 1936 que Alfred Blalock adoptó la esternotomía para abordar el mediastino (31) y fue quién sentó las bases anatómicas para esta técnica quirúrgica. Su primer reporte relata el caso de una mujer de 19 años quien sufría de miastenia gravis grave y en quién se removió un tumor quístico dependiente el timo. Más adelante, Blalock practicó la timectomía en pacientes con miastenia gravis sin timomas asociados y acumuló experiencia total con 20 casos (2 timomas) en los cuales obtuvo mejoría en 13 de 17 sobrevivientes(32).
Harvey, en 1942, demostró mediante estudios neurofisiológicos el beneficio ofrecido por la timectomía(33). El desarrollo de la cirugía del timo para el tratamiento de la miastenia gravis fue seguido por el cirujano británico Geoffrey Keynes(34), especialista en tiroides, cuyo éxito inicial con la cirugía del timo lo llevó a completar 281 timectomías para 1956 (16), de lo cual concluyó que la timectomía ofrece mayor beneficio en los pacientes más jóvenes y sin timomas. Más adelante, en 1969, Paul Kirschner (35) retomó el abordaje transcervical para la timectomía, sustentando un manejo más simplificado y un curso postoperatorio más benigno al compararse con la esternotomía.
Las timectomías se realizaban sólo retirando el tejido tímico contenido dentro de la cápsula. Sin embargo, en la década de los 70, apareció en escena Akira Masaoka(36), cirujano japonés, quién reportó un hallazgo decisivo para la cirugía tímica moderna. Examinaron microscópicamente los especímenes quirúrgicos de timo intracapsular y tejido adiposo extracapsular, obtenidos mediante un abordaje transesternal; encontraron tejido tímico microscópico en el tejido graso de 72% de los casos estudiados. Esto llevó al principio de que, para asegurarse de extirpar todo el tejido tímico, se debía remover todo el tejido adiposo del mediastino anterior, procedimiento que se llamaría "timectomía extendida". Para evaluar la superioridad de esta nueva técnica, Masaoka y Monden(37) realizaron la comparación entre las timectomías transesternal simple, transcervical simple y transesternal extendida, determinando las tasas de remisión (pacientes sin síntomas y sin medicación) y las tasas de paliación (pacientes en remisión más pacientes con mejoría) con un seguimiento de 10 años. Encontraron que, en pacientes con miastenia gravis no timomatosa, las tasas de remisión de la timectomía transesternal simple y transesternal extendida eran superiores a las de la transcervical simple a los 3 y 5 años de seguimiento; mientras que la tasa de paliación de la timectomía transesternal extendida era superior a las otras a los 3 meses, 6 meses, 1 año y 3 años de seguimiento. Concluyeron, entonces, que la timectomía transesternal extendida es superior a las otras técnicas.
Excelentes descripciones de la técnica quirúrgica se encuentran en otros artículos(30,38), al igual que revisiones sobre los cuidados perioperatorios de estos pacientes(39,40). Los resultados de la timectomía transesternal en casos de miastenia gravis sin timoma (n=286) y con timoma (n=89) fueron reportados con un seguimiento final de 20 años por Masaoka et al.(41) y pueden observarse en la figura 1. Se ve claramente el beneficio que ofrece la timectomía en la miastenia gravis, el cual es mayor en los casos no asociados a timoma. En los últimos 5 años, diferentes estudios con un buen número de pacientes han demostrado la utilidad de la timectomía transesternal en el tratamiento de la miastenia gravis y han mostrado tasas de remisión y tasas de paliación variables, que oscilan entre 17% y 75%, y 52% y 99%, respectivamente(42-51). Incluso en niños(52) y pacientes ancianos(53,54), la timectomía ha demostrado beneficios.
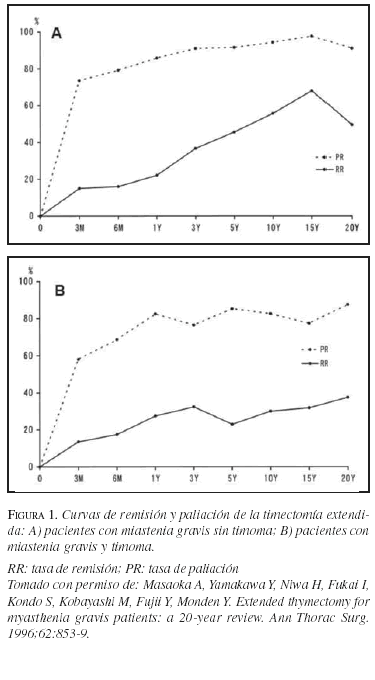
Entre los factores de pronóstico de la timectomía en miastenia gravis que se han encontrado están: el sexo, la edad joven, la histopatología (ausencia de timoma), la corta duración de la enfermedad, la sintomatología leve, el no haber usado esteroides en el periodo preoperatorio y la presencia de tejido tímico ectópico(41,42,46,48,55-58); al parecer la miastenia gravis seropositiva y la seronegativa responden de igual manera(59). Los pacientes a quienes no se practica una timectomía tienen un OR=2,8 (IC95% 1,5-5,2) de haber sufrido crisis miasténicas, respecto a los operados(60).
Las complicaciones de la timectomía son diversas y, en ocasiones, significativas, lo cual es lógico luego de una cirugía torácica mayor. Se han descrito casos de insuficiencia respiratoria, neumonía, estenosis traqueal, hematoma mediastinal, mediastinitis, hemotórax, neumotórax, quilotórax, hemorragia proveniente de la esternotomía, disrupción de la esternotomía, pericarditis, paresia temporal del nervio laríngeo recurrente y del nervio frénico, lesión permanente del nervio laríngeo recurrente y del nervio frénico, arritmias cardiacas, anemia e infección del sitio operatorio(44,46,49,58,61).
Las crisis miasténicas postoperatorias se han visto asociadas a la presencia preoperatoria de síntomas bulbares, historia de crisis preoperatorias, niveles séricos de anti-AchR superiores a 100 nmol/L y sangrado intraoperatorio mayor de 1.000 ml(62). La tasa de mortalidad es inferior al 1%(61).
Además de la esternotomía media para la realización de la timectomía extendida, Jaretzki et al.(63) propusieron la "timectomía máxima" en 1988, en la cual combinan una esternotomía media y una cervicotomía para lograr una resección en bloque del tejido tímico y del tejido adiposo en el mediastino anterior; asimismo, describieron otros sitios de tejido tímico ectópico que debían resecarse, como sobre el pericardio, detrás del tiroides, a lo largo de la pleura mediastinal y en el tejido adiposo del cuello. Sin embargo, el seguimiento a largo plazo de esta nueva técnica no ha demostrado una superioridad significativa frente a la timectomía transesternal extendida(30). Existen, también, otros abordajes y técnicas quirúrgicas para la realización de la timectomía que tienen sus defensores, como la esternotomía parcial, el abordaje transcervical con disección extendida(64,65) y la toracoscopia asistida por video (discutida en detalle en el próximo apartado), todos con resultados relativamente comparables.
Debido al sustento fisiopatológico, algunos autores han llegado a plantear la hipótesis de que la timectomía ofrecería beneficio a los pacientes que sufren de otras enfermedades autoinmunes, como el lupus eritematoso sistémico y la encefalitis autoinmune(66); sin embargo, esto aún no se ha intentado.
Timectomía toracoscópica asistida por video
El abordaje más común para la timectomía ha sido la esternotomía media. Sin embargo, la gran invasión del paciente, los cursos postoperatorios en algunas ocasiones lentos y los pobres resultados cosméticos, le restan validez a este abordaje. Si bien la cosmética no es una consideración mayor al momento de decidir una cirugía, la miastenia gravis ocurre frecuentemente en mujeres jóvenes, las cuales podrían rechazar el tratamiento quirúrgico por este hecho.
En los años 90, la cirugía torácica mediante toracoscopia asistida por video (video-assisted thoracoscopic surgery, VATS) surgió fuertemente como una técnica quirúrgica mínimamente invasiva versátil y que determinaría el curso de la cirugía de tórax moderna. El abordaje mediante VATS no ha sido ajeno a la enfermedad del mediastino(67) y cirujanos como Anthony Yim(68,69), Michael Mack(70) y Tommaso Mineo(71), han sido fundamentales en el desarrollo de las técnicas de la timectomía VATS. La timectomía VATS ofrece menos invasión del paciente, un curso postoperatorio benigno y corto, y mejores resultados cosméticos(68,70), lo cual motivaría a los pacientes y sus neurólogos tratantes a optar por un tratamiento quirúrgico precoz. El manejo perioperatorio y las consideraciones anestésicas se escapan de esta revisión.
Técnica quirúrgica
Se han descrito numerosos abordajes para la timectomía VATS, incluyendo la toracoscopia izquierda(71), la derecha(68) y la bilateral. Las razones a favor del abordaje izquierdo son la mejor visualización del polo inferior izquierdo del timo sobre el pericardio y del tejido tímico y adiposo que se extiende hacia la ventana aortopulmonar(70,71); aunque parecen razones suficientes, existen limitaciones. El corazón es una estructura de predominio izquierdo, por lo que el espacio para maniobrar el instrumental quirúrgico va a ser menor, al tiempo que es difícil identificar la arteria innominada y observar su llegada a la vena cava superior. Debido a lo anterior, Yim e Izzat(68) propusieron desde un comienzo el abordaje derecho, el cual es el preferido actualmente. Las ventajas son la mayor maniobrabilidad del instrumental, la más fácil identificación de la vena cava superior y la vena innominada, y la mayor comodidad ergonómica para los cirujanos diestros(70).
La experiencia de los autores con la timectomía VATS ha estado en mayor acuerdo con lo propuesto por Yim(68). Para hacer un abordaje derecho, el paciente se coloca en decúbito lateral izquierdo y la mesa se extiende a 30° a nivel de los pezones para optimizar la apertura de los espacios intercostales. El toracoscopio (cámara) y los demás puertos de acceso a la cavidad pleural se triangulan para evitar el choque de los instrumentos.
Se realiza una primera incisión en el sexto espacio intercostal con línea axilar posterior para insertar la cámara con un lente de 0°, el cual facilita el trabajo sobre el mediastino; sin embargo, debe tenerse a disposición el lente de 30° para cuando sea requerido. Los otros puertos para los instrumentos usualmente se ubican en el tercer espacio intercostal con línea axilar media y en el quinto o sexto espacio intercostal con línea axilar media o anterior. En las mujeres estas ubicaciones pueden variar debido al tejido mamario.
La timectomía VATS puede realizarse solamente con tres puertos, pero, en caso de necesitarse mayor comodidad en la disección, no debe dudarse en instalar un cuarto puerto. Para la disección, se utiliza instrumental torácico convencional (para cirugía abierta) e instrumental para toracoscopia.
Haciendo uso de bisturí eléctrico monopolar y torundas montadas en pinzas, se empieza la disección por el polo inferior derecho del timo, sobre el pericardio, y se asciende por el borde derecho del timo hasta llegar a la vena cava superior, teniendo especial cuidado de preservar el nervio frénico derecho. En este punto, donde confluye la vena braquiocefálica izquierda, se debe interrumpir el drenaje venoso del timo y, posteriormente, se continúa con la disección del polo inferior izquierdo.
Una vez liberados ambos polos inferiores, se continúa con el istmo y con los cuernos superiores. Para poder acceder a ellos, en ocasiones es necesario dividir los vasos mamarios internos. Mediante tracción delicada, se pueden liberar fácilmente los cuernos de sus uniones con fascias en el cuello.
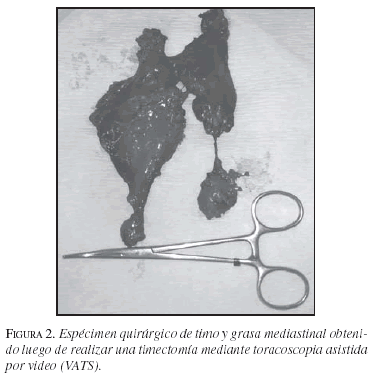
Una vez está libre el timo, se coloca en una bolsa plástica y se retira de la cavidad pleural a través de la incisión más anterior, ya que allí el espacio intercostal es más amplio. Se debe siempre observar el espécimen quirúrgico para verificar que la resección ha sido completa (figura 2).
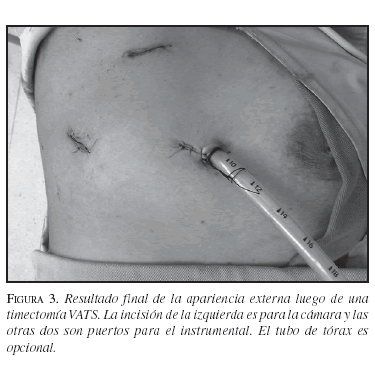
Finalmente, se verifica la hemostasia del lecho tímico y se deja un tubo de tórax para drenaje. Sin embargo, una vez garantizada la hemostasia y ya que no se incide la vía aérea, el drenaje pleural es opcional o puede realizarse sólo por pocas horas(68,70). La piel se cierra mediante una sutura intradérmica con polipropileno 3-0. El resultado externo final se observa en la figura 3. No es necesario enviar al paciente a la unidad de cuidados intensivos en el postoperatorio, a menos que haya una indicación clara. Se le puede dar de alta al siguiente día e, incluso, algunos grupos han planteado la posibilidad de realizar este procedimiento de manera ambulatoria.
Resultados
En 1996, la experiencia inicial con la timectomía VATS de cuatro grandes centros de cirugía de tórax mínimamente invasiva en el mundo, con una experiencia acumulada de 33 pacientes(72), mostró una tasa de mejoría de 88%. De manera individual, la experiencia del grupo de Yim en Hong Kong(73,74) con pacientes sin timoma, no muestra mortalidad perioperatoria y evidencia una tasa cruda de remisión de 22%, tasa de remisión a 10 años de 75% y tasa de mejoría de 92%. Mack y su grupo(70,75), por su parte, reportaron una tasa cruda de remisión completa de 14% y una tasa de mejoría de 83%. En los últimos cinco años(76-80), otras series han mostrado tasas de remisión entre 44% y 60%, tasas de mejoría entre 84% y 100%, tiempo promedio de cirugía entre 90 y 110 minutos, y ausencia de muertes perioperatorias.
Muy pocos pacientes (2%) requieren la conversión a un procedimiento abierto, casi siempre para manejar sangrados(75). Las complicaciones que se han encontrado producto de la timectomía VATS son hemorragias intraoperatorias, neumotórax contralateral, derrames pleurales persistentes, hemotórax, neumonía, arritmias y trombosis(75,76,79). La lesión del nervio frénico es extremadamente rara utilizando esta técnica, ya que la ampliación de la imagen mediante video permite una mejor identificación de las estructuras; en una serie que combinó el abordaje VATS y la cervicotomía, se reportó una lesión del nervio laríngeo recurrente que causó disfonía permanente(80).
Algunos estudios han comparado la timectomía VATS con los abordajes abiertos(81-83) y se ha encontrado que las tasas de remisión y de mejoría con cada técnica son comparables. Por el contrario, el uso de VATS reduce el sangrado intraoperatorio, el tiempo y la cantidad de drenaje por el tubo de tórax, la estancia hospitalaria y los puntajes de las escalas análogas visuales para dolor postoperatorio(82,83).
Además, la función pulmonar postoperatoria, evaluada mediante capacidad vital forzada (CVF) y volumen espiratorio forzado en 1 segundo (VEF1), se alteran menos luego de una cirugía mínimamente invasiva mediante VATS que mediante técnicas abiertas(84,85). Se ha encontrado que la función pulmonar inmediatamente después de la cirugía se reduce en 35% en los pacientes sometidos a toracoscopia, mientras que, en los sometidos a esternotomía, disminuye 65%. En el tercer día postoperatorio, la función pulmonar se recupera en todos los pacientes sometidos a toracoscopia y sólo en 55% de los que recibieron esternotomía(85).
Como cualquier otra actividad humana, la cirugía tiene curvas de aprendizaje: entre más procedimientos quirúrgicos se realicen, mayor será la habilidad y el éxito en su realización. Esto se evaluó para la timectomía VATS muy recientemente(86) y se encontró que un cirujano tiene tasas de éxito de 80%, 90% y 98%, luego de realizar las primeras 30 timectomías VATS, las siguientes 30-60 y luego de 60 procedimientos, respectivamente. Asimismo, se encontró que los puntajes de las escalas análogas visuales para dolor, el drenaje por el tubo de tórax y la estancia hospitalaria, se reducen consistentemente a medida que se avanza en la realización de este procedimiento(86).
En los últimos años, la cirugía de tórax mínimamente invasiva ha visto la entrada en escena de algunos robots (sistema quirúrgico da Vinci) que asisten en la realización de procedimientos quirúrgicos. La primera timectomía realizada con asistencia de robots, fue practicada en 2001; se trataba de un hombre de 74 años con un timoma de 2,5 cm (estado I de Masaoka)(87). Otros estudios han reportado su experiencia con pocos pacientes e incluso han comparado la timectomía VATS con asistencia robótica, contra los procedimientos abiertos convencionales (88-90) y los han encontrado comparables respecto a tasas de remisión y mejoría.
Conclusiones y perspectivas
La miastenia gravis es una enfermedad autoinmune que produce incapacidad, en la cual se ha observado que el timo juega cierto papel en su patogenia. A pesar de las numerosas investigaciones básicas y clínicas que proponen al timo como órgano central de la respuesta autoinmune, aún no hay certeza de esto y toda la evidencia, aunque sólida, se considera circunstancial.
A pesar de que existen diferentes tratamientos médicos para el manejo de la miastenia gravis, la mayoría no afecta significativamente el curso clínico de la enfermedad y se limita solamente a controlar los síntomas. Por otra parte, el tratamiento quirúrgico, que consiste en la extirpación del timo y del tejido adiposo del mediastino anterior (timectomía extendida), ha demostrado ser útil para alterar el curso de la enfermedad, al obtener la remisión completa (pacientes sin síntomas y sin tomar medicamentos) o la mejoría de los síntomas a largo plazo.
Sin embargo, a través de la historia de la investigación de la timectomía en la miastenia gravis, ha sido un problema la falta de estudios prospectivos, con buen tamaño de muestra, con asignación aleatoria, controlados, con evaluación incógnita de los desenlaces y con criterios clínicos unificados, que determinen de una buena vez el efecto de esta intervención. Actualmente, se está llevando a cabo un esfuerzo multinacional(91), con 79 centros participantes en 23 países de los cinco continentes, que busca evaluar la efectividad de la timectomía más prednisona comparándola con la de la prednisona sola en pacientes con miastenia gravis sin timoma; este gran ensayo clínico se encuentra en la etapa de reclutamiento y la fecha anticipada de finalización es noviembre de 2009, por lo que sus resultados todavía están lejos de conocerse. Colombia no se encuentra en la lista de países participantes hasta abril de 2009(91,92); por América Latina participan Argentina, Brasil, Chile y México.
Por lo tanto, se considera que a todos los enfermos con miastenia gravis generalizada y a una gran proporción de aquéllos con miastenia gravis ocular (que, en su gran mayoría, terminará generalizándose), se les debe ofrecer la opción de someterse a una timectomía extendida. Actualmente, existen técnicas mínimamente invasivas como la timectomía VATS, que ofrecen buenos resultados, con menos complicaciones y mejor estética para el paciente, por lo que este abordaje, a la luz de la evidencia o falta de evidencia actual, debería ser uno de los preferidos. De cualquier manera, la vía de abordaje para la timectomía debe ser una decisión concertada entre el paciente y el cirujano.
Agradecimientos
A Daniel Uribe, por su asistencia técnica con la edición de imágenes.
Conflictos de intereses
Ninguno hasta el momento.
Referencias
1. DRACHMAN DB. Myasthenia gravis. N Engl J Med. 1994;330:1797-810. [ Links ]
2. CONTI-FINE BM., MILANI M., KAMINSKI HJ. Myasthenia gravis: past, present, and future. J Clin Invest. 2006;116:2843-54. [ Links ]
3. FLACHENECKER P. Epidemiology of neuroimmunological diseases. J Neurol. 2006;253(Suppl.5):V2-8. Erratum in: J Neurol. 2008;255:308. [ Links ]
4. KALB B., MATELL G., PIRSKANEN R., LAMBE M. Epidemiology of myasthenia gravis: a population-based study in Stockholm, Sweden. Neuroepidemiology. 2002;21:221-5. [ Links ]
5. OÖPIK M., PUKSA L., LÜÜS SM., KAASIK AE., JAKOBSEN J. Clinical and laboratory-reconfirmed myasthenia gravis: a population-based study. Eur J Neurol. 2008;15:246-52. [ Links ]
6. BATEMAN KJ., SCHINKEL M., LITTLE F., LIEBENBERG L., VINCENT A., HECKMANN JM. Incidence of seropositive myasthenia gravis in Cape Town and South Africa. S Afr Med J. 2007;97:959-62. [ Links ]
7. MANTEGAZZA R., BEGHI E., PAREYSON D., ANTOZZI C., PELUCHETTI D., SGHIRLANZONI A., et al. A multicentre follow-up study of 1152 patients with myasthenia gravis in Italy. J Neurol. 1990;237:339-44. [ Links ]
8. ZHANG X., YANG M., XU J., ZHANG M., LANG B., WANG W., et al. Clinical and serological study of myasthenia gravis in HuBei Province, China. J Neurol Neurosurg Psychiatry. 2007;78:386-90. [ Links ]
9. SÁNCHEZ JL., URIBE CS., FRANCO A., JIMÉNEZ ME., ARCOS-BURGOS M., PALACIO LG. Prevalencia de la miastenia gravis en Antioquia, Colombia. Rev Neurol. 2002;34:1010-2. [ Links ]
10. NIKS EH., KUKS JB., VERSCHUUREN JJ. Epidemiology of myasthenia gravis with anti-muscle specific kinase antibodies in The Netherlands. J Neurol Neurosurg Psychiatry. 2007;78:417-8. [ Links ]
11. OWE JF., DALTVEIT AK., GILHUS NE. Causes of death among patients with myasthenia gravis in Norway between 1951 and 2001. J Neurol Neurosurg Psychiatry. 2006;77:203-7. [ Links ]
12. HILL M., BEN-SHLOMO Y. Neurological care and risk of hospital mortality for patients with myasthenia gravis in England. J Neurol Neurosurg Psychiatry. 2008;79:421-5. [ Links ]
13. VINCENT A. Immunology of disorders of neuromuscular transmission. Acta Neurol Scand. 2006;183(Suppl.):1-7. [ Links ]
14. RAGHEB S., LISAK RP. The thymus and myasthenia gravis. Chest Surg Clin N Am. 2001;11:311-27. [ Links ]
15. CASTELLANO JE., BENITO MA., RAMÍREZ R. Receptores nicotínicos neuronales. Rev Fac Med. 2001;49:155-61. [ Links ]
16. RAICA M., CIMPEAN AM., RIBATTI D. Myasthenia gravis and the thymus gland. A historical review. Clin Exp Med. 2008;8:61-4. [ Links ]
17. YOUNGER DS., RAKSADAWAN N. Medical therapies in myasthenia gravis. Chest Surg Clin N Am. 2001;11:329-36. [ Links ]
18. LEVINSON AI., SONG D., GAULTON G., ZHENG Y. The intrathymic pathogenesis of myasthenia gravis. Clin Dev Immunol. 2004;11:215-20. [ Links ]
19. MELMS A., LUTHER C., STOECKLE C., PÖSCHEL S., SCHROTH P., VARGA M., et al. Thymus and myasthenia gravis: antigen processing in the human thymus and the consequences for the generation of autoreactive T cells. Acta Neurol Scand. 2006;183(Suppl.):12-3. [ Links ]
20. HOHLFELD R, WEKERLE H. Reflections on the "intrathymic pathogenesis" of myasthenia gravis. J Neuroimmunol. 2008;201- 202:21-7. [ Links ]
21. YOUNGER DS., RAKSADAWAN N. Medical therapies in myasthenia gravis. Chest Surg Clin N Am. 2001;11:329-36. [ Links ]
22. BIRD SJ. Diagnosis of myasthenia gravis. UpToDate 2008;16.2. [ Links ]
23. JARETZKI A 3RD., BAROHN RJ., ERNSTOFF RM., KAMINSKI HJ., KEESEY JC., PENN AS., et al. Myasthenia gravis: recommendations for clinical research standards. Task Force of the Medical Scientific Advisory Board of the Myasthenia Gravis Foundation of America. Neurology. 2000;55:16-23. [ Links ]
24. MEHNDIRATTA MM., KUNTZER T., PANDEY S. Anticholinesterase treatment for myasthenia gravis (Protocol). Cochrane Database Syst Rev. 2008;(1):CD006986. [ Links ]
25. SCHNEIDER-GOLD C., GAJDOS P., TOYKA KV., HOHLFELD RR. Corticosteroids for myasthenia gravis. Cochrane Database Syst Rev. 2005;(2):CD002828. [ Links ]
26. HART IK., SATHASIVAM S., SHARSHAR T. Immunosuppressive agents for myasthenia gravis. Cochrane Database Syst Rev. 2007;(4):CD005224. [ Links ]
27. GAJDOS P., CHEVRET S., TOYKA K. Plasma exchange for myasthenia gravis. Cochrane Database Syst Rev. 2002;(4):CD002275. [ Links ]
28. GAJDOS P., CHEVRET S., TOYKA K. Intravenous immunoglobulin for myasthenia gravis. Cochrane Database Syst Rev. 2008;(1):CD002277. [ Links ]
29. GROB D., BRUNNER N., NAMBA T., PAGALA M. Lifetime course of myasthenia gravis. Muscle Nerve. 2008;37:141-9. 30. MASAOKA A. Extended trans-sternal thymectomy for myasthenia gravis. Chest Surg Clin N Am. 2001;11:369-87. [ Links ] [ Links ]
31. BLALOCK A., MASON MF., MORGAN HJ., RIVEN SS. Myasthenia gravis and tumors of the thymic region. Report of a case in which the tumor was removed. Ann Surg. 1939;110:544-61. [ Links ]
32. BLALOCK A. Thymectomy in the treatment of myasthenia gravis: report of 20 cases. J Thorac Surg. 1944;13:316-39. [ Links ]
33. HARVEY AM., LILIENTHAL JL., TALBOT SA. Observations on the nature of myasthenia gravis. The effect of thymectomy on neuromuscular transmission. J Clin Invest. 1942;21:579-88. [ Links ]
34. KEYNES G. The results of thymectomy in myasthenia gravis. BMJ. 1949;2:611-6. 35. KIRSCHNER PA. Studies in myasthenia gravis. Transcervical total thymectomy. JAMA. 1969;209:906-10. [ Links ] [ Links ]
36. MASAOKA A., NAGAOKA Y., KOTAKE Y. Distribution of thymic tissue at the anterior mediastinum. Current procedures in thymectomy. J Thorac Cardiovasc Surg. 1975;70:747-54. [ Links ]
37. MASAOKA A., MONDEN Y. Comparison of the results of transsternal simple, transcervical simple, and extended thymectomy. Ann N Y Acad Sci. 1981;377:755-65. [ Links ]
38. CICCONE AM., MEYERS BF. Transsternal thymectomy. Operative Techniques in Thoracic and Cardiovascular Surgery. 2001;6:190- 200. [ Links ]
39. KERNSTINE KH. Preoperative preparation of the patient with myasthenia gravis. Thorac Surg Clin. 2005;15:287-95. [ Links ]
40. BERTORINI TE. Perisurgical management of patients with neuromuscular disorders. Neurol Clin. 2004;22:293-313. [ Links ]
41. MASAOKA A., YAMAKAWA Y., NIWA H., FUKAI I., KONDO S., KOBAYASHI M., et al. Extended thymectomy for myasthenia gravis patients: a 20-year review. Ann Thorac Surg. 1996;62:853-9. [ Links ]
42. OZDEMIR N., KARA M., DIKMEN E., NADIR A., AKAL M., YÜCEMEN N., et al. Predictors of clinical outcome following extended thymectomy in myasthenia gravis. Eur J Cardiothorac Surg. 2003;23:233-7. [ Links ]
43. TANSEL T., ONURSAL E., BARLAS S., TIRELI E., ALPAGUT U. Results of surgical treatment for nonthymomatous myasthenia gravis. Surg Today. 2003;33:666-70. [ Links ]
44. ZIELIÑSKI M., KUZDZAL J., SZLUBOWSKI A., SOJA J. Comparison of late results of basic transsternal and extended transsternal thymectomies in the treatment of myasthenia gravis. Ann Thorac Surg. 2004;78:253-8. [ Links ]
45. GUILLERMO GR., TÉLLEZ-ZENTENO JF., WEDER-CISNEROS N., MIMENZA A., ESTAÑOL B., REMES-TROCHE JM., et al. Response of thymectomy: clinical and pathological characteristics among seronegative and seropositive myasthenia gravis patients. Acta Neurol Scand. 2004;109:217-21. [ Links ]
46. HUANG CS., HSU HS., HUANG BS., LEE HC., KAO KP., HSU WH., et al. Factors influencing the outcome of transsternal thymectomy for myasthenia gravis. Acta Neurol Scand 2005;112(2):108-14. [ Links ]
47. SHAHRIZAILA N., PACHECO OA., VIDAL DG., MIYARES FR., WILLS AJ. Thymectomy in myasthenia gravis: comparison of outcome in Santiago, Cuba and Nottingham, UK. J Neurol. 2005;252:1262-6. [ Links ]
48. PARK IK., CHOI SS., LEE JG., KIM DJ., CHUNG KY. Complete stable remission after extended transsternal thymectomy in myasthenia gravis. Eur J Cardiothorac Surg. 2006;30:525-8. [ Links ]
49. KATTACH H., ANASTASIADIS K., CLEUZIOU J., BUCKLEY C., SHINE B., PILLAI R., et al. Transsternal thymectomy for myasthenia gravis: surgical outcome. Ann Thorac Surg. 2006;81:305-8. [ Links ]
50. KIM HK., PARK MS., CHOI YS., KIM K., SHIM YM., HAN J., et al. Neurologic outcomes of thymectomy in myasthenia gravis: comparative analysis of the effect of thymoma. J Thorac Cardiovasc Surg. 2007;134:601-7. [ Links ]
51. RUIZ JR RL., REIBSCHEID SM., CATANEO AJM., REZENDE LA. Resultado da timectomía ampliada no tratamento de pacientes com Miastenia gravis. J Bras Pneumol. 2004;30:115-20. [ Links ]
52. ESSA M., EL-MEDANY Y., HAJJAR W., HARIRI Z., AL-MULHIM F., SALIH M., et al. Maximal thymectomy in children with myasthenia gravis. Eur J Cardiothorac Surg. 2003;24:187-9. [ Links ]
53. TSUCHIDA M., YAMATO Y., SOUMA T., YOSHIYA K., WATANABE T., AOKI T., et al. Efficacy and safety of extended thymectomy for elderly patients with myasthenia gravis. Ann Thorac Surg. 1999;67:1563-7. [ Links ]
54. ABT PL., PATEL HJ., MARSH A., SCHWARTZ SI. Analysis of thymectomy for myasthenia gravis in older patients: a 20-year single institution experience. J Am Coll Surg. 2001;192:459-64. [ Links ]
55. DE PERROT M., LICKER M., SPILIOPOULOS A. Factors influencing improvement and remission rates after thymectomy for myasthenia gravis. Respiration. 2001;68:601-5. [ Links ]
56. PONSETI JM., GAMEZ J., VILALLONGA R., RUIZ C., AZEM J., LÓPEZCANO M., et al. Influence of ectopic thymic tissue on clinical outcome following extended thymectomy in generalized seropositive nonthymomatous myasthenia gravis. Eur J Cardiothorac Surg. 2008;34:1062-7. [ Links ]
57. BUDDE JM., MORRIS CD., GAL AA., MANSOUR KA., MILLER JI JR. Predictors of outcome in thymectomy for myasthenia gravis. Ann Thorac Surg. 2001;72:197-202. [ Links ]
58. REMES-TROCHE JM., TÉLLEZ-ZENTENO JF., ESTAÑOL B., GARDUÑOESPINOZA J., GARCÍA-RAMOS G. Thymectomy in myasthenia gravis: response, complications, and associated conditions. Arch Med Res. 2002;33:545-51. [ Links ]
59. YUAN HK., HUANG BS., KUNG SY., KAO KP. The effectiveness of thymectomy on seronegative generalized myasthenia gravis: comparing with seropositive cases. Acta Neurol Scand. 2007;115:181-4. [ Links ]
60. SOLEIMANI A., MOAYYERI A., AKHONDZADEH S., SADATSAFAVI M., TAVAKOLI SHALMANI H., SOLTANZADEH A. Frequency of myasthenic crisis in relation to thymectomy in generalized myasthenia gravis: a 17-year experience. BMC Neurol. 2004;4:12. [ Links ]
61. KAS J., KISS D., SIMON V., SVASTICS E., MAJOR L., SZOBOR A. Decade-long experience with surgical therapy of myasthenia gravis: early complications of 324 transsternal thymectomies. Ann Thorac Surg. 2001;72:1691-7. [ Links ]
62. WATANABE A., WATANABE T., OBAMA T., MAWATARI T., OHSAWA H., ICHIMIYA Y., et al. Prognostic factors for myasthenic crisis after transsternal thymectomy in patients with myasthenia gravis. J Thorac Cardiovasc Surg. 2004;127:868-76. [ Links ]
63. JARETZKI A 3RD., PENN AS., YOUNGER DS., WOLFF M., OLARTE MR., LOVELACE RE., et al. "Maximal" thymectomy for myasthenia gravis. Results. J Thorac Cardiovasc Surg. 1988;95:747-57. [ Links ]
64. CALHOUN RF., RITTER JH., GUTHRIE TJ., PESTRONK A., MEYERS BF., PATTERSON GA., et al. Results of transcervical thymectomy for myasthenia gravis in 100 consecutive patients. Ann Surg. 1999;230:555-9. [ Links ]
65. SHRAGER JB., NATHAN D., BRINSTER CJ., YOUSUF O., SPENCE A., CHEN Z., et al. Outcomes after 151 extended transcervical thymectomies for myasthenia gravis. Ann Thorac Surg. 2006;82:1863-9. [ Links ]
66. GUO W., ZHAO YP., JIANG YG., FAN SZ., WANG RW., LI ZP. Thymectomy: a potential therapeutic method for autoimmune diseases besides myasthenia gravis. Med Hypotheses. 2008;70:1072-3. [ Links ]
67. ROVIARO G., VAROLI F., NUCCA O., VERGANI C., MACIOCCO M. Videothoracoscopic approach to primary mediastinal pathology. Chest. 2000;117:1179-83. [ Links ]
68. YIM APC., IZZAT MB. VATS approach to the thymus. En: Yim APC, Hazelrigg SR, Izzat MB, Landreneau RJ, Mack MJ, Naunheim KS, eds. Minimal access cardiothoracic surgery. Philadelphia, PA: W.B. Saunders; 2000. p. 209-20. [ Links ]
69. YIM AP. Paradigm shift in surgical approaches to thymectomy. ANZ J Surg. 2002;72:40-5. [ Links ]
70. MACK MJ. Video-assisted thoracoscopy thymectomy for myasthenia gravis. Chest Surg Clin N Am. 2001;11:389-405. [ Links ]
71. MINEO TC., POMPEO E., LERUT TE., BERNARDI G., COOSEMANS W., NOFRONI I. Thoracoscopic thymectomy in autoimmune myasthesia: results of left-sided approach. Ann Thorac Surg. 2000;69:1537-41. [ Links ]
72. MACK MJ., LANDRENEAU RJ., YIM AP., HAZELRIGG SR., SCRUGGS GR. Results of video-assisted thymectomy in patients with myasthenia gravis. J Thorac Cardiovasc Surg. 1996;112:1352-9. [ Links ]
73. YIM AP., KAY RL., HO JK. Video-assisted thoracoscopic thymectomy for myasthenia gravis. Chest. 1995;108:1440-3. [ Links ]
74. MANLULU A., LEE TW., WAN I., LAW CY., CHANG C., GARZON JC., et al. Video-assisted thoracic surgery thymectomy for nonthymomatous myasthenia gravis. Chest. 2005;128:3454-60. [ Links ]
75. SAVCENKO M., WENDT GK., PRINCE SL., MACK MJ. Videoassisted thymectomy for myasthenia gravis: an update of a single institution experience. Eur J Cardiothorac Surg. 2002;22:978-83. [ Links ]
76. LOSCERTALES J., AYARRA J., CONGREGADO M., ARROYO A., JIMÉNEZ R., GIRÓN JC., et al. Video-assisted thoracoscopic thymectomy for the treatment of myasthenia gravis. Arch Bronconeumol. 2004;40:409-13. [ Links ]
77. TOMULESCU V., ION V., KOSA A., SGARBURA O., POPESCU I. Thoracoscopic thymectomy mid-term results. Ann Thorac Surg. 2006;82:1003-7. [ Links ]
78. TOKER A., TANJU S., SUNGUR Z., PARMAN Y., SENTURK M., SERDAROGLU P., et al. Videothoracoscopic thymectomy for nonthymomatous myasthenia gravis: results of 90 patients. Surg Endosc. 2008;22:912-6. [ Links ]
79. BACHMANN K., BURKHARDT D., SCHREITER I., KAIFI J., BUSCH C., THAYSSEN G., et al. Long-term outcome and quality of life after open and thoracoscopic thymectomy for myasthenia gravis: analysis of 131 patients. Surg Endosc. 2008;22:2470-7. [ Links ]
80. SAITO EH., HIGA C., NUNES RA., MAGALHAES GC., VAZ LCA., CERVANTE VF. Timectomia estendida por cirugía torácica videoassistida e cervicotomía no tratamiento da miastenia. J Pneumol. 2003;29:273-9. [ Links ]
81. MANTEGAZZA R., BAGGI F., BERNASCONI P., ANTOZZI C., CONFALONIERI P., NOVELLINO L., et al. Video-assisted thoracoscopic extended thymectomy and extended transsternal thymectomy (T-3b) in non-thymomatous myasthenia gravis patients: remission after 6 years of follow-up. J Neurol Sci. 2003;212:31-6. [ Links ]
82. TOKER A., EROGLU O., ZIYADE S., TANJU S., SENTURK M., DILEGE S., et al. Comparison of early postoperative results of thymectomy: partial sternotomy vs. videothoracoscopy. Thorac Cardiovasc Surg. 2005;53:110-3. [ Links ]
83. WAGNER AJ., CORTES RA., STROBER J., GRETHEL EJ., CLIFTON MS., HARRISON MR., et al. Long-term follow-up after thymectomy for myasthenia gravis: thoracoscopic vs. open. J Pediatr Surg. 2006;41:50-4. [ Links ]
84. KASEDA S., AOKI T., HANGAI N., SHIMIZU K. Better pulmonary function and prognosis with video-assisted thoracic surgery than with thoracotomy. Ann Thorac Surg. 2000;70:1644-6. [ Links ]
85. RÜCKERT JC., WALTER M., MÜLLER JM. Pulmonary function after thoracoscopic thymectomy versus median sternotomy for myasthenia gravis. Ann Thorac Surg. 2000;70:1656-61. [ Links ]
86. TOKER A., TANJU S., ZIYADE S., KAYA S., DILEGE S. Learning curve in videothoracoscopic thymectomy: how many operations and in which situations? Eur J Cardiothorac Surg. 2008;34:155-8. [ Links ]
87. KERNSTINE KH. Robotics in thoracic surgery. Am J Surg. 2004;118(suppl.):89S-97S. [ Links ]
88. SAVITT MA., GAO G., FURNARY AP., SWANSON J., GATELY HL., HANDY JR. Application of robotic-assisted techniques to the surgical evaluation and treatment of the anterior mediastinum. Ann Thorac Surg. 2005;79:450-5. [ Links ]
89. REA F., MARULLI G., BORTOLOTTI L., FELTRACCO P., ZUIN A., SARTORI F. Experience with the "da Vinci" robotic system for thymectomy in patients with myasthenia gravis: report of 33 cases. Ann Thorac Surg. 2006;81:455-9. [ Links ]
90. CAKAR F., WERNER P., AUGUSTIN F., SCHMID T., WOLF-MAGELE A., SIEB M., et al. A comparison of outcomes after robotic open extended thymectomy for myasthenia gravis. Eur J Cardiothorac Surg. 2007;31:501-4. [ Links ]
91. ABAN IB., WOLFE GI., CUTTER GR., KAMINSKI HJ., JARETZKI A 3RD., MINISMAN G., et al. The MGTX experience: Challenges in planning and executing an international, multicenter clinical trial. J Neuroimmunol. 2008;201-202:80-4. [ Links ]
92. Thymectomy Trial in Non-Thymomatous Myasthenia Gravis Patients Receiving Prednisone Therapy: Clinicaltrials.gov record (disponible en http://clinicaltrials.gov/ct2/show/record/NCT00294658). [ Links ]














