Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582On-line version ISSN 2619-6107
rev. colomb. cir. vol.25 no.1 Bogotá Jan./Mar. 2010
(1) Departamento de Cirugía, Hospital Universitario Departamental de Nariño; Unidad Médica Bariátrica; docente, Facultad de Medicina, Universidad de Nariño, Pasto, Nariño, Colombia. Miembro de la Asociación Colombiana de Cirugía.
Correspondencia: Germán Rosero, MD, MACC, Pasto, Nariño. Correo electrónico: rosero@hotmail.com
Fecha de recibo: 1 de septiembre de 2009. Fecha de aprobación: 14 de diciembre de 2009.
Resumen
Uno de los hallazgos más sorprendentes de la cirugía bariátrica es la resolución de la mayoría de las enfermedades asociadas a la obesidad, especialmente la diabetes mellitus tipo 2: se encuentran tasas de remisión completas de 84% a 98,9% de los pacientes.
Los hallazgos muestran que la remisión de la diabetes mellitus tipo 2 no puede ser explicada únicamente por los cambios de peso experimentados por los pacientes. Hay diversas teorías para la explicación de la normalización de la glucemia, como una mayor producción de incretinas (glucagon-like peptide 1, GLP-1) por parte del intestino distal, fenómenos relacionados con la exclusión del paso de nutrientes por el duodeno, hormonas como la ghrelina y otros efectos que no se han descrito.
Un campo de intensa investigación actual es el uso de procedimientos quirúrgicos para el control de la diabetes mellitus tipo 2 en los pacientes no obesos.
Palabras clave: diabetes mellitus tipo 2; obesidad; cirugía bariátrica; ghrelina.
Abstract
One of the most amazing findings in bariatric surgery is the resolution of most comorbidities associated with obesity, especially type 2 Diabetes mellitus (T2DM), with remission rates in 84 to 98.9% of the patients. The evidence shows that such remission could not be explained only by the weight loss. There are several theories for explaining the normalization of glycemia as an increase in incretins production (GLP-1) from the distal gut, phenomena related to the exclusion of the nutrients passing through duodenum, hormones like ghreline and other effects not yet descript. A field under crescent investigation is the development of surgical procedures in the management of T2DM in non obese patients.
Key words: diabetes mellitus, type 2; obesity; bariatric surgery; ghrelin.
Introducción
La diabetes mellitus tipo 2 es una epidemia global. En los Estados Unidos, se hizo este diagnóstico en 1,5 millones de personas en el año 2.007 y se esperan 48,3 millones de nuevos casos en este país para el año 2050 (1). En Colombia, se ha estimado una prevalencia de 7% de diabetes mellitus tipo 2 en la población de 30 a 64 años y es una de las diez primeras causas de mortalidad en nuestro país (2).
El riesgo de desarrollar diabetes mellitus tipo 2 en el transcurso de la vida en los Estados Unidos es de 32,8 para hombres y de 38,5 para mujeres. La obesidad está directamente relacionada con la diabetes mellitus tipo 2. En 1990, de los pacientes diagnosticados, 48% de los hombres tenía un índice de masa corporal (IMC) mayor de 27,8 kg/m2 y 58% de las mujeres tenía un IMC mayor de 27,3 kg/m2. Esto contrasta claramente con la incidencia de 33% y 36% en hombres y mujeres con diabetes mellitus tipo 2 en la década de los 70, con IMC similares (3).
La obesidad y el sobrepeso están relacionados con la aparición de la diabetes mellitus tipo 2. En un estudio de 15.000 pacientes, el riesgo relativo fue de 2,73 para pacientes con sobrepeso y se incrementó a 7,26 en pacientes con diagnóstico de obesidad.
En el National Health and Nutrition Examination Survey (NHANES) de 1999 a 2002, en Estados Unidos, 85,2% de los pacientes con diabetes mellitus tipo 2 tenía sobrepeso (IMC: 25-29,9 kg/m2) y 54,8% fueron clasificados como obesos (IMC>30 kg/m2) (4).
En el metanálisis de Buchwald, con 22.094 pacientes obesos mórbidos, se encontró que en 98,9% de los 288 pacientes (IC95% 96,8-100) sometidos a derivación biliopancreática se resolvió completamente la diabetes mellitus tipo 2. Con derivación gastroyeyunal, se resolvió en 83,7% de 989 pacientes y en 71,6% con gastroplastia vertical y 47,9% con banda gástrica.
Se podría establecer una correlación entre la disminución de peso y la resolución de la diabetes mellitus tipo 2. La disminución de peso en kilogramos fue de 60,4% para la derivación biliopancreática, de 47,7% para la derivación gastroyeyunal y de 26,6% para la banda gástrica (5).
Es interesante anotar que la resolución de la diabetes mellitus tipo 2 en pacientes sometidos a derivación gastroyeyunal ocurre usualmente a los pocos días después de cirugía, incluso antes de que se haya producido una disminución importante de peso; esto sugiere que hay diferentes vías por medio de las cuales se resuelve la diabetes mellitus tipo 2, además de la disminución de peso (6).
En un estudio clínico aleatorio desarrollado recientemente en Australia, en pacientes con IMC mayor de 30 kg/m2, se comparó la resolución de la diabetes mellitus tipo 2 (glucemia en ayunas menor de 126 mg/dl y hemoglobina glicosilada (HbA1C) menor de 6,2% sin medicación) entre aquéllos sometidos a banda gástrica y los que recibieron el mejor cuidado médico. A los dos años, en 73% (22 de 30) de los pacientes del grupo de banda gástrica se había resuelto la diabetes mellitus tipo 2, en comparación con 13% (4 de 30) en el grupo que recibió el mejor cuidado médico. La resolución de la diabetes mellitus 2 en este estudio se correlacionó con la pérdida de peso y los previos niveles bajos de hemoglobina glicosilada (HbA1C). No se encontró efecto alguno con respecto al sexo, la edad, el IMC preoperatorio, el ejercicio o los niveles del péptido C. En este estudio, se incluyeron 13 pacientes con un rango de IMC de 30 a 35 kg/m2 (7).
Fisiopatología
La diabetes mellitus tipo 2 se produce, fundamentalmente, por una falla en la secreción de insulina ante las necesidades cada vez mayores en respuesta a la resistencia periférica a la insulina en pacientes diabéticos (8). La obesidad está directamente relacionada con la diabetes mellitus tipo 2. Esto es probablemente por la resistencia del tejido adiposo a la insulina. En los sujetos diabéticos de tipo 2 no obesos, podría deberse a una secreción inadecuada de insulina. En resumen, la resistencia a la insulina es un prominente marcador biológico de la obesidad y se la define como una inadecuada respuesta a la insulina exógena o endógena (9).
Las incretinas fueron descritas inicialmente por Bayliss y Starling en 1902. Fue la primera vez que un factor producido en el intestino se describió como partícipe en la estimulación de la secreción de insulina del páncreas (10). La Barre desarrolló el concepto de “incretinas” después de que Elrick y Steimmer (11-13) demostraran que los niveles de insulina plasmática aumentaron entre 50% y 70% cuando se administró glucosa oralmente, en comparación con la administración intravenosa. A este fenómeno se le ha llamado “efecto incretina”. Las incretinas que más se han estudiado son el GLP-1 (glucagon-like peptide 1) y el GIP (glucose dependent insulinotropic polypeptide).
El GLP-1 es una hormona producida por las células L del íleon distal, principalmente. Produce estimulación de la secreción de insulina, dependiente de glucosa, de las células beta del páncreas (14,15). También mejora la sensibilidad de las células beta resistentes a la glucosa, al incrementar su respuesta a la glucosa (16). Asimismo, estimula la proliferación de células beta, inhibe la apoptosis celular incrementando la masa de células pancreáticas beta (17-20) y tiene efectos sobre el vaciamiento gástrico, retardándolo (21,22).
El GIP es producido por las células K del duodeno. Entre sus acciones está el aumento de la secreción de la insulina pancreática, dependiente de glucosa. El bloqueo de sus receptores se asocia con intolerancia a la glucosa en ratas y monos (23).
En vivo, el GIP actúa sinérgicamente con los niveles de glucosa en sangre, estimulando la proliferación de las células beta del páncreas en ratas (24). En los pacientes con diabetes mellitus tipo 2 se presenta una disminución de la secreción de insulina en respuesta a la ingestión de alimentos; en estos casos se han encontrado niveles normales o aumentados de GIP, y disminución del GLP-1 en pacientes con intolerancia a la glucosa o diabetes mellitus tipo 2 (25,26). En pacientes con diabetes mellitus tipo 2, se halla disminución de la actividad insulinotrópica del GIP, no así del GLP-1 (27).
En estudios experimentales en humanos con diabetes mellitus tipo 2 a quienes se les administró GLP-1 en inyecciones subcutáneas tres veces al día, se encontró que, tras un periodo de tres semanas de tratamiento, se normalizaron los niveles de glucemia, aumentaron los niveles de insulina plasmática y disminuyeron los niveles de glucagón (28).
Entre los agonistas del GLP-1 con posibilidad de uso terapéutico se ha estudiado la exendrina, un péptido de 36 aminoácidos, el cual se aisló originalmente del veneno de Heloderma suspectum, una especie de lagarto (Gila monster) típica de los desiertos del oeste de los Estados Unidos. En estudios preclínicos, muestra una actividad superior a la GLP-1 nativa de 10 a 100 veces, y disminuye notoriamente los niveles de glucosa en plasma (29).
En estudios clínicos, la exendrina ha mostrado una disminución de la HbA1C a niveles menores de 7% (30). Otro campo activo de investigación está en los inhibidores de la enzima que degrada el GIP y el GLP-1: la DPP4. Algunos estudios en humanos han mostrado mejoría en los niveles de glucemia después de las comidas así como una disminución de los niveles de HbA1C luego de la administración oral de DPP4 (31).
Algunos investigadores en Francia realizaron experimentos en primates, a los cuales sometieron a banda gástrica y anastomosis gastroileal con ligadura del píloro y encontraron que uno de los mecanismos más relevantes en el control de la glucemia es el de la gluconeogénesis intestinal, que se incrementa de manera importante en los animales sometidos a anastomosis gastro-ileal y no en los sometidos a banda gástrica, y que este incremento lleva a una mejoría en el metabolismo hepático de la glucosa (32).
En un interesante experimento, se estudió el efecto de la pérdida de peso producida por la derivación gastroyeyunal comparada con la dieta hipocalórica en dos grupos de mujeres obesas (n=9 Vs. 10) con diabetes mellitus 2; los dos grupos disminuyeron de peso de manera equivalente. Se encontró un aumento significativo (p>0,001), cinco veces mayor, de los niveles de GLP-1 en el grupo de pacientes sometidas a derivación gastroyeyunal y no en aquéllas sometidas a dieta hipocalórica. Los niveles de glucemia disminuyeron significativamente en el grupo sometido a derivación gastroyeyunal (p<0,001). Los autores concluyeron que los mayores niveles encontrados de incretinas GLP-1 y GIP estaban relacionados directamente con la derivación gastroyeyunal y no con la pérdida de peso en sí misma. Este aumento temprano de los niveles de incretinas puede ser directamente responsable del control de la glucemia que se observa en los diabéticos sometidos a cirugía en los primeros días y no la disminución de peso per se, por lo menos en el posoperatorio inmediato (33).
Entre las teorías que se han mencionado como posibles explicaciones para la resolución quirúrgica de la diabetes mellitus tipo 2, se pueden mencionar las siguientes.
1. Disminución de peso: la disminución de peso, con la consecuente disminución del tejido adiposo y de la resistencia periférica a la insulina (34), se ha determinado como una de las formas principales en que la diabetes mellitus tipo 2 puede tratarse en el paciente obeso. En pacientes operados con procedimientos puramente restrictivos, se han encontrado tasas de curación sorprendentes relacionadas con la disminución de peso.
En el estudio de Dixon realizado en Australia (7), se comparó prospectivamente la resolución de la diabetes mellitus tipo 2 en obesos a quienes se les colocó banda gástrica Vs. la mejor atención médica. A dos años de seguimiento, se encontró resolución de la diabetes mellitus tipo 2 en 73% de los pacientes (22 de 30) a quienes se les colocó banda gástrica y solamente en 13% de aquéllos a quienes se les brindó la mejor atención médica. La resolución de la diabetes mellitus tipo 2 se correlacionó con la pérdida de peso.
Resultados similares se han encontrado con la banda gástrica en pacientes con diabetes mellitus tipo 2, con tasas de resolución reportadas entre el 45% y el 90% (35-37).
En un interesante estudio prospectivo de Lacy et al., se compararon 39 pacientes muy obesos, con diabetes mellitus tipo 2, a quienes se les practicó una manga gástrica (sleeve gastrectomy) Vs. 52 pacientes obesos con diabetes mellitus 2 a quienes se les practicó derivación gastroyeyunal. Ambos grupos fueron comparables en cuanto a tiempo previo de la diabetes mellitus tipo 2 y tipo de tratamiento. La diabetes mellitus 2 se resolvió en 33 (84,6%) de los 39 pacientes con manga gástrica y en 44 (84,6%) de los 52 pacientes sometidos a derivación gastroyeyunal. Concluyen los autores que, a los 12 meses, la manga gástrica y la derivación gastroyeyunal son igualmente efectivas en el control de la diabetes mellitus tipo 2 en pacientes muy obesos (38).
2. Teoría de la exclusión duodenal (upper intestinal theory): con los extraordinarios resultados de curación de la diabetes mellitus tipo 2 en pacientes obesos sometidos a derivación gastroyeyunal con tasas de curación superiores al 80% (5), encontrándose resolución o mejoría de la enfermedad días a semanas después del procedimiento quirúrgico antes de que hubiera una pérdida significativa de peso, se alentó la investigación de posibles mecanismos que explicasen este fenómeno.
La teoría de la exclusión duodenal fue liderada por Francesco Rubino, quien realizó este procedimiento en ratas Goto Kakizaki diabéticas no obesas con estómago intacto y demostró mejoría de la tolerancia a la glucosa una semana después de la cirugía, la cual persistió, al menos, por nueve meses, lo cual no sucedió en los controles sometidos a restricción calórica u operaciones de control (39). La teoría de las anti-incretinas de Rubino afirma que el GLP-1 y el GIP, son contrarreguladas por anti-incretinas, las cuales se producirían en el intestino proximal en respuesta al aumento de la estimulación por el alimento. De acuerdo con Rubino, la producción de estas substancias sería mayor que la de incretinas. La consecuencia de esta sobreproducción de anti-incretinas sería la disminución de la secreción y de la acción de la insulina y, finalmente, la disminución de la masa de células pancreáticas beta, lo que lleva al estado diabético. Como sucede en la derivación, la exclusión duodenal corregiría esta situación —evitando la excesiva producción de anti-incretinas—, lo cual lleva a la curación de la diabetes mellitus tipo 2 (40).
3. Malabsorción: la derivación biliopancreática con switch duodenal es uno de los procedimientos más efectivos en el tratamiento de la diabetes mellitus tipo 2 en pacientes obesos.
En el metanálisis de Buchwald se reportaron tasas de resolución de hasta de 98,9%. En una reciente revisión retrospectiva de 443 pacientes obesos con diabetes mellitus tipo 2 tratados con derivación biliopancreática, Scopinaro mostró tasas de resolución de 74%, 97% y 91%, a 1 mes, 10 años y 20 años, respectivamente. En este artículo el autor plantea la hipótesis de que, además de los cambios hormonales causados por la exclusión del intestino proximal y la estimulación del intestino delgado distal, el mecanismo por el cual se explicarían las tasas de resolución de casi el 100% sería la mínima absorción de grasas, menor de 40 g al día. Esto conduciría a una disminución importante de la grasa del miocito, lo cual disminuye la resistencia a la insulina y mejora el uso de la glucosa como combustible de los miocitos (41).
4. Estimulación del intestino delgado distal (hindgut theory): en términos generales, en esta hipótesis se considera que las dietas modernas muy refinadas y “predigeridas”, pobres en fibra y residuos, producen un aumento de la estimulación del intestino proximal y una pobre estimulación del intestino distal, con la consiguiente pérdida de la regulación hormonal. Se han reportado aumentos significativos de GLP-1 en pacientes sometidos a derivación yeyunoileal hasta 30 años después de la cirugía (42). Este aumento de los niveles de GLP-1 podría ser uno de los mecanismos de control de la diabetes mellitus tipo 2. Mason ya había propuesto la interposición del íleon como mecanismo de tratamiento de la diabetes mellitus tipo 2.
En estudios de experimentación animal en ratas Goto Kakizaki, la interposición del íleon mostró una mejoría en la tolerancia a la glucosa, sin otras alteraciones metabólicas.
Finalmente, DePaula, en Brasil, ha desarrollado el concepto de freno neuroendocrino (neuroendocrine brake) (43). Dos técnicas quirúrgicas distintas describen este concepto. En la II-SG (ileal interposition sleeve gastrectomy) se realiza una gastrectomía tipo manga más interposición del íleon de un segmento de íleon distal de 100 cm al yeyuno proximal. En la segunda técnica, llamada II-DSG (ileal interposition - diverted sleeve gastrectomy), se realiza una gastrectomía tipo manga, seccionando el duodeno hasta 3 a 4 cm distal al píloro. Se interpone un asa de íleon distal de 100 cm, se anastomosa al duodeno; el asa biliopancreática, 50 cm distal al ligamento de Treitz, se anastomosa al íleon interpuesto.
Con estas dos técnicas, DePaula et al. operaron 39 pacientes con diabetes mellitus tipo 2 de, por lo menos, 3 años de evolución, con IMC de 30,1 kg/m2 (rango 23,4-34,9) y tratamiento con insulina o hipoglucemiantes orales por un año antes de la cirugía. Con un seguimiento promedio de 7 meses, se encontró que 86,9% suspendió el uso de agentes hipoglucemiantes o insulina con adecuado control de su glucemia y el 13,1% permaneció usando un solo agente hipoglucemiante. La morbilidad en este estudio fue de 10,3% y la mortalidad fue de 2,6% (44).
5. Adaptación digestiva: este término fue utilizado por Santoro en una interesante propuesta antropológica, la cual refiere que los primates inferiores que consumen dietas crudas poco refinadas, poseen tubos digestivos más largos que los homínidos superiores que ingieren una cantidad proteica mayor (45,46). El hombre moderno consume dietas refinadas, “predigeridas” y cocinadas, las cuales se absorben casi en su totalidad, proximalmente, con poco estímulo del intestino distal, lo que produce una pobre secreción de GLP-1 y PYY. De esta forma, al estimular el intestino delgado distal, la “adaptación digestiva” trata de reducir el intestino delgado proximal, por medio de diferentes procedimientos, así:
- grado IA: manga gástrica
- grado IB: manga gástrica más omentectomía,
- grado II: manga gástrica más yeyunectomía parcial,
- grado IIIA: grado II más bipartición del tránsito intestinal (derivación biliopancreática parcial) (figura 1) y
- grado IIIB: manga gástrica más omentectomía más bipartición sin yeyunectomía.
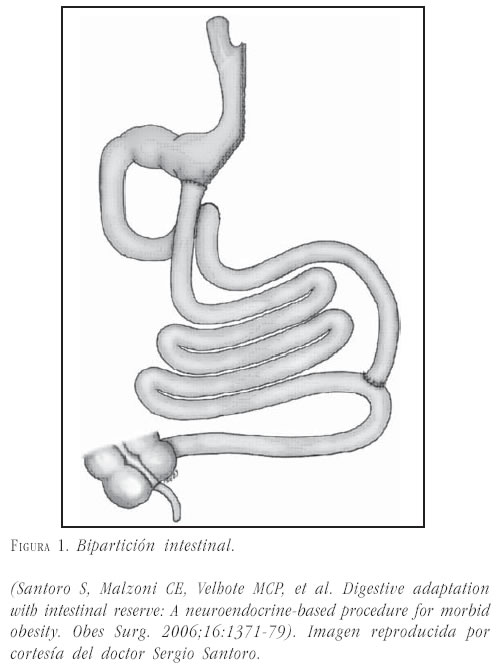
En un reporte de Santoro, con el uso de estos conceptos, fueron intervenidos 228 pacientes, con IMC de 35 a 51 kg/m2. Se utilizó un procedimiento mixto, abierto y por laparoscopia, realizando una gastrectomía por laparoscopia tipo manga y, mediante una minilaparotomía, resección de yeyuno conservando 40 cm proximales de yeyuno y los últimos 260 cm del íleon distal. Así, sólo dejaron 300 cm de intestino delgado. De estos pacientes, 75 tenían diabetes mellitus tipo 2; el 92% resolvió su cuadro de diabetes mellitus tipo 2 y 6 mejoraron con medicación (47). En la actualidad, el procedimiento más empleado por este grupo es la bipartición del tránsito intestinal (48).
Experiencia en el manejo quirúrgico de la diabetes mellitus tipo 2 en pacientes no obesos, con diferentes procedimientos
Derivación biliopancreática
Scopinaro reportó siete pacientes diabéticos de tipo 2, a quienes se les sometió a derivación biliopancreática. En cinco de ellos se diagnosticó diabetes mellitus tipo 2 de 4 a 10 años antes de la cirugía y estaban siendo tratados con hipoglucemiantes orales. En los dos restantes se hizo el diagnóstico durante la valoración prequirúrgica. El seguimiento fue de 13 años (rango de 10 a 18 años). La diabetes mellitus tipo 2 se resolvió en el 100% de los pacientes; todos se encontraban con dieta libre y sin medicación. El peso promedio de los pacientes bajó de 92 kg a 75 kg. Ninguno de ellos perdió peso en exceso y la pérdida de peso se correlacionó directamente con el IMC inicial (49).
Derivación gastroyeyunal
Cohen, de Brasil, reportó un grupo de 37 pacientes con diagnóstico de diabetes mellitus tipo 2 tratados con, al menos, dos agentes hipoglucemiantes orales, ninguno con insulina, quienes fueron sometidos a derivación gastroyeyunal. La edad promedio fue de 34 años (28 a 45), el IMC preoperatorio fue de 32,5±0,88 (32 a 34,9) y el tiempo de seguimiento fue de 6 a 48 meses. El tratamiento quirúrgico resolvió la diabetes mellitus tipo 2 en todos los pacientes y la pérdida promedio de peso excesivo fue de 81% (50).
Derivación duodenoyeyunal
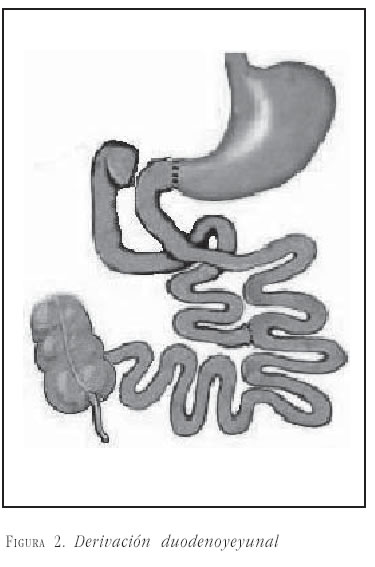
En un interesante artículo, Cohen, Rubino et al. reportaron el seguimiento de 2 de 7 pacientes a quienes se les realizó derivación duodenoyeyunal por laparoscopia (figura 2). La técnica consistió en un abordaje estándar de cinco puertos, con sección del duodeno y una duodenoyeyunostomía término-terminal con anastomosis del asa biliopancreática a 50 cm de la anastomosis proximal. Los pacientes tenían un IMC de 27 y 29 kg/m2, diabetes mellitus tipo 2 de duración de 2 y 7 años, y fueron tratados con 22 IU de Humulin®, y 850 mg/día de metformina, el primero, y rosiglitazone 4 mg/día, el segundo paciente. A los 9 meses de seguimiento, se encontró resolución de la diabetes mellitus tipo 2 en ambos, sin medicamentos y con Hb1Ac de 5 y 5,7 (IMC de 27 y 29,5 kg/m2, respectivamente) (51).
Exclusión duodenal
Ramos describió 20 pacientes con diabetes mellitus tipo 2 e IMC promedio de 27,1 (rango 25 a 30), quienes se sometieron a exclusión duodenoyeyunal por laparoscopia. La glucemia en ayunas, después de tres a seis meses de seguimiento, varió de 171,3 mg/dl (127 a 242) en el preoperatorio, a 107,1 mg/dl (82 a 145) en el tercer mes posoperatorio y a 96,3 mg/dl al sexto mes. Sólo dos pacientes (10%) permanecieron con metformina seis meses después de la cirugía (52).
Interposición del íleon combinada con gastrectomía tipo manga (II-DSG)
En una reciente publicación, DePaula et al. presentaron los resultados de 69 pacientes con diabetes mellitus tipo 2 con mínimo 3 años de duración e IMC de 25,7 (rango 41 a 63), a quienes se les realizó una II-DSG. En ésta se formó una manga gástrica con sección del duodeno y se dejó un segmento libre de íleon de 170 cm, cuya sección distal a 30 cm de la válvula ileocecal se anastomosó al duodeno en forma término-lateral. La continuidad del intestino delgado se estableció con una anastomosis término-terminal íleon-yeyuno, con un asa de yeyuno a 50 cm del ángulo de Treitz anastomosada al íleon distal interpuesto. En total, fueron siete líneas de sutura.
Después de un seguimiento promedio de 21,7 meses (rango, 7 a 42 meses), el 95,7% de los pacientes tuvo un control adecuado de la diabetes mellitus sin medicación con los siguientes resultados: HbA1c menor de 6 en el 65,2% de los pacientes, HbA1c de 6,1 a 7 en el 30,5% y HbA1c mayor de 7 en el 4,3% de los pacientes. El IMC preoperatorio disminuyó de 25,7±1,9 kg/m2 (rango, 21,8 a 29,2) a 21,8±4,1 kg/m2 (rango, 17,7 a 25,8) después del procedimiento. (53).
Modelo de investigación animal propuesto en el Hospital Universitario Departamental de Nariño, Universidad de Nariño
En la fisiopatogenia de la diabetes mellitus tipo 2, básicamente, hay una alteración en cuatro variables: entrega de la glucosa, sensibilidad de la insulina, niveles de insulina y regulación de la relación glucagón/incretinas (54).
Uno de los factores importantes en la resolución de la diabetes mellitus tipo 2 en los pacientes obesos (IMC>30 kg/m2) y con sobrepeso (IMC: 25-29,9 kg/m2), es la disminución del aporte calórico y, por consiguiente, la oferta y la entrega de glucosa (55). Ambos, la disminución de peso y la restricción calórica, son unos de los principales factores en el control y mejoría de la diabetes mellitus tipo 2 (56,57).
Se ha visto que con el uso de los procedimientos restrictivos puros, como la banda gástrica, se logran tasas de curación entre el 45% y el 90%. Es así como un procedimiento restrictivo como la manga gástrica, en pacientes con sobrepeso y probable resistencia a la insulina, es la primera línea para la curación de la diabetes mellitus tipo 2 y, por esta razón, la proponemos en conjunto con una duodenoyeyunostomía en asa.
La disminución de peso con la gastrectomía en manga, en pacientes no obesos mórbidos, no es tan importante como en los obesos mórbidos. En el estudio de DePaula, los diabéticos sometidos a interposición de íleon más manga gástrica, disminuyeron su peso de un IMC preoperatorio medio de 25,7±1,9 a 21,8±4,1 después de la cirugía (51). Además, la ghrelina se ha visto implicada en la inhibición de la secreción de insulina en humanos, induciendo hiperglucemia. Los niveles de ghrelina disminuyen significativamente después de una gastrectomía tipo manga (58-60).
Técnica quirúrgica
Estamos proponiendo una anastomosis duodenoyeyunal, preservando los primeros 3 cm del duodeno. Al conservar el píloro, probablemente se eviten la gastritis por reflujo biliar y las úlceras de la anastomosis. La anastomosis duodenoyeyunal debe ubicarse a 100 cm del ángulo de Treitz, suponiendo que a este nivel sea suficiente la exclusión del duodeno y que el reflujo sea mínimo o que, al menos, no alcance a estimular el duodeno.
De forma anecdótica, se comprobó que en los pacientes sometidos a la derivación yeyunoileal de Payne, el reflujo de nutrientes ocurre entre 7 y 10 cm proximalmente (61). Asimismo, con la anastomosis a este nivel, evitamos deficiencias nutricionales y pérdida exagerada de peso. Considerando que en la derivación minigástrica la anastomosis se realiza a 200 cm del ángulo de Treitz, la técnica propuesta cumpliría con los tres principios fundamentales para el control de la diabetes mellitus tipo 2:
1) disminución de peso y disminución del aporte calórico logrado con la manga;
2) adecuados niveles de anti-incretinas, mediante la exclusión duodenal, y
3) aumento de la producción de GLP-1 y otros factores implicados en la resolución de la diabetes mellitus tipo 2, por estimulación directa del intestino distal por medio de la duodenoyeyunostomía (figura 3).
Este es un procedimiento técnicamente fácil, que necesita una única anastomosis y sólo dos líneas de sutura (manga gástrica y muñón duodenal). Por lo tanto, podemos inferir que la tasa de complicaciones sería baja. Actualmente, se realiza la fase de experimentación metabólica en ratas Goto Kakizaki.
Referencias
1. Narayan KM., Boyle JP., Geiss LS., Saadine JB., Thompson TJ. Impact of recent increase in incidence on future diabetes burden: U.S., 2005-2050. Diabetes Care. 2006;29: 2114-6. [ Links ]
2. Aschner P., King H., Triana M., Rodríguez BM. Glucose intolerance in Colombia. A population-based survey in an urban community. Diabetes Care. 1993; 16:90-3. [ Links ]
3. Leibson CL., O´Brien PC., Atkinson E., Palumbo PJ., Melton LJ. Relative contributions of incidence and survival to increasing prevalence of adult-onset diabetes mellitus: A population based study. Am J Epidemiol. 1997; 146: 12-22. [ Links ]
4. Center for Control Disease Morbidity and mortality Weekly Report. 2004; 53:1066-8. [ Links ]
5. Buchwald H., Avidor Y., Braunwald E., Jensen MD., Pories W., Fahrbach K., Schoelles, K. Bariatric surgery: a systematic review and meta-analysis. JAMA. 2004;292:1724-37 [ Links ]
6. Pories WJ., Swanson MS., Macdonald KG., Long SB., Morris PG., Brown BM. et al. Who would have thought it? An operation proves to be the most effective therapy for adult-onset diabetes mellitus. Ann Surg. 1995; 222:339-52. [ Links ]
7. Dixon JB., O´Brien PE., Playfair J., Chapman L., Schachter LM., Skinner S., et al. Adjustable gastric banding and conventional therapy for type 2 diabetes. JAMA. 2008; 299:316-23. [ Links ]
8. American Diabetes Association. Prevention or delay of type 2 diabetes. Diabetes Care. 2004;27(Suppl.1):s47-53. [ Links ]
9. Patiño JF. Cirugía Bariátrica. Rev Colomb Cir. 2003;18:28-50. [ Links ]
10. Bayliss WM,Starling EH.On the causation of the so-called "peripheral reflex secretion" of the pancreas.Proc R Soc Lond Biol 1902;69:352-3. [ Links ]
11. La Barre J. Sur les possibilities d'un traitement du diabete par l'incretine. Bull Acad R Med Belg. 1932;12:620-34. [ Links ]
12. Mcintyre N., Holsworth DC., Turner DS. New Interpretation of oral glucose tolerance. Lancet. 1964; 2:20-1. [ Links ]
13. Elrick H., Stimmler L., Hlad CJ. JR., Arai Y. Plasma insulin response to oral and intravenous glucose administration. J Clin Invest. 1964;24: 1076-82. [ Links ]
14. Mojsov S., Weir GC., Habener JF. Insulinotropin: glucagon-like peptide I (7-37) co-encoded in the glucagon gene is a potent stimulator of insulin release in the perfused rat pancreas. J Clin Invest. 1987;79:616-9. [ Links ]
15. Kreymann B., Williams G., Chatei MA., Bloom SR. Glucagon- like peptide 1 7-36: a physiological incretin in man. Lancet.1987; 2:1300-4. [ Links ]
16. Heller RS., Stoffers DA., Liu A., Schedl A., Crenshaw EB. 3RD, Madsen OD., et al. The role of BM4/Pou3f4 and Pax6 in forming the pancreatic glucagon cell identity. Dev Biol. 2004; 268:123-34. [ Links ]
17. Holz GG., Kuhtreiber WM., Habener JF. Pancreatic beta-cells are rendered glucose-competent by the insulinotropic hormone glucagon- like peptide-1 (7-37). Nature. 1993; 361:362-5. [ Links ]
18. Buteau J., El-assad W., Rhodes CJ., Rosemberg L., Joly E., Prentki M. Glucagon-like peptide-1 prevents beta cell glucolipotoxicity. Diabetologia. 2004;47:806-15. [ Links ]
19. Farilla L., Bulotta A., Hirshberg B., Li Calzi S., Khoury N., Noushmehr H., et al. GLP-1 inhibits cell apoptosis and improves glucose responsiveness of freshly isolated human islets. Endocrinology. 2003;144:5149-58. [ Links ]
20. Yusta B., Baggio LL., Estall JL., Koehler JA., Holland DP., Li H., et al. GLP-1 receptor activation improves beta cell function and survival following induction of endoplasmic reticulum stress. Cell Metab. 2006; 4:391-406. [ Links ]
21. Willms B., Werner J., Holst JJ., Orskov C., Creutzfeld W., Nauck MA. Gastric emptying, glucose responses and insulin secretion after a liquid test meal: effects of exogenous glucagon-like peptide-1 (GLP-1) amide in type 2 (noninsulin-dependent) diabetic patients. J Clin Endocrinol Metab. 1996; 81:327-32. [ Links ]
22. Meier JJ., Gallwitz B., Salmen S., Goetze O., Holst JJ., Schmidt WE., et al. Normalization of glucose concentrations and deceleration of gastric emptying after solid meals during intravenous glucagon-like peptide 1 in patients with type 2 diabetes. J Clin Endocrinol Metab. 2003;88: 2719-25. [ Links ]
23. Tseng CC., Kieffer TJ., Jarboe LA., Usdin TB., Wolfe MM. Postprandial stimulation of insulin release by glucose-dependent insulinotropic polypeptide (GLP). Effect of a specific glucose-dependent insulinotropic polypeptide receptor antagonist in the rat. J Clin Invest. 1996; 98:2440-5. [ Links ]
24. Miyawaki K., Yamada Y., Yano H., Niwa H., Ban N., Ihara Y., et al. Glucose intolerance caused by a defect in the entero-insular axis: a study in gastric inhibitory polypeptide receptor knockout mice. Proc Natl Acad Sci USA. 1999; 96:14843-7. [ Links ]
25. Kim SJ., Winter K., Nian C., Tsuneoka M., Koda Y., Mcintosh CH. GIP stimulation of pancreatic beta-cell survival is dependent upon phosphatidylinositol 3-kinase (PI3-K)/protein kinase B (PKB) signaling, inactivation of the forkhead transcription factor Foxo1 and down regulation of bax expression. J Biol Chem. 2005; 280:22297-307. [ Links ]
26. Vilsboll T., Krarup T., Deacon CF., Madsbad S., Holst JJ. Reduced postprandial concentrations of intact biologically active glucagon-like peptide 1 in type 2 diabetic patients. Diabetes. 2001; 50:609-13. [ Links ]
27. Nauck MA., Heimesaat MM., Orskov C., Holst JJ., Ebert R., Creutzfeldt W. Preserved incretin activity of glucagon-like peptide 1 [7-36 amide] but not of synthetic human gastric inhibitory polypeptide in patients with type-2 diabetes mellitus. J Clin Invest. 1993; 91:301-7. [ Links ]
28. Todd JF., Edwards CM., Ghatei MA., Mather HM., Bloom SR. Subcutaneous glucagon-like peptide-1 improves postprandial glycaemic control over a 3-week period in patients with early type 2 diabetes. Clin Sci (Lond) 1998;95:325 -9 [ Links ]
29. Young AA., Gedulin BR., Bhavsar S., Bodkin N., Jodka C., Hansen B., et al. Glucose-lowering and insulin-sensitizing actions of exendin-4: studies in obese diabetic (ob/ob,db/db) mice, diabetic fatty Zucker rats, and diabetic rhesus monkeys (Macaca mulatta). Diabetes. 1999; 48:1026-34. [ Links ]
30. Buse JB., Henry RR., Han J., Kim DD., Fineman MS., Baron AD. Effects of exenatide (exendin-4) on glycemic control over 30 weeks in patients with type 2 diabetes treated with metformin and a sulfonylurea. Diabetes Care. 2005; 143:559-69. [ Links ]
31. Ahren B., Simonsson E., Larsson H., Landin-olsson M., Torgeirsson H., Jansson PA., et al. Inhibition of dipeptidyl peptidase IV improves metabolic control over a 4-week study period in type 2 diabetes. Diabetes Care. 2002; 25:869-75. [ Links ]
32. Troy S., Soty M., Ribeiro, Laval L., Migrenne S., Fioramonti X., et al .Intestinal gluconeogenesis is a key factor for early metabolic changes alter gastric bypass but not alter gastric lap-band in mice. Cell Metab. 2008;8:201-11. [ Links ]
33. Laferrère B., Texeira J., Mcginty J., Tran H., Egger JR., Colarusso A. et al. Effect of weight loss by gastric bypass surgery versus hypocaloric diet on glucose and incretin levels in patient with type 2 diabetes. J Clin Endocrinol Metab. 2008; 93:2479-85. [ Links ]
34. Parikh M., Ayoung-chee P., Romanos E., Lewis N., Pachter HL., Fielding G., et al. Comparison of rates of resolution of diabetes mellitus after gastric banding, gastric bypass and biliopancreatic diversion. J Am Coll Surg. 2007; 205:631-5. [ Links ]
35. Dixon JB., O'brien PE. Health outcomes on severely obese type 2 diabetic subjects 1 year after laparoscopic adjustable gastric banding. Diabetes Care. 2002; 25:358-62. [ Links ]
36. Dolan K., Bryant R., Fielding G. Treating diabetes in the morbidly obese by laparoscopic gastric banding. Obes Surg. 2003; 13:439-43. [ Links ]
37. Ponce J., Haynes B., Paynter S., Fromm R., Lindsey B., Shafer A., et al. Effect of Lap-Band® induced weight loss on type 2 diabetes mellitus and hypertension. Obes Surg. 2004; 14:1335-42. [ Links ]
38. Vidal J., Ibarzabal A., Romero F., Delgado S., Momblán D., Flores L., et al. Type 2 diabetes mellitus and the metabolic syndrome following sleeve gastrectomy in severely obese subjects. Obes Surg. 2008; 18:1077-82. [ Links ]
39. Pontiroli AE., Folli F., Paganelli M., Micheletto G., Pizzocri P., Vedani P., et al. Laparoscopic gastric banding prevents type 2 diabetes and arterial hypertension and induces their remission in morbid obesity. Diabetes Care. 2004; 28:2703-9. [ Links ]
40. Moo T., Rubino F. Gastrointestinal surgery as treatment for type 2 diabetes. Curr Opin Endocrinol Diabetes Obes. 2008; 15:153-8. [ Links ]
41. Scopinaro N., Papadia F., Camerini G., Adami GF., Marinari G. A comparison of a personal series of biliopancreatic diversion and literature data on gastric bypass help to explain the mechanism of resolution of type 2 diabetes by the two operations. Obes Surg. 2008;18:1035-8. [ Links ]
42. Naslund E., Backman L., Holst JJ., Theodorsson E., Hellstrom PM. Importance of small bowel peptides for the improved glucose metabolism 20 years after jejunoileal bypass for obesity. Obes Surg. 1998; 8:253-60. [ Links ]
43. De Paula AL., Macedo A., Prudente A., Silva L., Schraibman V., Neto JG, et al. Neuroendocrine brake for the treatment of morbid obesity: preliminary report. Einstein 2005; 3(2):110-114. [ Links ]
44. De Paula AL., Macedo A., Rassi N., Machado CA., Schraibman V, Silva LQ. et al Laparoscopic treatment of type 2 diabetes mellitus for patients with a body mass index less than 35. Surg Endosc. 2008; 22:706-16. [ Links ]
45. Milton K. Primate diets and gut morphology: implications for human evolution. In: Harris M, Ross EB, editors. Food and evolution. Toward a theory of human food habits. Philadelphia: Temple University Press; 1987. [ Links ]
46. Santoro S. Adaptive and neuroendocrine procedures: A new pathway in bariatric and metabolic surgery. Obes Surg. 2008; 18:1343-5. [ Links ]
47. Santoro S., Malzoni CE., Velhote MCP., Milleo FQ., Santo MA., Klajner S., et al. Digestive adaptation with intestinal reserve: A neuroendocrine-based procedure for morbid obesity. Obes Surg. 2006; 16:1371-9. [ Links ]
48. Santoro S., Milleo FQ., Malzoni CE., Klajner S., Borges PCM., Santo MA., et al. Enterohormonal changes after digestive adaptation: five-year results of a surgical proposal to treat obesity and associated diseases. Obes Surg. 2008; 18:17-26. [ Links ]
49. Scopinaro N., Papadia F., Marinari G., Camerini G., Adami G. Long -term control of type 2 diabetes mellitus and the other major components of the metabolic syndrome after biliopancreatic diversion in patients with BMI < 35 kg/m2. Obes Surg. 2007; 17:185-92. [ Links ]
50. Cohen RV., Pinheiro JS., Correa JL., Schiavon CA. Laparoscopic Roux-en-Y gastric bypass for BMI<35 kg/m2; a tailored approach. Surg Obes Relat Dis. 2006; 2:401-4. [ Links ]
51. Cohen RV., Schiavon CA., Pinheiro JS., Correa JL., Rubino F. Duodenal-jejunal bypass for the treatment of type 2 diabetes in patients with body mass index of 22-34 kg/m2: a report of 2 cases. Surg Obes Relat Dis. 2007; 3:195-7. [ Links ]
52. Ramos AC., Galvao MP., De Souza YM., Galvao M., Murakami A., Silva AC., et al. Laparoscopic duodenal-jejunal exclusion in the treatment of type 2 diabetes mellitus in patients with BMI < 30 kg/m2 (LBMI). Obes Surg. 2009;19:307-12. [ Links ]
53. De Paula AL., Macedo ALV., Mota BR., Schraibman V. Laparoscopic ileal interposition associated to a diverted sleeve gastrectomy is an effective operation for the treatment of type 2 diabetes mellitus patients with BMI 21-29. Surg Endosc 2009; 23:1313-1320 . [ Links ]
54. Rothkopf MM., Bilof ML., Haverstick LP., Nusbaum MJ. Synergistic weight loss and diabetes resolution with exenatide administration after laparoscopic gastric banding. Case Report. Surg Obes Relat Dis. 2009;5:128-31 [ Links ]
55. Gumbs AA., Modlin IM., Ballantyne GH. Changes in insulin resistance following bariatric surgery: role of caloric restriction and weight loss. Obes Surg. 2005; 15:462-73. [ Links ]
56. Wing RR., Marcus MD., Salata R., Epstein LH., Miaskiewicz S., Blair EG. Effects of a very-low-calorie diet on long term glycemic control in obese type 2 diabetic subjects. Arch Intern Med. 1991; 151:1334-40. [ Links ]
57. Henry RR., Scheaffer L., Olefsky JM. Glycemic effects of intensive caloric restriction and isocaloric refeeding in non-insulin-dependent diabetes mellitus. J Clin Endocrinol Metab. 1985; 61:917-25. [ Links ]
58. Broglio F., Arvat E., Benso A., Gottero C., Muccioli G., Papotti M. et al. Ghrelin, a natural GH secretagogue produced by the stomach, induces hyperglycemia and reduces insulin secretion in humans. J Clin Endocrinol Metab. 2001; 86: 5083-6. [ Links ]
59. Broglio F., Gottero C., Prodam F., Gauna C., Muccioli G., Papotti M. et al. Non-acylated ghrelin counteracts the metabolic but not the neuroendocrine response to acylated ghrelin in humans. J Clin Endocrinol Metab. 2004; 89:3062-5. [ Links ]
60. Langer FB., Reza Hoda MA., Bohdjalian A., Felberbauer FX., Zacherl J., Wenzl E. et al. Sleeve gastrectomy and gastric banding: effects on plasma ghrelin levels. Obes Surg. 2005; 15:1024-9. [ Links ]
61. Balthazar Ej, Goldfine S. Jejunoileal bypass. Roentgenographic observations. Am J Roentgenol. 1975; 125:138-42. [ Links ]














