Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582On-line version ISSN 2619-6107
rev. colomb. cir. vol.25 no.2 Bogotá Apr./June 2010
(1)Cirujano de seno y tejidos blandos, Precooperativa de Servicios Médicos Asociados en Cáncer, Cansercoop, Bogotá, D.C., Colombia
(2)Médica, patóloga oncóloga, Sección de Patología, Instituto Nacional de Cancerología, Bogotá, D.C., Colombia
Correspondencia: Eduardo Torregroza-Diazgranados, MD, Bogotá, D.C., Colombia. Correo electrónico: torregrozad@yahoo.com.mx
Fecha de recibo: 5 de abril de 2010. Fecha de aprobación: 11 de abril de 2010
Resumen
Introducción. Los tumores papilares intraductales del seno son un grupo heterogéneo de lesiones que se caracterizan por una configuración papilar en el examen macroscópico o microscópico. El objetivo del estudio fue caracterizar los tumores papilares intraductales del seno en relación con sus principales manifestaciones clínicas, características patológicas y métodos diagnósticos.
Materiales y métodos. Durante seis años se registró la información de 72 pacientes con tumores papilares intraductales del seno. Todos los pacientes con secreción por el pezón eran candidatos para la resección total de los conductos terminales, si cumplían los siguientes criterios clínicos: secreción espontánea por pezón, unilateral y persistente, o secreción serosa (como agua de roca) o hemorrágica por pezón. Cuando la manifestación clínica era una masa palpable, el algoritmo de manejo se basó en el enfoque de triple diagnóstico. Ante un hallazgo discordante entre los criterios clínico, radiológico y patológico, se indicó la resección completa de la lesión.
Resultados. El tipo de papiloma benigno más frecuente fue el tumor papilar intraductal, seguido del carcinoma papilar no invasivo y del papiloma atípico. La secreción hemorrágica por pezón fue la manifestación clínica más frecuente de los tumores papilares intraductales y era la indicación quirúrgica fundamental para su diagnóstico. La mayoría de papilomas benignos intraductales fueron únicos.
Conclusión. La historia clínica y el examen físico fueron la piedra angular para el diagnóstico certero. En presencia de secreción espontánea por pezón, persistente, unilateral, hemorrágica o serosa, se recomienda hacer resección total de los conductos terminales, aun cuando la mamografía y la ecografía mamaria sean reportadas como normales. En presencia de una masa palpable, la evaluación ideal es la de triple diagnóstico. La colaboración estrecha entre el patólogo y el cirujano de seno es vital para el manejo correcto de estas lesiones.
Palabras clave: neoplasias ductales, lobulares y medulares; papiloma intraductal; carcinoma papilar; carcinoma intraductal no infiltrante.
Abstract
Introduction: intraductal papillary tumors of the breast are a heterogeneous group of lesions characterized by a papillary configuration in macroscopic or microscopic examination or both.
Objectives: To characterize the main intraductal papillary tumors of the breast in relation to its main clinical manifestations, pathological characteristics and diagnostic methods of detection.
Materials and Methods: During 6 years of continuous and systematic manner the authors recorded information of 72 patients with intraductal papillary tumors of the breast.
All patients with nipple secretion were candidates for resection of terminal ducts if they met the following clinical criteria: nipple discharge spontaneous, unilateral, persistent, o nipple serous secretion (such as water rock) or hemorrhagic.
Patient whose clinical manifestation was the presence of palpable mass, management algorithm was based on the triple diagnostic approach.
A finding discordant between clinical and radiological-pathological, we recommended complete resection of the lesion.
Results: Benign papillomas were type of breast intraductal tumor papillary most frequent followed by non-invasive papillary carcinomas and atypical papillomas subsequently.
Nipple secretion hemorrhagic manifestation was the most frequent of intraductal papillary tumors and was critical to the surgical diagnosis.
Most benign intraductal papillomas were single.
Conclusion: Clinical history and physical examination were the cornerstone for the diagnosis of intraductal papillary tumors of the breast.
Total duct excision is idicated in presence of nipple discharge spontaneous, unilateral, persistent, o nipple serous secretion (such as water rock) or hemorrhagic, even, when mammography and breast ultrasound are reported as normal.
In the presence of a palpable mass, the ideal evaluation is of triple diagnosis approach.
Close collaboration between surgeon and breast disease is vital to proper management of these lesions.
Key words: neoplasms, ductal, lobular, and medullary; papilloma, intraductal; carcinoma, papillary; carcinoma, intraductal, noninfiltrating.
Introducción
Los tumores papilares intraductales del seno son un grupo heterogéneo de lesiones caracterizadas por una configuración papilar del epitelio mamario en el examen macroscópico, el microscópico o ambos.
Estos tumores incluyen un espectro de procesos patológicos que va desde los tumores papilares benignos hasta los carcinomas papilares no invasivos.
Como su nombre lo indica, este grupo de tumores se localiza y extiende exclusivamente en el sistema ductal mamario, en cualquier sitio desde el pezón hasta la unidad ducto-lobular terminal, y comparten una característica histológica en común: la proliferación del epitelio mamario soportada por un tallo fibrovascular.
La secreción por el pezón y la presencia de masa en el seno son sus manifestaciones clínicas principales. La presencia de cualquiera de ellas es fuente de ansiedad y temor para las pacientes, ya que puede ser la manifestación inicial de un cáncer mamario.
La clasificación general de los tumores papilares intraductales del seno de la Organización Mundial de la Salud (OMS), se presenta en la tabla 1 (1).

En algunas ocasiones, el diagnóstico correcto de los tumores papilares intraductales puede ser muy difícil. La evaluación radiológica (ecografía y mamografía) y el estudio citológico de la secreción por pezón (por separado o en combinación), tienen baja sensibilidad para su detección.
Precisamente, el propósito principal de este trabajo observacional y descriptivo fue evaluar las características clínicas, y los métodos de evaluación clínica, radiológica y de patología, para el diagnóstico preciso de estas lesiones.
Materiales y métodos
Desde enero de 2004, las diferentes afecciones mamarias se manejaron en forma consecutiva y se registraron sistemáticamente en el registro personal de tumores benignos, mastitis que no era de la lactancia y enfermedad inflamatoria ductal. Los detalles de este registro fueron publicados en un artículo anterior (2).
La información de los datos clínicos, los métodos diagnósticos y los hallazgos de patología de las pacientes con tumores papilares intraductales del seno, se obtuvo de la base de datos de dicho registro.
Evaluación de la secreción por el pezón
La evaluación y el manejo de las pacientes con secreción por el pezón, se basaron en los algoritmos de manejo que se muestran en las figuras 1 y 2.
En el interrogatorio se estableció si la secreción era espontánea o inducida y, durante el examen físico, se exprimió el pezón para verificar su presencia, su tipo, el número de conductos afectados y la posible localización del conducto afectado. También, se investigó la presencia de sangre oculta en la secreción, con el fin de clasificarla como hemorrágica o no hemorrágica.
Según la evaluación clínica de las pacientes, la secreción por pezón se clasificó en tres grupos: fisiológica, galactorrea y patológica.
A las pacientes con secreción fisiológica por el pezón (al exprimirlo y de forma bilateral), solamente se les aconsejó evitar exprimir manualmente el pezón.
Los casos de galactorrea (secreción espontánea, lechosa y bilateral) se investigaron para excluir las siguientes causas:
1. alteración endocrina, como adenoma pituitario o hipotiroidismo, y
2. uso de agentes farmacológicos: fármacos psicoactivos, antihipertensivos, anticonceptivos orales o terapia de reemplazo hormonal.
La galactorrea se consideró idiopática después de investigarla y excluir exhaustivamente las anteriores etiologías. Su manejo se hizo de acuerdo con la causa encontrada.
En el presente estudio, la secreción por pezón fue catalogada como patológica si era: espontánea, persistente, intermitente, unilateral, predominantemente por un solo conducto, hemorrágica o serosanguinolenta, acuosa como agua de roca, o asociada a una masa.
En caso de secreción patológica por pezón, sin otros hallazgos anormales en el examen físico, se practicó mamografía. Si el examen clínico o la mamografía demostraban la presencia de una masa, entonces, se practicaban ecografía mamaria, biopsia percutánea con aguja fina o biopsia con tru-cut.
En el presente estudio, en ningún caso de secreción patológica espontánea y unilateral por el pezón se indicó el practicar citología diagnóstica de la secreción ni galactografía. El manejo de la secreción patológica dependió de si ésta provenía de uno o de más de un conducto. Si provenía de un solo conducto galactóforo, independientemente de si era hemorrágica o no, y el examen clínico y la mamografía eran normales, se practicaba cirugía de conductos terminales.
En las pacientes que deseaban conservar la capacidad de lactancia, se indicaba resección selectiva del conducto afectado; de lo contrario, se indicaba resección total de los conductos terminales.
Cuando provenía de más de un conducto galactóforo y el examen clínico y la mamografía eran normales, se practicaba resección total de los conductos terminales si la secreción era hemorrágica, se asociaba con inversión del pezón o si representaba síntomas muy molestos para la paciente; de lo contrario, se dejaba en observación y seguimiento.
En el presente estudio, se practicó resección total de los conductos terminales en todas las pacientes con secreción patológica por pezón.
Evaluación de la masa palpable
Cuando la manifestación clínica fue una masa palpable, el algoritmo de manejo se basó en el enfoque de triple diagnóstico: examen clínico, evaluación radiológica y punción-aspiración con aguja fina.
Para disminuir al máximo el porcentaje de error, solamente si los resultados de todas las modalidades diagnósticas indicaban que se trataba de una masa benigna, se optaba por la observación y el seguimiento cuidadosos de la lesión. Ante un cambio en el tamaño u otras características de la masa, determinado por la historia clínica, el examen clínico o la evaluación radiológica, se resecaba la lesión. Cualquier muestra citológica inadecuada debía ser repetida.
Si la masa palpable no se visualizaba por mamografía o por ecografía, no se optaba por el abordaje de triple diagnóstico y el manejo se basaba en el resultado de la biopsia con aguja tru-cut. Ante un hallazgo discordante entre los criterios clínico, radiológico o patológico, se recomendaba la resección completa de la lesión.
Criterios de inclusión
En el presente estudio sólo se incluyeron las pacientes con secreción patológica por pezón y sometidas a resección de los conductos terminales, cuyo diagnóstico había sido el de tumor papilar intraductal.
Criterios de exclusión
Se excluyeron las pacientes con secreción fisiológica, galactorrea o secreción por pezón no hemorrágica o hemorrágica, sometidas a resección de los conductos terminales, cuyo diagnóstico hubiera sido ectasia ductal. También, se excluyeron las pacientes con diagnóstico de papilomatosis del seno, para ceñirse a la clasificación de los tumores papilares intraductales establecida por la OMS, en su última edición.
Análisis
En todos los pacientes con tumores papilares intraductales, se analizaron la edad de presentación, la manifestación clínica principal (masa palpable, secreción del pezón) y las enfermedades asociadas. Para la presentación más precisa de los resultados, se hizo un análisis global de todos los casos y tres subanálisis, según el tipo histológico del tumor:
A. Papilomas benignos
B. Papilomas atípicos
C. Carcinomas papilares no invasivos
Los papilomas centrales y periféricos se agruparon en la categoría de papilomas benignos. Los carcinomas papilares intraductales y los intraquísticos, se agruparon en la categoría de carcinomas papilares no invasivos.
Para el análisis de los papilomas benignos, éstos se analizaron y clasificaron según los siguientes criterios.
I. Anatomía patológica: papilomas benignos intraductales o intraquísticos.
II. Según su origen o localización en el sistema ductal mamario: papilomas benignos centrales originados en los conductos mayores del sistema ductal mamario o papilomas periféricos originados en la unidad ducto-lobulillar terminal.
III. Según el número de papilomas encontrados: papilomas únicos y papilomas múltiples.
Los datos se digitaron y analizaron en Stata® 8.2.
Las diferencias en el promedio de edad entre dos grupos se evaluaron con la prueba t de Student. Las diferencias en la mediana de edad entre más de dos grupos se evaluaron con la prueba de Kruskal-Wallis. Las proporciones entre los grupos se compararon mediante la prueba de ji al cuadrado. Un valor de p menor de 0,05 se consideró estadísticamente significativo.
Resultados
Análisis global
Desde enero de 2004 hasta marzo de 2010, se recolectó en el registro personal de tumores mamarios información de 72 casos de tumores papilares intraductales del seno (figura 3).
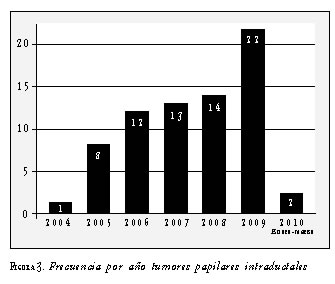
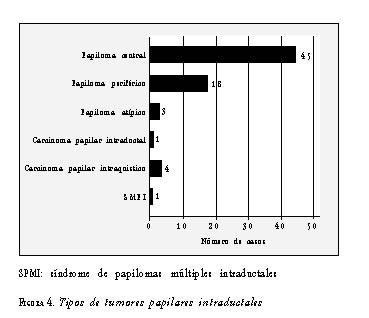
Según la clasificación de la OMS, los papilomas centrales fueron los tumores papilares intraductales más frecuentes con 45 casos, seguidos de los papilomas periféricos con 18 casos (figura 4). Hubo un caso de síndrome de papilomas múltiples intraductales, el cual se analizó por separado dadas sus características especiales.
De los 71 casos con tumores papilares intraductales, uno fue un hombre. El promedio y la mediana global de edad fueron de 48,3 años y 47 años, respectivamente.
Al agrupar los papilomas centrales y los periféricos en la categoría de papilomas benignos, el promedio de edad para éstos fue de 47,4 años, para los pacientes con papilomas atípicos fue de 60 años y para aquellas con carcinomas papilares no invasivos (carcinomas papilares intraductales e intraquísticos) fue de 53,2 años.
La mediana de edad fue de 47 años en los casos de papilomas benignos (n=63), de 56 años en los de papilomas atípicos (n=3) y de 49 años en los de carcinomas papilares no invasivos (n=5). Sin embargo, esta diferencia en la mediana de edad no fue estadísticamente significativa (prueba de Kruskal-Wallis, p=0,11).
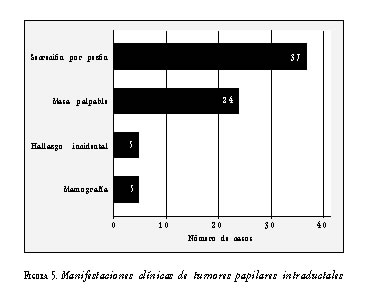
Las manifestaciones clínicas más frecuentes de los 71 pacientes con tumores papilares intraductales, fueron la secreción por el pezón y la masa palpable. Un grupo se detectó por mamografía y otro pequeño grupo se detectó de manera incidental, como resultado de cirugías mamarias practicadas por otras indicaciones (figura 5).
Análisis específico
Papiloma benigno
Hallazgos clínicos y anatomopatológicos. Los 63 pacientes con papilomas benignos correspondieron a mujeres: en 61 (96,8%) fueron unilaterales y en 2 (3,2%) fueron bilaterales.
El 65% de los papilomas benignos unilaterales se presentó en el seno izquierdo y el 35% en el seno derecho.
En general, el rango de edad de las pacientes con papilomas benignos fue de 55 años con un rango de 25 años a 80 años. El 25% tenía 39 años o menos, y otro 25% tenía 55 años o más; por consiguiente, 50% de los casos de papilomas benignos tenía entre 39 años y 55 años.
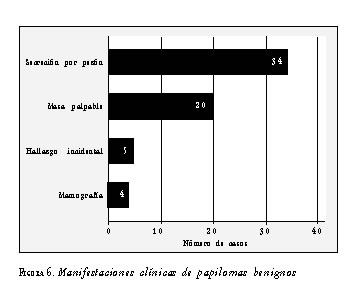
Las manifestaciones clínicas más frecuentes de los papilomas benignos fueron la secreción por pezón y la presencia de masa palpable (figura 6).
En cinco pacientes los papilomas se detectaron de manera incidental: dos casos como resultado de la resección de los conductos terminales por absceso subareolar secundario a ectasia ductal y tres casos por resección de tumores benignos mamarios.
De las 34 pacientes con secreción por el pezón, la secreción fue hemorrágica en 85,2%, mientras que, en 14,8% la secreción fue serosa.
Al clasificar los papilomas benignos según su anatomopatología, 57 (90,5%) fueron intraductales y 6 (9,5%) fueron intraquísticos.
El promedio de edad en los casos de papilomas benignos intraductales fue de 47,2 años, mientras que en los de papilomas benignos intraquísticos fue de 48,8 años.
La secreción por el pezón fue la manifestación clínica más frecuente de los papilomas intraductales en 59,6% de los casos, mientras que la masa palpable fue la única manifestación clínica de los intraquísticos en el 100% de los casos. Esta diferencia fue estadísticamente significativa (p=0,003) (tabla 2).
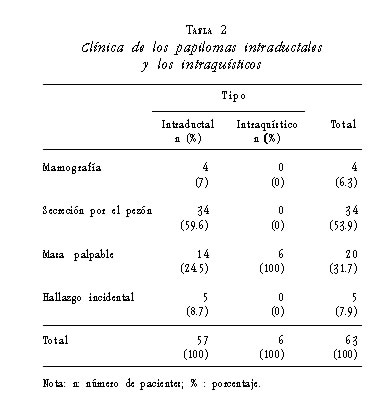
En cinco pacientes asintomáticas con papilomas intraductales, éstos se detectaron por mamografía. Estas lesiones se catalogaron como BI-RADS (Breast Imaging-Reporting and Data System) 4A, por lo cual se indicó la resección biopsia guiada por arpón.
Según su origen o localización, los papilomas benignos intraductales (n=57) se dividieron en papilomas centrales (n=40, 70,1%) y periféricos (n=17, 29,9%).
El promedio de edad de las pacientes con papilomas benignos intraductales periféricos fue menor que el de aquéllas con papilomas benignos intraductales centrales: 44,9 años Vs. 48,2 años, respectivamente. Sin embargo, esta diferencia de edad no fue estadísticamente significativa (p=0,38).
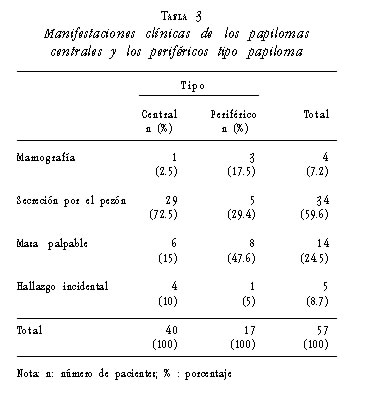
Las manifestaciones clínicas más frecuentes de los papilomas centrales fueron la secreción por el pezón (72,5%) y la presencia de masa palpable (15%).
Las manifestaciones clínicas más frecuentes de los papilomas periféricos fueron la presencia de masa palpable (47,6%) y la secreción por pezón (29,4%). La diferencia en la presentación clínica entre los papilomas centrales y los periféricos fue estadísticamente significativa (p=0,005) (tabla 3).
Según el número de papilomas, los papilomas benignos intraductales se dividieron en papilomas únicos y múltiples. La mayoría de ellos fueron únicos (n=40, 70,1%), mientras que 29,9% fueron múltiples (n=17).
El promedio de edad en los casos de papilomas benignos intraductales múltiples fue menor que para los de papilomas benignos intraductales únicos. La diferencia de edad entre estos dos grupos fue estadísticamente significativa (p=0,034) (tabla 4).

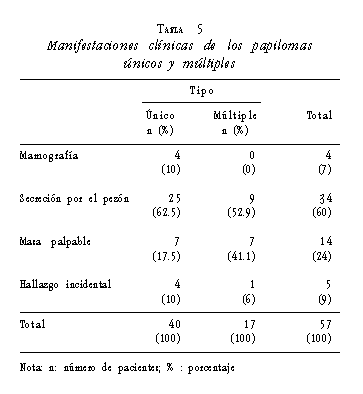
Las manifestaciones clínicas más frecuentes de los papilomas únicos fueron la secreción por pezón (62,5%) y la masa palpable (17,5%), y las de los múltiples fueron la secreción por pezón (52,9%) y la masa palpable (41,1%) (tabla 5).
El 90% de los papilomas únicos fue de localización central y el 76,5% de los papilomas múltiples tuvo una localización periférica. Esta asociación entre el origen o la localización, y el número de papilomas fue estadisticamente significativa (p=0,0001).
En forma global, el 63,5% de los papilomas benignos se acompañaron por otra lesión concurrente, en un sitio diferente del conducto que contenía al papiloma. Las alteraciones más frecuentes asociadas, fueron la ectasia ductal seguida del carcinoma ductal in situ del mismo lado (figura 7).
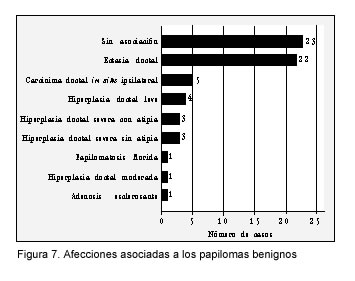
El 60% de los carcinomas in situ estuvieron asociados a papilomas periféricos o múltiples.
Hallazgos de radiología en los papilomas benignos
Papilomas detectados por mamografía. En cuatro pacientes se detectaron papilomas benignos por mamografía. Fueron lesiones nodulares, ovales, de mayor densidad que el tejido mamario adyacente, localizadas en los cuadrantes mamarios. En dos de ellos, no se observaron microcalcificaciones en su interior y, en los otros dos, sí se presentaron (figura 8).
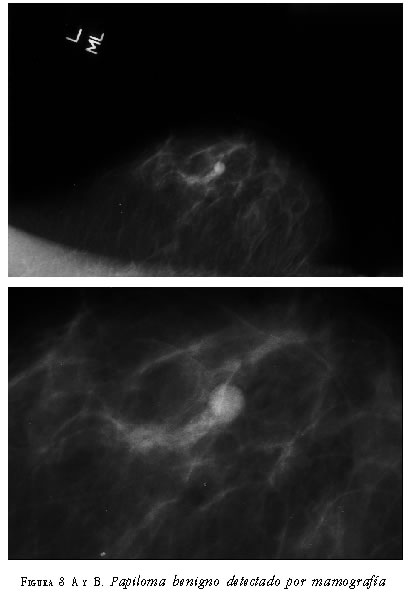
Papilomas benignos con manifestación de secreción patológica por pezón. En 34 pacientes el papiloma benigno se manifestó clínicamente por secreción patológica por el pezón. En 30, la mamografía fue BI-RADS B1 o B2.
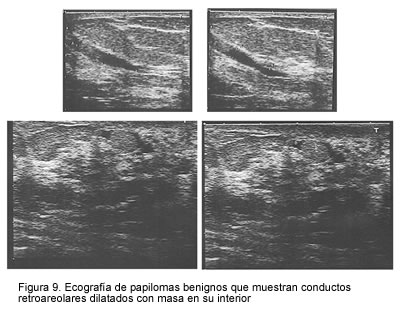
En cuatro pacientes la mamografía demostró algún tipo de alteración retroareolar BI-RADS B3: microcalcificaciones, aumento de la densidad retroareolar o imagen pseudonodular. En ellas, se practicó ecografía mamaria complementaria, la cual mostró dilatación de un conducto único retroareolar, en dos, y lesión intraductal indicativa de papiloma intraductal, en las otras dos (figura 9).
Papilomas benignos con masa palpable
Papiloma intraductal. El papiloma benigno se manifestó clínicamente como masa palpable en 20 pacientes, 14 de ellos intraductales y los 6 restantes, intraquísticos. De los catorce intraductales, 7 fueron únicos y 7 fueron múltiples.
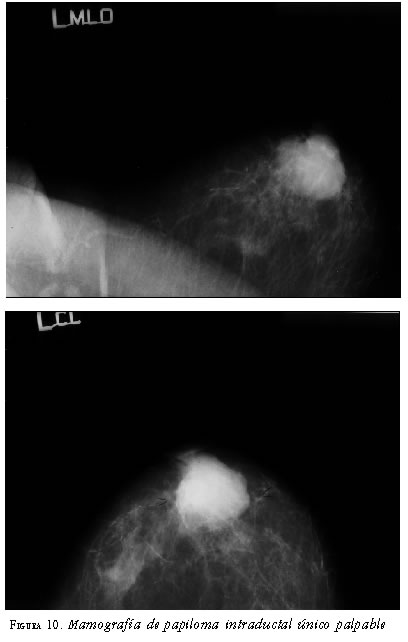
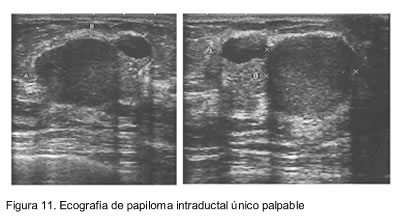
En los casos en que el papiloma único se manifestó como masa palpable, en la mamografía se encontró una lesión nodular densa de bordes regulares, B3. La ecografía mamaria complementaria mostró lesiones sólidas hipoecoicas intraductales con bordes definidos, B3 (figuras 10 y 11).
La mamografía en los 7 pacientes con papilomas benignos intraductales múltiples mostró densidad asimétrica en los cuadrantes mamarios y la ecografía mostró quistes múltiples confluentes o una masa mal definida.
Papiloma intraquístico. Hubo seis casos de papilomas intraquísticos benignos, a quienes se les realizó mamografía y ecografía mamaria. La mamografía mostró masas de mayor densidad al tejido mamario, circunscritas y ovaladas, cuatro catalogadas como B2 y cuatro como B3.
Los hallazgos ecográficos fueron patognomónicos de papilomas intraquísticos: lesión quística con una masa focal adherida a la pared del quiste en forma peduncular o sésil (figura 12).
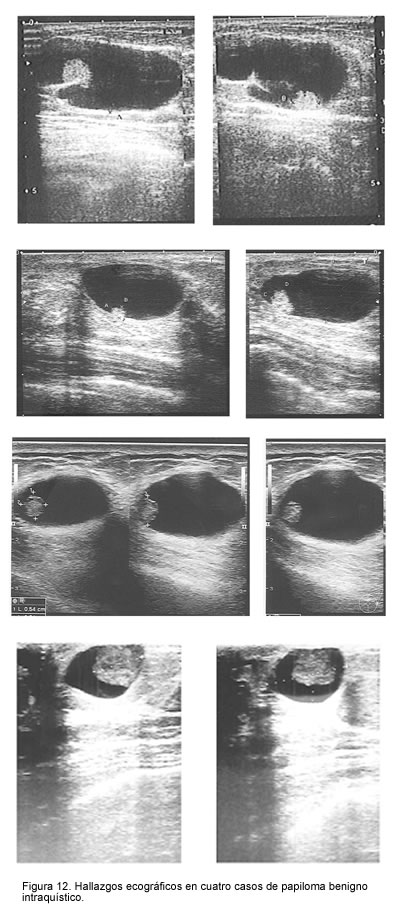
Hallazgos de la biopsia por aspiración con aguja fina de los papilomas benignos con manifestación de masa palpable
Papiloma intraductal. Se practicó biopsia por aspiración con aguja fina en las catorce pacientes con papilomas benignos intraductales y masa palpable. En once la biopsia fue inespecífica, en dos demostró una lesión papilar y en uno la muestra fue insuficiente.
Papiloma intraquístico. Se practicó biopsia por aspiración con aguja fina en seis pacientes con papilomas benignos intraquísticos. En tres se encontró sangre microscópica en el aspirado, en uno se demostró una lesión papilar y en dos el resultado fue inespecífico.
Seguimiento de los papilomas benignos
Con 6 años de seguimiento, de las 63 pacientes con papilomas benignos, ninguna desarrolló cáncer de seno.
Papiloma atípico
Dos pacientes con papilomas atípicos fueron mujeres y uno fue hombre, y todos tenían 54 años o más.
Las manifestaciones clínicas más frecuentes fueron la secreción de tipo hemorrágico por el pezón y la masa palpable. En una paciente asintomática, la lesión se detectó por mamografía y fue catalogada como BI-RADS 4A; se trataba de una lesión nodular con bordes irregulares, por lo cual se indicó biopsia por estereotaxia que demostró un tumor papilar. Posteriormente, se resecó totalmente la lesión, guiada por arpón, y el resultado fue un papiloma atípico.
Dos pacientes con papilomas atípicos presentaron lesiones asociadas en el estudio de patología: una, hiperplasia ductal importante con atipia y otra, un carcinoma ductal in situ.
Carcinoma papilar no invasivo
Los cinco pacientes con carcinoma papilar no invasivo fueron mujeres. Un caso era intraductal y cuatro, intraquísticos. La paciente con carcinoma papilar intraductal tenía 47 años y en los intraquísticos, el promedio de edad fue de 54,7 años y la mediana de 56 años. El carcinoma papilar intraductal se manifestó por secreción hemorrágica por el pezón y, los intraquísticos, por secreción hemorrágica por el pezón en un caso y por masa palpable en tres.
En los de tipo intraquístico, en la evaluación radiológica se observó una masa hiperdensa con bordes oscurecidos en uno de sus lados;en la ecografía se apreció un quiste complejo por la lesión sólida acompañante.
En dos pacientes, la biopsia por aspiración con aguja fina fue hemorrágica en el examen microscópico y, en otra, fue inespecífica.
Un caso de tipo intraductal y otro de tipo intraquístico, presentaron hiperplasia ductal grave con atipia, concomitantemente con la lesión índice.
Todos los casos fueron positivos para los receptores hormonales, tanto de estrógenos como de progesterona.
El tratamiento del carcinoma papilar intraductal y de la paciente de menor edad (42 años) con carcinoma papilar intraquístico, consistió en cuadrantectomía, radioterapia y tamoxifeno. En las tres de mayor edad (47, 62 y 65 años) con carcinoma papilar intraquístico, consistió en cuadrantectomía sin radioterapia más tamoxifeno. En todos los casos los bordes de resección de la cuadrantectomía fueron negativos.
El seguimiento de las pacientes ha consistido en control clínico cada tres meses durante el primer año, cada seis meses durante el segundo año y cada año durante los siguientes años, con mamografía anual bilateral.
La paciente con carcinoma papilar intraductal completó cinco años de terapia con tamoxifeno, mientras que una con el tipo intraquístico completó cuatro años. Las tres restantes llevan menos de un año con este medicamento. Todas las cinco pacientes están libres de recurrencia local, hasta la actualidad.
Síndrome de papilomas múltiples intraductales
La paciente con síndrome de papilomas múltiples intraductales era una mujer de 45 años, en quien las manifestaciones clínicas principales fueron la secreción hemorrágica por ambos pezones y masas palpables en los cuadrantes del seno. Los papilomas fueron de tipo histológico benigno y atípico.
Hallazgos radiológicos
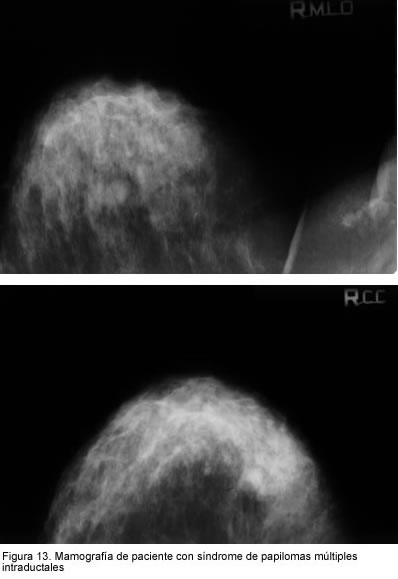
La mamografía de la paciente con este síndrome mostró
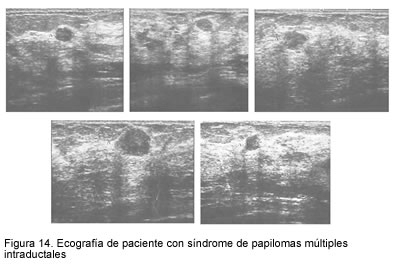
senos densos con múltiples imágenes nodulares, una bien definida BI-RADS 0, la cual se muestra en la mamografía (figura 13). En la ecografía se encontraron múltiples masas redondas u ovaladas bien definidas en los cuadrantes mamarios, en ambos casos BI-RADS 3 (figura 14).
Discusión
La mastalgia, la presencia de masa palpable en el seno y la secreción por el pezón son síntomas mamarios de consulta muy frecuentes. Aproximadamente, 5% de las pacientes presentan secreción por el pezón como síntoma mamario principal.
La causa más frecuente de la secreción patológica por el pezón son los papilomas intraductales, en más del 50% de los casos. La correcta evaluación diagnóstica de la secreción patológica, para excluir o confirmar el cáncer de seno, es un aspecto muy controvertido en la literatura mundial.
El centro de este debate es el tratamiento más adecuado para este síntoma: resección total de conductos, resección selectiva del conducto afectado o sólo a observación.
Ninguna paciente del presente estudio se sometió a citología diagnóstica de la secreción por el pezón ni a ductografía. Dixon (3) considera que ni la citología ni la ductografía juegan ningún papel en el manejo rutinario de las pacientes con secreción por pezón, en lo cual concuerda nuestro protocolo de manejo. Según Dixon, estarían indicadas solamente en pacientes con síntomas mínimos cuando se quiere evitar la cirugía, o en mujeres muy jóvenes y sin hijos en quienes la localización de cualquier anormalidad permitiría una cirugía selectiva del conducto afectado con el fin de preservar la capacidad de lactancia (3).
Por otra parte, en lo cual también concuerda nuestro protocolo de tratamiento, Dixon considera que toda paciente con secreción patológica del pezón, sea espontánea, persistente, confinada a un solo conducto, hemorrágica, serosanguinolenta o asociada a masa, debe someterse a cirugía de los conductos terminales (3).
Sin embargo, otros autores como Lang y Kuerer (4) realizan ductografía en todas las pacientes con secreción patológica por el pezón y con mamografía normal. Si la mamografía y la ductografía son normales, la conducta para ellos es la observación y el seguimiento de la paciente.
En caso de secreción patológica por el pezón, la resección total de los conductos terminales fue el método diagnóstico (para evaluación histopatológica) y terapéutico (para manejo de la secreción) en todas nuestras pacientes.
Recientemente, ha habido diferentes publicaciones que sustentan el uso de la ductoscopia mamaria con el objetivo de reducir la extensión de la resección de los conductos mediante la visualización directa y la toma de biopsia de la lesión intraductal, y para guiar durante la cirugía la escisión del conducto afectado.
Shen et al. (5) practicaron ductoscopia a 259 mujeres que habían tenido secreción patológica por el pezón, y analizaron los hallazgos visuales, el lavado ductal y los hallazgos de la patología. Encontraron que en 92 mujeres (36%) la ductoscopia había sido exitosa en detectar una lesión papilar intraductal. De las lesiones observadas, 68 eran papilomas únicos; 21, papilomas múltiples, y 3 correspondieron a papilomatosis. El valor diagnóstico positivo global fue de 83%. La conclusión de este artículo fue que la ductoscopia ofrece una alternativa a la ductografía para guiar la resección quirúrgica en el tratamiento de las pacientes con secreción por pezón.
Papiloma benigno
El papiloma benigno se caracteriza por ser una estructura arborescente compuesta de un tallo fibrovascular cubierto por una capa externa de células epiteliales y una capa intermedia de células mioepiteliales entre la capa de células epiteliales y la membrana basal más interna.
En el estudio, 88,7% de los tumores papilares intraductales correspondieron a papilomas benignos.
Los papilomas benignos son tumores friables que pueden crecer en la luz de un conducto dilatado, los llamados papilomas benignos intraductales, o dentro de una cavidad quística de mayor tamaño, los llamados papilomas intraquísticos benignos. En el caso de los intraquísticos, el tamaño palpado es de mayor proporción, debido al contenido hemorrágico del quiste.
En el presente estudio, el 90,5% de los papilomas benignos eran intraductales y el 9,5%, intraquísticos. La manifestación clínica más frecuente de los intraductales fue la secreción patológica por el pezón y la de los intraquísticos fue la presencia de masa palpable.
Según su origen y localización dentro del sistema ductal mamario, los papilomas benignos se clasifican en centrales y periféricos.
En 1984, Ohuchi et al. (6) propusieron la clasificación de los papilomas en centrales y periféricos. En 15 casos de su estudio, se hizo reconstrucción tridimensional de las imágenes de los papilomas intraductales, mediante secciones semiseriales, para visualizar la distribución intraductal de los papilomas. En cinco pacientes los papilomas eran únicos y se habían originado en conductos mayores, segmentarios o subsegmentarios, pero no comprometían la unidad ducto-lobulillar terminal. En los demás casos, en la reconstrucción tridimensional, los papilomas eran multifocales; cada uno de ellos se había originado en la unidad ducto-lobulillar terminal y se había diseminado secundariamente a los conductos mayores, lo cual sugería su origen periférico. Con base en los resultados, estos autores propusieron una nueva nomenclatura para la clasificación de los papilomas, en centrales y periféricos.
El 70,1% de nuestros casos correspondieron a papilomas benignos de localización central y el 29,9% a papilomas benignos periféricos. La separación bien precisa de los papilomas benignos entre centrales y periféricos, puede realizarse únicamente mediante el estudio tridimensional de la lesión (6). En el presente estudio, la separación se hizo con base en el criterio de la patología usual y convencional, y sólo en dos informes de patología se consignó explícitamente el origen de la lesión como central o periférica. En el resto de los casos, la clasificación se hizo con base en la descripción microscópica del informe de patología. Por no haber realizado el estudio de reconstrucción tridimensional, reconocemos la posibilidad de un margen de error, por parte nuestra, en la clasificación de los papilomas benignos como centrales o periféricos.
Conforme con lo reportado en la literatura mundial y acorde con los resultados de nuestra serie, los papilomas benignos centrales son en su mayoría únicos, se presentan en mujeres entre la cuarta y la quinta décadas de la vida, se localizan en los conductos lactíferos subareolares y con mayor frecuencia son unilaterales (7).
El 72,5% de nuestras pacientes con papilomas centrales presentaron secreción hemorrágica o serosa por el pezón, porcentaje que en la literatura mundial está entre el 64% y el 88% (7). En 15% de nuestros casos, la manifestación clínica fue la presencia de masa palpable, que pudo palparse en el examen clínico hasta en un tercio de los casos.
La manifestación clínica más frecuente de los papilomas periféricos fue la presencia de masa palpable (47,6%) y en el 60% de los casos se asociaron a carcinoma ductal in situ o a lesiones de bajo a alto riesgo para cáncer invasivo. Además, en contraste con los papilomas centrales y únicos, los periféricos se asociaron con mayor frecuencia a hiperplasia ductal usual, hiperplasia ductal atípica, carcinoma ductal in situ, adenosis esclerosante o carcinoma invasivo (8).
Los papilomas benignos se clasifican según el número de papilomas encontrados, en papilomas únicos y múltiples.
El 70,1% de los papilomas benignos en el estudio fueron únicos, la mayoría unilaterales y la manifestación clínica más frecuente fue la secreción por el pezón.
El 29,9% de los papilomas benignos fueron múltiples, la mayoría unilaterales y la manifestaciones más frecuentes fueron la presencia de masa palpable y la secreción por pezón.
De acuerdo con nuestros datos y lo reportado en la literatura, los papilomas múltiples se asocian más frecuentemente a hiperplasia ductal atípica, carcinoma ductal in situ, adenosis esclerosante o carcinoma invasivo (9).
Un hallazgo importante de este estudio fue la relación entre la localización del papiloma y su número. El 90% de los papilomas únicos fueron de localización central, mientras que el 76,5% de los múltiples fueron de localización periférica.
En los papilomas benignos intraductales, los hallazgos ecográficos más sobresalientes en el presente estudio, fueron la dilatación única de un solo conducto retroareolar, la masa intraductal con dilatación del conducto afectado y la masa de aspecto sólido que llenaba el conducto galactóforo.
En el caso de los papilomas benignos intraquísticos, los hallazgos ecográficos fueron casi patognomónicos de lesión papilar: lesión quística con un componente sólido de aspecto arborescente con un pedículo sésil o pedunculado en su interior.
El riesgo de un carcinoma invasivo subsiguiente asociado a un papiloma benigno, depende de la lesión concurrente asociada al papiloma benigno.
Los papilomas benignos se han estratificado en dos categorías, según el riesgo ulterior de cáncer invasivo, en papiloma benigno único y central, en el cual el riesgo es bajo, y papiloma múltiple y periférico, en el cual el riesgo es un poco mayor debido a su asociación mayor con carcinoma ductal in situ o lesiones de alto riesgo (9).
La resección quirúrgica completa de los papilomas benignos es el tratamiento usual y curativo para estas lesiones.
Al considerar los resultados de nuestro estudio, la manera más precisa de clasificar a los papilomas benignos es teniendo en cuenta el criterio morfológico y el número de papilomas. A menos que se haga la reconstrucción tridimensional del papiloma, la clasificación de los papilomas benignos en centrales o periféricos podría estar sujeta a un margen de error.
Papiloma atípico
El componente epitelial de un papiloma benigno puede mostrar un espectro de cambios morfológicos que incluye hiperplasia usual, hiperplasia ductal atípica y carcinoma ductal in situ. La presencia de un área de hiperplasia ductal atípica dentro de un papiloma benigno, califica a esta lesión como papiloma atípico.
Page et al. (10) diferencian un papiloma atípico de un carcinoma de bajo grado, según la extensión de la población de células atípicas dentro de un papiloma benigno. Si la extensión de la población de células atípicas es de 3 mm o menos, lo consideran un papiloma atípico; si es mayor de 3 mm, lo consideran carcinoma ductal in situ originado en un papiloma benigno.
Tavassoli considera el papiloma como atípico cuando menos del 33% de la población de células atípicas se encuentra dentro del papiloma benigno y, como carcinoma in situ originado dentro de un papiloma, si dicho porcentaje es de 33% a menos de 90% (11).
Los criterios usados para diferenciar un papiloma atípico de un carcinoma originado en un papiloma benigno, se aplican solamente en lesiones de bajo grado. Si el componente de células atípicas dentro de un papiloma benigno es de alto grado, la lesión se considera un carcinoma originado dentro del papiloma, independientemente de su extensión o proporción.
Las células mioepiteliales están reducidas o ausentes en el foco de hiperplasia ductal atípica, pero permanecen claramente identificables en el área del papiloma benigno y alrededor del conducto comprometido. Las células del foco de atipia característicamente carecen de expresión de citoqueratinas de alto peso molecular (citoqueratinas 5/6) y presentan, especialmente, expresión ante los receptores de estrógenos.
En el presente estudio, el 4,2% de los tumores papilares intraductales correspondió a papilomas atípicos y, comparados con los papilomas benignos, se presentaron en pacientes de mayor edad y, en un caso, en un hombre.
El riesgo de un carcinoma invasivo subsiguiente asociado a un papiloma atípico, depende de la lesión concurrente asociada. El 66,6% de los casos de papiloma atípico presentaron una lesión asociada concurrente: carcinoma ductal in situ o hiperplasia ductal serio con atipia.
Page et al. reportaron un riesgo relativo de 7,5 si la atipia estaba confinada solamente al papiloma; sin embargo, el riesgo aumentó a 15,8 si también había atipia en el tejido adyacente al papiloma atípico (10).
Al igual que en los papilomas benignos, la resección quirúrgica completa es el tratamiento ideal de los atípicos, con el fin de establecer la presencia de una lesión adyacente de más consideración. Sin embargo, es motivo de arduo debate si se necesita resección completa de la lesión en casos de papiloma benigno diagnosticado por biopsia por esteroataxia o si no se necesita.
Sydnor et al. determinaron el grado de subestimación del diagnóstico de cáncer de seno en lesiones papilares inicialmente diagnosticadas por biopsia con aguja gruesa (12). La frecuencia de tumor maligno fue de un caso de 38 papilomas benignos (3%), 10 de 15 papilomas atípicos (67%), 2 de 4 micropapilomas (50%) y uno de 6 papilomas escleróticos (17%). Este artículo concluyó que los papilomas benignos diagnosticados por biopsia rara vez (3%) se asocian con un proceso maligno y es suficiente el seguimiento mamográfico. Además, que debido a la alta asociación de procesos malignos (67%), el hallazgo de un papiloma atípico por biopsia debería ser indicación de la resección quirúrgica completa de la lesión para hacer un diagnóstico definitivo.
Por el contrario, Mercado et al. revisaron 43 lesiones papilares diagnosticadas mediante biopsia con aguja gruesa (13). Treinta y seis de 43 lesiones en las que se practicó biopsia se resecaron quirúrgicamente. El estudio de anatomopatología de la pieza quirúrgica resecada informó: ausencia de lesión residual en 10 pacientes, papiloma intraductal en 14, papilomatosis intraductal en 2, papiloma con focos de hiperplasia ductal atípica adyacente en 8 y carcinoma papilar intraductal en 2. Este artículo concluyó que las lesiones papilares diagnosticadas como benignas por la biopsia con aguja gruesa, deben extirparse quirúrgicamente debido a que un sustancial número de lesiones son reclasificadas como hiperplasia ductal atípica y carcinoma ductal in situ.
Aunque la frecuencia de un carcinoma ductal in situ o invasivo adyacente a un papiloma benigno es baja, la consideramos clínicamente importante y nuestra conducta frente al diagnóstico de una lesión papilar por biopsia con aguja gruesa, es la resección completa de la lesión, independientemente del tipo histológico del papiloma.
Síndrome de papilomas múltiples intraductales
Un aporte importante del presente estudio es la descripción, por primera vez en la literatura latinoamericana, del síndrome de papilomas múltiples intraductales. Este nombre se reserva para un grupo muy reducido de casos en los cuales el sistema ductal está comprometido por múltiples papilomas, a menudo palpables y de gran tamaño, con distribución periférica (3).
La mayoría de los pacientes sin este síndrome presentan un solo papiloma, usualmente central y unilateral, y la manifestación clínica más frecuente es la secreción por el pezón o una masa palpable por separado. Precisamente, la concurrencia en una misma paciente de múltiples papilomas bilaterales, tanto centrales como periféricos, con secreción por el pezón y masas palpables, son las características que sugieren el diagnóstico del síndrome de papilomas múltiples intraductales.
El caso reportado en el presente estudio correspondió a una mujer con telorragia bilateral concurrente con múltiples papilomas bilaterales palpables y que se acompañaba de papilomas benignos y atípicos.
Carcinoma papilar intraductal
Al igual que para la atipia, existen varias definiciones de anatomopatología para esta entidad. La primera es la de la OMS, en su última edición. En esta definición, el carcinoma papilar intraductal se caracteriza por la proliferación de tallos fibrovasculares y su diagnóstico requiere que 90% o más del proceso papilar esté totalmente desprovisto de la capa de células mioepiteliales, independientemente de la presencia o ausencia notable de proliferación epitelial, o que cualquiera de los patrones de carcinoma ductal in situ de bajo grado ocupe el 90% o más de la lesión (11).
Para Collins et al., estos carcinomas se caracterizan por la proliferación papilar y las células en sí mismas son neoplásicas, y no hay evidencia de un papiloma benigno en la lesión estudiada (14). Además, el núcleo de las células epiteliales neoplásicas son a menudo de grado bajo a intermedio y siempre hay una capa de células mioepiteliales en la periferia de los conductos involucrados, una característica que define a esta entidad como carcinoma no invasivo.
El epitelio de los carcinomas papilares intraductales puede consistir de una o varias capas de células en columna o puede mostrar una proliferación más pronunciada de células uniformes con patrones de crecimiento sólido, micropapilar o cribiforme.
El 1% de los tumores papilares intraductales correspondieron a carcinoma papilar intraductal. Conforme a los resultados del presente estudio, en este tipo de carcinoma, los núcleos de la población de células epiteliales son de bajo grado y los receptores de estrógenos y progesterona son fuertemente positivos.
Carcinoma papilar intraquístico
Según Collins et al., el carcinoma papilar intraquístico es una lesión papilar localizada dentro de una gran cavidad quística caracterizada por un tallo fibrovascular delgado desprovisto de la capa de células miopepiteliales y una población de células epiteliales neoplásicas que usualmente presentan características de un carcinoma ductal in situ de bajo grado (14).
Microscópicamente, se caracterizan por la presencia de carcinoma papilar rodeado por una cápsula fibrosa delgada.
No se encuentran células mioepiteliales en las papilas del carcinoma papilar intraquístico. En contraste con el carcinoma papilar intraductal, dichas células están ausentes en la periferia de los espacios involucrados en el carcinoma papilar intraquístico.
En el presente estudio, el 5,6% de los tumores papilares intraductales correspondió a carcinomas papilares intraquísticos. Según los resultados, estos últimos se presentan usualmente en mujeres de edad avanzada (60 años o más) y son tumores clínicamente palpables y de gran tamaño.
Los patrones histológicos vistos en el carcinoma papilar intraquístico incluyen: micropapilar, cribiforme, trabecular y sólido. En el presente estudio, en este tipo de carcinoma los núcleos de la población de células epiteliales fueron de bajo grado y los receptores de estrógenos y progesterona eran fuertemente positivos.
Puede presentarse invasión de la pared de estos carcinomas y ser difícil de identificar. El componente invasivo puede ser por carcinoma ductal infiltrante o de tipo especial. Por lo tanto, la evaluación del tejido mamario circundante adyacente al carcinoma papilar intraquístico, es importante para determinar la presencia y la extensión del carcinoma ductal in situ adyacente.
El carcinoma papilar intraquístico, en ausencia de carcinoma in situ o invasivo en el tejido adyacente, tiene buen pronóstico. La presencia de carcinoma in situ en el tejido adyacente se asocia con aumento de la recurrencia local, mientras que la presencia de carcinoma invasivo lo hace con aumento de la recurrencia local y de metástasis. Es indispensable la evaluación minuciosa de las lesiones que acompañan a los carcinomas papilares no invasivos, ya que el pronóstico y el manejo dependen de ella.
Carter et al. evaluaron el tratamiento y el pronóstico de 41 casos de carcinoma papilar intraquístico (15). Veintinueve pacientes fueron tratadas con mastectomía, 11 de ellas con vaciamiento ganglionar axilar. Ninguna de estas pacientes tuvo metástasis ganglionares o recurrencia en el seguimiento promedio de 5 años. Once pacientes no se sometieron a mastectomía ni radioterapia. De ellas, ocho no tuvieron recurrencia en el mismo tiempo de seguimiento. Solamente hubo recurrencia en una paciente, quien presentó carcinoma ductal in situ en la biopsia por escisión.
La conclusión de este artículo es que es mucho más probable la curación del carcinoma papilar intraquístico mediante tratamiento local solamente, que cuando se acompaña de carcinoma ductal in situ.
Fayanju et al. revisaron la experiencia del manejo de 41 pacientes con carcinoma papilar intraquístico, para evaluar los factores asociados al uso de radioterapia y hormonoterapia complementaria (16). En 21 pacientes se presentó el tipo papilar intraquístico puro, es decir, sin carcinoma ductal in situ ni carcinoma infiltrante; en 18, se asoció con carcinoma ductal in situ y, en 6, con microinvasión.
Las pacientes con carcinoma papilar intraquístico puro se manejaron más frecuentemente con cirugía solamente, que en aquéllas en quienes el tumor se acompañaba de carcinoma ductal in situ o de microinvasión. Dentro del subgrupo con carcinoma papilar intraquístico puro, el tratamiento con cirugía y radioterapia adyuvante fue más frecuente en las menores de 50 años que en las mayores. Las pacientes con carcinoma papilar intraquístico y carcinoma ductal in situ o microinvasión, recibieron terapia endocrina con mayor frecuencia que aquéllas con carcinoma papilar intraquístico puro.
La conclusión de este artículo fue que las pacientes con carcinoma papilar intraquístico asociado a carcinoma ductal in situ o microinvasión, eran tratadas con radioterapia adyuvante y terapia endocrina con base en la condición asociada; además, que el uso de radioterapia, terapia endocrina o de ambas, debería considerarse en pacientes menores de 50 años con carcinoma papilar puro.
Una categorización general de los tumores papilares intraductales se presenta conforme a los resultados de nuestro estudio (figura 15).
Consideramos que el primer paso es la identificación de la lesión en el seno como un tumor papilar intraductal. A su vez, este tumor debe categorizarse como macropapilar o micropapilar.
Los tumores macropapilares incluyen el papiloma benigno, el papiloma atípico, el carcinoma ductal in situ originado en un papiloma y el carcinoma papilar no invasivo (17).
El tumor papilar se clasifica según su histología en: papiloma benigno puro, tumor papilar mixto (papiloma atípico, carcinoma ductal in situ originado en un papiloma benigno) y carcinoma papilar no invasivo.
A su vez, los papilomas benignos se clasifican, según su morfología, origen, localización y acorde al número, en papiloma benigno intraquístico o intraductal, papiloma benigno central o periférico, y papiloma benigno único o múltiple.
La presencia de un área de hiperplasia ductal atípica, menor de 3 mm o de menos de 33%, dentro de un papiloma benigno, califica para la denominación de papiloma atípico; y la presencia de una población de células atípicas mayor de 3 mm o entre 33% y 90%, dentro de un papiloma benigno, califica para la denominación de papiloma que alberga un carcinoma ductal in situ. Esto se aplica a las áreas de atipias nucleares de bajo grado solamente, pues ante la presencia de un área de atipia nuclear de alto grado, la lesión se clasifica como carcinoma ductal in situ originado en un papiloma benigno. La figura 16 resume las principales características diferenciales entre estos dos tipos de lesiones.
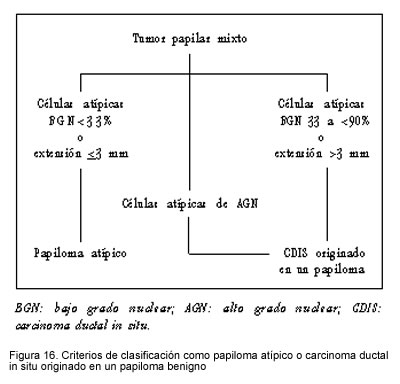
Consideramos que la categoría de papiloma atípico y carcinoma ductal in situ originado en un papiloma benigno, impide que estas lesiones se consideren como carcinoma papilar no invasivo, lo cual evita su tratamiento excesivo.
Con base en los criterios histológicos y de inmunohistoquímica, el tumor papilar intraductal maligno se clasifica como carcinoma papilar intraductal o intraquístico.
La distribución de las células miopepiteliales en los conductos periféricos afectados, evaluada por medio de los marcadores p63, calponina o miosina de músculo liso de cadena pesada, es de gran utilidad para diferenciar entre estas dos entidades. La ausencia de dichas células dentro de las papilas y en los conductos periféricos afectados, cataloga al carcinoma papilar como intraquístico; mientras que, su ausencia en la papila con su presencia en los conductos periféricos afectados, cataloga al carcinoma como intraductal. La tabla 6 resume las principales características diferenciales entre estos dos tipos de carcinoma papilares.
Dados las múltiples denominaciones de una misma entidad papilar intraductal y los diferentes criterios histológicos para su definición, la consideración más importante para el tratamiento correcto de esta entidad, es la comunicación estrecha entre el patólogo y el cirujano de seno.
Referencias
1. MacGrogan G, Moinfar F, Raju U. Intraductal papillary neoplasms. Pathology & Genetics. Tumors of the breast and female genital organs. Geneva: World Health Organization Classification of Tumours;. 2003. p. 10. [ Links ]
2. Torregroza E, Gómez M, Viaña L, Figueroa J. Mastitis granulomatosa crónica lobular idiopática: una patología vigente. Rev Colomb Cir. 2007;22:83-90. [ Links ]
3. Dixon JM, Bundred NJ. Management of disorders of the system and infections. In: Harris JR, Lippman ME, Morrow M, Osborne CK, editors. Diseases of the breast. Philadelphia: Lippincott Williams & Wilkins2000. p. 47-8. [ Links ]
4. Lang JE, Kuerer HM. Breast ductal secretions: clinical features, potential uses, and possible applications. Cancer Control. 2007;14:350-9. [ Links ]
5. Shen KW, Wu J, Lu JS, HanQX, Shen ZZ, Nguyen M, et al. Fiberoptic ductoscopy for patients with nipple discharge. Cancer. 2000;89:1512-9. [ Links ]
6. Ohuchi N, Abe R, Takahashi T, Tezuka F. Origin and extension of intraductal papillomas of the breast: a three-dimensional reconstruction study. Breast Cancer Res Treat. 1984;4:117-28. [ Links ]
7. Al Sarakbi W, Worku D, Escobar PF, Mokbel K. Breast papillomas: current management with a focus on a new diagnostic and therapeutic modality. Int Semin Surg Oncol. 2006;3:1-8. [ Links ]
8. Ali-Fehm R, Carolin K, Wallis T, Visscher DW. Clinicopathologic analysis of breast lesions associated with multiple papillomas. Hum Pathol 2003; 34(3):234-9. [ Links ]
9. Carter D. Intraductal papillary tumors of the breast: a study of 78 cases. Cancer. 1977;39:1689-92. [ Links ]
10. Page DL, Salhany KE, Jensen RA, Dupont WD. Subsequent breast carcinoma risk after biopsy with atypia in a breast papilloma. Cancer. 1996;78:258-66. [ Links ]
11. Tavassoli FA, Devilee P. Pathology and genetics of tumours of the breast and female genital organs. MacGrogan G, Moinfar F, Raju U, editors. Intraductal papillary neoplasms. 2003. p 78 [ Links ]
12. Sydnor MK, Wilson JD, Hijaz TA, Massey HD, Shaw ES. Underestimation of the presence of breast carcinoma in papillary lesions initially diagnosed at core-needle biopsy. Radiology. 2007;242:58-62. [ Links ]
13. Mercado CL, Hamele-Bena D, Oken SM, Singer CI, Cangiarella J. Papillary lesions of the breast at percutaneous core-needle biopsy. Radiology. 2006;238:801-8. [ Links ]
14. Collins LC, Schnitt SJ. Papillary lesions of the breast: selected diagnostic and management issues. Histopathology. 2008;52:20-9. [ Links ]
15. Carter D, Orr SL, Merino MJ. Intracystic papillary carcinoma of the breast. After mastectomy, radiotherapy or excisional biopsy alone. Cancer. 1983;52:14-9. [ Links ]
16. Fayanju OM, Ritter J, Gillanders WE, Eberlein TJ, Dietz JR, Aft R, et al. Therapeutic management of intracystic papillary carcinoma of the breast: the roles of radiation and endocrine therapy. Am J Surg. 2007;194:497-500. [ Links ]
17. Oyama T, Koerner FC. Noninvasive papillary proliferations. Semin Diagn Pathol. 2004;2:32-41. [ Links ]














