Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582On-line version ISSN 2619-6107
rev. colomb. cir. vol.27 no.1 Bogotá Jan./Mar. 2012
Neoplasias quísticas del páncreas
Cystic neoplasmas of the pancreas
1 Estudiantes, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
2 Profesor asistente, Grupo de Gastrohepatología, Facultad de Medicina, Universidad de Antioquia; Unidad de Cirugía Hepatobiliar y Pancreática, Programa de Trasplante Hepático, Universidad de Antioquia-Hospital Pablo Tobón Uribe, Medellín, Colombia.
Correspondencia: Sergio Hoyos, MD Correo electrónico: sergiohoyosd@yahoo.es Bogotá, D.C., Colombia.
Fecha de recibido: 19 de octubre de 2011. Fecha de aprobación: 6 de marzo de 2012.
Resumen
Dados el incremento del uso de la imaginología en el proceso diagnóstico y los avances tecnológicos en su resolución y calidad, muchas enfermedades antes no esclarecidas, e incluso asintomáticas, están siendo descubiertas accidentalmente. Tal es el caso de las lesiones quísticas del páncreas, las cuales no eran diagnosticadas unos 30 años atrás, puesto que la mayoría cursan sin síntomas. Gran cantidad de las lesiones quísticas sintomáticas que afectan el parénquima pancreático, se deben a la presencia de seudoquistes no neoplásicos, cuyo manejo puede ser simplemente el drenaje o el seguimiento médico, mientras que las lesiones quísticas generalmente asintomáticas, son quistes neoplásicos.
Palabras clave: páncreas; neoplasias pancreáticas; quiste pancreático; pancreatectomía.
Abstract
Given the increasing use of imaging in the diagnosis process and the technological advances in resolution and quality of the images, many pathologic entities not yet clearly defined, even those asymptomatic, are now incidentally detected. Such is the case with the pancreatic cystic lesions, which could not de diagnosed some 30 years ago because most of them are asymptomatic. The majority of symptomatic cystic lesions that affect the pancreatic parenchyma are due to the presence of non-neoplastic pseudocysts whose management may be just drainage or clinical follow-up, while those asymptomatic cystic lesions are generally neoplastic.
Key words: pancreas; pancreatic neoplasms; pancreatic cyst; pancreatectomy.
Introducción
En los últimos años, es cada día más frecuente encontrarse con el diagnóstico de lesiones quísticas del páncreas, debido al mayor uso y mejores técnicas de imaginología; muchas de estas lesiones son descubiertas de manera incidental.
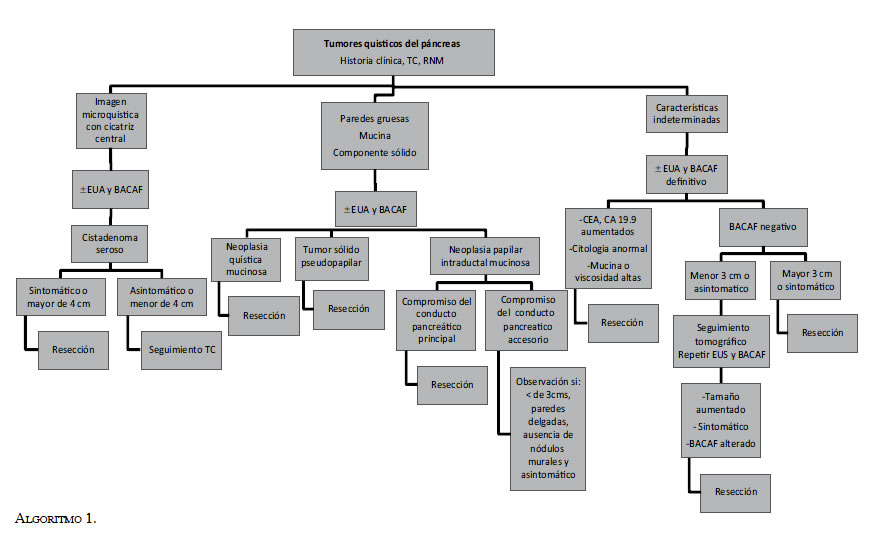
Anteriormente se consideraba que la mayoría de estas lesiones eran inflamatorias1, ahora se sabe que muchas pueden ser tumorales. Existen fundamentalmente cuatro tipos de lesiones identificadas y clasificadas por la Organización Mundial de la Salud (OMS), que son: la neoplasia quística serosa, la neoplasia quística mucinosa, la neoplasia papilar intraductal mucinosa y la neoplasia sólida seudopapilar (tabla 1). Es pertinente aclarar que tanto el tratamiento como el pronóstico de cada una de las lesiones, difiere según su tipo, razón por la cual es necesario lograr, en lo posible, un adecuado diagnóstico diferencial de estas neoplasias. Se propone, entonces, hacer una revisión de cada una de las neoplasias quísticas pancreáticas.

Tumor papilar intraductal mucinoso
Generalidades
El tumor papilar intraductal mucinoso fue descrito por primera vez en 1982 por Ohashi, et al. 2, como un tumor de páncreas productor de mucina. Comprende un grupo de lesiones que difieren de las neoplasias quísticas mucinosas porque están en comunicación directa con el conducto de Wirsung y no existe estroma de tipo ovárico 3. Estos tumores representan, aproximadamente, el 7 % del diagnóstico clínico de los tumores del páncreas y hasta 50 % de los quistes pancreáticos diagnosticados accidentalmente 4.
Está caracterizado por el crecimiento papilar o no del epitelio ductal, con producción de mucina y expansión quística del conducto involucrado 5,6. La historia natural de este tumor es diferente a la del adenocarcinoma ductal: en 90 a 100 % de los casos es extirpable, con una tasa de supervivencia que llega a 80-90 % para el carcinoma in situ, 50-70 % para el carcinoma invasivo y 40-50 % cuando hay metástasis ganglionar 6.
Los tumores papilares intraductales mucinosos aparecen comúnmente en hombres ancianos, con una edad media de presentación de 70 años y, aunque pueden ubicarse en cualquier parte de la glándula 7, se encuentran localizados en la cabeza del páncreas, usualmente en el proceso uncinado 5,8.
Clasificación
Se clasifican, según su localización, como del tipo del conducto pancreático principal o del conducto accesorio, definido como una comunicación entre el conducto pancreático principal normal y la lesión quística 5,6, pudiendo comprometer los dos tipos de conductos (tipo multifocal, combinado)6. Este último tipo suele ser una presentación de los tumores papilares intraductales mucinosos que comprometen el conducto principal, según la clasificación de la OMS; sin embargo, es más frecuente encontrarlo en aquellos tumores que afectan el conducto accesorio 7. El tumor que compromete los conductos accesorios tiene un curso diferente al de los otros dos tipos, ya que se encuentra más comúnmente en pacientes jóvenes y su potencial como neoplasia maligna es muy bajo 9.
El tamaño de la lesión producida por los tumores papilares intraductales mucinosos es mayor de 1 cm y varía en un rango de atipia celular que va desde la displasia leve hasta un carcinoma franco 8, por lo tanto, se consideran lesiones premalignas que pueden ser claramente malignas. Los detalles de su progresión a enfermedad invasiva no son claros, pero se estima que en un rango de 5 a 7 años 10, el tumor papilar intraductal mucinoso –que es un precursor importante del adenocarcinoma ductal pancreático– podría progresar en la secuencia hiperplasia-adenoma-carcinoma 5. Por esta razón, es importante considerarlo como un factor de riesgo, indicativo de adenocarcinoma concurrente en una etapa temprana. Se recomienda, entonces, la evaluación radiológica detallada del páncreas 5.
Histológicamente, en los tumores papilares intraductales mucinosos se encuentran células neoplásicas productoras de mucina organizadas en un patrón papilar. La producción de mucina por las células conduce a una acumulación intraductal de mucina y a una subsecuente dilatación quística. La producción de mucina puede ser tan abundante, que se puede ver saliendo por la ampolla de Vater, lo cual es un hallazgo patognomónico 8.
Manifestaciones clínicas
En general, todas las lesiones quísticas pancreáticas dan lugar a síntomas. Los pacientes frecuentemente refieren dolor en la región epigástrica que, en algunas ocasiones, se irradia a la espalda y se exacerba con la comida 3,8. El dolor se explica por el crecimiento papilar y por la obstrucción causada por el exceso de producción de mucina que bloquea el conducto pancreático 5,8. Se pueden incluir, además, otros signos y síntomas, como pérdida de peso, fiebre e ictericia 6,8. Muchos pacientes reciben un diagnóstico erróneo al considerarse que sufren una pancreatitis crónica 8.
Diagnóstico
El diagnóstico, usualmente, se basa en las imágenes radiológicas 6, en las que se observa un conducto pancreático dilatado, asociado eventualmente a masas quísticas; también es posible diferenciar entre mucina e infiltraciones papilares dentro del conducto y demostrar comunicaciones entre la lesión quística y el conducto de Wirsung normal por medio de la colangio-pancreatografía retrógrada endoscópica, la tomografía computadorizada o la resonancia magnética colangio-pancreática con estimulación de secretina 6,7 (sensibilidad de 83 % para el diagnóstico)6. La comunicación con el conducto confirmaría el diagnóstico 6,8.
En el ultrasonido de los tumores papilares intraductales mucinosos, generalmente, se encuentra un conducto pancreático dilatado en el caso de los del tipo del conducto pancreático principal, o una masa quística pleomorfa bien circunscrita en el caso de los del conducto accesorio. La ecografía no siempre demuestra comunicación con el conducto principal en las lesiones accesorias 11. Por las dificultades para la evaluación de los hallazgos, el ultrasonido no es específico para estas lesiones y, por lo tanto, requieren ser evaluadas por otro tipo de estudios imaginológicos.
En la tomografía computadorizada, el tumor del conducto accesorio aparece comúnmente como una lesión hipodensa con contornos pleomorfos cerca del conducto pancreático. Clásicamente, se encuentra en el proceso uncinado. El conducto pancreático principal no se observa dilatado. La comunicación entre la lesión y el conducto usualmente no se ve en la imagen axial. Las lesiones del conducto pancreático principal son tipificadas por su dilatación segmentaria o difusa. Una lesión discreta podría no ser visualizada. El contraste resalta las lesiones que contienen focos nodulares y permite diferenciar los glóbulos de mucina de un tumor sólido, ya que este último resalta ante el contraste, mientras que los primeros pasan desapercibidos.
La resonancia magnética colangio-pancreática permite evaluar el sistema del conducto pancreático sin ser invasiva. En ella se pueden observar lesiones del conducto pancreático principal caracterizadas por la dilatación de todo el conducto pancreático principal. Una lesión discreta podría no ser visualizada. Sin embargo, los tumores del conducto pancreático principal deben considerarse en los pacientes con un conducto pancreático dilatado sin una lesión obstructiva visible o sin estenosis y con disfunción de la ampolla. En estos casos, una resonancia magnética colangio-pancreática con inyección de secretina o una colangio-pancreatografía retrógrada endoscópica podrían ayudar a esclarecer el diagnóstico. Las lesiones del conducto accesorio tienen una apariencia pleomorfa y son hiperintensas en T2 e hipointensas en T1. La lesión se encuentra próxima o en comunicación directa con el conducto principal pancreático. Las lesiones combinadas que comprometen el conducto pancreático principal y los conductos accesorios, tienen una dilatación simultánea de los dos tipos de conductos. Luego de la infusión con gadolinio, se pueden observar las áreas de engrosamiento de la pared o los componentes nodulares de la lesión 12.
La ecografía endoscópica es una de las ayudas diagnósticas más sensibles para caracterizar las neoplasias quísticas pancreáticas. En el caso de los tumores papilares intraductales mucinosos, puede visualizar la comunicación entre el conducto pancreático principal y un conducto aledaño dilatado, y ayuda a hacer el diagnóstico diferencial entre los depósitos de moco y las lesiones polipoides intraductales; igualmente, visualiza el adelgazamiento de la pared del conducto pancreático o nodos murales. La efectividad diagnóstica de este método es de 92 %. Se sugiere una lesión maligna cuando el diámetro del conducto principal pancreático es mayor de 10 mm, se encuentran lesiones mayores de 40 mm, delgadas con tabique irregular y presencia de nódulos murales que excedan 10 mm de diámetro 13.
En el estudio de las neoplasias quisticas del pancreas tambien se puede utilizar tecnicas de ecografia endoscopica con contraste o con Power Doppler las cuales muestran informacion sobre la irrigacion y el flujo sanguineo en los tejidos afectados. En los tumores pancreaticos pequenos (.2 cm), la sensibilidad para detectar carcinoma ductal es de 83,3 % y 50 %, respectivamente. Recientemente fue desarrollada una tecnica de ecoendoscopia con un transductor de banda ancha llamado harmonico; esta tecnologia puede detectar senales de microtubulos en vasos con flujo lento, permitiendo caracterizar la irrigación del tumor 13,14.
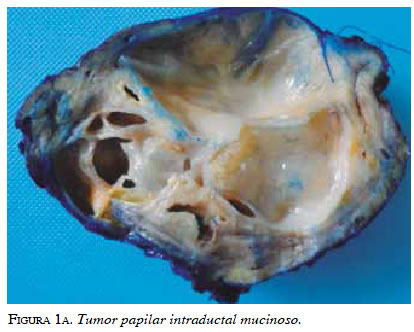
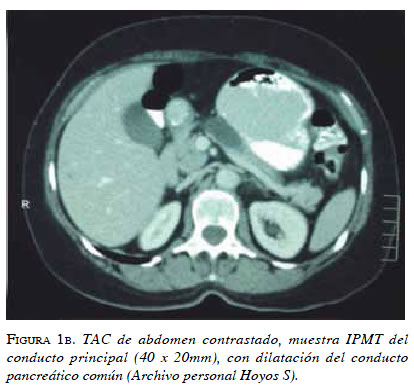
Dada la asociación que existe entre el tumor papilar intraductal mucinoso con el cáncer extrapancreático (gástrico y colorrectal, principalmente) 15, es importante descartar cualquiera de estas dos neoplasias una vez se haya hecho el diagnóstico del quiste pancreático, ya que hay series que reportan tasas de correlación que van desde 8,5 hasta 16,8 % para los occidentales 16 y de 30 a 38 % para los orientales 17. La diferencia entre los orientales y los occidentales podría ser difícil de explicar, pero puede deberse a las diferencias regionales en la incidencia individual del cáncer 18 (figuras 1a y 1b).
Manejo
Actualmente se conocen ciertas características predictoras de un proceso maligno: tumor papilar intraductal mucinoso del conducto principal, dilatación del conducto pancreático (>6 mm) 19, tamaño del tumor >30 mm, presencia de nódulos murales (>5) 20, fuga de mucina por la ampolla de Vater, niveles de CA 19-9 (>37 U/ml) 19, pancreatitis previas, presencia de ictericia y diabetes 6.
Los tumores papilares intraductales mucinosos que comprometen los conductos accesorios tienen un bajo riesgo de progresión maligna 8; por lo tanto, debe observarse si las lesiones tienen un tamaño menor de 3 cm con paredes delgadas, ausencia de nódulos murales y el paciente se encuentra asintomático 3,6,7,16. El seguimiento debe ser anual si la lesión es menor de 1 cm, cada 6 a 12 meses si mide entre 1 y 2 cm, y, por último, si el tamaño es mayor de 2 cm se debe hacer cada 3 a 6 meses 3. La cirugía se recomienda tan pronto como se evidencie progresión de la enfermedad, manifestada por crecimiento secuencial del quiste, aparición de nuevos síntomas atribuibles a la presencia del quiste, tamaño quístico mayor de 3 cm o dilatación mayor de 6 mm del conducto pancreático principal. Si durante el seguimiento no se observan cambios, el intervalo de seguimiento puede aumentar después de los primeros dos años 3, pero siempre se debe continuar con la vigilancia a largo plazo.
La diferencia de edad de los pacientes con lesiones benignas y malignas y la evidencia de “progresión clonal” o neoplasia en el conducto principal, sugieren que los pacientes con tumores papilares intraductales mucinosos del conducto principal deben ser llevados a cirugía para la resección del tumor, independientemente de la presencia o ausencia de síntomas; esto está de acuerdo con el consenso de las Guías de la Asociación de Pancreatología 3,6,16. A los cinco años, la supervivencia de los pacientes con resección del tumor con cáncer no invasivo es mayor de 70 % y de 40 % cuando hay invasión 21. Entre el 20 y el 30 % de los tumores papilares intraductales mucinosos son multifocales; se observa más comúnmente en pacientes con tumor papilar intraductal mucinoso del conducto pancreático accesorio 7 y de 5 a 10 % podrían involucrar toda la glándula 22; por esta razón, más del 15 % de los pacientes requieren pancreatectomía total. El seguimiento es importante para los restantes, ya que se ha reportado recurrencia del 7 % de los casos, aun con márgenes de resección negativos 8,21. La observación y el seguimiento de los tumores papilares intraductales mucinosos debe hacerse con resonancia magnética colangio-pancreática con estimulación de secretina o sin ella 7, ya que los niveles séricos de CA19-9 no proveen ningún valor en el seguimiento de estos pacientes 3.
Ante la controversia que generan las indicaciones quirúrgicas y la extensión de la resección pancreática, en el caso de tumores papilares intraductales mucinosos multifocales y de bajo riesgo de neoplasia maligna 6, en un estudio prospectivo 7 se propuso una clasificación de manejo basada en la localización topográfica de los quistes (tabla 2).

Se concluye, entonces, que los tumores papilares intraductales mucinosos del conducto principal requieren cirugía inmediata por el alto riesgo de un proceso maligno, mientras que los que comprometen el conducto accesorio, deben ser evaluados clínica y morfológicamente para determinar cuál es el mejor tratamiento.
Tumores quísticos mucinosos
Generalidades
En 1996, la OMS describió dos tipos de tumores quísticos mucinosos: el tumor papilar intraductal mucinoso del páncreas y las neoplasias quísticas mucinosas, las cuales se caracterizan por la presencia de estroma de tipo ovárico y ausencia, en la mayoría de los casos, de comunicación con los conductos pancreáticos. Estas neoplasias quísticas del páncreas productoras de mucina son una entidad bastante reconocida; de hecho, en centros experimentados se diagnostican en 10 a 20 %, aproximadamente, del total de las pancreatectomías practicadas 21 y en la histopatología, los tumores papilares intraductales mucinosos y las neoplasias quísticas mucinosas presentan un amplio espectro de atipia celular que va desde la hiperplasia mucinosa leve al adenocarcinoma invasivo.
Las neoplasias quísticas mucinosas se presentan comúnmente en mujeres (proporción 20:1), con una edad media de 45 años, y se ubican en el cuerpo o en la cola del páncreas en el 95 % de los casos. Menos del 10 % de los casos se presenta en hombres, con una edad media de presentación más tardía, a los 70 años.
Clasificación
Las neoplasias quísticas mucinosas del páncreas son una entidad totalmente distinta a los tumores papilares intraductales mucinosos, representan el 10 % de los quistes pancreáticos y el 1 % de los tumores del páncreas exocrino y son clasificados histológicamente por la OMS como adenomas, tumores limítrofes o carcinomas (in situ o invasivos) 23,24. Histológicamente se caracterizan por la presencia de un revestimiento epitelial de células cilíndricas altas productoras de mucina, que están dispuestas en una capa ordenada única y que, abruptamente, se transforman en un epitelio papilar estratificado 25. Las células caliciformes se encuentran frecuentemente. Dentro de una misma lesión, pueden existir diferentes configuraciones en distintas porciones, con zonas de epitelio con apariencia relativamente benigna y cercanas a lesiones malignas, de tipo carcinoma invasivo 12.
Manifestaciones clínicas
La mayoría de las pacientes no presentan síntomas, solamente un vago dolor abdominal acompañado de sensación de plenitud, y en el examen físico sólo en un pequeño número de las pacientes es posible palpar alguna masa abdominal, acompañada en ocasiones de fiebre e ictericia.
Diagnóstico
En este tipo de neoplasia es muy raro que se presente alguna comunicación con el sistema de conductos pancreáticos y, cuando se presenta, sugiere un proceso maligno. Aunque se presumía que eran solitarios, se sabe que, generalmente, se presentan con un quiste dominante y varios quistes más pequeños alrededor del llamado “quiste madre” 26, con un rango de tamaño que va desde los 1,5 cm hasta los 36 cm y que la mayoría son multilobulares 27 con paredes gruesas. También es frecuente encontrar en el estroma ovárico característico de estas neoplasias, receptores de progesterona y estrógenos, en el 61,8 % de los casos; estos tumores también “marcan” en la inmunohistoquímica para la gonadotropina coriónica humana 28.
Las neoplasias quísticas mucinosas han sido divididas en aquellas con algún grado de displasia (bajo, moderado y alto) y el adenocarcinoma invasivo. La prevalencia de este último suele variar en un rango que va desde 6 % hasta 36 % 27. Para determinar esto, en varios estudios se ha demostrado que el perfil de expresión de la mucina se correlaciona con la agresividad y con el pronóstico del tumor pancreático 29. El hecho de que el marcador MUC5AC se exprese en las neoplasias quísticas mucinosas, los tumores papilares intraductales mucinosos y en algunas lesiones hiperplásicas del conducto pancreático, indica que no es específico para ningún tumor en particular y que no orienta al diagnóstico cuando se utiliza solo 28. Sin embargo, es posible afirmar que una neoplasia quística mucinosa no invasiva puede ser distinguida de un tumor papilar intraductal mucinoso y de un adenocarcinoma ductal por un perfil de mucina caracterizado por la expresión constante de MUC5AC, mientras que la expresión de MUC2 se presenta exclusivamente en las células caliciformes (productoras de moco). La expresión de MUC1 es característica de los adenocarcinomas ductales, por lo que su presencia indica que la neoplasia se encuentra en una fase invasiva.
Algunos grupos consideran que la citología debe ser parte de la evaluación diagnóstica de una neoplasia quística mucinosa para diferenciarla de un pseudoquiste pancreático o de otras neoplasias quísticas (tabla 3). El análisis del contenido del quiste, obtenido por biopsia con aguja fina guiada por ecografía, comprende la evaluación de la viscosidad, la citología y la medición de niveles de amilasa y marcadores tumorales, en particular del antígeno carcinoembrionario (ACE) 30. Los niveles elevados de antígeno carcinoembrionario indican una lesión neoplásica mucinosa, sin determinar si es benigna o maligna; los niveles bajos de antígeno carcinoembrionario sugieren cistadenomas serosos o pseudoquistes 31. Los niveles altos de amilasa se asocian a los pseudoquistes; los niveles menores, a tumores papilares intraductales mucinosos, y los niveles mucho más bajos, a neoplasias quísticas mucinosas 30.
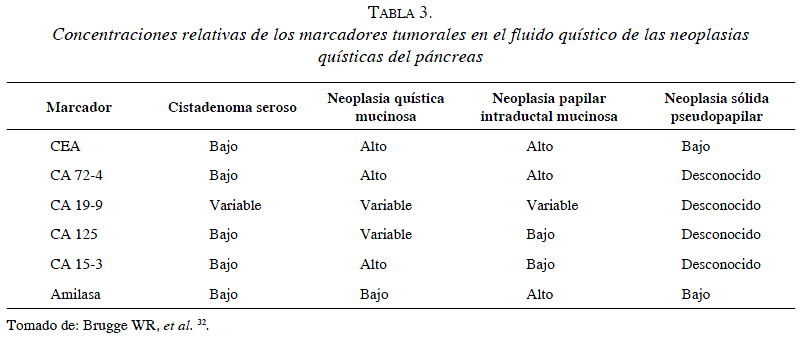
En el ultrasonido del tumor quístico mucinoso se encuentra una masa quística bien circunscrita en el cuerpo y la cola del páncreas en el 70 % de los casos 11. Dependiendo de su tamaño y composición, pueden tener contornos irregulares en su pared, tabiques, nódulos murales y calcificaciones. Sin embargo, estos hallazgos tienden a semejarse con los encontrados en otros tipos de tumores quísticos. Por lo tanto, es necesaria la evaluación con tomografía o resonancia magnética 12.
En la tomografía computadorizada, las neoplasias quísticas mucinosas se evidencian como lesiones hipodensas rodeadas de parénquima pancreático. Se encuentra que los quistes, usualmente, tienen una forma redonda. La lesión, generalmente, se aprecia bien circunscrita y con morfología blanda. Pueden observarse, además, calcificaciones curvilíneas en la periferia de la lesión o en su interior. Luego de la infusión del material de contraste, se observan tabiques o quistes murales en la pared quística. La presencia de tabiques y calcificaciones sugieren un proceso maligno.
En la resonancia magnética de las neoplasias quísticas mucinosas se observa una lesión quística hiperintensa en T2, con diferentes grados de intensidad en T1 por el contenido proteico contenido en la mucina. Posterior a la infusión de gadolinio, se pueden ver la pared quística, los tabiques y los nódulos. Las calcificaciones, si son visibles, son hipointensas en T1 y T2.
La presencia de tabiques, calcificaciones, múltiples lóbulos y proyecciones papilares se asocia frecuentemente con un proceso maligno 25 (figura 2).
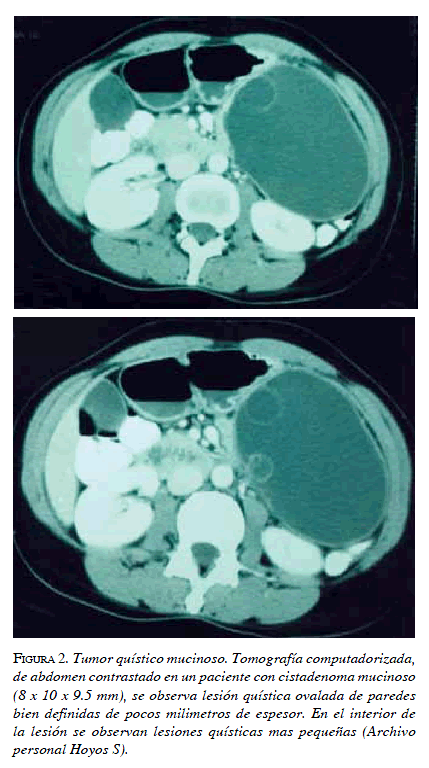
Manejo
Todas las neoplasias quísticas mucinosas deben resecarse por completo, a menos de que exista alguna contraindicación quirúrgica 3. Las bases para esta afirmación se encuentran en que la mayoría de los pacientes con neoplasias quísticas mucinosas son relativamente jóvenes en el momento en el que se hace el diagnóstico y, considerando la expectativa de vida y el riesgo permanente de progresión hacia la neoplasia maligna, se determina que la mejor conducta es la resección quirúrgica (usualmente pancreatectomía izquierda) por laparoscopia para aquellas lesiones ubicadas en el cuerpo y la cola del páncreas 33. En caso de que exista duda de las características de las lesiones, se debe practicar una resección oncológica (pancreatoduodenectomía, pancreatectomía izquierda, pancreatectomía total) con vaciamiento de los ganglios linfáticos regionales 3,34.
Desde el pasado suele existir una firme recomendación para resecar todas las neoplasias productoras de mucina, por el temor de que finalmente progresen hasta desarrollar cáncer 27,34.
El desempeño de la quimioterapia y de la radioterapia como tratamiento adyuvante aún es indeterminado y se requieren muchos más estudios para lograr hacer una recomendación 21. Los pacientes con neoplasias quísticas mucinosas benignas no requieren seguimiento, ya que muchos estudios han demostrado convincentemente que el riesgo de recurrencia de nuevas lesiones luego de la resección es cero 3. Contrario a esto, los pacientes con neoplasias quísticas mucinosas malignas deben someterse a un seguimiento cada seis meses para determinar recurrencias locales y metástasis (principalmente, hematógenas) por imágenes de tomografía computadorizada o resonancia magnética 3. A cinco años, las tasas de supervivencia para las neoplasias quísticas mucinosas malignas son de 50 a 60 %, aproximadamente 28, y para las lesiones benignas con displasia (incluyendo displasia de alto grado) la tasa de supervivencia es cercana al 100 % 3.
Neoplasia quística serosa
Generalidades
Son neoplasias quísticas benignas que se originan desde las células centroacinares del sistema pancreático exocrino; se consideran raras, sin embargo, son las neoplasias quísticas benignas pancreáticas más comunes 35, con una frecuencia del 1 % de los tumores pancreáticos exocrinos y 30 % de todas las neoplasias quísticas 36. Tienen una tasa de crecimiento variable y, aunque la mayoría son benignos, existen algunos reportes de tumores malignos 18. Su ubicación más frecuente es en el cuerpo y en la cola del páncreas, pero pueden desarrollarse en cualquier sitio del parénquima pancreático 37. Predominan en mujeres (razón mujerhombre de 3:1), y se presentan en la séptima década de la vida, por lo que se les denomina frecuentemente “la lesión de la abuela”12. En el pasado, se clasificaban junto a las neoplasias quísticas mucinosas bajo el término de “cistadenoma” y, a partir 1978, fueron reconocidos como una entidad distinta 38.
Manifestaciones clínicas
La mayoría de los pacientes son asintomáticos (20-25 %) y la lesión se detecta incidentalmente en el marco de otra enfermedad no relacionada, pero si llegare a causar síntomas, algunas de las características clínicas serían: náuseas, vómito, pérdida de peso, dolor epigástrico, diarrea o masa abdominal palpable 39. Otras características menos comunes y, en su mayoría, complicaciones agudas de la lesión son: pancreatitis recurrente, hemorragia gastrointestinal aguda debida a ulceración duodenal por el tumor, hemoperitoneo y peritonitis secundaria a ruptura de éste o erosión de vasos intramurales o peritumorales 36. Al igual que otras neoplasias pancreáticas, la naturaleza de los síntomas es inespecífica, lo que contribuye a la demora en el diagnóstico 37.
Esta neoplasia se ha asociado a la enfermedad de von Hippel-Lindau, la cual es un síndrome oncológico multisistémico, autosómico dominante; el compromiso pancreático se da en 60 a 80 % de los pacientes con esta enfermedad, y la neoplasia quística serosa es la más frecuente (35-75 %), con una distribución característicamente dispersa alrededor de la glándula 40.
Clasificación
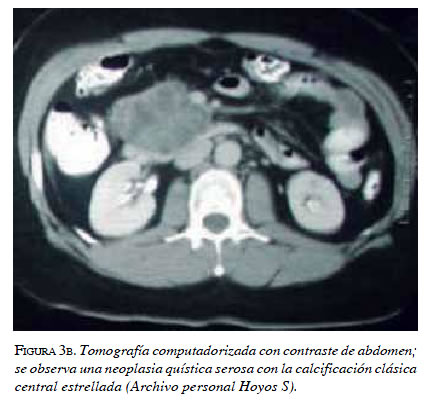
Como se describió previamente, antes se pensaba que todos los tumores pancreáticos serosos eran neoplasias benignas; sin embargo, debido al reporte de algunos casos en los que hubo un comportamiento maligno con invasión local y metástasis, la clasificación actual de la OMS divide estos tumores en dos categorías: “cistadenoma seroso” benigno y “cistadenocarcinoma seroso” maligno. Este último es poco frecuente (riesgo de proceso maligno de 3%) y, desde su descripción en 1989, solamente se han reportado 25 casos; la supervivencia para los cistadenocarcinomas resecados es significativamente mejor que para los no resecados, y es también mayor que para los adenocarcinomas pancreáticos, y puede llegar a cifras de 50 a 76 % 37,41. Se diagnostica sólo por la presencia de metástasis extrapancreáticas 42. También, basándose en la apariencia macroscópica y radiológica, los cistadenomas serosos se pueden clasificar en adenomas microquísticos serosos o cistadenomas sólidos serosos y adenomas macroquísticos serosos o adenomas oligoquísticos serosos 36,39.
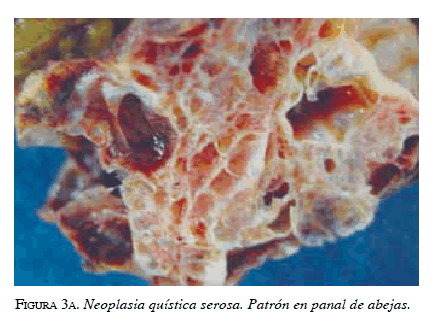
La forma microquística es la más común; alrededor del 70 % de las neoplasias quísticas serosas se presenta como una colección de múltiples quistes (<2 cm), esponjosa, bien circunscrita, separada por una línea fibrosa central que contiene calcificaciones, que da un patrón estrellado o en panal de abejas en las imágenes. Estos quistes contienen líquido seroso, son ricos en glucógeno y epitelio cúbico 35,42.
Los adenomas macroquísticos serosos, poco frecuentes, tienen menos quistes pero son de mayor tamaño y se presentan predominantemente en la cabeza del páncreas 42. Esta variedad tiene un gran significado clínico debido a que es radiológicamente muy parecido a la neoplasia quística mucinosa 8. En general, características como la ubicación en la cabeza del páncreas, el contorno lobular y la presencia de una cápsula delgada sin proyecciones papilares o nódulos, ayuda a distinguir el adenoma seroso de una neoplasia quística mucinosa o de un seudoquiste 35.
Algunos autores agregan a la clasificación las neoplasias asociadas a la enfermedad de von Hippel-Lindau, debido a la alta prevalencia en estos pacientes 43.
Diagnóstico
No existe ninguna prueba diagnóstica preoperatoria que pueda predecir la histología de una lesión quística en el 100 %; por lo tanto, se debe utilizar una combinación de pruebas diagnósticas de imagen (ecografía transabdominal, tomografía computadorizada, resonancia magnética, PET, ultrasonido endoscópico), análisis bioquímico y citológico del fluido del tumor o sangre, para llegar a un diagnóstico diferencial correcto 44. Sin embargo, los estudios recientes han demostrado que hasta un tercio de las neoplasias quísticas pancreáticas encontradas incidentalmente, tienen un diagnóstico preoperatorio incorrecto, lo que indica que es necesario desarrollar nuevas estrategias diagnósticas para poder brindar un tratamiento adecuado 45.
Los estudios radiológicos muestran tres patrones diferentes de estas lesiones:
1. poliquístico: tiene una frecuencia del 70 %, se caracteriza por la colección de múltiples quistes con un tamaño variable desde algunos milímetros hasta 3 cm;
2. en panal de abejas: se da en 30 % de los casos; el tumor consiste en numerosos quistes pequeños, con microlagunas, separados por un tabique fibroso, y
3. macroquístico: una frecuencia del 10 %, caracterizado por la presencia de una masa bien circunscrita, encapsulada, a veces mal definida, compuesta por algunos macroquistes o un macroquiste único 36.
La ecografía transabdominal puede ayudar a la diferenciación entre lesiones quísticas y sólidas, pero la evaluación completa del páncreas se dificulta por la presencia de gas intestinal. Actualmente, es poco utilizada para diferenciar las lesiones quísticas pancreáticas 46.
La tomografía computadorizada tiene una efectividad del 25 al 60 % 35 para diferenciar lesiones serosas de lesiones mucinosas. Se estima que con un abordaje diagnóstico apropiado, alrededor del 90 al 95 % de las neoplasias quísticas serosas pueden ser diagnosticadas con base en la combinación de los siguientes hallazgos: aumento de la irrigación del estroma, áreas de quistes pequeños predominantes, y ausencia de metástasis o invasión local en la imagen. Cuando el diagnóstico no es claro, se pueden utilizar otras pruebas diagnósticas para complementar la tomografía 42.
La resonancia magnética tiene mayor sensibilidad para detectar los componentes líquidos en los microquistes del tumor si se compara con la tomografía; se observan como áreas punteadas hiperintensas en T2, además, se puede visualizar el conducto pancreático para evidenciar una comunicación de éste con el quiste 8. En cuanto a los adenomas macroquísticos serosos, se describe que la mayoría tiene menos de seis quistes, con un tamaño mayor de 2 cm, ausencia de cicatriz en la zona central, y los componentes fibrosos son irregulares y se extienden al parénquima pancreático que hay alrededor 37,46.
En la imagen de alta resolución que se obtiene con la ultrasonografía endoscópica, se puede observar el patrón típico en panal de abejas. Una ventaja que ofrece este método es la posibilidad de utilizar la aspiración con aguja fina para obtener la muestra del líquido de los quistes para analizar la citología, niveles de antígeno carcinoembrionario y amilasas. Cuando se sospecha una neoplasia microquística serosa, la aspiración con aguja fina no es necesaria por dos razones. Primero, el tamaño pequeño de los quistes dentro del tumor no permite hacer una punción directa de éstos, sin embargo, podría servir para información citológica. Segundo, sólo la morfología sería suficiente para el diagnóstico si se trata de endosonografistas con experiencia 47.
Como se mencionó anteriormente, también puede ser utilizada la ecoendoscopia con contraste, con Doppler o harmónico. Esta última se ha ido remplazando por la técnica de imagen por inversión de pulso la cual utiliza las vibraciones de las microburbujas como sustrato, lo que mejora la resolución y aumenta la sensibilidad al contraste. Estudios recientes muestran que la técnica de ecoendoscopia con contraste es de utilidad para diferenciar los cistadenomas de los cistadenocarcinomas; los primeros muestran un patrón vascular a lo largo de bandas fibrosas, mientras que los cistadenocarcinomas son pobre y caóticamente irrigados, teniendo una sensibilidad mayor al 90% 48. Igualmente, es de gran utilidad para diferenciar los cistadenomas de los seudoquistes, con sensibilidad de 95 % y especificidad de 92% 49.
La tomografía por emisión de positrones (positron emission tomography, PET) tiene utilidad en la detección de lesiones quísticas malignas con sensibilidad de 94 % y especificidad de 97 %; sin embargo, las lesiones con características radiográficas sospechosas deben ser retiradas sin tener en cuenta los hallazgos en la PET 44.
Como se mencionó anteriormente, la prueba ideal para obtener las muestras del fluido es la aspiración con aguja fina guiada por ultrasonografía endoscópica 36. El fluido de las neoplasias quísticas serosas se caracteriza por ser incoloro, diluido, con viscosidad baja, sin estearasas leucocitarias, ausencia de mucina, bajas concentraciones de amilasas 43 y niveles bajos de los siguientes marcadores: CEA (usualmente menos de 5 ng/ml), NB/70K, CA15-3 y CA72-4 36. Aunque no existe ningún marcador sérico disponible para las neoplasias quísticas serosas, un aumento de más de dos marcadores, como CEA, CA19-9 o CA125, puede indicar un cistoadenocarcinoma mucinoso con un sensibilidad de 53 %44.
En cuanto a las características macroscópicas, se describen como tumores solitarios, con un tamaño promedio de 6 cm pero que pueden alcanzar hasta 25 cm 43, bien demarcados, compuestos por múltiples microquistes o macroquistes, los cuales tienen una pared fina y fluido claro en su interior. Microscópicamente, se componen de un epitelio cúbico simple uniforme que muestra unas características citológicas benignas, como un núcleo uniforme redondeado, bordes celulares bien definidos, citoplasma escaso finamente vacuolado y rico en glucógeno 39,44. Las tinciones para glucógeno, como la tinción peryódica ácida de Schiff es positiva, las células marcan positivamente con anticuerpos para pancitoqueratina (AE1/AE3), CAM 5.2, EMA, y citoqueratinas 7,8,18 y 19 39 (figuras 3a y 3b).
Manejo
Debido a que en ocasiones el diagnóstico es incierto o se desconoce la historia natural de algunos de estos tumores, algunos autores recomiendan la resección de rutina para todos los quistes pancreáticos, argumentando la dificultad en algunos casos para diferenciar entre lesiones malignas o benignas, y las posibles consecuencias que podría tener un manejo conservador de una neoplasia maligna 50,51,52.
Sin embargo, otros autores recomiendan un manejo más selectivo para la resección de las neoplasias quísticas serosas, identificando mediante las ayudas diagnósticas los pacientes que tengan menor riesgo de procesos malignos (quistes pequeños, descubiertos accidentalmente o asintomáticos), para no exponer a aquellos con lesiones benignas a los posibles riesgos que conlleva el abordaje quirúrgico 53,54,55. Varios estudios reportan una tasa anual de crecimiento para el cistadenoma de 0,5-0,6 cm 55,56; sin embargo, se observa que los tumores con un tamaño mayor de 4 cm tienen una tasa de crecimiento mayor, 1,98 cm por año, comparado con aquellos que tienen menos de 4 cm, 0,12 cm por año; la razón para explicar esta diferencia todavía no es clara, al igual que el posible potencial maligno. Además, los tumores con tamaño menor eran menos sintomáticos al compararse con los de más de 4 cm (22 % Vs. 72 %). Por esta razón, se recomienda la resección de los tumores sintomáticos o que tengan un tamaño mayor de 4 cm 35,56.
Un seguimiento radiográfico cuidadoso será necesario para aquellos pacientes que presenten masas pequeñas y sean asintomáticos; algunos autores recomiendan que, después de la evaluación inicial, se practique tomografía computadorizada o resonancia magnética cada seis meses durante los primeros dos años y, posteriormente, anualmente 55,57. En los pacientes ancianos se considera que después de un periodo de observación en el cual estén estables, no se recomiendan más estudios radiológicos 55.
Tumor sólido seudopapilar
Generalidades
Fue reportado por primera vez en 1933 por Lichtenstein, y fue descrito por Frantz como una entidad distinta en 1959 58. Se considera una lesión epitelial con bajo riesgo de ser maligno. Usualmente, comienzan como tumores sólidos y, posteriormente, se degeneran dando una apariencia quística 59. Es poco común, representa de 1 a 2 % de todos los tumores pancreáticos 60,61. El 87 al 90 % de los pacientes son mujeres (relación mujer:hombre de10:1) 39, en su mayoría jóvenes, con una edad promedio de aparición de los 22 a los 25 años; sin embargo, puede aparecer en pacientes entre los 2 y los 85 años 58. Se ubican más frecuentemente en la cola del páncreas, aunque pueden aparecer en cualquier parte del parénquima pancreático, y su tamaño varía entre 1,5 cm y 30 cm de diámetro 43. Según la clasificación de la OMS, se le debe denominar tumor sólido seudopapilar del páncreas, y se puede dividir en dos subtipos: 1) neoplasias sólidas seudopapilares con potencial maligno al límite y 2) carcinomas sólidos seudopapilares 1.
Manifestaciones clínicas
Esta neoplasia es usualmente asintomática y en la mayoría de los casos se descubre incidentalmente. Si llegaren a ser sintomáticos, las manifestaciones se relacionan con el tamaño del tumor y las más comunes son: dolor abdominal, masa abdominal palpable en epigastrio, náuseas, pérdida de peso, vómito y saciedad temprana. En algunos casos puede presentarse ictericia o hemoperitoneo debido a ruptura del tumor 62.
Diagnóstico
Al igual que en los demás tumores quísticos del páncreas, el mayor reto diagnóstico es poder caracterizar correctamente el tumor antes de la intervención quirúrgica. En un estudio realizado por Casadei, et al., se encontró que entre el 25 y el 50 % de los pacientes con estos tumores llegan con el diagnóstico correcto al momento de la cirugía 63.
La ecografía, generalmente, no ayuda a distinguir estos tumores de los otros tipos de lesiones quísticas pancreáticas; sin embargo, se describe como masa heterogénea, encapsulada, con componentes ecogénicos sólidos y quísticos hipoecoicos, con calcificaciones periféricas y distorsión de las estructuras que la rodean 62.
En la tomografía computadorizada, los tumores se describen como masas grandes, encapsuladas, quísticas y sólidas o solamente sólidas. En los tumores quísticos y sólidos, el tejido sólido se ubica generalmente en la periferia y en el centro se observan áreas de hemorragia y degeneración quística 12,63. Después de la infusión del medio de contraste, los componentes capsulares y sólidos (localizados típicamente en la periferia) pueden realzarse. Se ha descrito la presencia de calcificaciones, tanto marginales como centrales 12.
La resonancia magnética es útil para distinguir ciertas características del tejido, como la presencia de hemorragia, la degeneración quística o la presencia de cápsula, un hallazgo clave de este tumor.
En el estudio angiográfico, el tumor es usualmente avascular, a veces hipovascular y rara vez es de apariencia normal 58.
La ultrasonografía endoscópica con aspiración con aguja fina puede confirmar el diagnóstico en el 75 % de los casos. La apariencia característica es una masa bien demarcada, sólida y quística o puramente quística, debido a la necrosis hemorrágica. También se pueden observar calcificaciones en el 20 % de los casos 64. La ultrasonografía endoscópica juega un papel limitado debido al gran tamaño de las lesiones 13.
Los hallazgos citológicos de estos tumores consisten en áreas de células epiteliales poligonales profusamente irrigadas que alternan con espacios quísticos. Los cambios degenerativos hacen que ocurra una desconexión entre las células tumorales y los capilares que las rodeen, dando la apariencia seudopapilar característica 65. Las células tienen un citoplasma eosinofílico que puede ser vacuolado, y el núcleo usualmente es uniforme y redondeado. La actividad mitótica es baja 66.
A pesar de su bajo potencial maligno, alrededor de 10 a 15 % de estas lesiones puede desarrollar enfermedad metastásica, más frecuentemente a hígado y peritoneo 67,68. Hallazgos como la invasión perineural o vascular, el incremento de la tasa mitótica y los nidos necrobióticos prominentes, sugieren un proceso maligno 62,67.
Las neoplasias sólidas seudopapilares se pueden desarrollar en cualquier lugar de la glándula, pero predominan en el cuerpo y la cola. El tamaño varía entre 6 y 12,5 cm 69, pero se han reportado casos desde 1,5 cm hasta de 30 cm 70. Macroscópicamente, la apariencia cambia de acuerdo con el tamaño del tumor. Los tumores pequeños son los que menos expresan un patrón quístico y frecuentemente no tienen cápsula. Los tumores de mayor tamaño, comúnmente presentan una seudocápsula fibrosa que los rodea 58.
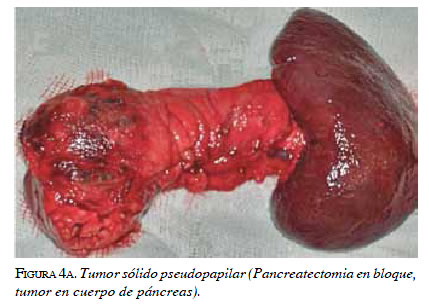
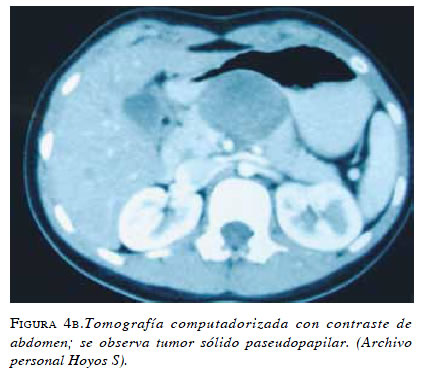
En el análisis de inmunohistoquímica se encuentra un patrón característico, en el cual las células neoplásicas son positivas para los marcadores vimentina, CD10 y CD56 69. Hasta el 90 % son positivos para la enolasaneuroespecífica, alfa1-antitripsina y receptores de estrógenos. El origen de estos tumores no está esclarecido; sin embargo, se cree que pueden originarse de las células de la cresta gonadal que fueron incorporadas al páncreas durante la embriogénesis 58,71 (figuras 4a y 4b).
Manejo
Estas neoplasias se consideran de bajo grado de malignidad, y el pronóstico en la mayoría de los pacientes es excelente 39,72. Más del 95 % de los pacientes responden adecuadamente a la resección quirúrgica 58. La enfermedad metastásica (ya sea a hígado o a peritoneo) se ha visto en algunos pacientes; sin embargo, responden adecuadamente al manejo quirúrgico 73.
La resección quirúrgica, entonces, es el pilar fundamental del tratamiento. El tipo de cirugía depende de la localización del tumor. Para los tumores localizados en la cola o el cuerpo del páncreas, la pancreatectomía distal con preservación del bazo es la más recomendada; las contraindicaciones para la preservación esplénica serían el compromiso vascular o hiliar del bazo, o la esplenomegalia 74. Cuando el tumor se encuentra en la cabeza del páncreas, se lleva a cabo una pancreatoduodenectomía (Whipple) con preservación del píloro en lo posible 58. Los tumores localizados en el cuello del páncreas son removidos por una pancreatectomía central con pancreatoyeyunostomía distal o pancreático-gastrostomía 69. La invasión de la vena porta o mesentérica superior no debe ser criterio para no resecar estos tumores.
Para los tumores pequeños distantes del conducto pancreático principal, la enucleación puede ser una alternativa de tratamiento, sobre todo en niños 58. No se considera la necesidad de linfadenectomía, ya que la metástasis a los ganglios linfáticos es poco frecuente (2 %). En los casos en que haya metástasis, se recomienda igualmente el manejo quirúrgico agresivo, ya que tienen muy buen pronóstico a largo plazo 74. Se sugiere una resección sincrónica de las metástasis hepáticas, ya que mejoran la tasa de supervivencia a los cinco años 58,74.
Conclusiones
Los resultados publicados recientemente 45 plantean la dificultad prequirúrgica que existe para hacer una buena clasificación de los tumores quísticos pancreáticos hallados incidentalmente, con los métodos diagnósticos actuales; sin embargo, es un tema en el cual se avanza de una manera constante y con mayor frecuencia se llega a un diagnóstico acertado por medio de las nuevas técnicas de ecografía endoscópica. Es por esta razón que tanto el diagnóstico prequirúrgico como el manejo quirúrgico de las neoplasias quísticas del páncreas, son un reto interesante y desafiante para el médico tratante. El cuidado óptimo de estos pacientes se facilita si el manejo es guiado por un equipo experimentado que incluya radiólogos, gastroenterólogos, cirujanos, patólogos y oncólogos. Las decisiones sobre el tratamiento deben ser individualizadas y basadas en la edad, las enfermedades concomitantes, las preferencias y la voluntad del paciente para someterse a los estudios de seguimiento y los riesgos quirúrgicos de una resección pancreática segura.
Referencias
1. Kloppel G, Solcia E, Longnecker D. Histological typing of tumors of the exocrine pancreas. WHO International Histological Classification of Tumors. Second edition. Berlin, Heidelberg, New York: WHO; 1996. [ Links ]
2. Ohashi K, Mirukami Y, Muruyama M, Takekoshi T, Ohta H, Ohashi I. Four cases of mucus secreting pancreas cancer. Progress of Digestive Endoscopy. 1982;20:348-51. [ Links ]
3. Tanaka M, Chari S, Adsay V, Fernández del Castillo C, Falconi M, Shimizu M, et al. International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology. 2006;6:17-32. [ Links ]
4. Bussom S, Saif MW. Intraductal papillary mucinous neoplasia (IPMN).Highlights from the "2010 ASCO Gastrointestinal Cancers Symposium". Orlando, FL, USA. January 22-24, 2010. JOP. 2010;11:131-4. [ Links ]
5. Jarry J, Belleannee G, Rault A, Sa Cunha A, Collet D. Can an intraductal papillary mucinous tumor be a potential indicator of concurrent adenocarcinoma of the pancreas? JOP. 2010;11:55-7 [ Links ]
6. Baiocchi GL, Portolani N, Missale G, Baronchelli C, Gheza F, Cantù M, et al.Intraductal papillary mucinous neoplasm of the pancreas (IPMN): clinico-pathological correlations and surgical indications. World J SurgOncol. 2010;8:25. [ Links ]
7. Salvia R, Partelli S, Crippa S, Landoni L, Capelli P, Manfredi R, et al. Intraductal papillary mucinous neoplasms of the pancreas with multifocal involvement of branch ducts. Am J Surg. 2009;198:709-14. [ Links ]
8. Garcea G, Ong SL, Rajesh A, Neal CP, Pollard C A, Berry DP, Dennison AR. Cystic lesions of the pancreas. A diagnostic and management dilemma.Pancreatology. 2008;8:236-51. [ Links ]
9. Yamaguchi K, Watanabe M, Nakamura M, Konomi H, Tanaka M. Intraductal papillary-mucinous neoplasm of the pancreas. Nippon Rinsho. 2006;64(Suppl.1):52-9. [ Links ]
10. Salvia R, Festa I, Butturini G, Tonsi A, Sartori N, Biasutti C. Pancreatic cystic tumours. Minerva Chir. 2004;59:185-207. [ Links ]
11. Ceballos MM, Tangarife TE, Ruiz PM. Evaluación imaginológica de las lesiones quísticas del páncreas Mag Reson Imaging. RevistaColombiana de Radiologia. 2010; 21(2):2882-900 [ Links ]
12. Sidden C, Mortele K. Cystic tumors of the pancreas: Ultrasound, computed tomography, and magnetic resonance imaging features. Semin Ultrasound CT MR. 2007;28:339-56 [ Links ]
13. Sakamoto H, Kitano M, Kamata K, El-Masry M, Kudo M. Diagnosis of pancreatic tumors by endoscopic ultrasonography. World J Radiol. 2010;2:122-34. [ Links ]
14. Kitano M, Kudo M, Maekawa K, Suetomi Y, Sakamoto H, Fukuta N, et al. Dynamic imaging of pancreatic diseases by contrast enhanced coded phase inversion harmonic ultrasonography. Gut. 2004;53:854-9 [ Links ]
15. Ikeuchi N. Prognosis of cancer with branch duct type IPMN of the pancreas. World J Gastroenterol. 2010;16:1890. [ Links ]
16. Calculli L, Pezzilli R, Brindisi C, Morabito R, Casadei R, Zompatori M. Pancreatic and extrapancreatic lesions in patients with intraductal papillary mucinous neoplasms of the pancreas: A single-centre experience. Radiol Med. 2010;115:442-52. [ Links ]
17. Kamisawa T, Tu Y, Egawa N. The incidence of pancreatic and extrapancreatic cancers in Japanese patients with chronic pancreatitis. Hepatogastroenterology. 2007;54:1579-81. [ Links ]
18. Friedel DM, Abraham B, Georgiou N, Stavropoulos SN, Grendell JH, Katz DS. Pancreatic cystic neoplasms.Southern Medical Journal. 2010;103:51-7. [ Links ]
19. Shin SH, Han DJ, Park KT, Kim YH, Park JB, Kim SC. Validating a simple scoring system to predict malignancy and invasiveness of intraductal papillary mucinous neoplasms of the pancreas. World J Surg. 2010;34:776-83. [ Links ]
20. Sugiyama M, Izumisato Y, Abe N, Masaki T, Mori T, Atomi Y. Predictive factors for malignancy in intraductal papillary mucinous tumours of the pancreas. Br J Surg. 2003;90:1244-9. [ Links ]
21. Sohn TA, Yeo CJ, Cameron JL, Hruban RH, Fukushima N, Campbell KA, et al. Intraductal papillary mucinous neoplasms of the pancreas. Ann Surg. 2004;239:788-99. [ Links ]
22. Campbell F, Azadeh B. Cystic neoplasms of the exocrine pancreas. Histopathology. 2008;52:539-51. [ Links ]
23. Ji Y, Xu JF, Kuang TT, Zhou YN, Lu SH, Tan YS. Mucin profile of the pancreatic mucinous cystic neoplasms. Chin Med J. 2006;119:328-30. [ Links ]
24. Kloppel G, Luttges J. WHO classification 2000: Exocrine pancreatic tumors. VerhDtschGesPathol. 2001;85:219-28. [ Links ]
25. Hara T, Kawashima H, Ishigooka M, Kashiyama M, Takanashi S, Yamazaki S, et al. Mucinous cystic tumors of the pancreas. Surg Today. 2002;32:965-9. [ Links ]
26. Scott J, Martin I, Redhead D, Hammond P, Garden OJ. Mucinous cystic neoplasms of the pancreas: Imaging features and diagnostic difficulties. ClinRadiol. 2000;55:187-92. [ Links ]
27. Thompson L, Becker R, Przygodzki R. Mucinous cystic neoplasm (mucinous cystadenocarcinoma of low-grade malignant potential) of the pancreas: A clinicopathologic study of 130 cases. Am J SurgPathol. 1999;23:1-16. [ Links ]
28. Izumo A, Yamaguchi K, Eguchi T. Mucinous cystic tumor of the pancreas: Immunohistochemical assessment of "ovarian-type stroma". Oncol Rep. 2003;10:515-25. [ Links ]
29. Terada T, Ohta T, Sasaki M, Nakanuma Y, Kim Y. Expression of MUC apomucins in normal pancreas and pancreatic tumours. J Pathol. 1996;180:160-5 [ Links ]
30. Lewandrowski KB, Southern JF, Pins MR, Compton CC, Warshaw AL. Cyst fluid analysis in the differential diagnosis of pancreatic cysts. A comparison of pseudocysts, serous cystadenomas, mucinous cystic neoplasms, and mucinous cystadenocarcinoma. Ann Surg. 1993;217:41-7 [ Links ]
31. Brugge W, Lewandrowski K, Lee-Lewandrowski E, Centeno B, Szydlo T, Regan S, et al. Diagnosis of pancreatic cystic neoplasms: A report of the cooperative pancreatic cyst study. Gastroenterology. 2004;126:1330-6. [ Links ]
32. Brugge WR, Lauwers GY, Sahani D, Fernández del Castillo C, Warshaw AL. Cystic neoplasms of the pancreas. N Engl J Med. 2004;351:18-26. [ Links ]
33. Matsumoto T, Hirano S, Yada K, Himeno Y, Shibata K, Aramaki M, et al. Safety and efficacy of laparoscopic distal pancreatectomy for the treatment of pancreatic disease. J Hepatobiliary Pancreat Surg. 2005;12:65-70. [ Links ]
34. Falconi M, Salvia R, Bassi C, Zamboni G, Talamini G, Pederzoli P. Clinicopathological features and treatment of intraductal papillary mucinous tumour of the pancreas. Br J Surg. 2001;88:376-81. [ Links ]
35. Morgan DE. Cystic lesions of the pancreas. Semin Roentgenol. 2009;44:255-65. [ Links ]
36. Alsaad K, Chetty R. Serous cystic neoplasms of the pancreas. Current Diagnostic Pathology. 2005;11:102-9. [ Links ]
37. Katz MHG, Mortenson MM, Wang H, Hwang R, Tamm EP, Staerkel G. Diagnosis and management of cystic neoplasms of the pancreas: An evidence-based approach. J Am Coll Surg. 2008;207:106-20. [ Links ]
38. Compagno J, Oertel J. Microcystic adenomas of the pancreas (glycogen-rich cystadenomas): A clinicopathologic study of 34 cases. American J Clin Pathol. 1978;69:289-98. [ Links ]
39. Hruban HR, Fukushima N. Cystic lesions of the pancreas. Diagn Histophatol. 2008;14:260-265. [ Links ]
40. Fasanella KE, McGrath K. Cystic lesions and intraductal neoplasms of the pancreas. Best Pract Res Clin Gastroenterol. 2009;23:35-48. [ Links ]
41. Butte JM, Noreno E, Duarte I, Llanos O. Tumores quísticos del páncreas. Revista Chilena de Cirugía. 2004;56:341-5. [ Links ]
42. Cao HST, Kellogg B, Lowy AM, Bouvet M. Cystic neoplasms of the pancreas. Surg Oncol Clin N Am. 2010;19:267-95. [ Links ]
43. Stamatakos M, Sargedi C, Angelousi A, Kontzoglou K, Safioleas P, Petropoulou C, et al. Management of the rare entity of primary pancreatic cystic neoplasms. J Gastroenterol Hepatol. 2009;24:1203-10 [ Links ]
44. Carpizo DR, Allen PJ, Brennan MF. Current management of cystic neoplasms of the pancreas. Surgeon. 2008;6:298-307. [ Links ]
45. Correa-Gallego C, Ferrone CR, Thayer SP, Wargo JA, Warshaw AL, Fernández del Castillo C. Incidental pancreatic cysts: Do we really know what we are watching? Pancreatology. 2010;10:144- 50. [ Links ]
46. Visser BC, Muthusamay VR, Mulvihill SJ, Coakley F. Diagnostic imaging of cystic pancreatic neoplasms. Surg Oncol. 2004;13:27-39. [ Links ]
47. Dewitt J. EUS-FNA of cystic pancreatic tumors. Tech Gastrointest Endosc. 2005;7:181-7. [ Links ]
48. Rickes S, Mönkemüller K, Malfertheiner P. Echo-enhanced ultrasound with pulse inversion imaging: A new imaging modality for the differentiation of cystic pancreatic tumours. J Gastroenterol. 2006;12:2205-8. [ Links ]
49. Rickes S, Wermke W. Differentiation of cystic pancreatic neoplasms and pseudocysts by conventional and echo-enhanced ultrasound. J Gastroenterol Hepatol. 2004;19(7):761-6. [ Links ]
50. Horvath KD, Chabot JA. An aggressive resectional approach to cystic neoplasms of the pancreas. Am J Surg. 1999;178:269-74. [ Links ]
51. Siech M, Tripp K, Schmidt-Rohlfing B, Mattfeldt T, Widmaier U, Gansauge F, et al. Cystic tumours of the pancreas: Diagnostic accuracy, pathologic observations and surgical consequences. Langenbeck Arch Surg. 1998;383:56-61. [ Links ]
52. Ooi L, Ho G, Chew S. Cystic tumours of the pancreas: A diagnostic dilemma. Aust NZ J Surg. 1998;68:844-6. [ Links ]
53. Spinelli KS, Fromwiller TE, Daniel RA, Kiely JM, Nakeeb A, Komorowski RA. Cystic pancreatic neoplasms. Ann Surg. 2004;239:651-9. [ Links ]
54. Walsh RM, Vogt DP, Henderson JM, Zuccaro G, Vargo J, Dumot J. Natural history of indeterminate pancreatic cysts. Surgery. 2005;138:665-71. [ Links ]
55. Allen PJ, D'Angelica M, Gonen M, Jaques DP, Coit DG, Jarnagin WR, et al. A selective approach to the resection of cysticlesions of the pancreas: Results from 539 consecutive patients. Ann Surg. 2006;244:572-82. [ Links ]
56. Tseng JF, Warshaw AL, Sahani DV, Lauwers GY, Rattner DW, Fernandez del Castillo C. Serous cystadenoma of the pancreas: Tumor gowth rates and recommendations for treatment. Ann Surg.2005;242:413-419; discussion 419-421. [ Links ]
57. Fernández del Castillo C, Targarona J, Thayer SP, Rattner DW, Brugge WR, Warshaw AL. Incidental pancreatic cysts: Clinicopathologic characteristics and comparison with symptomatic patients. Arch Surg. 2003;138:427-34. [ Links ]
58. Papavramidis T, Papavramidis S. Solid pseudopapillary tumors of the pancreas: Review of 718 patients reported in English literature. J Am Coll Surg. 2005;200:965-72. [ Links ]
59. Tipton S, Smyrk T, Sarr M, Thompson G. Malignant potential of solid pseudopapillary neoplasm of the pancreas. Br J Surg. 2006;93:733-7. [ Links ]
60. Yu PF. Solid pseudopapillary tumor of the pancreas: A review of 553 cases in Chinese literature. World J Gastroenterol . 2010;16:1209. [ Links ]
61. Aretxabala X, Roa I, León J, Maluenda F. Tumores quísticos del páncreas. Rev Med Chile. 2008;136:1188-96. [ Links ]
62. Romics L, Oláh A, Belágyi T, Hajdú N, Gyurus P, Ruszinkó V. Solid pseudopapillary neoplasm of the pancreas -proposed algorithms for diagnosis and surgical treatment. Langenbeck Arch Surg. 2010;395:747-55. [ Links ]
63. Casadei R, Santini D, Calculli L, Pezzilli R, Zanini N, Minni F. Pancreatic solid-cystic papillary tumor: Clinical features, imaging findings and operative management. JOP. 2006;7:137-44. [ Links ]
64. Bardales RH, Centeno B, Mallery JS, Lai R, Pochapin M, Guiter G, et al. Endoscopic ultrasound-guided fine-needle aspiration cytology diagnosis of solid-pseudopapillary tumor of the pancreas: A rare neoplasm of elusive origin but characteristic cytomorphologic features. Am J Clin Pathol . 2004;121:654-62. [ Links ]
65. Klimstra DS. Nonductal neoplasms of the pancreas. Mod Pathol. 2007;20(Suppl.1):S94-112. [ Links ]
66. Albores-Saavedra J, Simpson KW, Bilello SJ. The clear cell variant of solid pseudopapillary tumor of the pancreas: A previously unrecognized pancreatic neoplasm. Am J Surg Pathol. 2006;30:1237-42 [ Links ]
67. Tang LH, Aydin H, Brennan MF, Klimstra DS. Clinically aggressive solid pseudopapillary tumors of the pancreas: A report of two cases with components of undifferentiated carcinoma and a comparative clinicopathologic analysis of 34 conventional cases. Am J Surg Pathol. 2005;29:512-9. [ Links ]
68. Cerdán R, Barranco JI, Cantín S, Bernal J, Serrablo A, Esarte JM. Tumor de Frantz . Presentación de un caso. Revista Chilena de Cirugía. 2007;59:145-149. [ Links ]
69. Panieri E, Krige JE, Bornman PC, Graham SM, Terblanche J, Cruse JP. Operative management of papillary cystic neoplasms of the pancreas. J Am Coll Surg. 1998;186:319-24. [ Links ]
70. Santini D, Poli F, Lega S. Solid-papillary tumors of the pancreas: Histopathology. JOP. 2006;7:131-6. [ Links ]
71. Kosmahl M, Seada LS, Jänig U, Harms D, Klöppel G. Solidpseudopapillary tumor of the pancreas: Its origin revisited. Virchows Arch. 2000;436:473-80. [ Links ]
72. Aretxabala X, Rencoret G, Maluenda F, Fernandez C, Csendes A. Tumor sólido pseudopapilar del páncreas: caso clínico. Revista Chilena de Cirugía. 2008;60:241-5. [ Links ]
73. Adsay NV. Cystic neoplasia of the pancreas: Pathology and biology. J Gastrointest Surg. 2008;12:401-4. [ Links ]
74. De Castro SMM, Singhal D, Aronson DC, Busch ORC, van Gulik TM, Obertop H. Management of solid-pseudopapillary neoplasms of the pancreas: A comparison with standard pancreatic neoplasms. World J Surg. 2007;31:1130-5. [ Links ]