Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582On-line version ISSN 2619-6107
rev. colomb. cir. vol.27 no.3 Bogotá Jul./Sept. 2012
1 Médico cirujano especialista en cuidado intensivo y anestesia; profesor asociado, Universidad de Boyacá; coordinador, Unidad de Cuidado Intensivo, Clínica de los Andes de Tunja; líder, Grupo OXIGENAR, Tunja, Colombia
2 Estudiante de tercer año, Facultad de Medicina, Universidad de Boyacá, Tunja, Colombia
3 Médico cirujano; Ph.D en Patología; profesor titular, Universidad de Boyacá; coordinador, Servicio de Patología, Clínica de los Andes de Tunja, Tunja, Colombia
4 Bacteriologa; profesora asociada, Universidad de Boyacá, Tunja, Colombia
5 Enfermero, Ph.D en Salud Pública y Ph.D en Medicina Clínica; profesor titular, Facultad de Enfermería, Universidad Nacional de Colombia, Bogotá, D.C., Colombia; Profesor asociado UPTC.
Correspondencia: Efraín Riveros, MD., Tunja, Colombia. Correo electrónico: efrriveros@uniboyaca.edu.co
Fecha de recibido: 4 de mayo de 2012. Fecha de aprobación: 25 de mayo de 2012.
Resumen
Objetivo. Evaluar el efecto protector contra la lesión por isquemia-reperfusión intestinal del pretratamiento con alopurinol en ratas.
Materiales y métodos. Se llevó a cabo un experimento controlado en animales. Un grupo de 10 ratas Wistar de características morfométricas comparables se mantuvo en bioterio bajo condiciones controladas por tres días. A cinco animales se les administró 50 mg/kg diarios de alopurinol por vía oral durante los tres días y, una dosis adicional, antes de inducir isquemia intestinal por ligadura quirúrgica durante 60 minutos seguida de 60 minutos de reperfusión. El otro grupo de cinco ratas no recibió el medicamento. Se hizo el análisis histológico de la mucosa intestinal al final del experimento por medio de la clasificación de Chou y se tomaron hemocultivos de la cavidad cardiaca.
Resultados. Se encontraron hemocultivos positivos en 20 % de los animales pretratados con alopurinol, en comparación con el 100 % de las ratas control (p<0,0001). Se evidenció lesión profunda en la mucosa intestinal en todos los casos. La administración previa a la injuria de alopurinol redujo significativamente la lesión por isquemia-reperfusión (p<0,001).
Conclusiones. La administración de alopurinol antes de la isquemia intestinal, reduce los cambios morfológicos ocasionados por isquemia-reperfusión. El efecto benéfico se demostró con el pretratamiento por tres días.
Palabras clave: alopurinol; isquemia; daño por reperfusión; radicales libres; traslocación bacteriana.
Abstract
Objective: To evaluate the protective effect of pretreatment with allopurinol in an intestinal ischemia-reperfusion injury rat model.
Materials and methods: A controlled animal trial was conducted; 10 Wistar rats were kept under controlled conditions for three days. One group (n=5) received allopurinol 50 mg/kg per day for the 3-day period and an additional dose immediately prior to surgical mesenteric artery clamping (60 minutes) and reperfusion (60 minutes). The other group (n=5) did not receive the medication. Hystologic analysis of intestinal mucosa by means of Chou grading system was performed, and blood cultures from the heart were withdrawn.
Results: Positive blood cultures were found in 20% of the allopurinol group as compared with 100% in the control group (p<0.0001). Deep mucosal lesion was evidence in all cases. Allopurinol pretreatment reduced significantly the ischemia-reperfusion injury (p<0.001).
Conclusions: Allopurinol administration prior to intestinal ischemia ameliorated morphologic changes related to the ischemia-reperfusion process. The beneficial effect of allopurinol was demonstrated with pretreatment for three days.
Key words: allopurinol; ischemia; reperfusion injury; free radicals; bacterial translocation.
Introducción
La respuesta hemodinámica en situaciones de choque, involucra tanto la liberación de catecolaminas como el compromiso de la microcirculación esplácnica1,2. Las consecuencias fisiológicas de este "sacrificio" de la circulación intestinal y hepática son complejas y se relacionan con el reclutamiento de flujo desde el reservorio de su circulación venosa y con la redistribución a órganos prioritarios como el corazón y el cerebro3-5. Sin embargo, el precio que paga el intestino se establece por la lesión ocasionada por isquemia y reperfusión6,7, la cual se ha asociado con el desarrollo de disfunción orgánica múltiple8,9.
La falla orgánica múltiple es la primera causa de mortalidad en las unidades de cuidado intensivo en el mundo entero10 y su asociación con lo que se ha llamado la "hipótesis" intestinal como factor etiológico, hace que la investigación en este campo haya crecido en los últimos años. Los múltiples avances en la comprensión de la fisiopatología de la disfunción orgánica muestra que en fases tempranas ocurre derivación de flujo a la circulación central, acidosis11, aumento de permeabilidad intestinal12-14, alteración de la función de barrera endotelial sistémica mediada por la interacción entre la célula endotelial y los neutrófilos15, activación de neutrófilos9,16,17, disminución de la capacidad de deformarse de los eritrocitos18, falla de la médula ósea19, disfunción pulmonar8 y desarrollo de respuesta inflamatoria sistémica que altera la función inmunitaria y aumenta la liberación de sustancias proinflamatorias y lesivas, entre las que se incluyen los radicales libres de oxígeno9.
En la secuencia de eventos descrita, los neutrófilos activados en el intestino, con o sin translocación bacteriana20,21, juegan un papel fundamental en la cascada proinflamatoria que conduce a falla orgánica múltiple y, eventualmente, a la muerte22,23. Los primeros estudios que correlacionaron la isquemia intestinal con disfunción de órganos distantes se concentraron en la demostración de translocación bacteriana como el agente que conecta los dos eventos24. Sin embargo, los estudios más recientes han documentado que la translocación bacteriana a través de la vena porta no es un hecho constante, de tal manera que la atención se desvió hacia el papel de los ganglios y vasos linfáticos en la traducción de un fenómeno isquémico intestinal en uno inmunoinflamatorio sistémico25.
Teniendo en cuenta estos hechos, consideramos que no está claro el mecanismo por medio del cual la isquemia intestinal conduce a disfunción orgánica distante. Hay dos factores que parecen estar involucrados: la exportación de sustancias proinflamatorias desde el intestino y la translocación bacteriana por vía linfática intestinal o hemática. En cuanto a las sustancias proinflamatorias, se ha descartado el papel de las citocinas26, mientras que se ha postulado que la porción lipídica es la causante del daño endotelial y orgánico, pero no se ha identificado una única sustancia responsable del síndrome. Con respecto a la translocación bacteriana, aún no se ha establecido con certeza su relación con la circulación sistémica de gérmenes26,27.
Los efectos deletéreos de la isquemia/reperfusión en diferentes órganos son mediados en gran medida por radicales libres de oxígeno28,29. En el caso del intestino, la lesión que ocurre como resultado de los procesos de isquemia y reperfusión se ha asociado con daño de la barrera intestinal30 y disfunción orgánica múltiple31-37, y estos efectos se han relacionado con translocación bacteriana38 y circulación sistémica de neutrófilos activados en el intestino39.
Los neutrófilos involucrados en la evolución de la disfunción orgánica múltiple causan lesión por diferentes mecanismos, entre los cuales la liberación de radicales libres de oxígeno es de especial importancia39. Entre las vías metabólicas para la producción de radicales libres de oxígeno, se ha estudiado en profundidad el sistema xantina oxidasa/deshidrogenasa, el cual está involucrado en la producción de hipoxantina y ácido úrico a partir de xantina. Cuando el sistema se expresa en la forma de xantina-oxidasa, se producen radicales superóxido e hidroxilo, y cuando lo hace en la forma de deshidrogenasa, produce peróxido de hidrógeno. Teniendo en cuenta su papel fundamental en la producción de radicales libres de oxígeno por parte de los neutrófilos y células inflamatorias, la inhibición con alopurinol del sistema xantina-oxidasa puede tener efectos benéficos que han sido objeto de múltiples estudios40. Dawiskiba41 describió la disminución de la actividad de xantina-oxidasa en un modelo de ratón después de isquemia-reperfusión intestinal; la formación de una barrera puede estar relacionado con las peculiares anatomo-fisiológicas de los acuerdos de las vellosidades intestinales y puede privar a las células epiteliales de los sustratos importantes durante y después de un período de hipoperfusión42. Peto43 demostró un efecto favorable del alopurinol sobre factores hemoreológicos en perros, mientras que Ping-Guo44 documentó un efecto protector del alopurinol sobre la lesión hepática inducida por isquemia-reperfusión en ratones.
Ante este panorama que indica que la inhibición de xantina oxidasa limita la lesión esplácnica por reperfusión, nuestro estudio pretende estudiar específicamente el efecto sobre los cambios morfológicos de la mucosa intestinal y la translocación bacteriana a través de linfáticos, ligados por la permeabilidad de la barrera, del inhibidor de la xantina-oxidasa, el alopurinol.
Por una parte, se enfocó el experimento en el sistema xantina-oxidasa como factor humoral responsable de la relación entre isquemia intestinal y disfunción orgánica, por medio de su inhibición con alopurinol. Por otra parte, utilizando el mismo sistema xantina-oxidasa, se estudió el efecto local del alopurinol sobre la permeabilidad intestinal27 y la translocación bacteriana a la linfa y, finalmente, a la circulación sistémica.
Materiales y métodosDiseño del estudio
Es un experimento controlado en animales. El protocolo de investigación fue elaborado teniendo en cuenta la normatividad y las recomendaciones sobre el manejo de animales de laboratorio45,46, y recibió aprobación por parte del comité de bioética de la Facultad de Ciencias de la Salud de la Universidad de Boyacá.
Sujetos e intervención
Se estudiaron 10 ratas Wistar machos de siete semanas de vida con características que se muestran en la tabla 1. Los animales se dividieron en dos grupos. Ambos fueron alimentados por tres días ad libitum con agua y concentrado, y se mantuvieron en un ciclo día/noche de 12 horas. El primer grupo fue pretratado con 50 mg/kg diarios de alopurinol por vía oral durante tres días y una hora antes del procedimiento quirúrgico. Ambos grupos se sometieron a laparotomía bajo inducción anestésica por inhalación de éter y mantenimiento con sevoflurano y oxígeno en circuito semiabierto y 5 mg/kg de ketamina intramuscular. Posteriormente, se practicó la laparotomía con disección de arteria mesentérica superior y ligadura reversible con banda de caucho, por un periodo de 60 minutos. El segmento sometido a isquemia fue el íleon terminal. luego se liberó la ligadura y 60 minutos después se resecó el segmento intestinal sometido a isquemia/reperfusión y otro segmento control no isquémico. Se tomó muestra de sangre de la aurícula para el procesamiento de hemocultivos y la pieza anatómica de intestino se envió a análisis histológico al laboratorio de patología. Al terminar el procedimiento, se llevó a cabo eutanasia con cloruro de potasio en dosis letal. Las figuras 1 y 2 muestran imágenes del modelo desarrollado.
Variables de resultado
Se tomaron, como variables primarias, el número de unidades formadoras de colonias en hemocultivos y los cambios histológicos de la mucosa intestinal según la escala de Chiu15. Según el autor, los cinco grados de lesión de menor a mayor gravedad son los siguientes: grado 0, vellosidad mucosa normal; grado 1, desarrollo del espacio subepitelial de Gruenhagen, usualmente en el ápex de la vellosidad, a menudo con congestión capilar; grado 2, extensión del espacio subepitelial con levantamiento moderado de la capa epitelial a partir de la lámina propia; grado 3, levantamiento epitelial masivo a los lados de la vellosidad, con algún desnudamiento apical; grado 4, desnudamiento de la vellosidad con exposición de lámina propia y capilares dilatados (se puede ver aumento de celularidad en la lámina propia), y grado 5, digestión y desintegración de la lámina propia, con hemorragia y ulceración.
Análisis estadístico
Las diferencias estadísticas entre los grupos fueron evaluadas por medio de la prueba no paramétrica de Mann-Whitney.
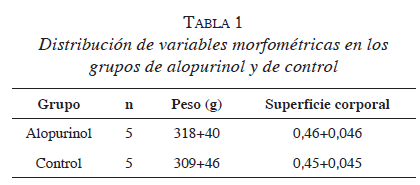
ResultadosNo se encontraron diferencias entre los grupos según las características antropométricas (tabla 1). La superficie corporal se calculó según la fórmula42 SC=k x peso2/3.
Los resultados de los hemocultivos tomados en cada una de las ratas de ambos grupos se muestran en la tabla 2.
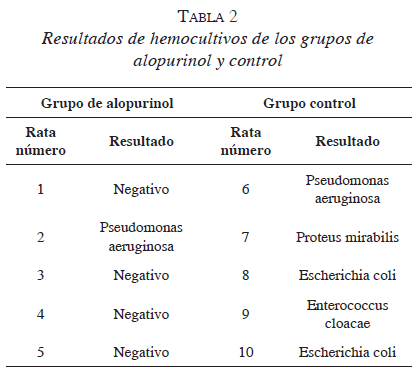
Los hemocultivos fueron positivos en 20 % de los animales pretratados con alopurinol, en comparación con el 100 % de las ratas control. La diferencia fue estadísticamente significativa (p<0,0001).
La tabla 3 muestra los resultados observados en la evaluación microscópica de la mucosa intestinal de acuerdo con la clasificación de Chiu15. Se evidenció un promedio de grado histológico de 2 después del periodo de isquemia y reperfusión para el grupo de alopurinol, en comparación con 3,4 3 y 4 en el grupo control.
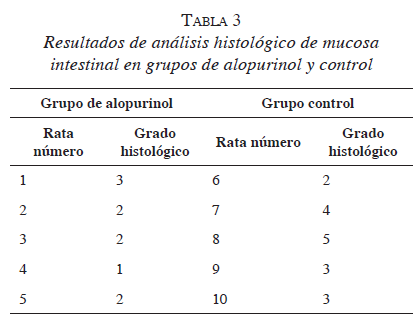
Los resultados revelaron que los periodos de 60 minutos de isquemia y 60 minutos de reperfusión, producen lesión profunda en la mucosa intestinal. La administración previa a la injuria de alopurinol redujo significativamente la lesión por isquemia-reperfusión (p<0,001).
DiscusiónLos procesos de isquemia intestinal relacionados con bajo gasto cardiaco guardan relación con el gasto cardiaco global47 y se entienden a la luz del compromiso de la microcirculación. Hasta hace dos décadas, la reperfusión que seguía a los procesos de isquemia se consideraba simplemente la reversión de la situación de bajo flujo. El trabajo de Parks demostró que el daño morfológico de la mucosa intestinal era peor tras un periodo de tres horas de isquemia y una hora de reperfusión, que después de cuatro horas de isquemia48. Granger y Parks responsabilizaron a los radicales libres de oxígeno como causantes de la injuria por reperfusión. McCord fue el primero en postular la capacidad de la xantina-oxidasa para generar radicales libres de oxígeno 49 y afirmó que el detonante para la producción de radicales libres era dicha enzima. La xantina-oxidasa se deriva de la xantina deshidrogenasa en condiciones de bajo aporte de oxígeno50. Esta teoría es aceptada aún en la actualidad, a pesar de haber sido propuesta hace más de 20 años28,51-54.
El papel de la xantina-oxidasa en el proceso de isquemia-reperfusión sólo puede ser demostrado de manera indirecta, como a través de la observación de un aumento de radicales libres de oxígeno durante la reperfusión intestinal55,56. De otra parte, la administración de enzimas antioxidantes ha logrado limitar la lesión por reperfusión57,58. En numerosos estudios se ha demostrado la capacidad del alopurinol (inhibidor de xantina-oxidasa) para limitar la lesión por isquemia-reperfusión en el intestino y en otros tejidos59-63. Nuestro experimento demostró una gran efectividad en la protección contra el daño morfológico por parte del alopurinol. Esto confirma el papel protagónico que juega la xantina-oxidasa en la lesión por reperfusión intestinal. Nuestros resultados contrastan con los de Nalini, quien encontró que, a pesar de una disminución de la actividad de xantina-oxidasa en 80 % con una dieta rica en tungsteno y libre de molibdeno, no hubo efecto sobre la lesión por isquemia-reperfusión56. De manera interesante, García encontró que cuando un grupo de ratas pretratadas con alopurinol por un día, se compara con otro pretratado por una hora antes de la isquemia, el grado de lesión se limita solamente en el primer caso, y la protección fue atribuible a los niveles intestinales del medicamento y no a la inhibición de la xantina-oxidasa61. A la luz de esos hallazgos, nuestros resultados protectores del alopurinol podrían haber ocurrido por mecanismos aún no dilucidados.
Este estudio tiene alguna limitación en cuanto a su capacidad de generalizar, pues ha demostrado protección del alopurinol sobre la lesión por isquemia-reperfusión cuando se administra antes del inicio de la injuria isquémica. Se puede decir que, en la práctica, salvo en situaciones específicas como la reparación de aneurisma de aorta abdominal, los pacientes reciben atención cuando el daño isquémico se ha instaurado, lo que restaría importancia a nuestros hallazgos. Esta misma preocupación ha sido evidenciada por Horne en un estudio que empleó diferentes estrategias para disminuir el estrés oxidativo64. Sin embargo, Dawiskiba encontró que, cuando se administra alopurinol durante la isquemia intestinal, conserva sus propiedades protectoras65. Esto se puede deber a propiedades del medicamento muy ocasionalmente mencionadas en la literatura científica. Su efecto más importante es la protección de los depósitos celulares de fuentes de energía mediante la inhibición de xantina-oxidorredutasas66,67, lo que se traduce en preservación de la relación aporte-consumo de oxígeno durante la isquemia y, por ende, reducción en la generación de radicales libres de oxígeno durante la reperfusión68.
Por último, este estudio tiene una muestra pequeña de animales, lo que limitaría la validez de los hallazgos. Sin embargo, las diferencias halladas fueron tan contundentes, que es fácil predecir que en una muestra de mayor tamaño, los resultados no cambiarían. Por el diseño del estudio, tampoco se puede evaluar la superviviencia de los animales para cada grupo. A pesar de su simplicidad, nuestro experimento permite sacar conclusiones acerca de los efectos del alopurinol sobre la isquemia y la reperfusión intestinales. Aunque el mecanismo para la protección del alopurinol no se ha esclarecido en su totalidad, su papel protector en modelos animales se ha demostrado. El empleo de alopurinol en isquemia intestinal en humanos debe ser evaluado, especialmente, en casos en que la isquemia se puede anticipar.
En conclusión, la administración de alopurinol antes del daño isquémico intestinal, reduce los cambios morfológicos ocasionados por isquemia-reperfusión. El efecto benéfico se demostró con el pretratamiento durante tres días. Si el efecto protector del fármaco se debe exclusivamente a inhibición de la xantina-oxidasa, sigue siendo motivo de controversia.
Referencias1. Gelman S, Mushlin PS. Catecholamine-induced changes in the splanchnic circulation affecting systemic hemodynamics. Anesthesiology. 2004;100:434-9. [ Links ]
2. Chang PI, Rutlen DL. Effects of beta-adrenergic agonists on splanchnic vascular volume and cardiac output. Am J Physiol. 1991;261:H1499-507. [ Links ]
3. Brooksby GA, Donald DE. Dynamic changes in splanchnic blood flow and blood volume in dogs during activation of sympathetic nerves. Circ Res. 1971;29:227-38. [ Links ]
4. Scott-Douglas NW, Robinson VJ, Smiseth OA, Wright CI, Manyari DE, Smith ER, et al. Effects of acute volume loading and hemorrhage on intestinal vascular capacitance: a mechanism whereby capacitance modulates cardiac output. Can J Cardiol. 2002;18:515-22. [ Links ]
5. Rothe CF. Control of capacitance vessels. In: Shepherd AP, Granger DN, editors. Physiology of the intestinal circulation. New York: Raven; 1984. p. 73. [ Links ]
6. Rochat MC. An introduction to reperfusion injury. Compend Contin Educ Pract Vet. 1991;13:923-30. [ Links ]
7. Kong SE, Blennerhassett LR, Heel KA, McCauley RD, Hall JC. Ischaemia-reperfusion injury to the intestine. Aust NZ J Surg. 1998;68:554-61. [ Links ]
8. Moore FA, Sauaia A, Moore EE. Postinjury multiple organ failure: a bimodal phenomenon. J Trauma. 1996;40:501-12. [ Links ]
9. Deitch EA. Multiple organ failure: Pathophysiology and potential future therapy. Ann Surg. 1992;216:117-34. [ Links ]
10. Deitch EA, Da-Zhong XU, Lu Q. Gut lymph hypothesis of early shock and trauma-induced multiple organ dysfunction syndrome: A new look at gut origin sepsis. J Organ Dysfunct. 2006;2:70-9. [ Links ]
11. Ivatory RR, Simon RJ, Islam S, Fueg A, Rohman M, Stahl WM. A prospective, randomized study of end points of resuscitation after major trauma: Global oxygen transport indices versus organ-specific gastric mucosal pH. J Am Coll. 1996;183:145-54. [ Links ]
12. Deitch EA. Intestinal permeability is increased in burn patients shortly after injury. Surgery. 1990;107:411-6. [ Links ]
13. Rush BF, Sori AJ, Murphy TF, Smith S, Flanagan JJ, Machiedo GW. Endotoxemia and bacteremia during hemorrhagic shock. Ann Surg. 1998;207:549-54. [ Links ]
14. Doig CJ, Sutherland LR, Sandham JD, Fick GH, Verhoef M, Meddings JB. Increased intestinal permeability is associated with the development of multiple organ dysfunction syndrome in critically ill ICU patients. Am J Respir Crit Care Med. 1998;158:444-51. [ Links ]
15. Pober JS, Cotran RS. Cytokines and endothelial cell biology. Physiol Rev 1990;70:427-51. [ Links ]
16. Goodman ER, Kleinstein E, Fusco AM, Quinlan DP, Lavery R, Livingston DH, et al. Role of interleukin 8 in the genesis of acute respiratory distress syndrome through an effect on neutrophil apoptosis. Arch Surg. 1998;133:1234-9. [ Links ]
17. Patrick DA, Moore FA, Moore EE, Barnett CC, Silliman CC. Neutrophil priming and activation in the pathogenesis of postinjury multiple organ failure. New Horiz. 1996;4:194-210. [ Links ]
18. Langenfeld J, Livingston DH, Machiedo GW. Red blood cell deformability is an early indicator of infection. Surgery. 1991;110:398-403. [ Links ]
19. Livingston DH, Gentile P, Malangoni MA. Bone marrow failure after hemorrhagic shock. Circ Shock. 1990;30:255-63. [ Links ]
20. Balzan S, De Almeida C, De Cleva R, Zilberstein B, Cecconello I. Bacterial translocation: Overview of mechanisms and clinical impact. J Gastroenterol Hepatol. 2007;22:464-71. [ Links ]
21. Moore FA, Moore EE, Poggetti R, McAnena OJ, Peterson VM, Abernathy CM, et al. Gut bacterial translocation via the portal vein: A clinical perspective with major torso trauma. J Trauma. 1991;31:629-38. [ Links ]
22. Lewis A, Harkin DW, D'Sa AA, McCallion K, Halliday MJ, Campbel, FC. Primed neutrophils in the venous effluent convert local to systemic inflammation after limb ischaemia-reperfusion injury. Br J Surg. 2001;88(Supp.1):3. [ Links ]
23. Ramaiah SK, Jaeschke H. Role of neutrophils in the pathogenesis of acute inflammatory liver injury. Toxicol Pathol. 2007;35:757-66. [ Links ]
24. Moore FA, Moore EE, Poggetti R, McAnena OJ, Peterson VM, Abernathy CM, et al. Gut bacterial translocation via the portal vein: A clinical perspective with major torso trauma. J Trauma. 1991;31:629-38. [ Links ]
25. Magnotti LJ, Upperman JS, Xu DZ, Lu Q, Deitch EA. Gut derived mesenteric lymph but not portal blood increases endothelial cell permeability and potentiates lung injury following hemorrhagic shock. Ann Surg. 1998;228:518-27. [ Links ]
26. Davidson MT, Deitch EA, Lu Q, Osband A, Feketeova E, Nemeth ZH, et al. A study of the biologic activity of traumahemorrhagic shock mesenteric lymph over time and the relative role of cytokines. Surgery. 2004;136:32-41. [ Links ]
27. Nastos C, Kalimeris K, Papoutsidakis N, Defterevos G, Pafiti A, Kalogeropoulou H, et al. Antioxidant treatment attenuates intestinal mucosal damage and gut barrier dysfunction after major hepatectomy. Study in a porcine model. J Gastrointest Surg. 2011;15:809-17. [ Links ]
28. Schoenberg MH, Beger HG. Reperfusion injury after intestinal ischemia. Crit Care Med. 1993;21:1376-87. [ Links ]
29. Peters-Scholte C, Braun K, Koster J, Kops N. Effects of allopurinol and deferoxamine on reperfusion injury of the brain in newborn piglets after neonatal ihipoxia-ischemia. Pediatr Res. 2003;54:516-22. [ Links ]
30. Yang H, Sheng Z, Guo Z, Shi Z, Lu J, Chai J, et al. Oxygen free radical injury and its relation to bacterial and endotoxin translocation after delayed fluid resuscitation: clinical and experimental study. Chin Med J (Engl). 1997;110:118-24. [ Links ]
31. Tandon P, García-Tsao G. Bacterial infections and multiorgan failure in cirrosis. Semin Liver Dis. 2008;28:26-42. [ Links ]
32. Taylor DE. Reviving the motor of multiple organ dysfunction síndrome: Gut dysfunction in ARDS and multiorgan failure. Respir Care Clin North Am. 1998;4:611-31. [ Links ]
33. Moore FA. The role of the gastrointestinal tract in post-injury multiple organ failure. Am J Surg. 1999;178:449-53. [ Links ]
34. Hassoun HT, Kone BC, Mercer DW, Moody FG, Weisbrodt NW, Moore FA. Post-injury multiple organ failure: the role of the gut. Shock. 2001;15:1-10. [ Links ]
35. Pastores SM, Katz DP, Kvetan V. Splachnic ischemia and gut mucosal injury in sepsis and the multiple organ dysfunction síndrome. Am J Gastroenterol. 1996;91:1697-710. [ Links ]
36. Nieuwenhuijzen GA, Goris RJ. The gut: The motor of multiple organ dysfunction syndrome? Curr Opin Nutr Metab Care. 1999;2:399-404. [ Links ]
37. Taylor DE, Piantadosi CA. Oxidative metabolism in sepsis and sepsis síndrome. J Crit Care. 1995;10:122-35. [ Links ]
38. Fares PL, Simon RJ, Martella AT. Intestinal permeability correlates with severity of injury in trauma patients. J Trauma. 1998;44:1031-6. [ Links ]
39. Koike K, Moore EE, Moore FA. Gut ischemia/reperfusion produces lung injury independent of endotoxin. Crit Care Med. 1994;22:1438-44. [ Links ]
40. Cem T, Ayhan K, Kessaf A. Prevention of deleterious effects of reperfusion injuryusing one week high dose allopurinol. Dig Dis Sci. 2001;40:430-7. [ Links ]
41. Dawiskiba T, Pupka A, Skora J, Janczak D, Pawtowski S, Krawczyk Z et al. The effect of allopurinol on intestinal ischemia-reperfusion injury development - the new approach. Chirurgia Polska. 2007;9:25-33. [ Links ]
42. Chiu CJ, McArdle AH, Brown R, Scott HJ, Gurd FN. Intestinal mucosal lesions in low-flow states. A morphological, hemodynamic and metabolic reappraisal. Arch Surg. 1970;101:478-83. [ Links ]
43. Peto K, Nemeth N, Brath E, Takacs IE, Baskurt OK, Meiselman HJ, et al. The effects of renal ischemia-reperfusion on hemorheological factors: Preventive role of allopurinol. Clin Hemorheol Microcirc. 2007;37:347-58. [ Links ]
44. Ping-Guo Liu, Song-Qing He, Yan-Hong Z, Jian Wu. Protective effects of apocynin and allopurinol on ischemia/reperfusion-induced liver injury in mice. World J Gastroenterol. 2008;14:2832-7. [ Links ]
45. Guide for the care and use of laboratory animals. NIH. Washington, D.C.: National Academy Press; 1996. p. 11-40. [ Links ]
46. Mrad A. Ética en la investigación con modelos animales experimentales. Alternativas y las 3 R's de Russell. Una responsabilidad y un compromiso ético que nos compete a todos. Rev Colomb Bioética. 2006;1:163-83. [ Links ]
47. Guyton AC, Jones CE, Coleman TG. Normal cardiac output and its variation. In: Guyton AC, Joes CE, Coleman TG, editors. Cardiac output and its regulation. Second edition. Philadelphia: WB Saunders Company; 1973. p. 3-29. [ Links ]
48. Parks DA, Granger DN. Contributions of ischemia and reperfusion to mucosal lesion. Am J Physiol. 1986;250:G749-53. [ Links ]
49. McCord JM, Fridovich I. The reduction of cytochrome c by milk xanthine oxidase. J Biol Chem. 1968;243:5753-60. [ Links ]
50. McCord JM, Roy RS. The pathophysiology of superoxide: Roles in inflammation and ischemia. Can J Physiol Pharmacol. 1982;60:1346-52. [ Links ]
51. Parks DA, Bulkley GB, Granger DN, Hamilton SR, McCord JM. Ischemic injury in the cat small intestine: Role of superoxide radicals. Gastroenterology. 1982;82:9-15. [ Links ]
52. Granger DN, McCord JM, Parks DA, Hollwarth ME. Xanthine oxidase inhibitors attenuate ischemia-induced vascular permeability changes in the cat intestine. Gastroenterology. 1986;90:80-4. [ Links ]
53. Meneshian A, Bulkley GB. The physiology of endothelial xanthine oxidase: From urate catabolism to reperfusion injury to inflammatory signal ransduction. Microcirculation. 2002;9:161-75. [ Links ]
54. Parks DA, Williams TK, Beckman JS. Conversion of xanthine dehydrogenase to oxidase in ischemic rat intestine: a reevaluation. Am J Physiol. 1988;254:768-74. [ Links ]
55. Fan H, Sun B, Gu Q, Lafond-Walker A, Cao S, Becker LC. Oxygen radicals trigger activation of NF-kappaB and AP-1 and upregulation of ICAM-I in reperfused canine heart. Am J Physiol. 2002;282:H1778-86. [ Links ]
56. Nalini S, Mathan MM, Balasubramanian KA. Oxygen free radical induced damage during intestinal ischemia/reperfusion in normal and xanthine oxidase deficient rats. Mol Cell Biochem. 1993;124:59-66. [ Links ]
57. Parks DA, Bulkley GB, Granger DN, Hamilton SR, McCord JM. Ischemic injury in the cat small intestine: Role of superoxide radicals. Gastroenterology. 1982;82:9-15. [ Links ]
58. Kacmaz M, Ozturk HS, Karaayvaz M, Guven C, Durak I. Enzymatic antioxidant defence mechanism in rat intestinal tissue is changed after ischemia-reperfusion. Effects of allopurinol plus antioxidant combination. Can J Surg. 1999;42:427-31. [ Links ]
59. Akgur F, Olguner M, Yenici O, Gokden M, Aktung T, Yilmaz M, et al. The effect of allopurinol pretreatment on intestinal hypoperfusion encountered after correlation of intestinal volvulus. J Pediatr Surg. 1996;31:1205-7. [ Links ]
60. llhan H, Alatas O, Tokar B, Olak O, Pasaoglu O, Koku N. Effects ofthe anti-ICAM-1 monoclonal antibody, allopurinol, and methylene blue on intestinal reperfusion injury. J Pediatr Surg. 2003;38 1591-5. [ Links ]
61. García JG, Rollan CM, Enríquez R, Madruga MH, Mariño-Hernández E, Macías-Núñez JF, et al. Improved survival in intestinal ischemia by allopurinol not related to xanthine-oxidase inhibition. J Surg Res. 1990;48:144-6. [ Links ]
62. Kacmaz M, Ozturk HS, Karaayvaz M, Guven C, Durak I. Enzymatic antioxidant defense mechanism in rat intestinal tissue is changed after ischemia-reperfusion. Effects of allopurinol plus antioxidant combination. Can J Surg. 1999;42:427-31. [ Links ]
63. Megison SM, Horton JW, Chao H, Walker PB. Prolonged survival and decreased mucosal injury after low-dose enteral allopurinol prophylaxis in mesenteric ischemia. J Pediart Surg. 1990;25:917-21. [ Links ]
64. Horne MM, Pascoe PJ, Ducharme NG, Barker IK, Grovum WL. Attempts to modify reperfusion injury of equine jejunal mucosa using dimethylsulfoxide, allopurinol and intraluminal oxygen. Vet Surg. 1994;23:241-9. [ Links ]
65. Dawiskiba T, Pupka A, Skora J, Janczak D, Pawtowski S, Krawczyk Z, et al. The effect of allopurinol on intestinal ischemia-reperfusion injury development - the new approach. Chirurgia Polska. 2007;9:25-33. [ Links ]
66. Godin DV, Bhimji S. Effects of allopurinol on myocardial ischemic injury induced by coronary artery ligation and reperfusion. Biochem Pharmacol. 1987;36:2101-7. [ Links ]
67. Peterson DA, Kelly B, Gerrard JM. Allopurinol can act as an electron transfer agent. Is this relevant during reperfusion injury? Biochem Biophys Res Commun. 1986;137:76-9. [ Links ]
68. van den Hoek TL, Li C, Shao Z, Schumacker PT, Becker LB. Significant levels of oxidants are generated by isolated cardiomyocytes during ischemia prior to reperfusion. J Mol Cell Cardiol. 1997;29:2571-83. [ Links ]














