Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582
rev. colomb. cir. vol.28 no.2 Bogotá Apr./June 2013
1 Médico, cirujano de Seno y Tejidos Blandos, Bogotá, D.C., Colombia.
2 Médicos generales, Universidad de La Sabana, Chía, Colombia.
Correspondencia: Juan Camilo Duque, MD. Correo electrónico: juanduque11@hotmail.com
Fecha de recibido: 28 de agosto de 2012. Fecha de aprobación: 2 de abril de 2013.
Introducción. La incidencia de enfermedades neoplásicas de seno se ha incrementado en los últimos años; por tal razón, existe un acentuado aumento de casos de neoplasias que anteriormente eran de baja frecuencia o inclusive inexistentes. Con la notable mejoría y mayor disposición de técnicas de tamización, de estudios de anatomía patológica y de mejor acceso a la atención clínica oportuna y adecuada, hemos sido testigos del aumento en el diagnóstico de tumores de células granulares, o tumor de Abrikossoff, que se refleja en los reportes disponibles en la literatura científica que sirven para aclarar y obtener una mejor perspectiva en cuanto a su diagnóstico, estudio y manejo.
Materiales y métodos. Se hizo una búsqueda sistemática de la literatura científica disponible en la base de datos de Pubmed, sin limitaciones de año de publicación, idioma, sexo, especialidad médica o características del tipo de reporte, comparando los diferentes resultados tanto de técnicas diagnósticas como de tratamientos y seguimiento aplicados.
Discusión. Existen múltiples reportes de casos clínicos de tumores de células granulares, aunque hay, hoy en día, algunas discrepancias sobre el tratamiento de estas neoplasias, especialmente cuando se encuentran localizados en la mama, ya que por sus características de comportamiento benigno pueden ser menospreciados y resultar en futuras complicaciones propias de la historia natural de este tipo de trastornos. Por tal razón, se deben enfatizar los nuevos enfoques diagnósticos y en los tratamientos contundentes para disminuir la morbimortalidad de los pacientes, y buscar estandarizar su origen y los criterios clínicos y de laboratorio para su diagnóstico.
Palabras clave: neoplasias de la mama; tumor de células granulares; tumor de Abrikossoff; mastectomía segmentaria.
Introduction: There is an increasing incidence of neoplastic diseases of the breast being recorded in recent years, with the consequent increase in the number of cases of neoplastic lesions that previously had been infrequent or nonexistent. With the marked improvement and availability of screening techniques, more sophisticated pathological studies, and better access to opportune and adequate medical treatment, we are witnessing an increase in the number of cases of the granular cell tumors of the breast, or Abrikossoff´s tumors.
Materials and methods. A systematic search of the literature available in PubMed was conducted, without limitations on the year of publication, language, gender, medical specialty or type of report, comparing the results from diagnostic techniques, management, and follow-up.
Discussion. There are multiple clinical reports of cases of granular cell tumors, but currently there are discrepancies regarding their treatment, especially when they are located in the breast, and that because of their benign clinical behavior they can be underestimated with the consequent complications proper of the natural history of these tumors. For this reason the newer diagnostic techniques and treatment modalities should be emphasized so as to diminish morbidity and mortality in these patients, and seek to standardize their origin and the clinical and laboratory criteria for their diagnosis.
Key words: breast neoplasms; granular cell tumor; abrikossoff's tumor; mastectomy, segmental.
El tumor de células granulares fue descrito por primera vez por Abrikossoff en 1926, quien se refirió a la lesión como mioblastoma, asumiendo que su origen estaba en el tejido muscular por sus características macroscópicas y microscópicas1,2. Posteriormente, en 1962, después de la implementación de los estudios de inmunohistoquímica de Fisher y Wechsler, se planteó su origen a partir de las células de Shwann y se reconoció como un tumor de células granulares; sin embargo, algunos autores continúan debatiendo su origen2,3.
El miofibroblastoma, o tumor de células granulares, es un tumor muy infrecuente que afecta las membranas mucosas del tubo aero-digestivo superior, especialmente el tejido muscular de la lengua 2. Según los reportes consultados, tiene una incidencia de 6 % entre los tumores y por sus características puede imitar clínica y radiológicamente un carcinoma, especialmente cuando se localiza en el tejido mamario.
Este tipo de neoplasia ha presentado un incremento de su incidencia en los últimos años; sin embargo, en nuestro medio no contamos con datos estadísticos de su presentación y no se ha esclarecido si el incremento en la frecuencia de esta neoplasia se debe a las novedosas técnicas de inmunohistoquímica con las que contamos actualmente, que nos permiten obtener un diagnóstico acertado y específico y, por ende, aumentan el número de casos, o si se trata propiamente de un aumento en su presentación.
Se hace una revisión descriptiva y actualizada de la literatura científica y se presentan los hallazgos clínicos, imaginológicos y patológicos de un miofibroblastoma de la mama, para ilustrar su presentación y manejo.
Se hizo una búsqueda sistemática de la literatura científica disponible en la base de datos de Pubmed, sin limitaciones de año de publicación, sexo, especialidad médica o características del tipo de reporte.
A pesar de su fortuita presentación, existen en la literatura científica inglesa más de 100 reportes de casos desde la primera publicación de Ravich, et al.1.
Los tumores de células granulares son neoplasias relativamente infrecuentes que se originan principalmente en los tejidos blandos; se calcula una prevalencia entre 0,0019 y 0,03 % para este tipo de tumores en relación con otras neoplasias. Están frecuentemente localizados en la cabeza y en el cuello, pero en su inmensa mayoría su localización es intraoral, afectando principalmente el tejido muscular de la lengua hasta en 40 % de los casos4,5. Existen en la literatura científica reportes en los cuales la piel y el tejido celular subcutáneo se encuentran afectados, siendo estos el segundo lugar en frecuencia con hasta el 30 % de todos los casos2,6. A pesar de su mayor incidencia en tejidos específicos, su presentación en la mama es bastante infrecuente y en algunas series se ha calculado en 6 %, aproximadamente, pero su presentación puede alcanzar el 15 %4,7,8,9.
En cuanto a su presentación, este tipo de neoplasias prevalece en su variante benigna, la cual ha sido establecida por la presencia de células poligonales con un citoplasma de características o contenido eosinofílico y un núcleo particularmente pequeño2,10,11. Sin embargo, como en la inmensa mayoría de neoplasias, existe una variante de características malignas que ha sido descrita hasta en 2 % de los pacientes1,12. Esta variante se caracteriza, principalmente, por el hallazgo de índices de mitosis en alto grado, al igual que por la presencia de un gran polimorfismo celular.
Específicamente, esta lesión se observa con una frecuencia relativamente baja en el tejido mamario y, como se describió anteriormente, presenta una relación con el carcinoma mamario de 1 en 1.000 pacientes4,13. Su presentación puede ser como nódulos solitarios o múltiples; la primera presentación es más frecuente y, generalmente, su característica es que presentan un tamaño menor de 3 cm. Su localización en el tejido mamario es más frecuente en el cuadrante supero-interno, en comparación con los carcinomas mamarios, cuya localización es más frecuente en el cuadrante supero-externo. No se ha descrito asociación con otros tipos de neoplasias malignas de la mama13; sin embargo, se ha reportado en algunos casos como un hallazgo incidental en el estudio anatomo-patológico de lesiones de pacientes sometidos a mastectomías por la presencia de carcinoma mamario; asimismo, se ha descrito en casos en los que previamente había sido extirpado un tumor de células ganglionares y, años más tarde, se había presentado un carcinoma maligno de mama 4.
Su presentación tiene una mayor incidencia en mujeres, especialmente en etapa premenopaúsica con una relación de 1,8 a 2,4 a 1, respectivamente, al igual que se ha evidenciado que se presenta con mayor predilección en pacientes de raza negra2,3,14. Se ha publicado que cuando se practica tamización para neoplasias de la mama, la prevalencia de tumores granulares es de 1 en 617 en pacientes con neoplasias malignas de la mama y de 6,7 en 1.000 pacientes con cáncer de mama. En cuanto al sexo masculino, se describe una prevalencia de tumores de células ganglionares hasta de 6,6 %12. La edad de presentación es variable, pero su incidencia es mayor entre la segunda y la sexta décadas de la vida, con un incremento entre los 40 y los 60 años; sin embargo, existen reportes de casos durante la niñez2,3,8,15.
A pesar de ser generalmente de comportamiento benigno y de tener bajo riesgo de recurrencia a largo plazo, estas neoplasias pueden desarrollar características de crecimiento infiltrativo vistas tanto clínica como imaginológicamente mediante estudios mamográficos en los que puede simular patrones típicos de carcinomas infiltrantes, razón por la cual se toman biopsias, generalmente con aguja de corte, para su estudio microscópico4,8,16,17,18.
Esta neoplasia tiene un índice descrito de recurrencia de 20 %, aunque en algunos casos puede alcanzar el 32 % cuando al extirparlos presentan bordes positivos. Asimismo, en los pacientes en quienes se confirma el carácter maligno de la neoplasia, la incidencia de metástasis es de 50 % y el pulmón es el órgano comprometido con mayor frecuencia12.
Los hallazgos histológicos típicos de estas neoplasias son grupos de células no encapsuladas, de forma poligonal y bordes definidos. En el citoplasma se observa un granulado eosinofílico característico y alteraciones morfológicas del nucléolo.
Se han establecido unos criterios diagnósticos de tipo histológico para predecir el comportamiento de estas neoplasias. Estos criterios diagnósticos fueron establecidos por Fanburg-Smith, et al., quienes los describieron como se presenta enseguida1,19,20.
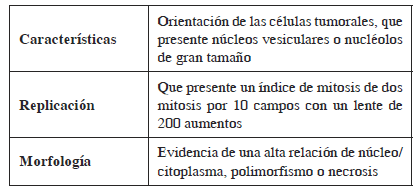
Características Orientación de las células tumorales, que presente núcleos vesiculares o nucléolos de gran tamaño
Replicación Que presente un índice de mitosis de dos mitosis por 10 campos con un lente de 200 aumentos
Morfología Evidencia de una alta relación de núcleo/citoplasma, polimorfismo o necrosis
Según lo establecido con estos criterios, las neoplasias que cumplen tres o más criterios se clasifican como altamente sugestivas de neoplasia maligna, aquellas que cumplan de uno a dos criterios se clasifican como una neoplasia atípica y, finalmente, se pueden clasificar como benignas las que presenten como único hallazgo el polimorfismo celular.
Aunque la histogénesis es todavía objeto de debate entre los autores, los últimos estudios de inmunohistoquímica y los consecuentes hallazgos de ultraestructura, apoyan la teoría del origen de esta neoplasia a partir del tejido nervioso periférico, específicamente a partir de las células nerviosas de Schwann3,8,19.
Este tipo específico de neoplasia presenta, además de las características estructurales, algunas propiedades histoquímicas únicas que lo diferencian de las neoplasias malignas; entre ellas se encuentra, principalmente, la reacción a la proteína S100, la cual debe estar presente para la confirmación del diagnóstico; asimismo, existe una relación con la expresión de proteínas específicas de mielina y de enolasa9.
A pesar de que la expresión de la proteína S100 hace parte fundamental del diagnóstico, en algunos casos ha sido descrita como negativa, pero su valor diagnóstico positivo toma importancia en el estudio anatomo-patológico de las neoplasias cuando se detecta hiperplasia pseudoepitelial, la cual puede simular un carcinoma de células escamosas de mama, lo que altera notoriamente el diagnóstico3,14,21,22,23.
En cuanto al diagnóstico inmunohistoquímico, se reporta en la literatura científica que este tipo de neoplasias presenta una inmunorreacción de los anticuerpos dirigidos contra el marcador de macrófagos CD68 (PK-1), el cual se usa tradicionalmente para la detección de células mieloides e histiocitos derivados de neoplasias; también, se ha observado ampliamente en el diagnóstico de tumores de células granulares, mientras que es negativo en neurofibromas, ganglioneuromas, gangliofibroblastomas y tumores carcinoides16,21.
La vimentina, por su parte, también se considera un marcador de inmunohistoquímica característico de estas neoplasias, sobre todo en las de comportamiento maligno en las que se encuentra positivo hasta en el 100 % de los casos. Aunque en las neoplasias de células ganglionares de mama no se ha reportado la presencia del marcador Ki67, se considera de gran importancia para el establecimiento de los criterios diagnósticos y su posible comportamiento16,23,24, 25.
El anticuerpo Ki67 se ha sido descrito como un marcador presente en la síntesis temprana de ARN y en el proceso de división celular. Su presencia en neoplasias malignas de mama y en el miofibroblastoma es importante, ya que confirma un estado activo en la replicación celular el cual se debe evaluar con el tamaño de la masa y presencia de nuevos vasos sanguíneos y, finalmente, da valor pronóstico para posibles casos de metástasis aunque en algunos metaanálisis no ha sido contundente16,21,26.
Se presenta el caso de una paciente de 48 años de edad, de sexo femenino, de raza blanca, con antecedentes quirúrgicos de dos tiroidectomías subtotales, colecistectomía, histerectomía y varicosafenectomía, y antecedente médico de hipotiroidismo tratado con levotiroxina (50 µg al día). Como antecedentes ginecológicos, presentó menarquia a los 12 años, G2P1A1, el último periodo menstrual lo tuvo cinco años atrás, antes de la histerectomía.
Había antecedentes familiares positivos para cáncer de seno (hermana y tres primas hermanas de la familia materna), negativos para BCRA 1-2 (mutaciones de Colombia), cáncer de riñón (padre) y cáncer de ovario (abuela paterna).
Asistió a consulta de seno con reporte de mamografía BIRADS-0, por imagen seudonodular de 2 cm en el cuadrante supero-externo de la mama derecha. Se practicó ecografía complementaria, la cual evidenciaba un foco de tejido mamario rodeado por tejido de características grasas. El examen clínico de la mama fue normal, sin masas palpables.
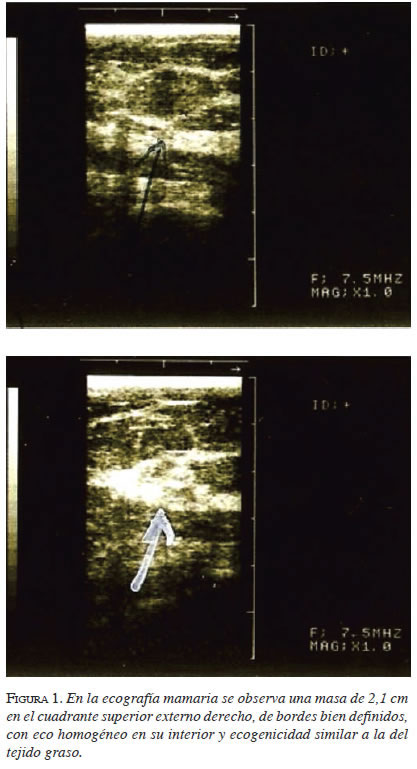
En el nuevo control de mamografía a los seis meses, se encontró una zona nodular de contornos circunscritos de 20 mm de diámetro en el cuadrante supero-externo de la mama derecha, que ha permanecido sin cambios de densidad, morfología o tamaño respecto a los estudios previos, múltiples calcificaciones mamarias puntiformes bilaterales, macrocalcificaciones de tipo necrosis grasa, bilaterales, sin lesiones estelares ni retracciones (BIRADS-2). En el estudio por ultrasonido se observó una masa de 2,1 cm en el cuadrante supero-externo derecho, de bordes bien definidos, con eco homogéneo en su interior y ecogenicidad similar a la del tejido graso (figura 1).
Debido a la persistencia de la masa, seis meses después se solicitó tomar una biopsia con aguja de corte. Por los hallazgos patológicos ("[...] tejido mamario con una lesión formada por fascículos cortos y de intersección de células fusiformes y epitelioides, con citoplasma claro, núcleos uniformes y sin actividad mitótica. Las células fueron positivas para CD34, desmina, actina, EMA, receptores de estrógeno y receptores de progesterona positivos. Ki67 es muy baja y no había actividad para citoqueratina AE1/AE3 [...]") se procedió a la resección de la masa, obteniéndose como informe de patología un miofibroblastoma (tumor de Abrikossoff) (figura 2).
Tratamiento
Por su carácter mayormente benigno, el tratamiento de elección de este tipo de neoplasias es la escisión completa de la masa sin la necesidad de tratamientos complementarios. En cuanto a los tumores atípicos, limítrofes o malignos, requieren después de la cirugía un seguimiento clínico e imaginológico estricto por el mayor riesgo de recurrencia y de metástasis2,11,17,20,21,23.
La escisión debe abordar toda la masa y extenderse ampliamente hasta obtener márgenes negativos12, siendo más agresivos en el manejo quirúrgico cuando la mejor opción es un procedimiento con la menor invasión posible, en los casos de cirugía oncológica. Akahan, et al.27, refieren en su trabajo que en cuatro de cada cinco casos la neoplasia se ha extendido a los ganglios linfáticos axilares, razón por la cual recomiendan que se practique un vaciamiento ganglionar axilar simultáneo con la extirpación del tumor1,3,22,28.
De igual manera, los tumores cuyo reporte histopatológico de la biopsia muestre niveles altos de reacción mayores del 10 % del anticuerpo Ki67, deben someterse a vaciamiento ganglionar, ya que este procedimiento ha demostrado notable mejoría en cuanto a la probabilidad de desarrollar metástasis1,18,21,26,29. A pesar de que se ha descrito la importancia del vaciamiento ganglionar axilar, existe controversia respecto a este punto ya que en el 2010, Giuliano, et al., presentaron, en el congreso de la American Society of Clinical Oncology que se llevó a cabo en Chicago, su trabajo en el cual reportaban que cuando el ganglio centinela es positivo, el hacer o no hacer el vaciamiento ganglionar completo no modifica la supervivencia del paciente30. Por tal razón, se ha abierto un espectro magnífico que nos motiva a mirar más detenidamente y a continuar en la búsqueda ininterrumpida de la mejor opción de tratamiento para nuestros pacientes.
El tumor de células ganglionares, o tumor de Abrikossoff, ha venido cobrando mayor importancia en nuestro medio, ya que se cuenta con más y mejores técnicas de diagnóstico, como en imaginología; además, hay un gran avance en la comprensión de los marcadores de histoquímica, que nos brinda las herramientas suficientes para abordar a los pacientes de una manera apropiada.
Vale la pena enfatizar que, a pesar de que en la literatura científica existen muy pocos reportes de este tipo de neoplasias, sí se presenta un acentuado incremento de su aparición en tejidos que anteriormente tenían incidencia baja o prácticamente nula. En el caso del tejido mamario propiamente dicho, se empieza a observar una tendencia al aumento de su compromiso, pero no se ha podido esclarecer si este fenómeno se debe a un incremento en su incidencia, que se acompaña de un mayor número de pacientes con enfermedades mamarias premalignas, a una mayor incidencia de las neoplasias malignas de la mama, o a que las herramientas diagnósticas disponibles y un más fácil acceso al especialista han permitido aumentar su diagnóstico.
Todo esto nos abre las puertas para continuar ampliando este campo de investigación y poder esclarecer su incidencia en nuestra población, al igual que continuar aportando al estudio de la historia natural de la neoplasia y de los beneficios o dificultades de las diferentes modalidades de tratamiento quirúrgico ya descritas.
1. Akahane K, Kato K, Ogiso S, Sakaguchi K, Hashimoto M, Ishikawa A, et al. Malignant granular cell tumor of the breast: Case report and literature review. Breast Cancer. 2012. Fecha de consulta: 26 de agosto de 2012. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/22467405 [ Links ]
2. Becelli R, Perugini M, Gasparini G, Cassoni A, Fabiani F. Abrikossoff's tumor. J Craniofac Surg. 2001;12:78-81. [ Links ]
3. Godoy G, Mufarrij PW, Tsou HC, Torres P, Taneja SS. Granular cell tumor of scrotum: A rare tumor of the male. Urology. 2008;72:716e7-9. [ Links ]
4. Al-Ahmadie H, Hasselgren PO, Yassin R, Mutema G. Colocalized granular cell tumor and infiltrating ductal carcinoma of the breast. Arch Pathol Lab Med. 2002;126:731-3. [ Links ]
5. De Rezende L, Lucendo AJ, Álvarez-Argüelles H. Granular cell tumors of the esophagus: Report of five cases and review of diagnostic and therapeutic techniques. Dis Esophagus. 2007;20:436-43. [ Links ]
6. Ramos A, Alcalá D, Arias A. Tumor de células granulosas: comunicación de un caso. Dermatología Rev Mex. 2009;53:31-3. [ Links ]
7. Quiroz-Rodríguez G, Robles-Vidal C, Guzmán-Navarro L, Ortiz-Hidalgo C. Granular cell (Abrikossoff) tumor of the breast. Breast J. 2006;12:494. [ Links ]
8. Aoyama K, Kamio T, Hirano A, Seshimo A, Kameoka S. Granular cell tumors: A report of six cases. World J Surg Oncol. 2012;10:204. [ Links ]
9. Brown AC, Audisio RA, Regitnig P. Granular cell tumour of the breast. Surg Oncol. 2011;20:97-105. [ Links ]
10. Magro G, Dipartimento GF. Epithelioid-cell myofibroblastoma of the breast: Expanding the morphologic spectrum. Am J Surg Pathol. 2009;33:1085-92. [ Links ]
11. Sharma A, Sen AK, Chaturvedi NK, Yadav R. Myofibroblastoma of male breast: A case report. Indian J Pathol Microbiol. 2007;50:326-8. [ Links ]
12. Taglietti L, Vettoretto N, Blanzuoli L, Giovanetti M. Granular cell tumor of the male breast. Updates Surg. 2011;63:139-42. [ Links ]
13. SennurlI l, Üstündag N, Calay Z, Bükey Y. Benign granular-cell tumour of the breast. Can J Surg. 2005;48:155-6. [ Links ]
14. C. Leo S, Briest A, Schütz S, Leinung H, Pilch LC. Horn Granular cell tumor of the breast mimicking breast cancer. Eur J Obstet Gynecol Reprod Biol. 2006;127:268-70. [ Links ]
15. El Achkar M, Giraldi S, Marinoni L, Abagge K, Neto J, Werner B. Tumor de células granulares: caso en la niñez. Dermatol Pediatr Lat. 2005;3:230-3. [ Links ]
16. Wargotz ES, Weiss SW, Norris HJ. Myofibroblastoma of the breast. Sixteen cases of a distinctive benign mesenchymal tumor. Am J Surg Pathol. 1987;11:493-502. [ Links ]
17. Curtis BV, Calcaterra TC, CoulsonWF. Multiple granular cell tumor: A case report and review of the literature. Head Neck. 1997;19:634-7. [ Links ]
18. Papalas J, Wylie J, Dash R. Recurrence risk and margin status in granular cell tumors of the breast. A clinico-pathologic study of 13 patients. Arch Pathol Lab Med. 2011;135:890-5. [ Links ]
19. Magro G, Bisceglia M, Michal M, Eusebi V. Spindle cell lipoma-like tumor, solitary fibrous tumor and myofibroblastoma of the breast: A clinico-pathological analysis of 13 cases in favor of a unifying histogenetic concept. Virchows Arch. 2002;440:249-60. [ Links ]
20. Subramaniam S, Nagpal K, Niazi M, Gumbs M. Granular cell tumor. Am Surg. 2011;77:E76-7. [ Links ]
21. Le BH, Boyer PJ, Lewis JE, Kapadia SB. Immunohistochemical assessment of inhibin-a, protein gene product 9.5, S100 protein, CD68, and Ki-67 proliferative index with clinical correlation. Arch Pathol Lab Med. 2004;128:771-5. [ Links ]
22. Bauerfeind I, Ditsch N, Sittek H, Diebold J. Reduction mammaplasty in granular cell tumour of the breast. Br J Plast Surg. 2004;57:458-4. [ Links ]
23. Magro G. Epithelioid-cell myofibroblastoma of the breast. Expanding the morphologic spectrum. Am J Surg Pathol. 2009;33:1085-92. [ Links ]
24. Meguerditchian AN, Malik DA, Hicks DG, Kulkarni S. Solitary fibrous tumor of the breast and mammary myofibroblastoma: The same lesion? Breast J. 2008;14:287-92. [ Links ]
25. Damiani S, Miettinen M, Peterse JL, Eusebi V. Solitary fibrous tumour (myofibroblastoma) of the breast. Virchows Arch. 1994;425:89-92. [ Links ]
26. Chen J, Wang L, Xu J, Pan T, Shen J, Hu W, Yuan X. Malignant granular cell tumor with breast metastasis: A case report and review of the literature. Oncol Lett. 2012;4:63-6. [ Links ]
27. Rubiano J. El cáncer y el cirujano hoy. Rev Colomb Cir. 2010;25:254-6. [ Links ]
28. Restrepo C, Estrada J, Mesa G, Arango A, D'Amato M, Escobar A, et al. Experiencia de la técnica del ganglio centinela en la cirugía del cáncer de mama, Medellín, Colombia, 2009. Rev Colomb Cir. 2011;26:25-32. [ Links ]
29. Dedic-Plavetic N, Jakic-Razumovic J, Kulic A, Vrbanec D. Prognostic value of proliferation markers expression in breast cancer. Med Oncol. 2013;30:523-35. [ Links ]
30. Giuliano AE, Hunt KK, Ballman KV, Beitsch PD, Whitworth PW, Blumencranz PW, et al. Axillary dissection Vs. no axillary dissection in women with invasive breast cancer and sentinel node metastasis: A randomized clinical trial. JAMA. 2011;305:569-75. [ Links ]













