Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582
rev. colomb. cir. vol.28 no.3 Bogotá July/Sept. 2013
1 Médico, especialista en Cirugía del Tórax; profesor asociado, Facultad de Medicina, Universidad de Cartagena, Cartagena, Colombia.
2 Médico, residente de III nivel de Cirugía General, Facultad de Medicina, Universidad de Cartagena, Cartagena, Colombia.
3 Estudiante de Medicina, Facultad de Medicina, Universidad de Cartagena, Cartagena, Colombia
Correspondencia: César Augusto Ortiz, MD., cortizg2@unicartagena.edu.co
Fecha de recibido: 24 de noviembre de 2012. Fecha de aprobación: 16 de abril de 2013.
Resumen
La práctica de la cirugía torácica ha evolucionado a lo largo del tiempo. Inicialmente se utilizaba la toracotomía como único abordaje para tratar las enfermedades torácicas de indicación quirúrgica. En el último siglo, el avance tecnológico y las nuevas técnicas de video han permitido el progreso de la video-toracoscopia, convirtiéndola en la actualidad en el método estándar para el diagnóstico y tratamiento de un importante número de enfermedades torácicas. Este método permite una recuperación rápida de los pacientes, con disminución del trauma quirúrgico, el estrés metabólico, los analgésicos, el tiempo de hospitalización, y las tasas de morbilidad y mortalidad. Aunque se considera un procedimiento seguro, no está exento de presentar complicaciones que pueden requerir, en un muy bajo porcentaje, la toracotomía, razón por la cual los cirujanos entrenados en video-toracoscopia nunca deben desconocer la técnica de abordaje a cielo abierto.
Palabras clave: cirugía torácica; cirugía torácica asistida por video; procedimientos quirúrgicos operativos; historia; complicaciones.
Abstract
The practice of thoracic surgery has evolved over time. Initially thoracotomy was performed as the only approach in the management of thoracic pathologies amenable to surgical treatment. The technological progress and the advent of video assisted techniques have allowed the advancement of video-assisted thoracic thoracoscopy, positioning it as the gold standard in the diagnosis and treatment of an important number chest diseases. This method permits a rapid recovery, diminution in the surgical trauma and metabolic stress, lesser analgesic requirements, shorter hospital stay, and lower morbidity and mortality rates. Although considered a safe approach, it is not void complications that may require, in a very low percentage, thoracotomy, for which reason surgeons trained in video-assisted thoracic surgery should never ignore the open approach technique.
Key words: thoracic surgery; thoracic surgery, video-assisted; surgical procedures, operative: complications.
Introducción
La cirugía toracoscópica surgió en la primera década del siglo XX. El internista sueco Hans Christiansen Jacobaeus del Hospital Serafimer-Lasarettet en Estocolmo, utilizó un cistoscopio para efectuar las primeras toracoscopias en 1910, en el estudio y manejo de las adherencias pleurales en pacientes con tuberculosis 1,2. Luego de esto, la cirugía toracoscópica comenzó a ser utilizada en todo el mundo; no obstante, con la llegada de la estreptomicina en la década de 1940, este método fue menos utilizado. En la última década del siglo XX, con el desarrollo del monitor de vídeo se retomó el interés por la toracoscopia operatoria, progresando a lo que conocemos actualmente como cirugía video-toracoscópica (Video-Assisted Thoracoscopic Surgery, VATS) 3. Desde entonces, su desarrollo ha sido vertiginoso, demostrando poseer numerosas ventajas y mejores resultados.
La cirugía video-toracoscopia es una técnica mínimamente invasiva que permite la intervención quirúrgica intratorácica compleja a través de incisiones mínimas por donde es introducido un telescopio y el instrumental quirúrgico, sin llegar a usar separador costal, de tal forma que la operación sólo se visualiza en el monitor 4. Es primordial el papel del equipo de anestesia, porque se requiere una buena ventilación respiratoria selectiva a un solo pulmón y una correcta atelectasia pulmonar unilateral, para que la cirugía se pueda llevar a cabo 5.
Perspectiva histórica
Hans Christiansen Jacobaeus es considerado el padre de la cirugía toracoscópica. Su primera publicación apareció en el Munchetter Medizinische Wochensatrift, en 1910, sobre un trabajo titulado "Sobre la posibilidad de utilizar un cistoscopio para examinar las cavidades serosas" 1,6. En 1911 publicó sus primeras experiencias en toracoscopia, describiendo la apariencia de la cavidad pleural normal y algunos cambios patológicos, tales como exudados pleurales, neumotórax y empiema. El primer intento de pleurólisis lo hizo en 1913, con la técnica denominada 'intervención de Jacobaeus', que consistía en insertar el toracoscopio en la cavidad pleural para identificar las adherencias pleurales y posteriormente introducir el galvano-cauterizador en un segundo puerto para liberar estas adherencias 7-9.
La técnica de Jacobaeus se adoptó con entusiasmo en Europa y en Estados Unidos y, en los siguientes años, hubo numerosas publicaciones, entre las que resaltan las series de Moore en 1934 10, las de Drash en 1938 11 y las de Day en 1948 12, que demostraban la conveniencia del abordaje toracoscópico para la liberación de adherencias pleurales, aunque con una alta incidencia de empiemas tuberculosos.
Con el pasar de los años también se intentó modificar la técnica de Jacobaeus para obtener mejores resultados. Davidson, en 1929 13, y Cutler, en 1933 14, utilizaron una técnica de un solo puerto, motivados por la iniciativa de minimizar la cirugía, pero obtenían menor visibilidad y técnicamente era más difícil.
La era del entusiasmo por la toracoscopia terapéutica terminó en 1945 con la introducción de la estreptomicina, y la era del abandono comenzó con la toracoscopia confinada principalmente a medidas diagnósticas. Después de 1945, la biopsia se convirtió en el único método operativo dentro de la pleura, y el interés en la toracoscopia se vio menospreciado por los reportes de complicaciones como tromboembolia, embolia gaseosa, enfisema quirúrgico, diseminación cancerosa, empiema, insuficiencia respiratoria y neumotórax persistente 15. Bloombergen, en 1978 16, fue quien mejor resumió la historia de la toracoscopia y su posición en el manejo de las enfermedades del tórax al manifestar:
"[...] Mientras algunas técnicas quirúrgicas del pasado aún siguen siendo usadas, hay una cierta cantidad que se han dejado a un lado y han pasado al olvido. Una de estas... es la toracoscopia [...]".
Los avances tecnológicos de la década de los 90, con el desarrollo del monitor y la cámara de video, y los nuevos instrumentos endoscópicos percutáneos, convirtieron nuevamente la toracoscopia meramente diagnóstica en toracoscopia terapéutica, y a un grado mínimamente invasivo, en lo que se conoce hasta la actualidad como cirugía video-toracoscópica (VATS) 17. Desde los inicios de 1990, esta técnica ha adquirido un importante protagonismo en la cirugía de tórax, utilizándose en operaciones de pulmón, pleura, mediastino, esófago, pericardio y otras, como cierre de conducto arterial persistente, simpatectomía torácica y corrección de eventración diafragmática 18.
Evaluación preoperatoria
Debe ser igual de completa a la del paciente que va a someterse a una cirugía torácica abierta. La historia clínica permite conocer la naturaleza de la enfermedad, analizar la viabilidad de un abordaje mínimamente invasivo y predecir el tiempo de recuperación 19.
La radiografía simple de tórax es suficiente en algunos casos para el diagnóstico de enfermedades intratorácicas; sin embargo, una tomografía computadorizada (TC) de tórax aporta información adicional sobre las estructuras anatómicas de la cavidad torácica. Igualmente, permite observar si existe compromiso de ganglios linfáticos, cuya biopsia es posible mediante la técnica de punción con aguja guiada por TC 20.
Es imprescindible evaluar la capacidad pulmonar de cada paciente. Si es fumador activo, la cirugía se programa cuando se cuente con una a dos semanas de abstinencia. La evaluación funcional pulmonar no es necesaria si no se planea una resección pulmonar significativa. La mayoría de los pacientes tolera la ventilación respiratoria monobronquial, excepto aquellos con edad avanzada, enfermedad pulmonar obstructiva crónica o cualquier otra enfermedad con pobre función pulmonar. Estos se deben evaluar con una espirometría y prueba de ejercicio gradual. Cuando se planea resecar un gran volumen pulmonar, se efectúan estudios gammagráficos con 99mTC 19.
Si se encuentran síntomas cardiovasculares, historia previa o evidencia de infarto del miocardio, angina inestable o falla cardiaca congestiva, resulta importante evaluar esta condición por medio de una prueba de esfuerzo simple o con estrés farmacológico 19.
Consideraciones anestésicas
El tipo de anestesia empleada en la cirugía video-toracoscópica puede ser local, regional o general, con ventilación de un pulmón. La infiltración de anestésicos locales en la pared torácica y la pleura parietal es la manera más sencilla de proveer anestesia. El bloqueo del nervio intercostal a nivel de la incisión y en dos espacios intercostales por encima y por debajo, provee una completa analgesia para la cirugía 21.
Para la intubación se utiliza un tubo endotraqueal de doble luz 22. Después de la intubación, se debe verificar siempre la correcta posición del tubo endotraqueal por medio de una fibrobroncoscopia, porque en el 48 % de los casos existen datos clínicos de mala posición 23,24.
La ventilación pulmonar se comienza con un volumen corriente de 10 ml/kg y la frecuencia respiratoria se ajusta para que la presión arterial de dióxido de carbono (PaCO2) sea igual a 40 mm Hg. Se proporciona una fracción inspirada de oxigeno (FiO2) alta para superar las pérdidas de volumen pulmonar por el neumotórax generado 21.
Si se presenta hipoxemia importante después de la intubación, se debe descartar una mala posición del tubo endotraqueal o un mal estado hemodinámico 21. Si lo anterior no resuelve la hipoxemia, se emplea la CPAP (presión positiva continua en la vía aérea) selectiva al pulmón superior y la PEEP (presión positiva al final de la inspiración) al pulmón inferior, para tratar de obtener la mayor distensión pulmonar y el menor cortocircuito derecho-izquierdo que mejore la saturación sanguínea 21.
Técnica quirúrgica
Lo esencial en el engranaje de una correcta cirugía video-toracoscópica es la adecuada planeación del procedimiento 17,18. Se deben revisar la radiografía y la TC de tórax para formular el plan para el acceso y la ubicación de los trocares entre las costillas, porque determinan la facilidad o la dificultad de la cirugía 25.
La posición del paciente, generalmente, es en decúbito lateral con el lado enfermo hacia arriba (figura 1). La ubicación del toracoscopio y el instrumental se logra a través de una incisión de 10 o 12 mm y una minitoracotomía de 3 a 5 cm, como máximo, en la cara axilar del hemitórax, utilizando como referencia el borde superior de la costilla inferior del espacio elegido para evitar la lesión del paquete vásculo-nervioso intercostal. Generalmente, se utilizan tres abordajes, pero pueden ser más 26.
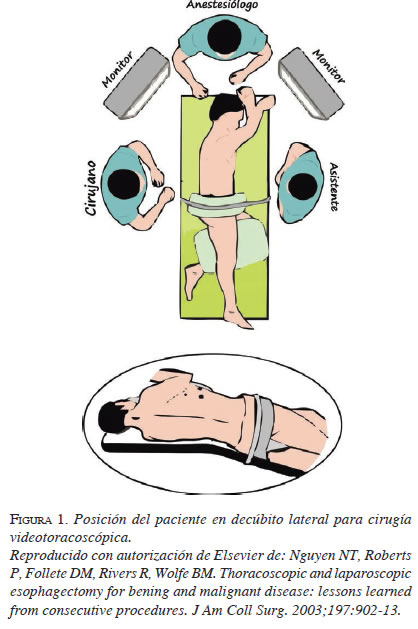
El sitio de acceso se explora digitalmente para identificar la presencia de adherencias pleurales que puedan impedir la correcta introducción de los instrumentos, con el riesgo de lesionar el parénquima pulmonar 17.
En general, el sexto o séptimo espacio intercostal en la línea axilar media es ideal para el acceso del toracoscopio a la cavidad pleural. Este lugar provee una vista clara del mediastino, de todas las superficies pleurales y del parénquima pulmonar 17. La insuflación de CO2 se usa ocasionalmente para facilitar el colapso pulmonar, conservando la presión del espacio pleural por debajo de 10 mm Hg 27. Una vez se introduce el toracoscopio, se espera el completo colapso del pulmón y se explora la cavidad torácica; el resto de los trocares se introducen bajo visión directa (figura 2) 26.
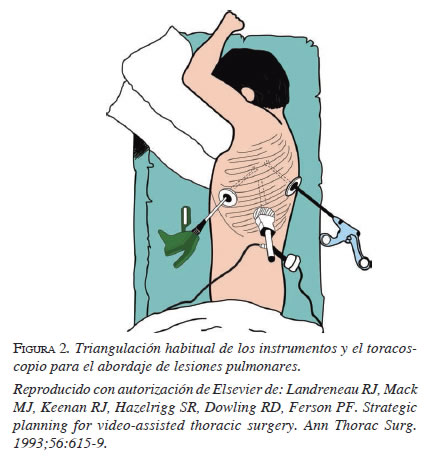
La posición del cirujano es dinámica. Cuando se aborda la cavidad pleural, el mediastino y los hilios pulmonares, el cirujano tiene mejor visión y manejo del instrumental ubicándose en la parte posterior del paciente. En los abordajes del mediastino posterior, la ubicación más cómoda es la parte anterior 27.
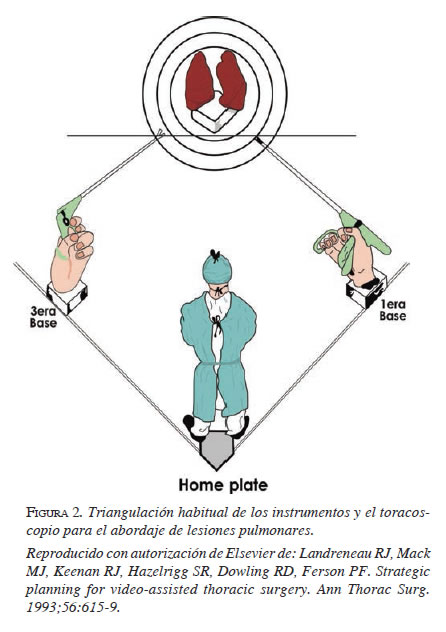
La estrategia operativa principal es orientar los instrumentos endoscópicos y la cámara toracoscópica en la misma dirección hacia la lesión diana (configuración en diamante de béisbol). Esto evita la manipulación torpe de los instrumentos debido a la formación de imágenes en espejo que resultan cuando los instrumentos se apuntan hacia la cámara toracoscópica 17 (figura 3).
Antes de retirar la cámara, se explora la cavidad torácica para comprobar la hemostasia y el anestesiólogo desbloquea el bronquio para visualizar la correcta expansión pulmonar. Finalizada la operación, se deja un tubo de drenaje de tórax por uno de los accesos mínimos más anteriores. Por precaución, se debe tener lista una mesa de instrumentación con los elementos necesarios para una eventual toracotomía de emergencia, en caso de surgir complicaciones 26.
Periodo posoperatorio
El periodo posoperatorio se enfoca según el tipo de cirugía practicada y la estabilidad hemodinámica de cada paciente. Se debe tomar una radiografía de tórax y controlar el dolor con analgésicos que van desde los antiinflamatorios no esteroideos (AINE) hasta los opioides, con el fin de mejorar la expansibilidad pulmonar. En nuestra Facultad, los pacientes en el periodo posoperatorio de cirugía video-toracoscópica son trasladados a la unidad de cuidados intensivos. La estancia en dicha unidad varía en 1,0 ± 2,0 días y la estancia hospitalaria total presenta una media de 5,2 ± 2,9 días 28.
Indicaciones
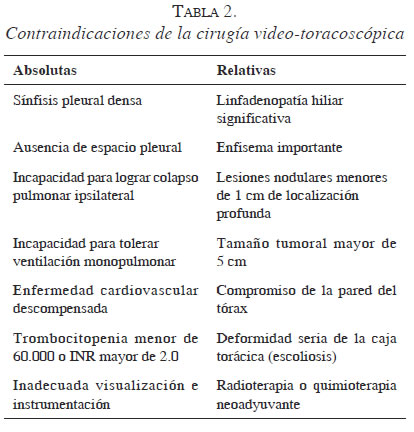
En la actualidad, la video-toracoscopia es considerada una técnica quirúrgica mínimamente invasiva que puede utilizarse prácticamente en cualquier intervención del tórax. El juicio y la experiencia del cirujano serán los que determinen su conveniencia e indicación en cada caso particular. En la tabla 1 se enumeran las ventajas y desventajas, y en la tabla 2, las contraindicaciones de este procedimiento.

Indicaciones diagnósticas en derrames
Derrame pleural. En el estudio de los exudados pleurales presuntamente malignos, la utilidad diagnóstica de la cirugía video-toracoscópica es del 82,3 % 29; además es un método de tratamiento paliativo al permitir la realización de pleurodesis 30. En el estudio del empiema, el porcentaje de resultados positivos de los cultivos de líquido pleural obtenido por cirugía video-toracoscópica, son significativamente mayores que aquellos de los tomados antes de esta intervención 29. La cirugía video-toracoscópica es útil para el diagnóstico de la tuberculosis pleural porque demuestra las lesiones típicas y permite obtener muestras para estudio 31.
Derrame pericárdico. El drenaje pericárdico por cirugía video-toracoscópica es factible, seguro y permite un diagnóstico etiológico. Esta intervención podría ser el tratamiento de referencia para el derrame pericárdico 32.
Indicaciones diagnósticas en tejidos
Biopsia pleural. La diferenciación entre mesotelioma, hiperplasia mesotelial y adenocarcinoma metastásico, es uno de los problemas más difíciles en la biopsia pleural. La cirugía video-toracoscópica puede aumentar su utilidad porque permite una visión directa de la lesión y la obtención de muestras más representativas. En casos de neoplasias, la biopsia a ciegas tiene un rendimiento diagnóstico del 50 %; cuando se toma por medio de cirugía video-toracoscópica, su rendimiento alcanza el 90 %33.
Biopsia en resección en cuña de pulmón. La resección pulmonar en cuña en el estudio de la enfermedad pulmonar intersticial difusa y de nódulos pulmonares indeterminados, permite establecer un diagnóstico preciso en más del 90 % de los casos. Cuando se practica por cirugía video-toracoscópica, es un procedimiento seguro, es posible omitir el tubo de tórax y la estancia hospitalaria es corta 34.
Biopsia de ganglio linfático del mediastino. La mediastinoscopia es una herramienta de diagnóstico importante cuando se requiere una biopsia de los ganglios linfáticos para identificar procesos patológicos en el mediastino, aunque la tomografía por emisión de positrones (PET) cada vez resulta más útil 35.
Biopsia de masas del mediastino. La mediastinoscopia cervical es el procedimiento de elección para el abordaje de masas del mediastino –anteriores y superiores–, en espacios peritraqueales, paratraqueales y subcarinales. En casos de tumores que se adhieren a la pared torácica anterior, o que se localizan en la ventana aorto-pulmonar y periaórtica, se indica la mediastinostomía 36.
Biopsia para enfermedad pulmonar intersticial. La biopsia pulmonar está indicada siempre que no se logre obtener un diagnóstico específico de enfermedad pulmonar intersticial con técnicas como el lavado broncoalveolar. Deben tomarse muestras de, al menos, dos áreas diferentes, una con aspecto macroscópico patológico y otra con aspecto normal. Cuando se practica por cirugía video-toracoscópica, supone un menor tiempo operatorio, menor incidencia de complicaciones posoperatorias y reducción de la estancia hospitalaria 37.
Indicaciones terapéuticas
Indicaciones terapéuticas pleuro-pulmonares
Lobectomía. La práctica de lobectomía por cirugía video-toracoscópica se ha incrementado debido al aumento de cáncer de pulmón en etapa temprana. Se ha demostrado que el cáncer de pulmón puede tratarse correctamente por medio de cirugía video-toracoscópica, con resultados oncológicos favorables 38,39. La lobectomía por cirugía video-toracoscópica es un procedimiento seguro 40, con menor tasa de dolor posoperatorio 41 y conserva mejor la función pulmonar 42, por lo que puede ser el procedimiento de elección en pacientes de alto riesgo, como ancianos y sujetos con función pulmonar baja 43.
Decorticación pleural. La decorticación por cirugía video-toracoscópica es un método seguro y eficaz para el tratamiento de empiema, derrame pleural complejo, derrame pleural recurrente y hemotórax retenido, pero la conversión a toracotomía es frecuente en los casos complejos 44.
Segmentectomía. La resección pulmonar segmentaria ha sido considerada como un tratamiento de segunda línea para el cáncer de pulmón de células no pequeñas 45. Se ha evidenciado que ofrece mejores resultados oncológicos que la resección en cuña 46 y resultados equivalentes a la lobectomía en el tratamiento de cáncer de pulmón en estadio I 47, asociados a una mínima morbilidad y mortalidad 45,48. Puede ser el procedimiento de elección en pacientes con función cardiopulmonar comprometida, enfermedades concomitantes significativas y cáncer de células no pequeñas, periférico y en estadio I 45,49.
Neumotórax espontáneo. Del 30 al 40 % de los casos de neumotórax espontáneo primario requiere tratamiento quirúrgico 50. El manejo con engrapado de bulas y pleurodesis con talco mediante cirugía video-toracoscópica tiene una gran eficacia, siendo superior a la pleurectomía subtotal y a la ligadura de bulas, y se reporta baja recurrencia del neumotórax (1,27 % con engrapado y 1,79 % con la pleurodesis con talco) 51.
Pleurodesis. Se han descrito tres formas de pleurodesis por cirugía video-toracoscópica: por abrasión mecánica, por medios físicos (electrocauterio o láser) y con talco, reportándose tasas de recidiva de 2,1 % a 2,7 % 52. Una pleurodesis fallida está asociada a la presencia de espacio aéreo posoperatorio, fuga de aérea, empiema y drenaje pleural prolongado 53.
Resección de secuestro pulmonar. Estas malformaciones pueden ser operadas por medio de lobectomía por cirugía video-toracoscópica. La arteria sistémica aberrante puede ser disecada con seguridad, la tasa de conversión es baja y se asocia con una baja frecuencia de complicaciones y una menor estancia hospitalaria 54.
Indicaciones terapéuticas en esófago
Resección de leiomiomas. El manejo de leiomiomas esofágicos por cirugía video-toracoscópica es una alternativa viable y segura, con baja morbilidad y mortalidad. Está indicada en leiomiomas sintomáticos del esófago torácico, mayores de 2 cm, que muestran evidencia de crecimiento y en los que se quiere descartar neoplasia maligna. La frecuencia de recurrencia es mínima a 10 meses de seguimiento 55.
Esofagomiotomía. La miotomía esofágica por cirugía video-toracoscópica ha mostrado resultados superiores a los obtenidos por cirugía abierta. El 90 % de los pacientes refieren mejoría absoluta de la disfagia y logran tolerar una dieta regular en las primeras 24 horas. La media de la estancia hospitalaria es de 2 días 56.
Esofagectomía. La cirugía video-toracoscópica está encaminada a la resección esofágica, mientras que la laparoscopia busca el ascenso de la cámara gástrica después de la resección 57. En otras revisiones se menciona que todo el procedimiento, incluyendo el ascenso gástrico, puede hacerse mediante cirugía video-toracoscópica 58.
Indicaciones terapéuticas en mediastino
Ventana pericárdica. El drenaje pericárdico por cirugía video-toracoscópica como diagnóstico y tratamiento para el derrame pericárdico, es factible, seguro y permite un diagnóstico etiológico 59.
Timectomía para miastenia gravis. La timectomía por cirugía video-toracoscópica para el tratamiento de la miastenia gravis, tiene como ventajas la reducción significativa del dolor posoperatorio, una menor necesidad de analgésicos, una estadía hospitalaria más corta y mejores resultados estéticos 60.
Timectomía para timoma en estadio I. Se ha reportado que la timectomía extendida para timoma en estadios clínicos de Masaoka I y II, y tumores mayores de 5 cm, brinda buenos resultados, sin necesidad de conversión a esternotomía media 61.
Resección de masas neurogénicas mediastinales posteriores. Este procedimiento puede ser practicado de forma segura y sin daño a los tejidos vecinos mediante cirugía video-toracoscópica 60, al igual que la toracoscopia robótica, debido a los precisos movimientos de los instrumentos y a la vista tridimensional 62.
Escisión de quistes broncogénicos o entéricos. El manejo quirúrgico por toracoscopia es factible y seguro, no incrementa el tiempo de operación o el riesgo de complicaciones, y disminuye la duración del drenaje pleural y la estancia hospitalaria 63.
Pericardiotomía. La pericardiotomía con cirugía video-toracoscópica es una forma de tratamiento para derrames pericárdicos benignos o malignos recurrentes, en los cuales los tratamientos convencionales, como el catéter de pericardiocentesis o la ventana subxifoidea, han fallado 64.
Mediastinitis. Se han obtenido buenos resultados, con una tasa de mortalidad aceptable y pocas complicaciones, usando el drenaje de cuello por vía de incisión cervical y el drenaje del mediastino con cirugía video-toracoscópica simultáneamente, en el manejo de la mediastinitis necrosante descendente en fases tempranas 65.
Otras indicaciones
Simpatectomía. Los casos descritos se han practicado a través de un solo puerto y la tasa de complicaciones son equivalentes a la de los procedimientos abiertos establecidos, pero, la morbilidad, la estancia hospitalaria y el tiempo para volver a las actividades diarias, se reducen significativamente 66.
Cirugía de columna. Se ha implementado el abordaje por cirugía video-toracoscópica por la rápida recuperación posoperatoria y los mejores resultados estéticos, aunque duplica en tiempo operatorio a la cirugía abierta. Se practican procedimientos como drenaje de abscesos espinales, biopsia de cuerpos vertebrales, disectomías de núcleos pulposos herniados y corrección de la cifoscoliosis 67.
Complicaciones
Las complicaciones son aquellos eventos que generan un procedimiento adicional en la cirugía o después de esta, y que no están planificados. En pacientes intervenidos por cirugía video-toracoscópica pueden clasificarse como complicaciones tempranas: hemorragia, fuga aérea persistente, empiema posoperatorio y neumonía posoperatoria; y complicaciones tardías: recurrencia de tumor, neumotórax recurrente, dolor crónico y adherencias pleurales 68.
En general, el porcentaje de complicaciones es bajo, aunque en otras series se reporta una mayor frecuencia de complicaciones, entre 7,7 % y 12 % 69,70. La complicación más frecuentemente reportada es la fuga prolongada de aire, con una frecuencia que varía entre 4,7 % y 22,2 % 71,72, especialmente en cirugía de nódulos pulmonares y bulas. Por otro lado, otras series reportan como complicación predominante la neuralgia intercostal (50 %) 69. Siguen en frecuencia las complicaciones hemorrágicas (2 %) y las complicaciones infecciosas (2,8 %) 71.
La conversión de cirugía video-toracoscópica a toracotomía abierta puede presentarse en el 1,7 % de los pacientes, debido a sangrado de difícil control, adhesión pleural extensa o imposibilidad de localizar la lesión durante la toma de biopsias 71.
Actualidad en cirugía torácica
Cirugía video-toracoscópica con acceso por un puerto. Actualmente, se ha demostrado que la cirugía video-toracoscópica por un solo puerto es tan efectiva como la video-toracoscópica convencional y genera menor morbilidad a los pacientes durante el posoperatorio 73.
Los instrumentos usados son insertados a través de la incisión única, ya sea directamente o a través de una plataforma flexible con múltiples estaciones 74,75. Los instrumentos usados en la cirugía video-toracoscópica por puerto único, deben ser flexibles y articulados, lo que permite total movimiento de estos dentro de la cavidad torácica 4.
Las principales ventajas de esta técnica son la reducción significativa del dolor posoperatorio, una rápida recuperación con una menor estancia hospitalaria y un pronto retorno al trabajo. La principal desventaja tal vez sea una insuficiente calidad de la visión, la cual depende del tipo de toracoscopio 75,76.
Cirugía toracoscópica asistida por robótica. Se han informado experiencias exitosas, como la reportada en el Hospital Higashi Nagoya de lobectomía por cirugía video-toracoscópica para tratar el cáncer de pulmón primario, utilizando un robot a control remoto, denominado Naviot®77.
Con el sistema quirúrgico Da Vinci®, uno de los sistemas robóticos más usados en cirugía en todo el mundo, se han informado casos exitosos de timectomía 78. Otras series también demuestran que la cirugía robótica torácica está siendo desarrollada de manera eficaz y segura en otra variedad de procedimientos y, a pesar de su alto costo, su futuro es bastante prometedor 79.
El funcionamiento del sistema quirúrgico Da Vinci® lo constituye, en primer lugar, la consola de mando, donde el cirujano dirige la operación sin estar en contacto directo con el paciente y, a su vez, le brinda al cirujano una buena postura ergonómica lo que reduce la fatiga y el estrés 80. Mediante la cámara, el cirujano puede 'navegar' dentro del cuerpo del paciente, hasta encontrar la zona afectada y comenzar la operación. Mediante los monitores, el cirujano siempre tiene contacto visual con los instrumentos que utiliza. Todo movimiento realizado por el robot, se origina en las manos del especialista, que genera comandos producidos por la consola maestra y pasan por un sistema que digitaliza y efectúa estos comandos, para luego transmitirlos al robot que ejecuta lo dispuesto. Sus principales ventajas radican en la posibilidad de operar en áreas muy pequeñas del cuerpo y su capacidad de eliminar los temblores del cirujano 81.
El robot está conformado por tres o cuatro brazos; uno porta la cámara mientras los otros manipulan los instrumentos. Cada brazo, diseñado con la tecnología EndoWrist®, copia milimétricamente los movimientos que el cirujano realiza en la consola, porque permite siete grados de libertad de movimientos, es decir, puede realizar 117.649 movimientos; esto es el 0,019 % del total de la capacidad del brazo y la muñeca del ser humano. Esta cifra es muy superior comparada con los tres grados de libertad y los 729 movimientos que permiten los instrumentos de cirugía laparoscópica convencional, y que representan el 0,00012 % del total de la capacidad del brazo humano 79,81.
Es así como el sistema Da Vinci® combina lo mejor de los movimientos manuales que se utilizan en la cirugía abierta tradicional con las técnicas menos traumáticas de la cirugía mínimamente invasiva.
Conclusión
Desde la primera toracoscopia realizada por Jacobeaus hace 100 años, la tecnología quirúrgica ha avanzado significativamente, permitiendo que hoy en día se disponga de equipos e instrumentos que permiten practicar cirugías mininamente invasivas en el área del tórax, con una menor tasa de complicaciones y un menor tiempo de estancia hospitalaria, en comparación con la cirugía abierta, con muy buenos resultados.
¿Hacia dónde vamos? Es una pregunta que en medicina siempre se debe hacer. El nacimiento de la cirugía robótica en el final del siglo XX, marca ahora el inicio de otra nueva era para la cirugía torácica.
Referencias
1. Jacobaeus HC. Über die Möglichkeit, die Zystoskopie bei Untersuchung seröser Höhlungen anzuwenden. Munch Med Wochenschr. 1910;57:2090-2. [ Links ]
2. Jacobaeus HC. The practical importance of thoracoscopy in surgery of the chest. Surg Gynecol Obstet. 1922;34:289-96. [ Links ]
3. Braimbridge M. Thoracoscopy: A historical perspective. En: Yim APC, Hazelrigg SR, Bashar MI, Landreneau RJ, Mack MJ, Naunheim KS, editors. Minimal access cardiothoracic surgery. Philadelphia: W.B. Saunders; 1999. p. 11-20. [ Links ]
4. Lee P, Mathur PN, Colt HG. Advances in thoracoscopy: 100 years since Jacobaeus. Respiration. 2010;79:177-86. [ Links ]
5. Brodsky JB, Cohen E. Video-assisted thoracoscopic surgery. Curr Opin Anaesthesiol. 2000;13:41-5. [ Links ]
6. Hatzinger M, Häcker A, Langbein S, Kwon S, Hoang-Böhm J, Alken P. Hans-Christian Jacobaeus (1879-1937): The inventor of human laparoscopy and thoracoscopy. Urologe A. 2006;45:1184-6. [ Links ]
7. Jacobaeus HC. The cauterization of adhesions in artificial pneumothorax treatment of pulmonary tuberculosis under thoracoscopic control. Proc R Soc Med. 1923;16:45-62. [ Links ]
8. Jacobaeus HC. The cauterization of adhesion in pneumothorax treatment of tuberculosis. Surg Gynaecol Obstet. 1921;32:493-500. [ Links ]
9. Jacobaeus HC. The cauterization of adhesions in artificial pneumothorax treatment of pulmonary tuberculosis under thoracoscopic control. Proc Roy Med. 1922-3;16:45-60. [ Links ]
10. Moore J. Intrauleural uneumonolysis: A critical review. J Thorac Surg. 1934;3:276-99. [ Links ]
11. Drash EC. An appraisal of closed intrapleural pneumonolysis in pulmonary tuberculosis: Relation of empyema to the operation. J Thorac Surg. 1938;7:411-9. [ Links ]
12. Day JC, Chapman PT, O'Brien EJ. Closed intrapleural pneumonolysis: An analysis of 1000 consecutive operations. J Thorac Surg. 1948;17:537-54. [ Links ]
13. Davidson LR. A simplified operating thoracoscope. Am Rev Tuberc. 1929;19:306-9. [ Links ]
14. Cutler JW. A technique and apparatus for intrapleural pneumonolysis. Am Rev Tuberc. 1933;28:528-36. [ Links ]
15. Viskum K, Enk B. Complications of thoracoscopy. Poumon Coeur. 1981;37:25-8. [ Links ]
16. Bloomberg AE. Thoracoscopy in perspective. Surg Gynecol Obstet. 1978;147:433-43. [ Links ]
17. Landreneau RJ, Mack MJ, Keenan RJ, Hazelrigg SR, Dowling RD, Ferson PF. Strategic planning for video-assisted thoracic surgery. Ann Thorac Surg. 1993;56:615-9. [ Links ]
18. Landreneau RJ, Mack MJ, Hazelrigg SR, Dowling RD, Acuff TE, Magee MJ, et al. Video-assisted thoracic surgery: Basic technical concepts and intercostal approach strategies. Ann Thorac Surg. 1992;54:800-7. [ Links ]
19. Meyer DM. Preoperative assessment for video-assisted thoracic surgery. En: Yim APC, Hazelrigg SR, Bashar MI, Landreneau RJ, Mack MJ, Naunheim KS, editors. Minimal access cardiothoracic surgery. Philadelphia: W.B. Saunders; 1999. p. 11-20. [ Links ]
20. Mack MJ, Gordon MJ, Postma TW, Berger MS, Aronoff RJ, Acuff TE, et al . Percutaneous localization of pulmonary nodules for thoracoscopic lung resection. Ann Thorac Surg. 1992;53:1123-4. [ Links ]
21. Huerta MC, Villazón DO, Acevedo CA, González RM. Ventilación mecánica selectiva (a un pulmón) y manejo anestésico en cirugía toracoscópica videoasistida. Rev Mex Cir Endoscop. 2001;2:87-96. [ Links ]
22. Benumof JL. Management of the difficult adult airway. With special emphasis on awake tracheal intubation. Anesthesiology. 1991;75:1087-110. [ Links ]
23. Capan LM, Turndorf H, Patel C, Ramanathan S, Acinapura A, Chalon J. Optimization of arterial oxygenation during one-lung anesthesia. Anesth Analg. 1980;59:847-51. [ Links ]
24. Benumof JL, Partridge BL, Salvatierra C, Keating J. Margin of safety in positioning modem double-lumen endotracheal tubes. Anesthesiology. 1987;67:729-38. [ Links ]
25. Wernly JA, DeMeester TR. Preoperative assessment of patients undergoing lung resection for cancer. En: Roth JA, Ruckedeschel JC, Weisenburger TH, editors. Thoracic Oncology. Philadelphia: W.B. Saunders; 1989. p. 156-176. [ Links ]
26. Bruno G, Pérez E, Pomi J, Maggiolo J. Conceptos generales de técnica quirúrgica en cirugía video toracoscópica [online]. Hospital Maciel. Uruguay. Fecha de consulta: 30 de mayo de 2012. Disponible en: http://www.mednet.org.uy/cq3/bibliografia/cir-lap/ [ Links ]
27. Lin JF. Strategic planning for video-assisted thoracic surgery. En: Yim APC, Hazelrigg SR, Bashar MI, Landreneau RJ, Mack MJ, Naunheim KS, editors. Minimal Access Cardiothoracic Surgery. Philadelphia: W.B. Saunders; 1999. p. 28-35. [ Links ]
28. Gutiérrez E, Cantillo E, Bobadilla N, Miranda P. Cirugía toracoscópica video-asistida por dos puertos. Experiencia en Cartagena. Colombia. Rev Cienc Biomed. 2012;3:24-30. [ Links ]
29. Medford AR, Awan YM, Marchbank A, Rahamim J, Unsworth-White J, Pearson PJ. Diagnostic and therapeutic performance of video-assisted thoracoscopic surgery (VATS) in investigation and management of pleural exudates. Ann R Coll Surg Engl. 2008;90:597-600. [ Links ]
30. Sayir F, Cobanoglu U, Mergan D, Demir H. Video-assisted thoracoscopic surgery for malignant pleural effusions. Asian Pac J Cancer Prev. 2011;12:415-8. [ Links ]
31. Fuentes E, Martín MA. Derrame pleural tuberculoso: diagnóstico mediante videotoracoscopia. Rev Cubana Cir. 2006;45:3-4. [ Links ]
32. Palma JH, Gaia DF, Guilhen JC, Branco JN, Buffolo E. Video-thoracoscopic pericardial drainage in the treatment of pericardial effusions. Rev Bras Cir Cardiovasc. 2009;24:44-9. [ Links ]
33. Escribano AM, Vaquero JM. Mesotelioma pleural maligno. En: Soto JG, editor. Manual de diagnóstico y terapéutica en neumología [Online]. Madrid: Ergon; 2005. Fecha de consulta: 30 de mayo de 2012. Disponible en: http://www.neumosur.net/files/EB04-53%20mesotelioma.pdf [ Links ]
34. Tapias L, Santamaría C, Tapias L, Tapias L. Resecciones pulmonares en cuña para estudio histopatológico: experiencia de Bucaramanga. Rev Colomb Cir. 2011;26:13-24. [ Links ]
35. Abdala F, Abdala O, Poleri C, Patané K, Rojas O, Rosenberg M. Utilidad de la mediastinoscopia sistemática en el diagnóstico y la estadificación del cáncer de pulmón. Rev Arg Med Resp. 2006;1: 51-3. [ Links ]
36. Cirino LM, Milanez JR, Fernández A, Samano MN, Fernández PP, Filomeno LT, et al. Diagnosis and treatment of mediastinal tumors by thoracoscopy. Chest. 2000;117:1787-92. [ Links ]
37. Suárez O, González G, Cepero M, Madrigal G, Cepero M, Collera A. Biopsia pulmonar por toracoscopia videoasistida en el diagnóstico de las enfermedades pulmonares intersticiales: nuestra experiencia. Rev Cubana Cir. 2005;44(1). [ Links ]
38. Roviaro GC, Rebuffat C, Varoli F, Vergani C, Mariani C, Maciocco M. Videoendoscopic pulmonary lobectomy for cancer. Surg Laparos Endosc. 1992;2: 244-7. [ Links ]
39. Lewis RJ, Caccavale RJ, Sisler GE, Mackenzie JW. Videoassisted thoracic surgical resection of malignant lung tumors. J Thorac Cardiovasc Surg. 1992;104:1679-85. [ Links ]
40. Shaw JP, Dembitzer FR, Wisnivesky JP, Litle VR, Weiser TS, Yun J, et al. Video-assisted thoracoscopic lobectomy: State of the art and future directions. Ann Thorac Surg. 2008;85:S705-9. [ Links ]
41. Nagahiro I, Andou A, Aoe M, Sano Y, Date H, Shimizu N. Pulmonary function, postoperative pain, and serum cytokine level after lobectomy: A comparison of VATS and conventional procedure. Ann Thorac Surg. 2001;72:362-5. [ Links ]
42. Demmy TL, Curtis JJ. Minimally invasive lobectomy directed toward frail and high-risk patients: A case-control study. Ann Thorac Surg. 1999;68:194-200. [ Links ]
43. Garzón JC, Ng CS, Sihoe AD, Manlulu AV, Wong RH, Lee TW, et al. Video-assisted thoracic surgery pulmonary resection for lung cancer in patients with poor lung function. Ann Thorac Surg. 2006;81:1996-2003. [ Links ]
44. Tong BC, Hanna J, Toloza EM, Onaitis MW, D'Amico TA, Harpole DH, et al. Outcomes of video-assisted thoracoscopic decortication. Ann Thorac Surg. 2010;89:220-5. [ Links ]
45. Leshnower BG, Miller DL, Fernández FG, Pickens A, Force SD. Video- assisted thoracoscopic surgery segmentectomy: A safe and effective procedure. Ann Thorac Surg. 2010;89:1571-6. [ Links ]
46. Okada M, Nishio W, Sakamoto T, Uchino K, Yuki T, Nakagawa A, et al. Effect of tumor size on prognosis in patients with non-small cell lung cancer: The role of segmentectomy as a type of lesser resection. J Thorac Cardiovasc Surg. 2005;129:87-93. [ Links ]
47. El-Sherif A, Gooding WE, Santos R, Pettiford B, Ferson PF, Fernando HC, et al. Outcomes of sublobar resection versus lobectomy for stage I non-small cell lung cancer: A 13-year analysis. Ann Thorac Surg. 2006;82:408-16. [ Links ]
48. Farjah F, Wood DE, Mulligan MS, Krishnadasan B, Heagerty PJ, Symons RG, et al. Safety and efficacy of video-assisted versus conventional lung resection for cancer. J Thorac Cardiovasc Surg. 2009;137:1415-21. [ Links ]
49. Cattaneo SM, Park BJ, Wilton AS, Seshan VE, Bains MS, Downey RJ, et al. Use of video-assisted thoracic surgery for lobectomy in the elderly results in fewer complications. Ann Thorac Surg. 2008;85:231-6. [ Links ]
50. Ben-Nun A, Soudack M, Best LA. Videoassisted thoracoscopic surgery for recurrent spontaneous pneumothorax: The long- term benefit. World J Surg. 2006;30:285-90. [ Links ]
51. Cardillo G, Facciolo F, Giunti R, Gasparri R, Lopergolo M, Orsetti R, et al. Videothoracoscopic treatment of primary spontaneous pneumothorax: A 6-year experience. Ann Thorac Surg. 2000;69:357-62. [ Links ]
52. Griffo S. Tecniche videotoracoscopiche di induzione della pleurodesi. En: Lavini C, Ruggiero C, Morandi U, editors. Chirurgia toracica videoassistita. Milan: Springer; 2006. p. 113-24. [ Links ]
53. Trotter D, Aly A, Siu L, Knight S. Video-assisted thoracoscopic (VATS) pleurodesis for malignant effusion: An Australian teaching hospital's experience. Heart Lung Circ. 2005;14:93-7. [ Links ]
54. Kestenholz PB, Schneiter D, Hillinger S, Lardinois D, Weder W. Thoracoscopic treatment of pulmonary sequestration. Eur J Cardiothorac Surg. 2006;29:815-8. [ Links ]
55. Samphire J, Nafteux P, Luketich J. Minimally invasive techniques for resection of benign esophageal tumors. Semin Thorac Cardiovasc Surg. 2003;15:35-43. [ Links ]
56. Maher JW. Thoracoscopic esophagomyotomy for achalasia: Maximum gain, minimal pain. Surgery. 1997;122:836-40. [ Links ]
57. Braghetto I, Cardemil G, Burdiles P, Korn O, Ramírez C. Esofagectomía por cirugía mini-invasiva vía toracoscópica o laparoscópica: indicaciones y resultados. Rev Chil Cir. 2005;58:118-26. [ Links ]
58. Braghetto I, Csendes A, Cardemil G, Burdiles P, Korn O, Valladares H. Open transthoracic or transhiatal esophagectomy versus minimally invasive esophagectomy in terms of morbidity, mortality and survival. Surg Endosc. 2006;20:1681-6. [ Links ]
59. Palma JH, Gaia DF, Guilhen JC, Branco JN, Buffolo E. Video-thoracoscopic pericardial drainage in the treatment of pericardial effusions. Rev Bras Cir Cardiovasc. 2009;24:44-9. [ Links ]
60. Luh SP, Liu HP. Video-assisted thoracic surgery -the past, present status and the future. J Zhejiang Univ Sci B. 2006;7:118-28. [ Links ]
61. Takeo S, Tsukamoto S, Kawano D, Katsura M. Outcome of an original video-assisted thoracoscopic extended thymectomy for thymoma. Ann Thorac Surg. 2011;92:2000-5. [ Links ]
62. Stoica S, Walker W. Video assisted thoracoscopic surgery. Postgrad Med J. 2000;76:547-50. [ Links ]
63. Tölg C, Abelin K, Laudenbach V, de Heaulme O, Dorgeret S, Lipsyc ES, et al. Open Vs. thoracoscopic surgical management of bronchogenic cyst. Surg Endosc. 2005;19:77-80. [ Links ]
64. So T, Nakanishi R, Kohno H, Oe M, Yasumoto K. Video-assisted thoracoscopic pericardiectomy for severe pericardial effusions. J Cardiovasc Surg. 1999;40:311-2. [ Links ]
65. Son H, Cho J, Prak S, Sun K, Kim K, Lee S. Management of descending necrotizing mediastinitis using minimally invasive video-assisted thoracoscopic surgery. Surg Laparosc Endosc Percutan Tech. 2006;16:379-82. [ Links ]
66. Apiliogullari B, Esme H, Yoldas B, Durán M, Duzgun N, Calik M. Early and midterm results of single-port video-assisted thoracoscopic sympathectomy. Thorac Cardiovasc Surg. 2012;60:285-9. [ Links ]
67. Verma R, Pazmino P, Regan J. Thoracoscopic discectomy. En: Ozgur B, Benzel E, Garfin S, editors. Minimally invasive spinal surgery: A practical guide to anatomy and techniques. New York: Springer; 2009. p. 59-66. [ Links ]
68. Lucena JR, Coronel P, Orellana Y. Videotoracoscopia sus complicaciones. Rev Saber [online]. 2007;19:164-71.Fecha de consulta: 30 de mayo de 2012. Disponible en: http://ri.biblioteca.udo.edu.ve/handle/123456789/1317 [ Links ]
69. Carrasco LM, González RP, Peña NE, Batista R, Verdecía A. Comportamiento de la cirugía videotoracoscópica en pacientes atendidos en el Hospital Clínico Quirúrgico Lucia Iñiguez Landín. Corr Med Cient Holg. 2011;15:28-37. [ Links ]
70. Lewis RJ, Caccavale RJ, Sisler GE. Video-assisted thoracic surgery. En: Pearson FG, Deslauriers J, Ginsberg RJ, Hiebert CA, McKneally MF, Urschel HC Jr, editors. Thoracic surgery 1st edition. New York: Churchill Livingstone; 1995. p. 917-29. [ Links ]
71. Imperatori A, Rotolo N, Gatti M, Nardecchia E, De Monte L, Conti V, et al. Peri-operative complications of video-assisted thoracoscopic surgery (VATS). Int J Surg. 2008;6(Suppl.1):S78-81. [ Links ]
72. Cheng K, Barrera JC, Mederos ON, Valdés JM, Cantero A, Romero CA. Morbilidad y mortalidad en la cirugía de las bullas enfisematosas. Rev Cubana Cir. 2008;47(1). [ Links ]
73. Rocco G, La Rocca A, La Manna C, Scognamiglio F, D'Aiuto M, Jutley R, et al. Uniportal video-assisted thoracoscopic surgery pericardial window. J Thorac Cardiovasc Surg. 2006;131:921-2. [ Links ]
74. Rocco G. Single port video-assisted thoracic surgery (uniportal) in the routine general thoracic surgical practice. Op Tech Thorac Cardiovasc Surg. 2008;14:326-35. [ Links ]
75. Gigirey O, Berlanga L, Sánchez E. Single port thoracoscopic surgery using the SILS tool as a novel method in the surgical treatment of pneumothorax. Arch Bronconeumol. 2010;46:439-41. [ Links ]
76. Rocco G. One-port (uniportal) video-assisted thoracic surgical resections-A clear advance. J Thorac Cardiovasc Surg. 2012;144:S27-31. [ Links ]
77. Yamada K, Kato S. Robot-assisted thoracoscopic lung resection aimed at solo surgery for primary lung cancer. Gen Thorac Cardiovasc Surg. 2008;56:292-4. [ Links ]
78. Rücker JC, Swierzy M, Ismail M. Comparison of robotic and nonrobotic thoracoscopic thymectomy: A cohort study. J Thorac Cardiovasc Surg. 2011;141:673-7. [ Links ]
79. Martínez C. Robótica y cirugía laparoscópica. Cir Esp. 2006;80:189-94. [ Links ]
80. Palep JH. Robotic assisted minimally invasive surgery. J Minim Access Surg. 2009;5:1-7. [ Links ]
81. Kernstine KH. Robotics in thoracic surgery. Am J Surg. 2004;188(Suppl.4A):89S-97S. [ Links ]













