Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Cirugía
versão impressa ISSN 2011-7582
rev. colomb. cir. vol.28 no.3 Bogotá jul./set. 2013
1 Estudiante de Medicina, Universidad de los Andes, Bogotá, D.C., Colombia.
2 Médica internista y endocrinóloga, Hospital Universitario Fundación Santa Fe de Bogotá, Universidad de los Andes, Bogotá, D.C., Colombia.
Correspondencia: Deyanira González, MD., Correo electrónico: deyaniragonzalezdevia@yahoo.com; v.jeanneret59@uniandes.edu.co
Fecha de recibido: 11 de septiembre de 2012. Fecha de aprobación: 12 de junio de 2013.
Resumen
La cirrosis es un estado avanzado de fibrosis, consecuencia de la progresión de la enfermedad hepática crónica, que se caracteriza por destrucción de la arquitectura hepática y predispone al desarrollo de carcinoma hepatocelular. La cirrosis produce cambios metabólicos complejos que conducen al desarrollo de alteraciones en el metabolismo óseo, conocidas como osteodistrofia hepática.
En general, el deterioro de la masa y de la calidad ósea obedecen a factores múltiples, como son: las deficiencias nutricionales, el hipogonadismo, el uso de medicamentos, la deficiencia de vitamina D, la inflamación crónica y la gravedad de la enfermedad. La incidencia de osteoporosis es dos veces más alta en los pacientes con enfermedad hepática crónica, comparada con la de la población general. La tasa de fracturas vertebrales y no vertebrales se encuentra incrementada en la enfermedad hepática crónica, especialmente en mujeres posmenopáusicas. La disponibilidad de la densitometría ósea por absorciometría de rayos X de energía dual ha llevado a un aumento en el diagnóstico de osteoporosis y baja masa ósea en pacientes con enfermedad hepática. Por otra parte, la morfometría vertebral tiene un gran rendimiento para el diagnóstico de fracturas vertebrales asintomáticas.
Se hace una actualización de la literatura científica de la enfermedad ósea en casos de hepatopatía crónica y de las recomendaciones para el manejo de pacientes con cirrosis, enfocado en la salud ósea.
Palabras clave: cirrosis hepática; trasplante de hígado; osteodistrofia; osteoporosis; fractura.
Abstract
Cirrhosis is an advanced stage of fibrosis; it is a consequence of the progression of chronic liver disease, characterized by destruction of architecture and predisposes to the development of hepatocellular carcinoma. Cirrhosis cause complex metabolic changes that led to the development of alterations in bone metabolism known as hepatic osteodystrophy (HO). In general deterioration of bone mass and quality are due to multiple factors such as nutritional deficiencies, hypogonadism, use of medications, vitamin D deficiency, chronic inflammation and severity of the disease. The incidence of osteoporosis is twice as high in patients with chronic liver disease compared with the general population. The rates of vertebral and nonvertebral fractures are increased in chronic liver disease, especially in postmenopausal women. The availability of DXA bone densitometry (BMD-DXA) has led to an increase in the diagnosis of osteoporosis and low bone mass (LBM)in patients with liver disease. Moreover, vertebral morphometry (VMP) has a high diagnostic yield of asymptomatic vertebral fractures. This an update of the literature on bone disease in patient with chronic liver disease and recommendations for the management of patients with cirrhosis, focusing on bone health.
Key words: liver cirrhosis; liver transplantation; osteodystrophy; osteoporosis; fracture.
Introducción
Con el aumento de la supervivencia de los pacientes con cirrosis después del trasplante hepático, se ha encontrado que la osteoporosis y la presencia de fracturas son dos de las principales causas de morbilidad y de mortalidad en esta población 1. Se ha documentado una pérdida de masa ósea en pacientes con trasplantes en los primeros tres meses después de la cirugía 1,2 y la presencia de fracturas en el primer año tiene una prevalencia hasta del 33 % 3. Existen numerosos factores que determinan la magnitud de la pérdida de masa ósea; entre ellos, se ha encontrado que el más importante en el desarrollo de enfermedad ósea posterior al trasplante es la densidad mineral ósea antes de la cirugía. Asimismo, hay otros factores que contribuyen al desarrollo de alteraciones en el metabolismo óseo, como son el uso de glucocorticoides y otros inmunosupresores como la ciclosporina A y el tacrolimus, la inmovilidad y las deficiencias nutricionales 1,2,4. El índice de masa corporal antes del trasplante, la enfermedad colestásica hepática, el incremento en la edad, las enfermedades concomitantes como la diabetes mellitus de tipo 2 y el hipogonadismo, se correlacionan significativamente con el riesgo de fractura 5,6,7.
La fisiopatología de la enfermedad ósea en el paciente con cirrosis es multifactorial y está asociada a factores iatrogénicos como el uso de medicamentos y, también, a la osteodistrofia hepática preexistente. En múltiples estudios de corte transversal se ha demostrado una reducción de la masa ósea y alta prevalencia de osteoporosis en pacientes valorados para trasplante hepático.
En la literatura científica se reporta que la prevalencia de osteoporosis en pacientes con cirrosis varía entre el 12 y el 55 % 3. En cuanto a la prevalencia de fracturas en la enfermedad hepática crónica, oscila entre el 7 y el 35 % para las de cualquier característica y entre el 3 y el 44 % para las vertebrales 4,5. Las fracturas de cadera son infrecuentes debido a que la mayoría de pacientes con enfermedad hepática crónica no sobreviven hasta ser adultos mayores 6. La cirrosis aumenta en un factor de 2 el riesgo de presentar una fractura, además, la prevalencia de fracturas incrementa con la edad. Se ha encontrado una tasa de fracturas en pacientes posmenopáusicas con cirrosis del 67 %, en hombres, del 15% y en mujeres jóvenes, del 6 al 20 % 4. La presencia de fracturas vertebrales se relaciona con una baja densidad mineral ósea en la columna lumbar, con la seriedad de la disfunción hepática y con el hipogonadismo. Las fracturas periféricas se correlacionan con la presencia de cirrosis, el hipogonadismo y el consumo de alcohol 4.
En un estudio en el Hospital Universitario Fundación Santa Fe de Bogotá con sujetos valorados para trasplante hepático, se encontró que, independientemente de la causa de la cirrosis, tenían una gran pérdida de masa ósea; el 39 % tenía osteoporosis y el 37 %, baja masa ósea. El 15 % de los sujetos tenían fracturas radiológicas en el momento de la valoración. Los valores bajos de la densidad mineral ósea en la columna lumbar se correlacionaron con mayor prevalencia de fracturas a nivel dorso-lumbar; en nuestra población, no se encontró relación aparente entre la gravedad de la enfermedad hepática y la densidad mineral ósea o presencia de fracturas 8. Sin embargo, en la literatura científica se ha demostrado que los índices de gravedad de la enfermedad hepática y la cirrosis en estado avanzado se correlacionan con los resultados de osteoporosis y gran pérdida de masa ósea y, también, con la presencia de fracturas.
El estado óseo debe evaluarse rutinariamente en pacientes con enfermedad hepática grave. La creciente disponibilidad de la absorciometría de rayos X de energía dual para determinar la densidad mineral ósea, ha llevado a un aumento del diagnóstico de osteoporosis y baja masa ósea, en la enfermedad hepática. Se encontró relación entre la densidad mineral ósea y la presencia de fracturas vertebrales. La morfometría vertebral tiene un gran rendimiento para el diagnóstico de fracturas vertebrales asintomáticas 1.
Fisiopatología
La cirrosis se define como un estado avanzado de fibrosis hepática que se caracteriza por la pérdida de los hepatocitos, destrucción de la arquitectura hepática, proliferación de miofibroblastos hepáticos y aumento del depósito de matriz extracelular; estos fenómenos conllevan desintoxicación insuficiente, hipertensión portal, carcinoma hepatocelular, falla renal y pulmonar, y aumento de la mortalidad.
Un evento clave en la fibrosis hepática es la activación y proliferación de las células hepáticas estrelladas. Las células hepáticas quiescentes almacenan vitamina A y residen en el espacio subendotelial de Disse. La lesión hepática crónica conlleva la activación de estas células, las cuales se tornan contráctiles, producen componentes de matriz extracelular, y secretan citocinas y quimiocinas proinflamatorias tales como el factor beta transformador de crecimiento (Transforming Growth Factor beta, TGF-β) 1.
La activación de la célula hepática estrellada depende de las células de Kupffer, las células endoteliales, los hepatocitos y las plaquetas. El depósito de matriz extracelular es constantemente opuesto a la degradación de estas proteínas. En la fibrosis hepática progresiva, el balance se desvía hacia el depósito de matriz extracelular en exceso. Las metaloproteinasas de la matriz y sus reguladores (Tissue Inhibitors of Metalloproteinases, TIMP) controlan el depósito y la degradación de la matriz. En la fibrogénesis hepática, el TIMP-1 es producido por las células hepáticas estrelladas 2.
Múltiples situaciones pueden desencadenar la cirrosis, entre ellas, infecciones virales, consumo excesivo de alcohol, enfermedades de depósito y autoinmunitarias, otras enfermedades metabólicas y medicamentos.
Fragilidad ósea en el paciente con cirrosis
La cirrosis establecida se asocia con baja densidad ósea cuando se compara con enfermedad hepática no cirrótica. La duración de la enfermedad hepática no se correlaciona con la masa ósea; sin embargo, los estados cirróticos avanzados, clínicos e histológicos, presentan mayor deficiencia esquelética 9. En los pacientes cirróticos se ha visto una mayor reducción de la masa ósea en los estadios avanzados de enfermedad hepática, medidos en términos del puntaje de Child-Pugh 4.. En un estudio de la Clínica Mayo, se demostró que la gravedad de la enfermedad hepática contribuye significativamente a la pérdida de masa ósea 10, asimismo, en el estudio de Wiboux, et al., la densidad mineral ósea total de la cadera se correlacionó con el puntaje MELD (Model for End-Stage Liver Disease) y la albúmina sérica 11.
Como se mencionó anteriormente, la incidencia de osteoporosis es dos veces más alta en casos de enfermedad hepática crónica, en comparación con la población general 8. La tasa de fracturas vertebrales y no vertebrales se encuentra incrementada en la enfermedad hepática crónica, especialmente en mujeres posmenopáusicas.
Las fracturas periféricas se han relacionado con la cirrosis establecida, el hipogonadismo y el abuso de alcohol. La tasa de fracturas es baja en pacientes no cirróticos con eugonadismo 8. La tasa de incidencia de fracturas está menos caracterizada, pero la densidad mineral ósea en la columna lumbar parece ser un factor de riesgo para el incremento en la fractura vertebral 8.
En el estudio de Wiboux, et al., que incluyó 99 pacientes, se encontró que, por criterios de la Organización Mundial de la Salud (OMS), el 38 % tenía osteoporosis y el 35 %, baja masa ósea; el 48 % tenía historia previa de fracturas, y a 36 % se le documentó, al menos, una fractura radiológica en los cuerpos vertebrales (algunos presentaban hasta siete fracturas). La densidad mineral ósea en la columna lumbar, toda la cadera y el cuello femoral, se asoció con la presencia de fracturas vertebrales radiográficas. La densidad mineral ósea de toda la cadera fue un factor de riesgo independiente para la presencia de fracturas vertebrales radiológicas. Los sitios de fracturas clínicas por fragilidad más frecuentemente reportados, fueron: columna vertebral (10 %), pelvis (4 %), radio distal (27 %), costillas (21 %), fémur proximal (2 %), tobillo (10 %), tibia (15 %), codo (6 %) y huesos metatarsianos (4 %) 12.
Los marcadores de recambio óseo se pueden alterar en la enfermedad hepática avanzada. En el estudio de Wiboux, et al., todos los marcadores de recambio óseo se hallaron anormales. Los marcadores de resorción, como los puentes cruzados de colágeno sérico y el fragmento C-terminal de telopéptidos del procolágeno de tipo 1 (Carboxyterminal Telopeptide of Type I Collagen, ICTP), se correlacionaron con la densidad mineral ósea de la columna lumbar 11.
Otro factor que puede predisponer al desarrollo de osteoporosis en la enfermedad hepática, es la predisposición genética, determinada por polimorfismos del gen del receptor de la vitamina D o de la cadena α-1 del colágeno de tipo 1 13.
No está claramente establecido si el diagnóstico etiológico de cirrosis sea un factor asociado con la salud ósea. A continuación, se examina brevemente el papel que juega cada agente etiológico en el desarrollo de la osteodistrofia hepática.
Fisiopatología de la osteodistrofia hepática
La enfermedad hepática, y más precisamente la cirrosis, produce cambios metabólicos complejos que conducen al desarrollo de alteraciones óseas que se conocen como osteodistrofia hepática. Este fenómeno ha sido estudiado ampliamente y se ha demostrado que los marcadores de formación ósea están reducidos en la enfermedad hepática de larga data 4. La fisiopatología de la osteodistrofia hepática se basa en la deficiencia de factores de crecimiento sintetizados en el hígado, en la acumulación de tóxicos como el hierro y en la mala absorción del calcio por alteración de las microvellosidades intestinales 14.
En el estudio de Diamond, et al., se comparó la histomorfometría dinámica ósea en pacientes con cirrosis y sin ella. Se encontró que el volumen y el grosor de las trabéculas estaban significativamente reducidos (p<0,001, hombres, y p<0,01, mujeres), con hallazgos histológicos de osteoporosis en el 21 % de los sujetos con cirrosis y una disminución de la tasa de formación ósea del 57 %. Se concluyó que los pacientes con cirrosis tenían un defecto en la función osteoblástica, dada por disminución del grosor del osteoide, de la superficie osteoblástica y de la tasa de formación ósea 10.
Los cambios metabólicos complejos de la enfermedad hepática producen alteraciones en el metabolismo óseo; en general, el deterioro de la masa y de la calidad ósea obedecen a factores múltiples, como son: las deficiencias nutricionales, el hipogonadismo, el uso de medicamentos, la deficiencia de vitamina D, la inflamación crónica, la hiperbilirrubinemia y la gravedad de la enfermedad hepática (figura 1).
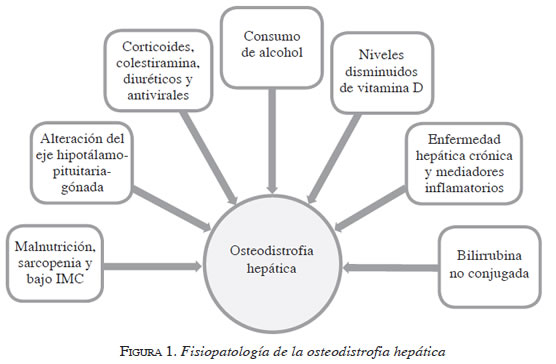

Al evaluar la densidad mineral ósea se puede encontrar acentuada heterogeneidad en la población de los pacientes con cirrosis, que oscila desde ningún efecto hasta el déficit notorio 9. Con variables como el índice de masa corporal, la historia de ingestión de corticoides, la edad y el sexo, se puede predecir la presencia de osteoporosis y de riesgos de fractura 10.
A continuación, se revisan algunos de los factores que condicionan el desarrollo de la osteodistrofia hepática.
Trastornos colestásicos
Los trastornos colestásicos, como la colangitis esclerosante primaria y la cirrosis biliar primaria, reducen la densidad mineral ósea en forma acelerada comparada con otras causas; sin embargo, la colestasis per se no difiere de otras alteraciones no colestásicas, en términos de osteoporosis y riesgos de fractura 8.
En la colangitis esclerosante primaria, el riesgo de fractura está relacionado con el aumento de la edad, la coexistencia de enfermedad intestinal inflamatoria y la enfermedad biliar avanzada 15.
Se ha encontrado una asociación más acentuada de la cirrosis biliar primaria, seguramente porque afecta mujeres posmenopáusicas de edad avanzada 10. El 43 % de las mujeres con cirrosis biliar primaria son osteoporóticas y hasta el 22 % tienen fracturas 7. Aquellas con cirrosis biliar primaria tienen cuatro veces más riesgo de osteoporosis y dos veces más riesgo de fracturas, cuando se comparan con controles 14. Se ha demostrado que la disminución de la formación ósea es el principal mecanismo de baja masa ósea, en esta forma de enfermedad hepática.
Hepatitis virales
La prevalencia de osteoporosis en la cirrosis secundaria a hepatitis viral crónica, es del 20 al 53 % 11. La cirrosis viral se ha asociado con reducción significativa de la proteína ósea Gla (Bone Gla Protein, BGP), de la hormona paratiroidea, de la testosterona en hombres de los niveles de 25-OH vitamina D, con aumento de la fosfatasa alcalina específica del hueso y el fragmento C-terminal de telopéptido del procolágeno de tipo 1 16,17.
Hemocromatosis
Se ha reconocido la presencia de osteoporosis en pacientes con cirrosis asociada a hemocromatosis. En un estudio se encontró que el riesgo de osteoporosis es influenciado por la presencia de cirrosis y por el grado de sobrecarga de hierro 18.
Sinigaglia, et al., demostraron que la enfermedad ósea es más común en sujetos con hipogonadismo 19 y que la enfermedad hepática crónica asociada a sobrecarga de hierro usualmente se acompaña de hipogonadismo 20.
Asimismo, se ha encontrado que la elevación de los niveles de hierro en otras enfermedades con sobrecarga de hierro, como la talasemia y la siderosis, están asociados a osteoporosis 21.
Deficiencia nutricional
Como se evidencia en el trabajo de Cabré y Gassul, las deficiencias nutricionales son comunes en la cirrosis y pueden asociarse a la osteodistrofia hepática 22. Asimismo, la pérdida de masa muscular y los bajos índices de masa corporal, asociados a la enfermedad crónica, se han visto involucrados en el desarrollo de anormalidades óseas. El estado nutricional se puede evaluar mediante la medición de los pliegues cutáneos y, la gravedad de la cirrosis, por medio de la clasificación de Child-Pugh 7.
Hipogonadismo
El hipogonadismo se encuentra presente hasta en el 75 % de los pacientes con cirrosis y se ha visto que juega un papel fundamental en el desarrollo de enfermedad ósea 18. El hipogonadismo de larga data en los hombres está asociado con aumento de la remodelación y reducción de la formación ósea, que es reversible con el reemplazo hormonal adecuado 7.
En mujeres con enfermedad hepática, se ha encontrado una pérdida mayor de masa ósea que en los controles sanos 8.
Medicamentos
Los medicamentos empleados para el tratamiento de la enfermedad hepática pueden tener efectos adversos en el metabolismo óseo, entre ellos, los glucocorticoides para la hepatitis autoinmunitaria, la colestiramina, los diuréticos y los antivirales (tabla 1).

Glucocorticoides
Múltiples enfermedades crónicas requieren el uso de glucocorticoides a largo plazo como tratamiento de base, incluyendo alteraciones hepáticas, gastrointestinales, reumatológicas, renales y pulmonares, como, también, la supresión del rechazo en el trasplante de órganos.
Los glucocorticoides tienen efectos adversos sobre el metabolismo óseo, ampliamente estudiados: promueven la hipocalcemia y la pérdida de calcio corporal por reducción en la absorción intestinal de calcio, debido a que interfieren con la acción de la 1,25-dihidroxi-vitamina D. Asimismo, incrementan la excreción del calcio, induciendo hiperparatiroidismo secundario y, como consecuencia, generan un aumento en la resorción ósea osteoclástica mediante la producción de interleucina 1 (IL-1). La administración de prednisolona disminuye en 30 % el valor basal de la absorción intestinal al día catorce, e incrementa el valor de la excreción renal de calcio hasta dos veces después de cinco días de medicación; este efecto es independiente de la vitamina D y sus metabolitos activos 23,24.
Los glucocorticoides tienen efectos nocivos directos sobre el metabolismo óseo por reducción en la formación de hueso, disminuyendo la función, replicación y diferenciación del osteoblasto e incrementando su apoptosis. La mayor tasa de pérdida de hueso se da en los primeros seis meses de uso, con un promedio de disminución del 5 % durante el primer año de tratamiento. Posteriormente, se presenta una pérdida de masa ósea de 1 a 2 % anual. El hueso trabecular, incluyendo el del fémur proximal y el borde cortical de los cuerpos vertebrales, es el más sensible al efecto deletéreo de los glucocorticoides, comparado con el de la corteza de los huesos largos. De este modo, la columna lumbar y el fémur proximal son particularmente vulnerables a la pérdida ósea relacionada con las fracturas por glucocorticoides Los pacientes jóvenes que reciben glucocorticoides en forma crónica pierden masa ósea más rápidamente que los mayores25; sin embargo, la mujer posmenopáusica con glucocorticoides a dosis equivalentes tiene mayor riesgo de fractura, posiblemente porque se aumenta la pérdida ósea. Los efectos esqueléticos de los glucocorticoides son similares en ambos sexos y, de igual manera, en las razas negra y blanca 26.
El uso de glucocorticoides orales a largo plazo incrementa el riesgo de fractura de cadera y de vértebras. La incidencia de fractura asociada a pérdida ósea por glucocorticoides se estima entre 1,3 y 2,6 veces más en la población que recibe glucocorticoides, comparada con la que no los reciben. De 30 a 50 % de los pacientes que reciben glucocorticoides a largo plazo, desarrollan fracturas. El riesgo de fractura de cadera se duplica y el de fractura vertebral se incrementa, al menos, tres veces, en comparación con los pacientes que no reciben glucocorticoides. El riesgo de fracturas se relaciona principalmente con dos factores: el tiempo del uso del medicamento y la dosis recibida; ingerir glucocorticoides por un año consecutivo, incrementa el riesgo de fractura vertebral hasta 5,9 veces y, de cadera, hasta 5,0 veces 12.
Los glucocorticoides conllevan catabolismo sistémico y tienen múltiples efectos secundarios. La prevalencia de eventos adversos es proporcional a la dosis. La dosis oral de prednisona igual o mayor de 7,5 mg al día, produce importantes efectos osteoporóticos 27. Sin embargo, las dosis intermitentes o inferiores a 5 mg al día de prednisona o su equivalente, pueden conferir riesgo incrementado de osteoporosis 28. Los efectos adversos no se reducen al administrar la prednisona en días alternos 29.
Los glucocorticoides inhiben la liberación de factores de crecimiento celular como FCI-1 y TGF-β. La transcripción de los genes de osteoblastos, incluyendo los de colágeno de tipo I y osteocalcina, esta disminuida 30. Los glucocorticoides producen atrofia muscular que conlleva una reducción en la fuerza del estímulo mecánico requerido para desencadenar la formación de hueso nuevo 31,32.
Los glucocorticoides promueven indirectamente la pérdida ósea mediante la inhibición de la liberación de gonadotrofinas, produciendo hipogonadismo secundario 33.
Los pacientes tratados con glucocorticoides tienen factores adicionales de riesgos independientes que conllevan la pérdida de masa ósea y fracturas; entre ellos, está la enfermedad primaria de base, particularmente las alteraciones inflamatorias y autoinmunitarias que causan detrimento del metabolismo óseo independientemente del tratamiento con glucocorticoides.
Colestiramina
Impide la unión de los ácidos grasos y, de esta manera, reduce la absorción gastrointestinal de 25-hidroxi-vitamina D. Además, la precipitación de las sales de calcio en el intestino, por la presencia de grasas no absorbidas, puede contribuir a la mala absorción del calcio.
Diuréticos
El uso de diuréticos es común en los pacientes con enfermedad hepática avanzada. Los diuréticos de asa promueven la pérdida renal de calcio y, en una cohorte de 8.127 mujeres mayores de 65 años seguidas por más de cuatro años, se asociaron con una pérdida pequeña de masa ósea en la cadera; en este estudio no hubo asociación con fractura 34. En una cohorte del Women's Health Initiative (WHI) de 133.855 mujeres seguidas por más de siete años, se halló que el uso prolongado de diuréticos se asociaba con mayores riesgos de fractura en las posmenopáusicas, pero no se asociaba con alteraciones de la masa ósea o caídas 35. En un estudio de 3.269 hombres mayores de 65 años seguidos por más de cuatro años, se halló un incremento de la pérdida de masa ósea 36.
La espironolactona es un diurético antiandrógeno que no tiene estudios de asociación con osteoporosis y sus resultados, pero, por su efecto antiandrogénico podría contribuir al deterioro óseo.
Antivirales
Un estudio de corte transversal sugiere que la ribavirina puede inducir pérdida de masa ósea en pacientes con hepatitis crónica (Z score 1,5 veces disminuido, comparado con pacientes no tratados con ribavirina) 37, pero el mecanismo de este efecto no se ha determinado claramente y ha sido refutado por otro estudio longitudinal 38.
Consumo de alcohol
Los pacientes con cirrosis alcohólica tienen un patrón de bajo recambio óseo. En un estudio de 56 hombres alcohólicos, se demostró que 32 % tenía disminución de los niveles de 25-hidroxi-vitamina D y de la densidad mineral ósea 39. La ingestión excesiva de alcohol puede llevar a un desequilibrio entre la formación y la resorción ósea, que favorece el desarrollo de osteopenia. Asimismo, el consumo de alcohol es un factor de riesgo independiente para la osteoporosis y, además, incrementa el riesgo de fractura de cadera en 2,8 veces 7.
Deficiencia de vitamina D
En la literatura científica se reporta que los niveles de vitamina D están disminuidos en dos tercios de los pacientes con cirrosis y en 96 % de los que se encuentran en espera de trasplante hepático 40. En el estudio de Wiboux, et al., se reportó 88 % de prevalencia de insuficiencia y deficiencia de vitamina D 1.
El hígado tiene un papel esencial en el metabolismo de la vitamina D. Se encarga de la secreción de las sales biliares, la absorción de la vitamina D3 de la dieta y la 25-hidroxilación de la vitamina D 41. En casos de enfermedad hepática, la colestasis y ciertos medicamentos –incluyendo los glucocorticoides–, alteran la captación y el metabolismo de la vitamina D 42.
La osteomalacia es infrecuente en los pacientes con cirrosis 10; sin embargo, la hipovitaminosis D se encuentra asociada con reducción de la densidad mineral ósea, bajo recambio óseo y aumento del riesgo de fracturas que ocurre en estos casos 41.
Inflamación crónica
El proceso inflamatorio crónico, la alteración del flujo sanguíneo hepático, la activación de células estrelladas y la pérdida de la función sintética, son algunas de las consecuencias de la cirrosis que se encuentran relacionadas con las alteraciones metabólicas óseas (figura 3).
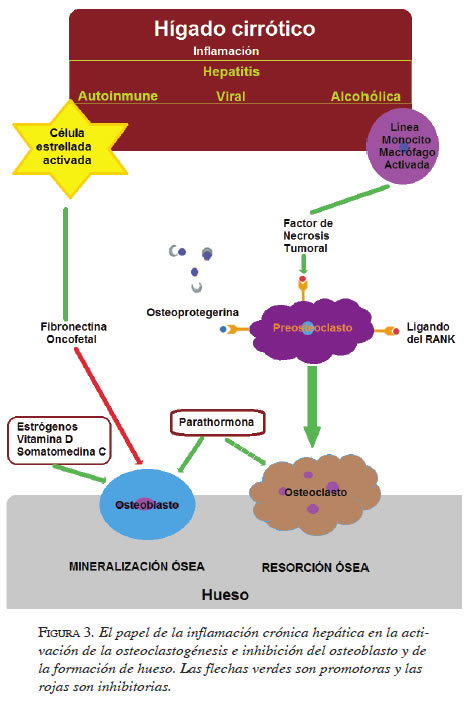
El FCI-1 juega un papel importante en la remodelación ósea y el mantenimiento de la masa ósea. Sin embargo, se encuentra disminuido en la enfermedad hepática avanzada, de manera proporcional a su gravedad. Se ha demostrado que el reemplazo de FCI-1 en ratas es efectivo para la prevención e, incluso, la reversión parcial de la osteoporosis 19.
La leptina, producida por las células adiposas, tiene acción periférica para el control de la masa ósea mediante el aumento de la proliferación osteoblástica, la síntesis de matriz ósea y la supresión de la producción de RANK-L y, por lo tanto, disminuye la resorción ósea. Esta molécula se encuentra disminuida en algunas formas de enfermedad hepática, especialmente las colestásicas 19.
Las citocinas proinflamatorias, como el FNT y la IL-1, e incrementan la actividad de osteoclastos por activación de sus precursores. Estos se encuentran aumentados, principalmente en las hepatitis virales y en la cirrosis inducida por alcohol 19.
Conclusión
En la osteodistrofia hepática, el deterioro de la masa ósea es complejo y se debe a factores relacionados con la enfermedad en sí, complicaciones nutricionales y medicamentos. Aún no se ha evaluado la carga genética individual en esta enfermedad. Existen múltiples factores de riesgo que podemos contrarrestar con el abordaje integral en la atención médica.
Recomendaciones
Entre las medidas preventivas para detener y evitar la pérdida de la densidad mineral ósea y la aparición de osteoporosis con sus fracturas, se encuentran la tamización y el diagnóstico, la disminución de los factores de riesgo y el tratamiento activo.
- Al paciente con cirrosis se le debe practicar una absorciometría de rayos X de energía dual para evaluar la densidad mineral ósea.
- Se debe ordenar medición en suero de la 25-hidroxi-vitamina D, y los niveles de calcio y fósforo.
- Hay que incentivar el ejercicio y las medidas para prevenir fracturas.
- Se deben corregir los factores de riesgo modificables, como el consumo de alcohol, el bajo índice de masa corporal, el consumo de tabaco, el sedentarismo, el riesgo de caídas, etc.
- Hay que corregir los defectos de calcio y vitamina D en los pacientes que presenten alteraciones.
- Se deben tratar la osteoporosis y el deterioro de la masa ósea, según las recomendaciones actuales para el manejo de osteoporosis.
Referencias
1. Crosbie OM, Freaney R, McKenna MJ, Curry MP, Hegarty JE. Predicting bone loss following orthotopic liver transplantation. Gut 1999;44:430-4. [ Links ]
2. Monegal A, Navasa M, Guañabens N, Peris P, Pons F, Martínez MJ, et al. Bone disease after liver transplantation: A long-term prospective study of bone mass changes, hormonal status and histomorphometric characteristics. Osteoporosis Int. 2001;12:484-92. [ Links ]
3. Leidig-Bruckner G, Hosch S, Dodidou P, Ritschel D, Conradt C, Klose C, et al. Frequency and predictors of osteoporotic fractures after cardiac or liver transplantation: A follow-up study. Lancet. 2001;357:342-7. [ Links ]
4. Leslie WD, Bernstein CN, Leboff MS; American Gastroenterological Association Clinical Practice Commitee. AGA technical review on osteoporosis in hepatic disorders. Gastroenterology. 2003;125:941-66. [ Links ]
5. Millonig G, Graziadei IW, Eichler D, Pfeiffer KP, Finkenstedt G, Muehllechner P, et al. Alendronate in combination with calcium and vitamin D prevent bone loss after orthoptic liver transplantation: A prospective single-center study. Liver Transpl. 2005;11:960-6. [ Links ]
6. Ninkovic M, Love SA, Tom B, Alexander GJ, Compston JE. High prevalence of osteoporosis in patients with chronic liver disease prior to liver transplantation. Calcif Tissue Int. 2001;69:321-6. [ Links ]
7. García HD, Córdoba N, Marín JI, Restrepo JC. Osteoporosis en pacientes con hepatopatías crónicas: una complicación tardía poco conocida. Rev Colomb Gastroenterol. 2011;26:292-302. [ Links ]
8. Jeanneret V, Abril D, Vera A, Romero J, González D. Osteoporosis pretransplante hepático en la FSFB. Primer Congreso Multidisciplinario sobre Manejo de Osteoporosis. Fundación Santa Fe de Bogotá, Bogotá, D.C., 30 de septiembre de 2011. [ Links ]
9. Janes CH, Dickson ER, Okazaki R, Bonde S, McDonagh AF, Riggs BL. Role of hyperbilirubinemia in the impairment of osteoblast proliferation associated with cholestatic jaundice. J Clin Invest. 1995;95:2581-6. [ Links ]
10. Guañabens N, Parés A. Liver and bone. Arch Biochem Biophys. 2010;503:84-94. [ Links ]
11. American Gastroenterological Association Medical Position Statement: Osteoporosis in hepatic disorders. Gastroenterology. 2003;125:937-40. [ Links ]
12. Luxon B. Bone disorders in chronic liver diseases. Curr Gastroenterol Rep. 2011;13:40-8. [ Links ]
13. Mendoza-Delgado SA, Velbes-Marquetti PE, Astencio-Rodríguez G, Suárez-Navarro E, Santana-Porbén S. La enfermedad metabólica ósea en la cirrosis hepática: la influencia del estado nutricional. Rev Gastroenterol Méx. 2011;76:97-107. [ Links ]
14. Negri AL, Plantalech LC, Russo MF, Otero A, Sarli M. Osteoporosis postrasplante. Medicina (Buenos Aires). 1999;59:777-86. [ Links ]
15. Guañabens N, Parés A, Ros I, Caballería L, Pons F, Vidal S, et al. Severity of cholestasis and advanced histological stage but not menopausal status are the major risk factors for osteoporosis in primary biliary cirrhosis. J Hepatol. 2005;42:573-7. [ Links ]
16. Corazza GR, Trevisani F, Di Stefano M, De Notariis S, Veneto G, Cecchetti L, et al. Early increase of bone resorption in patients with liver cirrhosis secondary to viral hepatitis. Dig Dis Sci. 2000;45:1392-9. [ Links ]
17. Tsuneoka K, Tameda Y, Takase K, Nakano T. Osteodystrophy in patients with chronic hepatitis and liver cirrhosis. J Gastroenterol. 1996;31:669-78. [ Links ]
18. Sinigaglia L, Fargion S, Fracanzani AL, Binelli L, Battafarano N, Varenna M, et al. Bone and joint involvement in genetic hemochromatosis: Role of cirrhosis and iron overload. J Rheumatol. 1997;24:1809-13. [ Links ]
19. Kaymakoglu S, Okten A, Cakaloglu Y, Boztaº G, Beºiºik F, Taºçioglu C, et al. Hypogonadism is not related to the etiology of liver cirrhosis. J Gastroenterol. 1995;30:745-50. [ Links ]
20. Diamond T, Stiel D, Posen S. Osteoporosis in hemochromatosis: Iron excess, gonadal deficiency, or other factors? Ann Intern Med. 1989;110:430-6. [ Links ]
21. Voskaridou E, Terpos E. New insights into the pathophysiology and management of osteoporosis in patients with beta thalassaemia. Br J Haematol. 2004;127:127-39. [ Links ]
22. Cabre E, Gassull MA. Nutritional and metabolic issues in cirrhosis and liver transplantation. Curr Opin Clin Nutr Metab Care. 2000;3:345-54. [ Links ]
23. Yurgaky JM, Arredondo AM. Osteoporosis asociada a glucocorticoides, una aproximación práctica. Rev Fac Med. 2010;18:210-20. [ Links ]
24. Boling EP. Secondary osteoporosis: Underlying disease and the risk for glucocorticoid-induced osteoporosis. Clin Ther. 2004;26:1-14. [ Links ]
25. Lukert BP, Raisz LG. Glucocorticoid-induced osteoporosis: Pathogenesis and management. Ann Intern Med. 1990;112:352-64. [ Links ]
26. Defranco DJ, Lian JB, Glowacki J. Differential effects of glucocorticoid on recruitment and activity of osteoclasts induced by normal and osteocalcin-deficient bone implanted in rats. Endocrinology. 1992;131:114-21. [ Links ]
27. van Staa TP, Leufkens HG, Abenhaim L, Zhang B, Cooper C. Oral corticosteroids and fracture risk: Relationship to daily and cumulative doses. Rheumatology (Oxford). 2000;39:1383-9. [ Links ]
28. van Staa TP, Leufkens HG, Abenhaim L, Zhang B, Cooper C. Use of oral corticosteroids and risk of fractures. J Bone Miner Res. 2000;15:993-1000. [ Links ]
29 . Ruegsegger P, Medici TC, Anliker M. Corticosteroid induced bone loss. A longitudinal study of alternate day therapy in patients with bronchial asthma using quantitative computed tomography. Eur J Clin Pharrnacol. 1983;25:615-20. [ Links ]
30. Baxter JD. Advances in glucocorticoid therapy. Adv Intern Med. 2000;45:317-49. [ Links ]
31. Cunnane G, Lane NE. Steroid-induced osteoporosis in systemic lupus erythematosus. Rheum Dis Clin North Am. 2000;26:311-29. [ Links ]
32. Goldstein MF, Fallon JJ Jr, Harning R. Chronic glucocorticoid therapy-induced osteoporosis in patients with obstructive lung disease. Chest. 1999;116:1733-49. [ Links ]
33. Vleggaar FP, van Buuren HR, Wolfhagen FHJ, Schalm SW, Pols HA. Prevention and treatment of osteoporosis in primary biliary cirrhosis. Eur J Gastroenterol Hepatol. 1999;11:617-21. [ Links ]
34. Lim LS, Fink HA, Blackwell T, Taylor BC, Ensrud KE. Loop diuretic use and rates of hip bone loss, and risk of falls and fractures in older women. J Am Geriatr Soc. 2009;57:855-62. [ Links ]
35. Carbone LC, Johnson KC, Bush AJ, Robbins J, Larson JC, Thomas A, et al. Loop diuretic use and fracture in postmenopausal women. Findings from the Women's Health Initiative. Arch Intern Med. 2009;169:132-40. [ Links ]
36. Lim LS, Fink HA, Kuskowski MA, Taylor BC, Schousboe JT, Ensrud KE, et al. Loop diuretic use and increased rates of hip bone loss in older men: The osteoporotic fractures in men study. Arch Intern Med. 2008;168:735-40. [ Links ]
37. Solis-Herruzo JA, Castellano G, Fernández I, Muñoz R, Hawkins F. Decreased bone mineral density after therapy with alpha interferon in combination with ribavirin for chronic hepatitis C. J Hepatol. 2000;33:812-7. [ Links ]
38. Trombetti A, Giostra E, Mentha G, Negro F, Rizzoli R. Lack of evidence for ribavirin-induced bone loss. Hepatology. 2002;36:255-7. [ Links ]
39. Mobarhan SA, Russell RM, Recker RR, Posner DB, Iber FL, Miller P. Metabolic bone disease in alcoholic cirrhosis: A comparison of the effect of vitamin D2, 25-hydroxyvitamin D, or supportive treatment. Hepatology. 1984;4:266-73. [ Links ]
40. Crawford BA, Labio ED, Strasser SI, McGaughan GW. Vitamin D replacement for cirrhosis-related bone disease. Nat Clin Pract Gastroenterol Hepatol. 2006;3:689-99. [ Links ]
41. Arnaud SB. 25-hydroxyvitamin D3 treatment of bone disease in primary biliary cirrhosis. Gastroenterology. 1982;83:137-40. [ Links ]
42. Wolfhagen FH, van Buuren HR, Vleggaar FP, Schalm SW. Management of osteoporosis in primary biliary cirrhosis. Baillieres Best Pratt Res Clin Gastroenterol. 2000;14:629-41. [ Links ]













