Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582
rev. colomb. cir. vol.29 no.2 Bogotá Apr./June 2014
1 Médico, cirujano de cabeza y cuello, Fundación Cardioinfantil-Instituto de Cardiología; profesor asistente, Universidad del Rosario; profesor clínico principal, Universidad de La Sabana, Bogotá, D.C., Colombia.
2 Médica, especialista en Medicina Nuclear, Fundación Cardioinfantil-Instituto de Cardiología; profesora asistente, Universidad del Rosario; profesora clínica principal, Universidad de La Sabana, Bogotá, D.C., Colombia.
3 Médico endocrinólogo, Fundación Cardioinfantil-Instituto de Cardiología; profesor asistente, Universidad del Rosario; profesor clínico principal, Universidad de La Sabana, Bogotá, D.C., Colombia.
4 Estadístico, Ph.D., Escuela de Estadística, Universidad del Valle, Cali, Colombia.
Correspondencia: Gabriel Sánchez, MD. Bogotá, D.C., Colombia. Correo electrónico: gsanchez@cardioinfantil.org y gsanchez64@etb.net.co
Fecha de recibido: 5 de mayo de 2014. Fecha de aprobación: 27 de mayo de 2014.
Resumen
Introducción. La falta de una clasificación preoperatoria confiable para determinar el riesgo de recaída en cáncer diferenciado de tiroides, nos motivó a explorar factores que pudieran ofrecer algunos indicios para plantear hipótesis que explicaran las diferencias entre el comportamiento de nuestros casos y lo reportado en la literatura científica.
Materiales y métodos. Se llevó a cabo un estudio descriptivo del tipo serie de casos, tomando la información registrada en la historia clínica de individuos con carcinoma de tiroides, tratados por el grupo de especialistas de Cirugía de Cabeza y Cuello, Medicina Nuclear, Endocrinología y Patología de una clínica especializada con nivel IV de atención de Bogotá, Colombia, en el período comprendido entre enero de 1997 y diciembre de 2012.
Resultados. Se obtuvieron 501 registros de cáncer de tiroides, de los cuales, 469 (93,6 %) correspondían a carcinoma diferenciado. La distribución por sexo fue predominantemente femenina, 418 (83,4 %). Se observó asociación significativa entre recidiva y siete factores histopatológicos. La mediana para el tiempo de seguimiento fue de 38 meses (rango, 1 a 312). Se documentó recidiva tumoral en 59 pacientes (12,6 %) con una mediana para el tiempo libre de recaída de 31 meses (rango, 7 a 288). La supervivencia observada a 5 y 10 años fue de 97,4 % y 96,8 %, respectivamente.
Discusión. La presencia de factores histopatológicos, la falta de una clasificación preoperatoria para establecer el riesgo de recaída, de mortalidad o de ambos, y el deficiente sistema de salud que no permite un adecuado seguimiento de los pacientes, pueden ser razones suficientes para justificar una citorreducción quirúrgica agresiva como tratamiento inicial del carcinoma diferenciado de tiroides.
Palabras clave: neoplasias de la tiroides; carcinoma papilar; adenocarcinoma folicular; tiroidectomía; factores de riesgo.
Abstract
Introduction. The lack of a reliable preoperative classification system for determining the risk of a recurrence in differentiated thyroid cancer that has low mortality led us to conduct a descriptive study in order to identify histological, surgical and complementary therapeutic factors that could be used to generate hypotheses that could explain the differences between the results of our cases and what is reported in the literature.
Materials and Methods. A descriptive study of the case series type was conducted, using information recorded in the medical records of individuals with a thyroid carcinoma treated by the group of specialists in head and neck surgery, nuclear medicine, endocrinology and pathology at a Level IV specialized clinic, in the city of Bogotá D.C., Colombia, Fundación Cardioinfantil, Instituto de Cardiología, from January 1997, through December 2012.
Results. There were 501 cases of thyroid cancer, of which 469 (93.6%) corresponded to DTC. Gender distribution was predominantly feminine: 418 (83.4%). Subtotal thyroidectomy was carried out on 61 patients (13%), total thyroidectomy on 58 patients (12.4%). Seven histopathological factors were significant. Tumor recurrence was documented in 59 patients (12.6%) with a median recurrence-free time of 31 months (range 7-288). Survival observed at 5 and 10 years was 97.4% and 96.8%, respectively.
Discussion. In according with our findings, tumors larger than 2cm, the high percentage of PTC aggressive histological variants, multicentricity, bilaterality, metastatic lymph nodes in the upper-anterior mediastenum, the lack of a reliable preoperative classification for establishing the risk of recurrence and/or mortality and our deficient health system that does not allow proper follow-up, constitute enough reasons for performing an aggressive surgical approach as the first line of treatment in differentiated thyroid cancer.
Key words: thyroid neoplasms; carcinoma, papillary; adenocarcinoma, follicular; thyroidectomy; risk factors.
Introducción
La glándula tiroidea está compuesta por células foliculares y parafoliculares envueltas en tejido conjuntivo. Las primeras se encargan de captar el yodo, y producir tiroglobulina y hormonas tiroideas (T3 y T4). Todas estas actividades son inducidas por la hormona estimulante de la glándula tiroidea, tirotropina (TSH), producida en la adenohipófisis y que, a su vez, es estimulada por la hormona liberadora de TSH, tiroliberina (TRH), producida en el hipotálamo. Las hormonas tiroideas hacen una retroalimentación negativa al hipotálamo y a la hipófisis que mantiene la homeostasis. Además, la TSH estimula la replicación de las células foliculares. Las células de Hürthle, también llamadas células oxifílicas u oncocíticas, hacen parte de las foliculares, pero con la característica de que no captan yodo y no producen tiroglobulina.
Las células parafoliculares (células C o células claras) producen calcitonina y se localizan en la periferia de los folículos. El tumor maligno originado en estas células se llama carcinoma medular. Su marcador tumoral específico es la calcitonina.
El carcinoma diferenciado de tiroides hace referencia a los tumores malignos de la glándula tiroidea originados en las células foliculares. Pertenecen a este grupo el carcinoma papilar, el folicular y el de células de Hürthle. Dado que el el carcinoma papilar y el folicular responden al estímulo de la TSH, han sido llamados tumores hormono-dependientes. Con este mismo criterio, el reemplazo hormonal posquirúrgico ha sido llamado "supresivo" –para diferenciarlo del tratamiento de suplemento–, cuya intención es dar una dosis de levotiroxina suficiente para mantener la TSH alrededor de 0,01 mU/L con una T4 libre (T4L) dentro de rangos normales (de 0,7 a 1,6 ng/dl). En ausencia de tejido tiroideo y de autoinmunidad, la tiroglobulina se convierte en su marcador tumoral 1-3. Cuando los anticuerpos antitiroglobulina son positivos, también se deben medir durante el seguimiento, como marcador tumoral, dado que pueden ser responsables de que la tiroglobulina sea reportada falsamente como negativa 4.
La propiedad de las células foliculares de captar yodo es utilizada para la ablación del tejido tiroideo residual o recidivante, tumoral o no tumoral, con yodo radioativo, I-131.
Según diferentes publicaciones, el carcinoma diferenciado de tiroides constituye entre el 85 y el 90 % de los casos de tumores malignos de la glándula, y entre estos, el carcinoma diferenciado de tiroides con sus variantes clásica y folicular representan del 80 al 90 % 5-11. Sin embargo, existen 10 % de variantes con patrón histológico agresivo, que son el de célula alta, cilíndrica, sólido y esclerosante difuso 12-14. Sakamoto, et al. 15, describieron en 1983 el "carcinoma de tiroides pobremente diferenciado" para referirse a un tumor en estado intermedio de progresión entre el carcinoma diferenciado de tiroides y el carcinoma anaplásico.
El presente trabajo tuvo como objetivo mostrar la experiencia de un grupo multidisciplinario en el manejo del carcinoma diferenciado de tiroides, las diferencias y variaciones en los grupos histológicos asociados a la población tratada en la institución, en su mayoría compuesta por individuos colombianos de estrato socioeconómico medio o bajo, y contar con evidencia propia que permita argumentar sobre la necesidad de adaptar las múltiples guías de manejo de esta neoplasia al complejo sistema de salud colombiano.
Materiales y métodos
Se hizo un estudio descriptivo del tipo serie de casos, tomando la información registrada en la historia clínica de individuos con carcinoma de tiroides, tratados por el grupo de especialistas de Cirugía de Cabeza y Cuello, Medicina Nuclear, Endocrinología y Patología de una clínica especializada de nivel IV de Bogotá, la Fundación Cardioinfantil Instituto de Cardiología, en el período comprendido entre enero de 1997 y diciembre de 2012.
Se revisaron 860 historias clínicas de pacientes con carcinoma de tiroides atendidos en el Servicio de Cabeza y Cuello, de las cuales, 501 cumplían con el criterio de diagnóstico, manejo quirúrgico, estudio histopatológico y seguimiento en la institución. La información se consignó en un formulario prediseñado donde se incluyeron algunas variables demográficas, variables citológicas (BACAF), anatomo-patológicas (biopsia por congelación, tipo de tumor, subtipo histológico del carcinoma diferenciado de tiroides, grado de diferenciación del carcinoma diferenciado de tiroides, tamaño, múltiples centros, bilateralidad, invasión capsular, invasión linfovascular, invasión a tejido peritiroideo, glándula tiroidea no tumoral, presencia de glándulas paratiroideas, ganglios del vaciamiento central y ganglios cervicales), tipo de cirugía practicada, complicaciones posoperatorias, tratamiento ablativo recibido, recurrencia y supervivencia.
Se consideró que existía hipocalcemia permanente en aquellos pacientes que presentaban niveles bajos de calcio sérico y necesidad de suplemento de carbonato de calcio de más de 600 mg diarios para controlar los síntomas, por un período superior a los seis meses. La lesión del nervio laríngeo recurrente se estableció por consignación expresa en la descripción quirúrgica, disfonía posoperatoria, laringoscopia indirecta y flexible. La variable 'tiempo libre de recaída' se midió desde el manejo quirúrgico completo hasta la fecha de confirmación histológica de la recidiva.
El tratamiento ablativo con I-131 se administró a aquellos pacientes con más de dos factores anatomo-patológicos presentes, de los mencionados anteriormente.
El análisis estadístico de los datos comprendió el cálculo de proporciones en el caso de las variables cualitativas, y estadísticas descriptivas para las variables cuantitativas. En vista de que se contaba con un tamaño de muestra lo suficientemente grande como para hacer aproximaciones asintóticas, se evaluaron las relaciones entre variables utilizando la prueba de ji al cuadrado y se asumió que un valor de p menor de 0,05 permitía tener suficiente evidencia para rechazar la hipótesis de independencia.
Resultados
De los 501 casos de cáncer de tiroides, 469 (93,6 %) correspondían a carcinoma diferenciado de tiroides (tabla 1). Según la distribución por sexo, se observó predominio de las mujeres (418, 83,4 %). La mediana para la edad de presentación de la enfermedad fue de 47 años (rango, 3 a 93 años).

El principal elemento diagnóstico fue la citología por aspiración. Sin embargo, en 31 pacientes el diagnóstico se obtuvo por biopsias o procedimientos en otros sitios: 22 en ganglios metastásicos, cuatro en quiste del conducto tirogloso, uno en pulmón, uno en esófago, uno por fractura patológica de cadera y dos por lesiones osteolíticas vertebrales. Llama la atención que de los 22 pacientes con diagnóstico en ganglios, 7 (31,8 %) presentaban microcarcinomas de la glándula tiroidea (tumores menores de 1 cm) y en todos se observaron ganglios metastásicos al practicar el vaciamiento central. Por otra parte, los cuatro pacientes con diagnóstico de carcinoma diferenciado de tiroides en quiste del conducto tirogloso, se sometieron a tiroidectomía oncológica y en todos se observaron focos de carcinoma diferenciado en la glándula.
El manejo quirúrgico inicial fue predominantemente la "tiroidectomía oncológica" (tiroidectomía total más vaciamiento del mediastino antero-superior o central), con vaciamiento unilateral o bilateral de cuello, en los casos en que se documentó enfermedad metastásica regional (85 pacientes, 18,1 %) (tabla 2). Además, en 13 pacientes la citorreducción quirúrgica incluyó cuatro vaciamientos de mediastino por esternotomía limitada, dos resecciones traqueales con anastomosis, dos traqueoplastias, dos faringoplastias, dos esofagorrafias y una esofagectomía con ascenso gástrico. En 150 de los casos se practicó biopsia por congelación intraoperatoria, la cual fue conclusiva de proceso maligno en 134 (89,4 %).
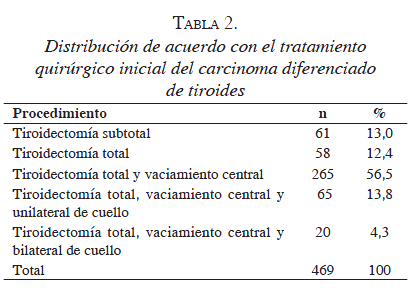
Al evaluar la información de los individuos con tiroidectomía subtotal (n=61) se encontró que a 37 (61 %) se les completó la tiroidectomía oncológica, al encontrar tumor del lado opuesto en 19 (31,1 %) y ganglios metastásicos en el vaciamiento central en 15 (24,6 %). En siete personas también se hizo vaciamiento de cuello por compromiso regional. De los 24 pacientes a quienes no se les completó la tiroidectomía, 18 (29,5 %) permanecen sin evidencia de recidiva, 5 (8,2 %) se perdieron del seguimiento y 1 (1,6 %) presentó metástasis pulmonares y falleció por la enfermedad.
De los pacientes llevados a tiroidectomía total sin vaciamiento central (n=58), 17 (29,3 %) fueron reintervenidos por persistencia o recidiva tumoral. De los otros 41 pacientes, 35 (60,3 %) permanecen libres de enfermedad, 5 (8,6 %) se perdieron del seguimiento y uno (1,7 %) presenta recaída pulmonar.
Las complicaciones derivadas del tratamiento quirúrgico fueron: hipocalcemia en 99 (21,1 %) pacientes, en 67 % transitoria y en 33 % permanente; lesión del nervio laríngeo recurrente en 29 (6,2 %); sangrado posoperatorio en 7 (1,5 %), e infección del sitio operatorio en 2 (0,4 %).
Diez (2,1 %) pacientes requirieron nueva intervención temprana (cuatro por hematoma, dos para traqueostomía, dos por fístula quilosa, uno por infección y uno por lesión del plexo braquial). No hubo mortalidad perioperatoria.
En 96 (16,9 %) pacientes se practicó una segunda cirugía oncológica, 43 para completar la resección y 53 por recaída tumoral. Catorce pacientes (3,0 %) requirieron una tercera cirugía por recidiva, y 4 (0,8 %) se reintervinieron cuatro o más veces para citorreducción quirúrgica. Entre las cirugías de rescate se practicaron una laringectomía, dos traqueoplastias, una metastasectomía cerebral y dos corpectomías con vertebroplastia en columna cervical.
Respecto a los informes histopatológicos, de los 469 casos de carcinoma diferenciado de tiroides, 449 (89 6 %) correspondieron a carcinoma papilar de tiroides y, entre estos, se encontró 24,5 % de variantes histológicas agresivas (tabla 3).
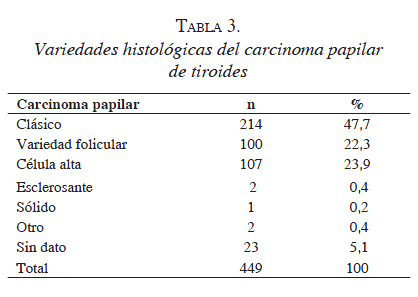
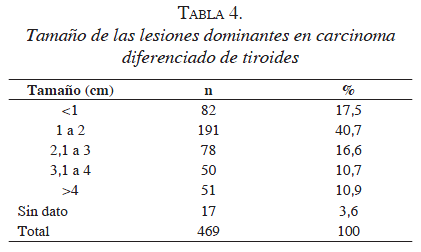
De acuerdo con los datos presentados en la tabla 4, en poco más de la mitad de los casos, las lesiones dominantes tenían dos o menos centímetros de diámetro. Al hacer la evaluación de la presencia de factores de riesgo histológico, se observó que: 53,7 % de los individuos presentaban múltiples centros (otro focos de carcinoma en el mismo lóbulo e istmo); el 31,7 %, bilateralidad (otros focos de carcinoma en el lóbulo contralateral); el 51,9 %, invasión de la cápsula; el 48,3%, invasión a tejido peritiroideo; el 11,8 %, invasión vascular; el 30,5 %, invasión linfática; el 41,3 %, asociación con bocio, y el 32,1 %, asociación con tiroiditis crónica. El grado histológico fue reportado en 328 pacientes, así: bajo grado, 215 (65,5 %); grado intermedio, 81 (24,7%), y alto grado, 32 (9,8 %). Entre los 387 vaciamientos centrales practicados, se encontraron ganglios metastásicos en 251 (64,8 %). El número mediano de ganglios disecados fue de cinco (rango, 1 a 19) y, para los ganglios positivos, de dos (rango, 1 a 12). Los reportes de patología informaron la presencia de glándulas paratiroideas en las piezas quirúrgicas en 172 casos (36,6 %); una glándula en 134 (77,9 %), dos glándulas en 31 (18,0 %), tres glándulas en 6 (3,5 %) y cuatro glándulas en 1 (0,6 %).
El tratamiento ablativo con I-131, complementario a la cirugía, se suministró a 379 (80,8,%) pacientes, con dosis ajustadas de acuerdo con los factores de riesgo histológico, la edad, el sexo y la función renal. Cinco pacientes (1,3 %) recibieron menos de 50 mCi; 17 (4,5 %), de 51 a 100 mCi; 223 (58,8%), de 101 a 150 mCi; 127 (33,5 %), de 151 a 200 mCi, y 7 (1,8 %), más de 200 mCi.
El rastreo después del tratamiento con I-131 se informó: como negativo en 43 (11,3 %) pacientes, remanente central en 255 (67,3 %), remanente central y captación en cuello o mediastino en 44 (11,6 %), y metástasis a distancia en 18 (4,7 %). En 19 (5,0 %) casos no se encontró el reporte del rastreo. Por recidiva o persistencia tumoral, 62 (13,2 %) pacientes recibieron una segunda ablación, 23 (4,9 %), un tercer tratamiento, y 8 (1,7%), cuatro o más tratamientos con I-131.
La mediana para el tiempo de seguimiento de los pacientes con carcinoma diferenciado de tiroides, fue de 38 meses (rango, 1 a 312 meses). Se documentó recidiva tumoral en 59 (12,6 %) con una mediana para el tiempo libre de recaída de 31 meses (rango, 7 a 288 meses). En 17 (28,8 %) casos la recaída fue local, en 35 (59,3 %) fue regional, en 4 (6,8 %) a distancia y en 3 (5,1 %) en dos o más sitios.
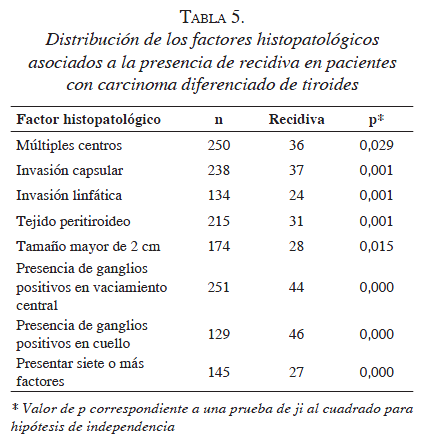
Al evaluar la asociación de recidiva tumoral con tiroiditis linfocítica y con factores histológicos, se observó que, con la primera, nuestros registros no permiten concluir que haya asociación, mientas que con siete de los factores histopatológicos la prueba de ji al cuadrado arrojó un valor de p estadísticamente significativo; este resultado también se observó al comparar las proporciones de individuos con más de siete factores presentes entre quienes presentaron recidiva y los que no la presentaron. El factor histológico más común fue la presencia de, al menos, un ganglio positivo en cuello (35,7 %), mientras que para los otros factores la proporción de casos observados varió entre 14 y 19 % (tabla 5).
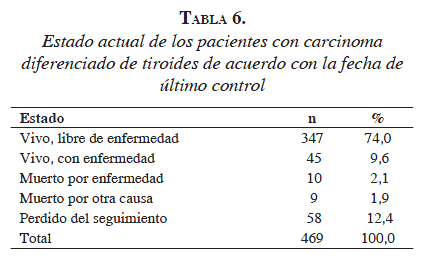
La supervivencia a 5 y 10 años fue de 97,4 y 96,8 %, respectivamente. Diez (2,1 %) pacientes murieron por la enfermedad, cinco en los primeros tres años, dos antes de los nueve años y tres después de 10 años de seguimiento. En la tabla 6 se muestra el estado actual de los pacientes, según la fecha del último control.
Discusión
El carcinoma de la glándula tiroidea es el tumor más frecuente en cabeza y cuello, y su mejor tratamiento, con intención curativa, sigue siendo la citorreducción quirúrgica. El incremento en su diagnóstico se debe al avance de las imágenes diagnósticas, principalmente la ultrasonografía, con criterios claros para sospechar un proceso maligno en un nódulo y con protocolos que incluyen el mapeo linfático cervical. Consecuentemente, se aumentó el número de biopsias con aguja fina y el diagnóstico en estadios más tempranos.
Si bien los elementos diagnósticos han mejorado y hay nuevas fronteras en el campo de la inmunogenética, la capacidad de predecir el comportamiento biológico del tumor antes de la cirugía sigue siendo un problema sin resolver. Si le adicionamos el factor de ser una neoplasia maligna de alta supervivencia, la aparición de nuevas tecnologías en cirugía, como la técnica invasiva mínima, el bisturí armónico y la neuromonitorización 16-18, y que solo alrededor de 20 % de dichos procedimientos son realizados por cirujanos experimentados 19-24, se encuentran algunas explicaciones a la proliferación de guías de manejo con algunas diferencias según la experiencia y el grupo que las publica 25-31.
El grupo multidisciplinario que maneja el paciente debe tener claro que las clasificaciones de riesgo propuestas en las guías de la American Thyroid Association, el Sistema Nacional de Clasificación de Cáncer de los Estados Unidos (National Comprehensive Cancer Network, NCCN) y la Sociedad de Medicina Nuclear 25,29-30, tienen como propósito planear el manejo complementario y el seguimiento de los pacientes, sin determinar la extensión de la cirugía inicial, puesto que factores como la multiplicidad de centros, variantes agresivas del carcinoma diferenciado de tiroides y el compromiso ganglionar del compartimiento central, son muy difíciles de comprobar preoperatoriamente. Asimismo, los rastreos anuales y rutinarios con I-131, deben reservarse exclusivamente para pacientes con carcinoma diferenciado de tiroides de riesgo intermedio o alto, en quienes el marcador tumoral persista elevado, existan más de tres factores histológicos de riesgo y el rastreo después del tratamiento inicial haya mostrado captación local y regional o a distancia.
Desde el punto de vista histopatológico, se observa que el comportamiento de la enfermedad en individuos colombianos presenta diferencias importantes con respecto a los hallazgos reportados en publicaciones estadounidenses y europeas. Por un lado, tenemos una mayor proporción de carcinoma diferenciado de tiroides (89,6 % Vs. 80 y 85 %) y una menor proporción de carcinoma folicular de tiroides (1,8 % Vs. 10 y 12 %). Entre los diferenciados, tenemos una mayor frecuencia de variantes histológicas agresivas (24,5 % Vs. 10 %) y de tiroiditis crónica asociada (32,1 % Vs. 20 y 25 %) 1,2,4,8,10-12,14,32-39.
Dada la gran cantidad de publicaciones sobre el tema en diferentes partes del mundo, existe gran confusión en nuestro medio a la hora de decidir sobre objetivos terapéuticos y patrones de seguimiento de la enfermedad. Para algunos especialistas no es claro si se debe tratar la enfermedad microscópica, la bioquímica, la estructural o la clínicamente significativa. Además, falta aclarar si la información de los nuevos biomarcadores, como el BRAF, RAS y el RET/CPT, es diagnóstica o pronóstica 40,41.
Según nuestros resultados, se puede concluir a manera de hipótesis que, en el carcinoma diferenciado de tiroides, la presencia de tumores mayores de 2 cm, el alto porcentaje de variantes histológicas agresivas (24,5 %), la multiplicidad de centros (53,7 %), la bilateralidad (31,7 %), los ganglios metastásicos en mediastino antero-superior (64,8 %), la falta de una clasificación preoperatoria confiable para establecer riesgo de recaída o de mortalidad y el deficiente sistema de salud que no permite un adecuado seguimiento de nuestros pacientes, pueden ser razones suficientes para justificar una citorreducción quirúrgica agresiva como tratamiento inicial. Obviamente, la recomendación de los autores es que la decisión terapéutica y la forma de seguimiento de cada paciente, deben ser individuales y apoyadas en un grupo multidisciplinario que involucre al cirujano, médico nuclear, endocrinólogo, patólogo y radiólogo, idealmente en una sola institución.
Referencias
1. Garavito G. Seguimiento del cáncer de tiroides bien diferenciado, de origen folicular. Rev Colomb Cancerol. 2000;4:46-50. [ Links ]
2. Sánchez G, Mosquera M, Kadamani A, Martínez T. Cirugía de la glándula tiroides. Reporte de 250 casos. Acta de Otorrinolaringología y Cirugía de Cabeza y Cuello. 2003;31:113-9. [ Links ]
3. Mazzaferri EL, Robbins RJ, Spencer CA. A consensus report of the role of serum thyroglobulin as a monitoring method for low-risk patients with papillary thyroid carcinoma. J Clin Endocrinol Metab. 2003;88:1433-41. [ Links ]
4. Guzmán GE, Sánchez G, Tovar RJ. Relación entre la tiroiditis linfocítica y la persistencia/recurrencia del carcinoma diferenciado de tiroides. Investigación de postgrado. Bogotá, 2013. En prensa. [ Links ]
5. Tuttle RM, Leboeuf R, Martorella AJ. Papillary thyroid cancer: Monitoring and therapy. Endocrinol Metab Clin North Am. 2007;36;753-8. [ Links ]
6. Callender DL, Sherman SI, Gagel RF. Cancer of the thyroid. In: Myers EN, Suen JY, editors. Cancer of the head and neck 1996. Philadelphia: WB Saunders Co.; 1996 p. 485-515. [ Links ]
7. Wells SA, Austen WG, Brennan MF, Fonkalsrud EW, Polk HC, Steichen FM. Well-differentiated thyroid cancer. Curr Probl Surg. 1994;31:935-1013. [ Links ]
8. Chala A. Estudio descriptivo de 12 años de cáncer de tiroides en Manizales, Colombia. Rev Colomb Cir. 2010;25:276-89. [ Links ]
9. Patel KN, Shaha AR. Poorly differentiated and anaplastic thyroid cancer. Cancer Control. 2006;13:119-28. [ Links ]
10. Schlumberger M, Pacini F. Pathology of thyroid tumors. In: Schlumberger M, Pacini F. Thyroid tumors 2006. Third edition. Paris: Editions Núcleon; 2006 p. 35-47. [ Links ]
11. Piana V, Loyola A. Variantes anatomo-patológicas del carcinoma papilar. En: Kowalski LP, Novelli JL, editores. Carcinoma papilar de tiroides 2010. Rosario: UNR Editora; 2010 p. 99-122. [ Links ]
12. Grebe SK, Hay ID. Follicular thyroid cancer. Endocrinol Metab Clin North Am. 1995;24:761-801. [ Links ]
13. Wiseman SM, Loree TR, Wesley LH, Rigual NR, Winston JS, Tan D, et al. Anaplastic thyroid cancer evolved from papilar carcinoma. Arch Otolaryngol Head Neck Surg. 2003;129:96-100. [ Links ]
14. Zúñiga SF, Sanabria A. Complicaciones y recurrencia en el tratamiento del carcinoma papilar de tiroides. Experiencia en el Instituto Nacional de Cancerología. Rev Colomb Cir. 2007;22:166-72 . [ Links ]
15. Sakamoto A, Kasai N, Sugano H. Poorly differentiated carcinoma of the thiroyd. A clinic-pathologic entity for a high-risk group of papillary and follicular carcinomas. Cancer. 1983;52:1849-55. [ Links ]
16. Randolph GW, Kulcsar MA, Brandao LG. New aspects of nerve monitoring in thyroid and parathyroid surgery. In: Cernea CR, editor. Pearls and pitfalls in head and neck surgery 2012. 2nd edition. São Paulo: Karger Editor. 2012 p. 6-7. [ Links ]
17. Miccoli P, Berti P, Raffaelli M, Materazzi G, Conte M, Galleri D. Impact of harmonic scalpel on operative time during video-assisted thyroidectomy. Surg Endosc. 2002;16:663-6. [ Links ]
18. Sackett WR, Barraclough BH, Sidhu S, Reeve TS, Delbridge LW. Minimal access thyroid surgery: Is it feasible, is it appropriate? ANZ J Surg. 2002;72:777-80. [ Links ]
19. Reeve TS, Curtin A, Fingleton L, Kennedy P, Mackie W, Porter T, et al. Can total thyroidectomy be performed as safely by general surgeons in provincial centers as by surgeons in specialized endocrine surgical units? Making the case for surgical training. Arch Surg. 1994;129:834-6. [ Links ]
20. Stavrakis AI, Ituarte PH, Ko CY. Surgeon volumen as a predictor of outcomes in inpatient and outpatient endocrine surgery. Surgery. 2007;142:887-99. [ Links ]
21. Saunders BD, Wainess RM, Dimick JB, Doherty GM, Upchurch GR, Gauger PG. Who performs endocrine operations in the United States? Surgery. 2003;134:924-31. [ Links ]
22. Lifante JC, Duclos A, Couray-Targe S, Colin C, Peix JL, Schott AM. Hospital volume influences the choice of operation for thyroid cancer. Br J Surg. 2009;96:1284-8. [ Links ]
23. Cherenfant J, Gage M, Mangold K, Du H, Moo-Young T, Winchester DJ, et al. Trends in thyroid surgery in Illinois. Surgery. 2013;154:1016-23. [ Links ]
24. Wells SA, Prinz R, Kim A, Rossi H. Difficult problems in thyroid surgery. Curr Probl Surg. 2002;39;3-89. [ Links ]
25. Silberstein EB, Alavi A, Balon HR, Clarke SE, Divgi Ch, Gelfand MJ, et al. The SNM practice guideline for therapy of thyroid disease with 131-I 3.0. J Nucl Med. 2012;53:1-19. [ Links ]
26. Ain KB. Papillary thyroid carcinoma. Etiology, assessment and therapy. Endocrinol Metab Clin North Am. 1995;24:711-60. [ Links ]
27. Pacini F, Castagna MG, Brilli L, Pentheroudakis G. Differentiated thyroid cancer: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol. 2009;20(Suppl.4):43-6. [ Links ]
28. Pitoia F, Ward LS. Differences between Latin American and American association thyroid cancer guidelines. Thyroid. 2010;20:361-2. [ Links ]
29. Cooper DS, Doherty GM, Haugen BR, Kloos RT, Lee SL, Mandel SJ, et al. Revised American thyroid association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2009;19:1167-14. [ Links ]
30. Tuttle RM, Sherman SI, Ball DW, Byrd D, Shah JP, McCaffrey, et al. Clinical practice guidelines in oncology - v.1.2011 Thyroid Cancer. National Comprehensive Cancer Network, NCCN. Fecha de consulta: 20 de abril de 2014. Disponible en: www.nccn.org/professionals/...gls/f_guidelines.asp. [ Links ]
31. Tala H, Tuttle RM. Contemporary post surgical management of differentiated thyroid carcinoma. Clin Oncol . 2010;22:419-29. [ Links ]
32. Zúñiga SF, Sanabria A. Prophylactic central neck dissection in stage N0 papillary thyroid carcinoma. Arch Otolaryngol Head Neck Surg. 2009;135:1087-91. [ Links ]
33. Sywak M, Cornford L, Roach P, Stalberg P, Sidhu S, Delbridge L. Routine ipsilateral level VI lymphadenectomy reduces postoperative thyroglobulin levels in papillary thyroid cancer. Surgery. 2006;140:1000-7. [ Links ]
34. Barczynski M, Konturek A, Stopa M. Prophylactic central neck dissection for papillary thyroid cancer. Br J Surg. 2013;100:410-8. [ Links ]
35. Chan AC, Lang BH, Wong KP. The pros and cons of routine central compartment neck dissection for clinically nodal negative (cN0) papillary thyroid cancer. Gland Surg. 2013;2:186-95. [ Links ]
36. Glover AR, Gundara JS, Norlen O, Lee JC, Sidhu SB. The pros and cons of prophylactic central neck dissection in papillary thyroid carcinoma. Gland Surg. 2013;2:196-205. [ Links ]
37. Fujimoto SI. Thyroid-conserving surgery without TSH suppression may be considered for patients with low-risk PTC to avoid potential adverse effects of TSH suppression. J Clin Endocrinol Metab. 2010;22:16-8. [ Links ]
38. Carty SA, Cooper DS, Doherty GM, Duh QY, Kloos RT, Mandel SJ, et al. Consensus statement on the terminology and classification of central neck dissection for thyroid cancer. Thyroid. 2009;19:1153-9. [ Links ]
39. Ferlito A, Shah JP, Medina JE, Sanabria A, Bradford CR, Weber RS, et al. Proposal for a rational classification of neck dissections. Head Neck. 2011;33:445-50. [ Links ]
40. Kundra P, Burman KD. Thyroid cancer molecular signaling pathways and use of targeted therapy. Endocrinol Metab Clin North Am. 2007;36:839-53. [ Links ]
41. Howell GM, Nikiforova MN, Carty SE. BRAF V600E mutation independently predicts central compartment lymph node metastasis in patients with papillary thyroid cancer. Ann Surg Oncol. 2013;20:47-52. [ Links ]













