Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582
rev. colomb. cir. vol.29 no.2 Bogotá Apr./June 2014
1 Cirugía Oncológica, Instituto Nacional de Cancerología, Bogotá, D.C., Colombia.
2 Universidad Militar Nueva Granada, Bogotá, D.C., Colombia.
Correspondencia: Héctor López, MD, Pasto, Colombia. Correo electrónico: hlopezmoncayo@yahoo.com.m
Fecha de recibido: 21 de noviembre de 2013. Fecha de aprobación: 27 de febrero de 2014.
Resumen
El melanoma acral lentiginoso es el tipo de melanoma de localización distal más frecuente, suele diagnosticarse en los estadios más avanzados y tiene un comportamiento biológico más agresivo que otros tipos de melanoma, por lo cual son de peor pronóstico. Representa entre el 5 % y el 10 % de los melanomas malignos y es más frecuente en asiáticos, en la raza negra y en latinoamericanos.
El objetivo de este artículo fue hacer una revisión bibliográfica actualizada con el fin de conocer las tasas de incidencia del tumor, los nuevos avances con respecto a los factores de riesgo, biología molecular, diagnóstico y tratamiento, y el desarrollo de nuevos tratamientos en el manejo del melanoma avanzado y metastásico.
Palabras clave: melanoma; interferón-alfa; quimioterapia; radioterapia; cirugÃa.
Abstract
Acral lentiginous melanomas, the melanomas most commonly found the distal portions of the limbs, have usually reached more advanced stages than other types of melanoma when diagnosed. Their biologic behavior is more aggressive than in other types of melanoma, so that they have a worse prognosis. It represents 5 to 10% of all malignant melanomas, and is more frequently seen among the Asian, African American and Latin population. The objective of this paper was to complete a review of the current literature, in order to establish the rates of incidence, new findings regarding risk factors, molecular biology, diagnosis and treatment, and the development of new target therapies in the management of advanced and metastatic melanomas.
Key words: melanoma; interferon-alpha; drug therapy; radiotherapy; surgery.
Introducción
El melanoma es el tumor maligno de piel más agresivo, con capacidad de dar metástasis linfáticas y hemáticas, y causa el 90 % de muertes asociadas a este tipo de tumor. En el 2012, en Estados Unidos se diagnosticaron 76.250 nuevos casos de melanoma que causaron 9.180 muertes 1. Desde mediados de los años 60, la incidencia del melanoma maligno se ha incrementado en todo el mundo. La tasa de incidencia en Europa es de 10 a 20 por 100.000 personas, en los Estados Unidos, de 20 a 30 por 100.000, y en Australia, de 50 a 60 por 100.000 personas 2.
En Colombia, según el Registro de Cáncer de Cali, el promedio anual de incidencia de melanoma se incrementó entre 1966 y 2007 de 1,6 a 3,5 en hombres y de 1,0 a 3,2 en mujeres. Los datos del Centro Dermatológico Federico Lleras Acosta de Bogotá indican que el melanoma se incrementó del 2003 al 2005 de 2,7 casos por 10.000 a 13 casos por 10.000. En el Instituto Nacional de Cancerología se reportó que el melanoma maligno había sido la principal causa de muerte por neoplasias de piel (40 %) y que representó el 1 % del total de muertes por cáncer 3.
En el 2010, en el Instituto Nacional de Cancerología se registraron 143 casos nuevos de melanoma; de estos, 35 fueron diagnosticados como melanoma acral lentiginoso, correspondientes a 24,5 % del total de melanomas 4.
Existen cuatro subtipos principales de melanoma: el de extensión superficial –el más frecuente– (60 a 70 %), el melanoma nodular (15 a 30 %), el melanoma lentigo maligno (5 %) y el melanoma acral lentiginoso (5 a 10 %). Según algunos autores, el 7 % de todos los melanomas cutáneos se localizan en zonas distales 5. Todos los tipos de melanoma maligno se pueden encontrar en zonas distales, pero el subtipo más prevalente es el melanoma acral lentiginoso. Este subtipo aparece en el dorso de las manos y los pies, en las palmas, las plantas, las muñecas, en los tobillos y en la región subungular 6.
El melanoma acral lentiginoso es el subtipo más común de melanoma en las razas no caucásicas, el 70 % en personas de raza negra, 40 % en asiáticos, 15 % en hispanos y solo de 2 a 8 % en caucásicos; sin embargo, no presenta una mayor incidencia global con respecto a los demás subtipos de melanomas mencionados anteriormente. La edad media de presentación es superior que en el resto de los melanomas malignos, entre la quinta y sexta década, con un pico máximo de presentación a los 70 años 7.
La primera descripción de un melanoma acral lentiginoso fue hecha por Redd, et al., en 1976. El primer reporte de casos clínicos fue publicado por Arrington en 1977, con un total de 27 casos, y se consideró como un subtipo histológico de los melanomas malignos en 1979 8, 9.
El melanoma acral lentiginoso se diagnostica con menor frecuencia en estadios tempranos respecto al melanoma lentigo maligno y el de extensión superficial. Este hecho podría ser explicado por varias hipótesis no excluyentes entre sí: un comportamiento biológico más agresivo que en otros tipos de melanoma maligno, falta de conciencia en la población de la posibilidad de que el melanoma se presente en las regiones subungulares o palmo-plantares, presentación clínica distinta a las de otros tipos de melanoma maligno o dificultad para detectar las lesiones por estar ocultas a la vista durante la vida cotidiana o por una menor atención primaria de salud debido al grupo de edad en que se presenta 10, 11.
Sus factores etiológicos probablemente difieren de los de los melanomas cutáneos que se presentan en otros sitios anatómicos. La radiación ultravioleta probablemente no juegue un papel importante en las zonas no expuestas, como palmas y plantas. La patogénesis del melanoma acral lentiginoso no es clara, algunos estudios han vinculado la exposición a químicos y las lesiones traumáticas como factores de riesgo en poblaciones caucásicas. Además, en personas de raza negra y en las que tienen la piel con pigmentación intermedia, como los latinos y los asiáticos, así como en los de raza blanca, el melanoma acral lentiginoso ocurre en zonas no expuestas a la luz ultravioleta, por lo que esta causa podría no ser el factor etiológico más importante para este tipo de melanoma 8, 9, 11, 12, 13.
La localización de estos melanomas en zonas de apoyo, sugiere que la presión puede tener algún papel etiopatogénico, quizá asociado al calor o a los traumatismos repetidos. El reciente hallazgo de la sobreexpresión de NUAK2 en los melanomas acrales lentiginosos podría apoyar esta teoría 14.
Factores pronóstico
Presenta los mismos factores pronóstico que cualquier tipo de melanoma, como lo son el estado del ganglio centinela, la presencia de satelitosis microscópicas, la invasión vascular, la regresión, el infiltrado linfocitario intratumoral y el tipo celular predominante. Se encontró que el espesor del tumor, según la clasificación de Breslow, la presencia de ulceración, el estadio histopatológico y el índice mitótico (mayor de una mitosis por mm2), son los factores pronóstico más importantes asociados con una menor supervivencia libre de enfermedad específica, según estudios recientes 15,16.
Otros factores asociados a un mal pronóstico son la edad avanzada y el sexo masculino. La presencia de nevus melanocíticos y el grado de invasión de Clark, son factores con un poder pronóstico moderado. Cabe recalcar que en numerosos estudios se encontró que la variable histológica no se consideró como factor pronóstico para la supervivencia, cuando se lo corrigió con el grosor del tumor (grosor de Breslow y grado de Clark) 17, 18.
En un estudio en España, se determinó que en el grupo de melanoma acral lentiginoso, la supervivencia fue de 32,9 meses en comparación con 40,7 meses en el de melanomas no acrales, con valores estadísticos significativos. La disminución de la supervivencia se explicaría por el mayor grosor de Breslow y grado de Clark encontrados en el melanoma acral lentiginoso, y no por la localización o por el tipo histopatológico encontrado. Esto se correlaciona con la demora en el diagnóstico de este tipo de melanoma, que se estima en 1 a 3,7 años, y en la cual parecen estar involucrados muchos factores como, por ejemplo, edad avanzada, sitios ocultos, presentación inusual y diagnósticos previos errados 19.
Alteraciones genéticas o diagnóstico molecular
Con los avances en la biología molecular, se ha detectado la importancia de las mutaciones en el gen KIT para los melanomas acrales y mucosos, a diferencia de las mutaciones de los genes BRAF y n-RAS, que se asocian con melanomas por exposiciones intermitentes al sol y con el de extensión superficial 20.
La frecuencia de mutaciones del BRAF en el melanoma acral lentiginoso varió entre 9,5 y 23 %, en contraste con una mayor en melanomas por daño inducido por exposición solar crónica o en melanomas de otros subtipos histológicos 21,22. Las mutaciones de n-RAS estuvieron presentes en 0 a 47,7 % de los casos. Se encontraron bajas tasas de mutación de n-RAS en población japonesa y, las más altas, en población de Inglaterra y Escocia. No hubo diferencia en esta mutación con respecto a melanomas de otras localizaciones u otros subtipos histológicos 23.
La frecuencia de las mutaciones del gen c-kit es de 11 a 13 % en los melanomas acrales lentiginosos, es similar en tumores primarios y metastásicos, y en melanomas de mucosas, y es menor en los melanomas relacionados con exposición solar. La proteína KIT, analizada por inmunohistoquímica mediante el anticuerpo cd117, se expresó en 75 a 83 % de los casos de melanoma acral lentiginoso 24.
Existen otras mutaciones importantes, como la que produce alteración de la vía de CDK4, la cual se encuentra mal regulada en 90 % de los melanomas. El principal resultado de la activación de CDK4 es la fosforilación y, por lo tanto, la inhibición de la proteína del retinoblastoma que conduce a una transición del ciclo celular en la fase G1-S y, además, inhibe el envejecimiento celular y la apoptosis. Por esto se han desarrollado inhibidores de CDK4 con el fin, no solo de frenar el ciclo celular, sino de generar apoptosis en la célula cancerígena, generando una posibilidad terapéutica importante 25, 26.
Además, el melanoma acral lentiginoso presenta mutaciones específicas, como los focos de amplificación de la ciclina D1 (CCDN1), lo cual genera sobreexpresión del gen. Esto lo demostraron Ibrahim, et al., en una serie de casos en la que compararon melanomas acrales y no acrales, para establecer si eran positivos para la expresión de ciclina D1. Encontraron que 68 % de los acrales eran positivos, mientras que solo 33 % de los no acrales lo eran, con una diferencia estadísticamente significativa (p<0,05), hallazgo que puede mejorar el diagnóstico histológico y la detección de márgenes de resección positivos, en el melanoma acral lentiginoso 25, 26.
Manifestaciones clínicas
El melanoma acral lentiginoso ocurre en palmas y plantas o debajo del lecho ungular. Sin embargo, no todos los melanomas de palmas y plantas corresponden a este tipo, pues una pequeña fracción son melanomas de diseminación superficial y melanomas nodulares. La mayor parte de los acrales lentiginosos se presenta en pies (58 % en blancos y 88 a 100 % en raza negra) y en manos (7 a 22 % en blancos y 0 a 18 % en raza negra). El método ABCDE (asimetría, bordes irregulares, cambio de color, diámetro superior a 6 mm y evolución) es el propuesto para la detección en estadios precoces 27. Aunque, generalmente, en las palmas y plantas se presentan con relativa frecuencia los signos y síntomas del ABCDE (figura 1), existe un importante retraso diagnóstico del melanoma acral lentiginoso debido a su polimorfismo clínico 5, 6, 20.
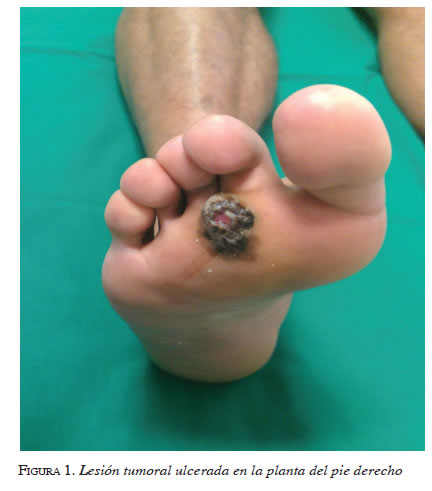
Soon, et al., refieren que en su serie de 112 melanomas acrales lentiginosos plantares, 33,9 % fueron incorrectamente diagnosticados; de estos, hasta 60 % eran amelanóticos y 39 % simulaban una lesión hiperqueratósica benigna 28. Asimismo, Pereda, et al., en un estudio retrospectivo descriptivo, entrevistaron telefónicamente a pacientes sobre la lesión según la lista de chequeo de 7 puntos de Glasgow, el método ABCDE y si había existido retraso en el diagnóstico temprano del melanoma acral lentiginoso. Encontraron que hubo un retraso de más de un año atribuible al paciente debido a una consulta tardía, en 30,4 %, y un retraso en más de un año debido a la falta de sospecha del médico tratante y a no ordenar toma de biopsia a pesar de que el paciente consultó por cambios en el tamaño, el color, sangrado o ausencia de cicatrización de la lesión, en un 20 %. Con lo anterior, estos dos autores subrayan la poca utilidad del método ABCDE para la detección temprana del melanoma acral lentiginoso, debido a la falta de reconocimiento de los signos de alarma por parte de los pacientes y de los médicos, y recomiendan hacer énfasis en las campañas de prevención sobre la posibilidad de aparición de melanomas en las palmas y, particularmente, en las plantas 29.
Diagnóstico
El diagnóstico se confirma con la biopsia, por incisión o escisión, según el tamaño y la localización de la lesión; si esta mide menos de 1,5 cm de diámetro y no se encuentra en sitios críticos (cara, palmas, plantas, dedos, uñas), se puede practicar una biopsia por escisión, con un margen de piel de 2 mm y cuya espesor incluya el tejido celular subcutáneo. En caso de otra localización anatómica, se debe hacer una por incisión con bisturí y del sitio más afectado. La biopsia por incisión no aumenta la recurrencia local ni disminuye la supervivencia 5, 6, 20.
Se recomienda orientar la biopsia en dirección del drenaje linfático, siguiendo el eje de las extremidades, para que la cicatriz no interfiera con dicho drenaje ni con la resección del ganglio centinela. No se recomienda la biopsia por afeitado, debido a que no permite determinar el grado de invasión 30.
Características histopatológicas
Generalmente, estos tumores presentan una fase de crecimiento radial con epidermis hiperplásica y proliferación lentiginosa variable de células melanocíticas atípicas que exhiben dendritas prominentes que se extienden a través de la epidermis. El núcleo es alargado, hipercromático y pleomorfo (figura 2), y existen diversos grados de mielinización. La dermis está compuesta por células fusiformes, pero ocasionalmente pueden verse células epiteliodes y pleomorfas. La regresión puede observarse en 39 % de los casos y, el neurotropismo, en 14 % 5, 6, 20.
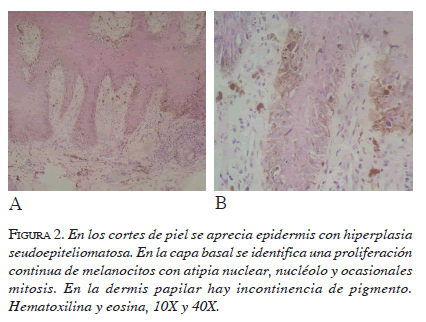
En casos de difícil diagnóstico, se recomiendan los estudios de inmunohistoquímica (hmb-45, proteína s-100, melan A, enolasa neurona específica, etc.) o el de reacción en cadena de polimerasa (PCR) para establecer la expresión de moléculas como CDK4, CDKN2A, CCND1, KIT, TP53, RAC1 Y MITF. De esta forma, se hace un diagnóstico histológico más preciso y se determinan las células iniciadoras del melanoma, que conforman una subpoblación de crecimiento lento pero con un gran poder neoplásico in vivo; además, estas expresan algunos marcadores como CD20, CD133, CD24, CD271, o el transportador ABC. Las células iniciadoras del melanoma han demostrado ser las responsables de la alta recidiva de este tipo de tumores, ya que generan el denominado efecto de campo, debido a la presencia de alteraciones moleculares similares a las observadas en el tumor que se ubican adyacentes a la lesión e, incluso, a más de un cm de distancia del borde de resección libre de tumor. Además, estas células son capaces de disminuir la concentración de los antineoplásicos intracelulares, aumentado la producción de bombas de flujo de salida (ABCB5), y pueden evitar el sistema inmunitario mediante simulación al no expresar o enmascarar el antígeno MART 1, tal cual como lo explican Bastian y Berlotto 31-33.
Estadificación
La estadificación del melanoma maligno se hace con base en la clasificación TNM (Tabla 1) propuesta por el American Joint Committee on Cancer (AJCC Cancer Staging Manual), en los siguientes estadios 34, 35:

Tratamiento
Aunque el melanoma se presenta en la superficie de la piel, donde teóricamente debería ser fácilmente diagnosticado y tratado, esto no es así. Su tratamiento es complicado por la naturaleza agresiva del tumor y su impredecible patrón metastásico, lo cual lo hace más letal que otros tumores de patrón sólido. Por lo anterior, el tratamiento del melanoma es fundamentalmente quirúrgico, tanto de la lesión primaria, como del territorio ganglionar de drenaje si se encuentra comprometido por el tumor 5, 6, 20.
Lesión primaria
El tratamiento del melanoma acral lentiginoso es particularmente desafiante debido a la dificultad para obtener los márgenes adecuados y al déficit funcional que se puede originar en la ampliación. Dichas áreas tienen de dos a cinco veces más recurrencia en comparación con otras áreas, debido a los pequeños márgenes utilizados. Históricamente, el manejo de elección del melanoma subungular fue, sin ninguna duda, la amputación del dedo afectado; sin embargo, en los últimos años, se están empleando técnicas más conservadoras que permiten obtener márgenes amplios sin necesidad de amputaciones y sin alterar el pronóstico en comparación con la cirugía radical. En una pequeña serie de casos realizado en 1997, Tseng observó que, cuando el grosor de Breslow era menor de 1,5 mm, el melanoma subungular tenía una menor tasa de metástasis ganglionar, por lo cual sugirió que estaría indicada la escisión local amplia con márgenes de un cm. La cirugía micrográfica de Mohs se considera el tratamiento de elección para el melanoma acral lentiginoso, ya que permite extirpar la lesión completa y preservar la mayor cantidad posible de tejido sano. Sin embargo, tiene la limitación de que, en nuestro medio, son pocos los centros que puedan ofrecer dicha técnica quirúrgica, además del costo requerido 36.
La amplitud de la resección depende del espesor invadido por el melanoma. Para melanomas in situ, se recomienda un margen de resección de 0,5 cm; para los menores de 1,0 mm, uno de 1 cm; para los de 1,01 a 2 mm, uno de 1 a 2 cm; para los de 2,01 a 4 mm, uno de 2 cm; y para los mayores de 4 mm, uno de 2 cm. Estos criterios son también válidos para los melanomas palmares y plantares 37.
El margen quirúrgico puede modificarse según la localización anatómica, por ejemplo, en el rostro. Debe tenerse en cuenta que la resección de la lesión tumoral puede implicar otros procedimientos quirúrgicos, como la amputación, según la localización y la magnitud de la lesión. Si los márgenes de resección son positivos, se debe reintervenir al paciente 36, 37.
En melanomas localizados en la planta o en la palma, se recomiendan los mismos lineamientos de tratamiento según el grosor de Breslow. De ser posible, se debe respetar una porción de talón o un cojinete de la superficie plantar, así como de fascia sobre los extensores, lo cual servirá de base para un injerto de piel 36, 37.
Ganglios regionales
El papel de la linfadenectomía electiva es controversial. El principal problema es que si se practica en pacientes que no presentan metástasis, se trataría de una cirugía innecesaria. Esto se evita con la técnica de mapeo linfático y búsqueda del ganglio centinela. Se debe hacer biopsia de ganglio centinela en todos los melanomas con grosor de Breslow mayor de 1 mm o en aquellos melanomas delgados menores de 1 mm con factores de riesgo como un grado de Clark IV o V, fenómeno de regresión, ulceración, o una o más mitosis 38.
Son interesantes los resultados de los estudios multicéntricos MSLT-1 y MSLT-2 (Multicenter Selective Lymphadenectomy Trials). En el primero, demuestran que la técnica de ganglio centinela es un procedimiento mínimamente invasivo de diagnóstico y estadificación que, practicado por un equipo de profesionales con experiencia, puede detectar el compromiso ganglionar en 95 a 98 % de los casos. Por otra parte, la biopsia permite identificar 15 a 50 % de los pacientes con metástasis ganglionares que son candidatos para linfadenectomía inmediata y 80 a 85 % de aquellos sin metástasis que no necesitan disección ganglionar. Dicha técnica es indispensable en todos los melanomas con un grosor intermedio, entre 1,0 y 4,0 mm, y con grado de Clark IV a V 38.
Respecto al MSLT-2, se encontró que en el 88 % de los casos con un tumor con ganglio centinela positivo, pueden no tener metástasis adicionales en el espécimen del vaciamiento ganglionar cuando se examina con la coloración de hematoxilina y eosina. Si las metástasis ganglionares están limitadas a uno o dos ganglios centinela, la biopsia de estos ganglios puede ser terapéutica o diagnóstica; este estudio fue designado para evaluar esta posibilidad bajo la hipótesis de que el vaciamiento ganglionar terapéutico puede evitarse en la mayoría de los pacientes con metástasis en el ganglio centinela, haciendo seguimiento con ultrasonido de alta resolución. En este estudio se compara ganglio centinela más vaciamiento ganglionar frente al ganglio centinela más observación con ultrasonido de alta resolución de los ganglios linfáticos positivos confirmados por patología y técnicas moleculares (RT-PCR) 39.
La linfadenectomía terapéutica se indica en casos en los que se diagnostica metástasis a ganglios linfáticos o cuando clínicamente hay ganglios palpables y su compromiso tumoral se confirma mediante biopsia por aspiración con aguja fina (BACAF) 38, 39.
Interferón alfa
Los dos metaanálisis más grandes de fase III sobre el uso del interferón alfa 2b y el interferón alfa 2 con polietilen-glicol como tratamiento adyuvante en melanoma son el 18952 y el 1899140.
En el estudio EORTC 18952, de fase III y asignación aleatoria, se comparó la administración de dosis intermedias de interferón alfa 2b durante uno o dos años con la observación, en pacientes con melanoma en estadios IIb y III, y se encontró que no hay impacto en la supervivencia libre de metástasis a distancia ni en la supervivencia global 40.
En el estudio EORTC 18991, de fase III y asignación aleatoria, se comparó el tratamiento adyuvante con interferón alfa 2b con polietilen-glicol con la observación, en casos de resección de melanoma en estadio III, y se encontró un impacto estadísticamente significativo en la supervivencia libre de recurrencia de enfermedad y un beneficio significativo de supervivencia libre de metástasis a distancia en pacientes con compromiso ganglionar microscópico 40.
No se observó incremento en la supervivencia global en la población general y los pacientes con ulceración y baja carga tumoral tuvieron mayor beneficio. Se concluyó que no hay mejoría en la supervivencia global con el tratamiento con interferón 40.
El interferón alfa se ha empleado de forma adyuvante y neoadyuvante, sin obtener resultados favorables en la supervivencia, como se describió en los estudios anteriores, por lo cual hasta el momento, no tiene indicación en el manejo del melanoma en monoterapia, pero en combinación con antineoplásicos como la dacarbazina, disminuye la masa tumoral. Sin embargo, la inmunoterapia es un campo promisorio para el manejo de este tumor inmunogénico y se requiere el desarrollo de nuevos medicamentos y el mejoramiento de los actuales 32, 41.
Quimioterapia
La quimioterapia se puede utilizar en dos circunstancias, sea que no haya metástasis o que sí estén presentes. En el primer caso, se usa como tratamiento adyuvante en pacientes sin evidencia de metástasis, pero con alto riesgo de recurrencia o diseminación del tumor. En estudios publicados se ha utilizado en melanomas de más de 1,5 mm de espesor o en estadios II-III de la clasificación del American Joint Committee on Cancer (AJCC), sin que haya mostrado ninguna ventaja terapéutica 42. En el segundo, cuando hay enfermedad metástasica, la quimioterapia puede lograr regresión tumoral y reducción de los síntomas relacionados con el tumor.
La quimioterapia convencional se basa en agentes alquilantes tales como fotemustina (Muphoran®) y temozolomida (Temodal®), que desencadenan efectos citotóxicos mediante el bloqueo de la replicación celular. Sin embargo, estos fármacos promueven sólo 10 % de mejoría objetiva, sin prolongar la supervivencia global, por lo cual no se recomiendan en monoterapia 32, 41.
La dacarbazina (dimetil-triaceno-imidazol-carboxamida, DTIC) es el fármaco de elección de primera línea en el tratamiento del melanoma avanzado o metastásico; aumenta el tiempo libre de enfermedad en 7 % y no muestra diferencias en cuanto supervivencia global. La combinación de agentes citostáticos y citocinas como el interferón, aumenta la mejoría objetiva, es decir, disminuye la masa tumoral 42.
Se han logrado tasas más altas de remisión que con la monoterapia al combinar múltiples antineoplásicos (poliquimioterapia) en esquemas como DVC (dacarbazina, vindesine, cisplatino) o DBC (dacarbazina, BCNU, cisplatino o carboplatino), o esquemas con paclitaxel mas carboplatino o cisplatino o poliquimioterapia asociada a citocinas. Ninguno de los esquemas de quimioterapia utilizados ha demostrado mejoría en la supervivencia global 43.
Con el descubrimiento de la activación del gen BRAF por mutación en un alto porcentaje de melanomas, se abrió la posibilidad de buscar un agente terapéutico que pudiera inhibirlo. Entonces, se desarrolló el primer inhibidor de BRAF denominado sorafenib, antes llamado BAY 43-9006 y actualmente Nexavar®, un inhibidor multicinasa que actúa sobre el BRAF (V600E) y otros genes, como VEGFR, PDGFR, cKIT y FLT3. Sin embargo, este fármaco no demostró ser eficaz en melanomas no resecables o metastásicos, por lo cual se hicieron importantes esfuerzos para desarrollar un inhibidor de BRAF más específico. En 2011, se logró un gran avance en el manejo del melanoma, al aprobar la Food and Drug Administration (FDA) el vemurafenib (anteriormente conocido como PLX -4032 y actualmente comercializado como Zelboraf®), el primer fármaco que inhibe el BRAF V600E mutado y tiene pocos efectos sobre el BRAF de tipo salvaje 32, 41, 44, 45.
En las fases 1 y 2 de ensayos clínicos, el vemurafenib ha demostrado una tasa de mejoría objetiva de más de 50 % en casos de melanoma. Estos hallazgos se confirmaron en un ensayo clínico de fase 3 (BRIM3); comparando el vemurafenib con la dacarbazina, se obtuvieron tasas de mejoría de 48 % Vs. 5 %, aumento de la supervivencia de 5,3 Vs. 1,6 meses, y supervivencia global a los seis meses de 84 % Vs. 64 %, respectivamente. Sin embargo, se ha evidenciado un subgrupo de pacientes con BRAF V600E, que eran inicialmente resistentes al vemurafenib o que desarrollaron resistencia secundaria mediante la reactivación de la vía de la MAP cinasa con la elevación de la fosforilación de ERK. Además, algunos presentaron efectos secundarios, como el desarrollo de carcinomas de células escamosas cutáneas, mediante la activación paradójica de señalización MAPK 32, 41, 44, 45.
Por lo tanto, existe la necesidad urgente de prevenir una eventual resistencia a los medicamentos y de mejorar el resultado clínico. En este momento se encuentran en desarrollo otros inhibidores de BRAF, como el dabrafenib (Tafinlar®), aprobado por la FDA para el melanoma no resecable o metastásico con mutaciones de BRAF en 2013; es de la misma clase que el vemurafenib y genera una eficiencia similar pero con mejores resultados en pacientes con metástasis cerebrales 32, 41, 44, 45.
Con el fin de aumentar la eficacia y disminuir los efectos secundarios, se desarrollaron combinaciones terapéuticas como la de un inhibidor de BRAF y un inhibidor de la enzima MEK (trametinib más MEK162); esta redujo la incidencia de toxicidad dérmica, incluyendo el desarrollo de cánceres de piel, posiblemente debido a la inhibición de la activación paradójica de la vía MAPK, y mejoró la supervivencia en 4,8 meses 32, 41, 44, 45.
Perfusión aislada de extremidades
Diseñada por Creech y Krementz en 1956, es un procedimiento que permite aplicar dosis de antineoplásicos en una extremidad, en concentraciones 25 a 30 veces superiores a las de una quimioterapia convencional; permite procedimientos oncológicos de menor morbilidad, incluyendo el salvamento de extremidades, y minimizar la toxicidad sistémica de los antineoplásicos. Consiste en aislar la circulación de la extremidad comprometida y conectarla a un sistema extracorpóreo; al momento de alcanzar una temperatura elevada, se administra el medicamento, de elección melphalan y factor de necrosis tumoral, a través del sistema de perfusión. Está indicado en metástasis en tránsito con presentación múltiple y compromiso extenso del tumor primario de la extremidad; permite el control de la enfermedad y evita la amputación 46-48.
En 1996, Thompson desarrolló la infusión aislada de las extremidades, como una alternativa para la perfusión aislada, la cual es técnicamente simple y de baja morbilidad. Mediante radiología intervencionista, se obtiene acceso vascular a la extremidad afectada por vía inguinal contralateral, con la técnica de Seldinger. Después de confirmar radiográficamente el acceso vascular, se insufla un torniquete en la parte más proximal de la extremidad, y se instila el antineoplásico por vía arterial y se recupera por vía venosa; tiene una duración de dos a tres horas, en promedio 47, 48.
Al compararla con la perfusión aislada, la infusión se diferencia porque: es menos compleja; el acceso vascular es percutáneo; el tiempo de infusión-perfusión es menor; la duración del procedimiento es menor; no requiere perfusionista ni máquina de circulación extracorpórea; se puede practicar con anestesia regional; se puede llevar a cabo en pacientes con enfermedad arterial oclusiva crónica; se puede repetir; las metástasis no son una contraindicación; no requiere transfusión sanguínea de rutina; limita la fuga sistémica, ya que utiliza un sistema de baja presión; puede presentarse hipoxia progresiva y acidosis, y su máxima temperatura es de 39 grados centígrados 47, 48.
Este tipo de tratamiento produce remisión completa 39 a 82 % de los casos. Sin embargo, no existen estudios clínicos de asignación aleatoria que demuestren mejoría en la supervivencia. Los pacientes pueden presentar morbilidad, tanto en la técnica convencional como en la hipertérmica, como linfedema (30 a 40 %), síndrome de los compartimentos (10 a 15 %), neuropatía periférica (5 a 8 %) y riesgo de amputación por toxicidad grave (1 a 2 %). Otros efectos leves y más frecuentes, son eritema, descamación, alopecia, onicólisis, cambios en el color de la piel y dolor, que pueden aparecer en las primeras semanas después del procedimiento y suelen ser transitorios 47, 48.
Radioterapia
La radioterapia con intención curativa, en caso de tumor primario irresecable o de enfermedad concomitante que contraindiquen la cirugía primaria, es una alternativa de tratamiento.
La radioterapia complementaria y adyuvante, sobre las cadenas ganglionares, está indicada cuando hay cuatro o más ganglios con compromiso tumoral con de más de 3 cm, o compromiso extracapsular o de tejidos blandos.
La radioterapia paliativa se usa cuando hay metástasis cerebrales sintomáticas, compresión medular o compromiso óseo 49.
Nuevos tratamientos
En los últimos años se están desarrollando nuevos fármacos con base en el mejor conocimiento de la biología de la célula tumoral y su interacción con el sistema inmunitario del huésped, con resultados prometedores que pueden aumentar la tasa de respuesta tumoral y su duración, con respecto a la quimioterapia tradicional.
Antes del 2010, los tratamientos sistémicos no mostraron aumento de la supervivencia global en pacientes con melanoma metastásico y solo se observó un leve incremento con interferón como adyuvante.
El ipilimumab, un anticuerpo monoclonal anti-CTLA-4, y vemurafenib, un inhibidor selectivo del BRAF, han mostrado incrementar la supervivencia en pacientes con melanoma metastásico, en estudios de asignación aleatoria 32.
El ipilimumab es un nuevo tipo de inmunoterapia que actúa indirectamente sobre el tumor, al estimular el sistema inmunológico para que reconozca y destruya las células cancerosas. Bloquea una molécula denominada antígeno 4, asociado al linfocito T citotóxico (CTLA-4), que desempeña un papel importante en la supresión de la respuesta inmunológica normal frente al cáncer; impide esa supresión y, por lo tanto, permite al sistema inmunológico responder a organismos extraños como las células tumorales 32.
Mejoró la supervivencia a largo plazo en un ensayo clínico de fase III, de asignación aleatoria y doble ciego, cuyos resultados se publicaron en junio de 2010 en el New England Journal of Medicine. En los pacientes que recibieron ipilimumab, las tasas de supervivencia a doce meses y a dos años fueron de 46 y 24 %, respectivamente, frente a 25 y 14 % en el grupo de control. Además, los resultados del estudio mostraron que algunos pacientes permanecían vivos después de tres y cuatro años de seguimiento 50.
El vemurafenib está indicado en monoterapia para el tratamiento de pacientes adultos con melanoma no resecable o metastásico, y con mutación del BRAF V600 37. Se trata de una molécula de bajo peso molecular, que se administra por vía oral y es inhibidor de la serina-treonina cinasa BRAF. Las mutaciones en el gen BRAF sustituyen el aminoácido valina en la posición 600 y dan lugar a la activación de las proteínas BRAF, las cuales promueven la proliferación celular en ausencia de los factores de crecimiento que normalmente se requieren 44.
Los resultados preclínicos generados en las valoraciones bioquímicas, han demostrado que el vemurafenib puede inhibir de forma potente las cinasas BRAF mediante la activación de la mutación del codón 600.
La mutación más común del BRAF es la V600E, seguida por la V600K, y corresponde a 95 % de las mutaciones del BRAF encontradas en todos los pacientes con cáncer. En un estudio de asignación aleatoria y de fase III se comparó el vemurafenib con la quimioterapia en pacientes, con melanoma y mutación del BRAF V600E, que no habían recibido tratamiento previo. La tasa de mejoría objetiva fue de 48 %, la reducción del riesgo de progresión de enfermedad fue de 74 % y la reducción del riesgo de muerte fue de 63 %. El uso de inhibidores BRAF se ha asociado con incrementos en las tasas de supervivencia libre de enfermedad y global, en pacientes con melanoma con mutación del BRAF44.
Supervivencia
La supervivencia a cinco años es de 97 % en el estadio clínico IA, de 92 % en el IB, de 81 % en el II, de 74 % en el III A, de 59 % en el IIIB, de 40 % en el IIIC, y de 15 a 20 % en el IV (Tabla 2). Existen muchos factores que influyen en el pronóstico final; entre los más importantes están la presencia de metástasis a ganglios linfáticos, el espesor de la lesión y la ulceración 15.
Recientemente, en julio de 2013, se publicó en Annals of Surgical Oncology, una serie de casos de 281 pacientes con melanoma, cuyos resultados demuestran que la supervivencia específica libre de enfermedad fue significativamente menor en casos de melanoma acral que en los de melanoma no acral, lo cual quizás refleja alteraciones inherentes a la biología tumoral 51-53.
Bibliografía
1. Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [ Links ]
2. Garbe C, Leiter U. Melanoma epidemiology and trends. Clin Dermatol. 2009;27:3-9. [ Links ]
3. Schmerling RA, Loria D, Cinat G, Ramos WE, Cardona AF, Sánchez JL, et al. Cutaneous melanoma in Latin America: The need for more data. Rev Panam Salud Pública. 2011;30:431-8. [ Links ]
4. Instituto Nacional de Cancerología. Anuario estadístico 2010. Fecha de consulta: 3 de mayo 2012. Disponible en: http://www.incancerologia.gov.co. [ Links ]
5. Thompson JF, Scolyer RA, Kefford RF. Cutaneous melanoma. Lancet. 2005;365:687-701. [ Links ]
6. Kuchemeister C, Schaumburg-Lever G, Garbe C. Acral cutaneous melanoma in Caucasians: Clinical features, histopathology and prognosis in 112 patients. Br J Dermatol. 2000;143:275-80. [ Links ]
7. Phan A, Touzet S, Dalle S, Ronger-Savlé S, Balme B, Thomas L. Acral lentiginous melanoma: A clinic-prognostic study of 126 cases. Br J Dermatol. 2006;155:561-9. [ Links ]
8. Chamberlain A, Jonhatan NG. Cutaneous melanoma: A typical variants and presentations. Aust Fam Physician. 2009;38:476-82. [ Links ]
9. Puig-Butillé J. Genetic alterations in RAS regulated pathway in acral lentiginous melanoma. Exp Dermatol. 2013;22:148-50. [ Links ]
10. Nagore E, Pereda C. Botella-Estrada, Requena C, Guillén C. Acral lentiginous melanoma presents distinct clinical profile with high cancer susceptibility. Cancer Causes Control. 2009;20:115-9. [ Links ]
11. O'Leary JA, Berend KR, Johnson JL, Levin LS, Seigler HF. Subungual melanoma: A review of 93 cases with identification of prognostic variables. Clin Orthop Relat Res. 2000;378: 206-12. [ Links ]
12. Nestle FO. Halpern AC. Neoplasm of the skin. Dermatology. Second edition. Madrid: Mosby; 2008. p. 1745-69. [ Links ]
13. Balch CM, Urist MM, Maddox WA, Soong SJ. Melanoma in the Southern United States. In: Balch CM, Milton WG, editors. Cutaneos melanoma: Clinical management and treatment results worldwide. Philadelphia, PA: JB Lippincott, 1985. p. 397-406. [ Links ]
14. Durbec F, Martin L, Derancourt C, Grange F. Melanoma of the hand and foot: Epidemiological, prognostic and genetic features. A systematic review. Br J Dermatol. 2012;166:727-39. [ Links ]
15. Balch CM, Gershenwald JE, Soong SJ, Thompson JF, Atkins MB, Byrd DR, et al. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol. 2009;27:6199-206. [ Links ]
16. Thompson JF, Soong SJ, Balch CM, Gershenwald JE, Ding S, Colt DG, et al. Prognostic significance of mitotic rate in localized primary cutaneous melanoma: An analysis of patients in the multi-institutional American Joint Committee on Cancer melanoma staging database. J Clin Oncol. 2011;29:2199-205. [ Links ]
17. Bello DM, Chou JF, Panageas KS, Brady MS, Coit DG, Carvajal RD, et al. Prognosis of acral melanoma: A series of 281 patients. Ann Surg Oncol. 2013;20:3618-25. [ Links ]
18. Bradford P. Acral lentiginous melanoma: Incidence and survival patterns in the United States, 1986-2005. Arch Dermatol. 2009;145:427-34. [ Links ]
19. Rex J, Paradelo C, Mangas C, Hilari JM, Fernández-Figueras MT, Ferrándiz C. Management of primary cutaneous melanoma of the hands and feet: a clinic-prognostic study. Dermatol Surg. 2009;35:1505-13. [ Links ]
20. Takata M. Acral melanoma: Clinical, biologic and molecular genetic characteristics. En: Murph M, editor. Melanoma in the clinic: Diagnosis, management and complications of malignancy. InTech. 2011;3-14. [ Links ]
21. Colombino M, Capone M, Lissia A, Cossu A, Rubino C, De GiorgiV, et al. BRAF/NRAS mutation among primary tumors and metastases in patients with melanoma. J Clin Oncol. 2012;30:2522-9. [ Links ]
22. Maldonado JL, Fridlyand J, Patel H, Jain AN, Busam K, Kageshita T, et al. Determinants of BRAF mutations in primary melanomas. J Natl Cancer Inst. 2003;95:1878-80. [ Links ]
23. Saldanha G, Potter L, Daforno P, Pringle JH. Cutaneous melanoma subtypes show different BRAF and NRAS mutation frequencies. Clin Cancer Res. 2006;12:4499-505. [ Links ]
24. Ashida A, Takata M, Murata H, Kido K, Saida T. Pathological activation of KIT in metastasic tumors of acral and mucosal melanomas. Int J Cancer. 2009;124:863-8. [ Links ]
25. Marrero B, Shirley S, Heller R. Delivery of interleukin-15 to B16 melanoma by electroporation leads to tumor regression and long-term survival. Technol Cancer Res Treat. 2013. Fecha de consulta: 22 de febrero de 2014. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/24000979. DOI:10.7785/tcrtexpress.2013.600252. [ Links ]
26. Ibrahim ZA. Cyclin D1 expression in acral melanoma: A case control study in Sarawak. Malays J Pathol. 2012;34:89-95. [ Links ]
27. Abbasi NR, Shaw HM, Rigel DS, Friedman RJ, McCarthy WH, Osman I, et al. Early diagnosis of cutaneous melanoma: Revisiting the ABCDE criteria. JAMA. 2004;292:2771-6. [ Links ]
28. Soon SL, Salomon Jr AR, Papadopoulos D, Murray DR, McAlpine B, Washington CV. Acral lentiginous melanoma mimicking benign disease: The Emory experience. J Am Acad Dermatol. 2003;48:183-8. [ Links ]
29. Pereda C. Clinical presentation of acral lentiginous melanoma: A descriptive study. Actas Dermosifiliogr. 2013;104:220-6. [ Links ] doi: 10.1016/j.ad.2012.06.006.
30. Pflugfelder A, Weide B, Eigentler TK, Forschner A, Leiter U, Held L, et al. Incisional biopsy and melanoma prognosis: Facts and controversies. Clin Dermatol. 2010;28:316-8. [ Links ]
31. Takata M, Saida T. Early cancers of the skin: Clinical, histopathological, and molecular characteristics. Int J Clin Oncol. 2005;10:391-7. [ Links ]
32. Bertolotto C. Melanoma: From melanocyte to genetic alterations and clinical options. Scientifica. 2013; Article ID 635203. [ Links ]
33. Bastian BC. Targeting activated KIT signaling for melanoma therapy. J Clin Oncol . 2013;31:3288-90. [ Links ]
34. Edge S, Byrd DR, Compton CC. Melanoma of the skin. AJCC Cancer Staging Manual. 7th edition. New York. Springer; 2010. p. 325-44. [ Links ]
35. Trotter S. A global review of melanoma follow-up guidelines. J Clin Aesthet Dermatol. 2013;6:18-26. [ Links ]
36. Moehrle M, Metzger S, Schippert W, Garbe C, Rassner G, Breuninger H. "Functional" surgery in subungual melanoma. Dermatol Surg. 2003;29:366-74. [ Links ]
37. Australian Cancer Network Melanoma Guidelines Revision Working Party. Clinical Practice Guidelines for the Management of Melanoma in Australia and New Zealand. Cancer Council Australia and Australian Cancer Network, Sydney and New Zealand Guidelines Group, Wellington (2008). Fecha de consulta: 29 de mayo de 2014. Disponible en: www.cancer.org.au/skincancerguides . [ Links ]
38. Morton DL. Overview and update on the first and second Multicenter Selective Lymphadenectomy Trials (MSLT-I and MSLT-II) in melanoma. Clin Exp Metastasis. 2012;29:699-706. [ Links ]
39. Morton DL, Thompson JF, Cochran AJ, Mozzillo N, Elashoff R, Essner R. Sentinel-node biopsy or nodal observation in melanoma. N Engl J Med. 2006;355:1307-17. [ Links ]
40. Eggermont AM, Suciu S, Testori A, Kruit W, Marsden J, Punt C, et al. Ulceration and stage are predictive of interferon efficacy in melanoma: Results of the phase III adjuvant trials EORTC 18952 and EORTC 18991. Eur J Cancer. 2012;48:218-25. [ Links ]
41. Tsao H, Atkins MB, Sober AJ. Management of cutaneous melanoma. N Engl J Med. 2004;351:998-1042. [ Links ]
42. Davar D, Tarhini AA, Kirkwood JM. Adjuvant therapy for melanoma. Cancer J. 2012;18;192-202. [ Links ]
43. Bedikian AY, DeConti RC, Conry R, Agarwala S, Papadopoulos N, Kim KB, et al. Phase 3 study of docosahexaenoic acid-paclitaxel versus dacarbazine in patients with metastatic malignant melanoma. Ann Oncol. 2011;22:787-93. [ Links ]
44. Chapman PB, Hauschild A, Robert C, Haanen JB, Ascierto P, Larkin J, et al. Improved survival with vemurafenib in melanoma with BRAF-V600E mutation. N Engl J Med. 2011;364:2507-16. [ Links ]
45. Hauschild JJ, Grob LV, Demidov LV, Jouary T, Gutzmer R, Millward M, et al. Dabrafenib in BRAF-mutated metastatic melanoma: A multicentre, open label, phase 3 randomized controlled trial. Lancet. 2012;380:358-65. [ Links ]
46. Hayes AJ, Neuhaus SJ, Clark MA, Thomas JM. Isolated limb perfusion with melphalan and tumor necrosis factor alpha for advanced melanoma and soft-tissue sarcoma. Ann Surg Oncol. 2007;14:230-8. [ Links ]
47. Moreno-Ramírez D. Isolated limb perfusion for malignant melanoma: Systematic review on effectiveness and safety. Oncologist. 2010;15:416-27. doi: 10.1634/theoncologist. 2009-0325. [ Links ]
48. Coleman A. Optimizing regional infusion treatment strategies for melanoma of the extremities. Expert Rev Anticancer Ther. 2009;9:1599-609. [ Links ] doi: 10.1586/era.09.126.
49. Ballo MT, Ang KK. Malignant melanoma. In: Gunderson L, Tepper J. editors. Clinical radiation oncology. Second edition. Philadelphia: Churchill Livingstone; 2007. p. 865-77. [ Links ]
50. Hodi FS, O'Day SJ, McDermott DF, Weber RW, Sosman JA, Haanen JB, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med. 2010;363:711-23. [ Links ]
51. Bello DM, Chou JF, Panageas KS, Brady MS, Coit DG, Carvajal RD, et al. Prognosis of acral melanoma: A series of 281 patients. Ann Surg Oncol. 2013;20:3618-25. [ Links ]
52. Kosmidis C, Efthimiadis C, Anthimidis G, Grigoriou M, Vasiliadou K, Ioannidou G, et al. Acral lentiginous melanoma: A case-control study and guidelines update. Case Rep Med. 2011; Article ID 670581. [ Links ]
53. Sheppard KE. The cell-cycle regulator CDK4: An emerging therapeutic target in melanoma. Clin Cancer Res. 2013;19:5320-8. doi: 10.1158/1078-0432.CCR-13-0259. [ Links ]













