Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Cirugía
versão impressa ISSN 2011-7582
rev. colomb. cir. vol.30 no.1 Bogotá jan./mar. 2015
1 Médica, cirujana general, Clínica Universitaria Bolivariana; docente de pregrado y posgrado en Cirugía General, Universidad Pontificia Bolivariana, Medellín, Colombia.
2 Médico, residente de Cirugía General, Universidad Pontificia Bolivariana, Medellín, Colombia.
3 Medica, Universidad Pontificia Bolivariana, Medellín, Colombia.
Fecha de recibido: 5 de junio de 2014. Fecha de aprobación: 19 de diciembre de 2014.
Resumen
El tumor del estroma gastrointestinal (Gastrointestinal Stromal Tumor, GIST), localizado en el apéndice, constituye una entidad poco frecuente. Su cuadro clínico e imaginológico es indistinguible de una apendicitis aguda, por lo que su diagnóstico definitivo está dado por el estudio histopatológico e inmunohistoquímico. El tratamiento estándar es la apendicectomía. El propósito de este artículo es la presentación de un caso clínico y la revisión de la literatura.
Palabras clave: apéndice; apendicitis; tumores del estroma gastrointestinal; diagnóstico diferencial; apendicectomía.
Abstract
The gastrointestinal stromal tumor (GIST) located in the appendix is a rare entity. It is clinical indistinguishable from acute appendicitis, so definitive diagnosis is given by the histopathological and immunohistochemical studies. The standard treatment is appendectomy. The purpose of this article is presenting a case study and review of the literature.
Key words: appendix; appendicitis; gastrointestinal stromal tumors; diagnosis, differential; appendectomy.
Introducción
Los tumores submucosos gastrointestinales son principalmente de origen mesenquimatoso, e incluyen tumores miogénicos, neurogénicos y los del estroma propiamente dicho, los cuales son las neoplasias más frecuentes originadas en el mesénquima del tubo digestivo y muy resistentes a la quimioterapia y a la radioterapia 1, 2. Los GIST (Gastrointestinal Stromal Tumor) tienen una baja incidencia reportada a nivel mundial, de 11 a 15 casos por 1'000.000 habitantes 3 y, aunque predominan en personas adultas, pueden presentarse en niños y adolescentes (1,4 a 2,7 %) 4.
Los GIST se originan en las células de Cajal, que son células progenitoras mesenquimatosas, situadas en los plexos mientéricos de la pared gastrointestinal y que actúan sobre la motilidad intestinal coordinando la peristalsis. Expresan en su membrana un receptor proteínico de la familia de las tirosin-cinasas, denominado KIT, codificado por el protooncogen C-Kit, que permite el diagnóstico mediante la detección del anticuerpo monoclonal CD117, que es positivo en el 95 % de los casos reportados 5-7 con tipología fusiforme, epitelioide o mixta; son primarios del aparato gastrointestinal, epiplón, mesenterio y retroperitoneo 8. El 5 % es negativo para CD117 (GIST Kit-negativos), del cual el 90 % presenta una mutación en el gen PDGFRA en los exones 12 y 18, con tan débil expresión de la proteína KIT que no puede detectarse por inmunohistoquímica 9.Los tumores mesenquimatosos del apéndice son muy raros y, generalmente, su diagnóstico es incidental. Hasta el año 2001 no había reportes en la literatura científica, porque se clasificaban como leiomioma, leiomiosarcoma y leiomioblastoma 10, haciendo difícil la caracterización de su comportamiento, manejo y pronóstico 11-12. De los casos reportados posteriormente, solo un caso era maligno 13.
En el caso que se presenta, la apendicectomía reveló una lesión tumoral apendicular. El reporte de patología fue indicativo de GIST y el análisis de inmunohistoquímica fue positivo para C-Kit (CD117), CD4 y proteína S100.
Presentación de caso
Paciente de 57 años de edad que ingresó al servicio de urgencias por un cuadro clínico de tres días de evolución de dolor abdominal súbito de tipo cólico, de moderada intensidad, inicialmente localizado en el mesogastrio y posteriormente irradiado a la fosa ilíaca derecha, acompañado de emesis. Refirió antecedentes: patológicos, de diabetes mellitus, dislipidemia y esteatosis hepática; farmacológicos, de consumo crónico de estatinas y metformina; y quirúrgicos, de cesárea, colecistectomía y cistopexia.
Se encontró estabilidad hemodinámica, dolor a la palpación abdominal y signos de irritación peritoneal en la fosa ilíaca derecha. Los exámenes de laboratorio mostraron hemoglobina, 15 g/dl; leucocitos, 9.290/µl; 60 % de neutrófilos; 28 % de linfocitos; 10 % de monocitos; 308.000 plaquetas/µl y proteína C reactiva, 1,65 mg/L.
Se programó una intervención quirúrgica con la impresión diagnóstica de apendicitis aguda. Como hallazgos intraoperatorios se informó un apéndice edematoso y una lesión tumoral de aspecto nodular y color blanco grisáceo, de 1 cm de longitud, aproximadamente.
En la histopatología se informó: luz apendicular ocupada por pus, mucosa focalmente ulcerada con infiltrado inflamatorio por polimorfomonucleares neutrófilos que comprometía todas las capas viscerales y se extendía hasta el tejido periapendicular. Hacia la punta apendicular, a nivel submucoso y comprometiendo la capa muscular, se observó una neoplasia de estroma, compuesta por células fusiformes de apariencia uniforme, dispuestas en fascículos entrecruzados, sin atipias y con mitosis ocasionales.
Estos hallazgos indicaban un tumor del estroma gastrointestinal, que se confirmó con marcadores positivos C-Kit, CD 34 y proteína S100 positivos (figura 1).
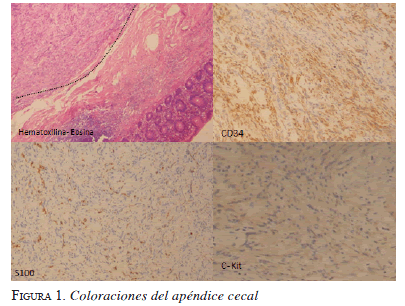
En el periodo posoperatorio, la paciente evolucionó favorablemente. Se realizó seguimiento con colonoscopia y tomografía axial abdominal con contraste, los cuales no evidenciaron otras lesiones.
Discusión
Los GIST son la neoplasia más común del aparato gastrointestinal originada en el mesénquima; ocurren entre la quinta y la sexta décadas de la vida, y son más frecuentes en hombres que en mujeres 11. Pueden presentarse en cualquier parte del tubo digestivo: estómago (50-60 %), intestino delgado (20-30 %), duodeno (4-5 %), recto (4 %), colon y apéndice (1-2 %) y esófago (<1 %).
Aunque son lesiones tumorales que predominan en la población adulta, la pediátrica también puede verse afectada. En niños, el estómago es el órgano más afectado (76 %), seguido por el intestino delgado (21 %) y el colon (3 %); más raro aún, es el reporte de un GIST apendicular en un niño de siete años con cuadro de apendicitis aguda, que fue llevado a apendicectomía por laparoscopia, sin complicaciones y con margen negativo para compromiso tumoral 4.
Se ha demostrado la presentación sincrónica de los GIST con otros tumores, específicamente con la neurofibromatosis de tipo I, el síndrome de Carney (GIST gástrico, condroma pulmonar y paragangliomas extrasuprarrenales) y el síndrome de Carney-Stratakis (paragangliomas y GIST hereditarios) 14-16. También se ha reportado asociación con otras enfermedades, en especial con trastornos hematológicos; sin embargo, no existe suficiente evidencia para demostrar su directa relación 16,17.
El pronóstico de estos tumores varía según su agresividad, la cual está dada por factores como tamaño, actividad mitótica y localización de la lesión; se consideran de bajo riesgo los de escasa actividad mitótica y menor tamaño.
Los criterios de Fletcher, et al., clasificaron el riesgo con base en dos criterios, tamaño y tasa de mitosis, distribuyéndolos así:
• Muy bajo riesgo: menor de 2 cm, tasa mitótica inferior a 5 por 50 campos de mayor aumento.
• Bajo riesgo: entre 2 y 5 cm, y tasa mitótica menor de 5 por 50 campos de mayor aumento.
• Riesgo intermedio: tamaño menor de 5 cm, mitosis de 6 a10 por 50 campos de mayor aumento, o tamaño entre 5 y 10 cm y mitosis de menos de 5 por 50 campos de mayor aumento.
• Alto riesgo: mayor de 5 cm y tasa de mitosis menor de 5 por 50 campos de alto poder, o de 10 o más cm y cualquier tasa mitótica. o cualquier tamaño y mitosis de más de10 por 50 campos de mayor aumento 18,19.
Los sitios de metástasis más comunes son el hígado y el peritoneo; comprometen con menor frecuencia huesos, pulmones y ganglios linfáticos 20. De 20 a 25 % de los tumores de localización gástrica y 40 a 50% de los de intestino delgado, son clínicamente invasores 21,22 y, aproximadamente, de 10 a 25 % de los pacientes se presentan con enfermedad metastásica 23.
El tratamiento de elección para los GIST gastrointestinales es la resección quirúrgica completa con márgenes sin compromiso tumoral (R0). En caso de resección R1, la reescisión puede llegar a ser una opción terapéutica.
Para los pacientes con enfermedad localizada tratados quirúrgicamente, los esquemas rutinarios de seguimiento pueden diferir según las instituciones. Se puede practicar una tomografía axial abdominal y las lesiones de riesgo muy bajo no necesitan de pruebas rutinarias de seguimiento 24.
Son resistentes a la quimioterapia y a la radioterapia. Los tumores irresecables o potencialmente resecables que requieran una resección extensa de un órgano con el fin de obtener márgenes negativos, se beneficiarían de tratamiento neoadyuvante oral, con inhibidores selectivos del receptor Kit de la tirosin-cinasa 25. No obstante, no hay consenso aceptado sobre el tratamiento adyuvante, y su aplicación se basa en las características individuales del paciente y el riesgo de recurrencia o persistencia de la enfermedad. Incluso, el estudio del estado de las mutaciones del PDGFRA y el D842V, pueden ser útiles para determinar la sensibilidad y la respuesta.
En el año 2002, la Food and Drug Administration (FDA) de los Estados Unidos, aprobó el imatinib para los GIST metastásicos o irresecables y, en 2006, el sunitinib, para los casos resistentes al imatinib. La PET-18F-FDG (tomografía por emisión de positrones-tomografía computadorizada con 18F-fluorodeoxiglucosa) tiene gran sensibilidad en la valoración de la respuesta precoz y a largo plazo, frente al tratamiento con imatinib en pacientes con GIST avanzados CD117-positivos, pues, a mayor captación de glucosa por parte del tumor, mayor actividad metabólica y, por tanto, mayor agresividad 26-29.
En cuanto a la supervivencia, en un estudio retrospectivo que incluyó 200 pacientes con tumores del estroma gastrointestinal de cualquier localización, la mediana de supervivencia específica para aquellos con enfermedad metastásica (n=94) fue de 19 meses 23.
Los GIST que comprometen el apéndice cecal son muy raros. En resecciones de colon que incluyeron apéndice, han reportado una incidencia de 0,1 % de GIST microscópicos 30,31. Su presentación clínica da la impresión diagnóstica de apendicitis aguda, por lo cual la apendicectomía es el tratamiento quirúrgico, y la histopatología y la inmunohistoquímica hacen el diagnóstico definitivo. En general, se consideran de buen pronóstico, sin tener claridad si es por el tamaño tumoral o por su detección y tratamiento precoces 32.
Debido a su rareza, el perfil de riesgo y el manejo adecuado de los GIST apendiculares aún no se han establecido completamente. En la actualidad, no existen guías específicas para el manejo de estos tumores. Sin embargo, extrapolaciones del tratamiento en otras regiones del aparato gastrointestinal, dan pautas para su tratamiento. El tratamiento adyuvante con imatinib se recomienda en casos específicos, como ruptura intraoperatoria del tumor por el riesgo de recurrencia o compromiso peritoneal, o en tumores de alto riesgo según sus características histológicas.
En la revisión de la literatura científica se han reportado 14 casos de GIST en el apéndice (tabla 1). Los pacientes afectados tienen un rango de edad de 7 a 78 años, con predominio en el sexo masculino. El tamaño de estos tumores varía entre 2,5 y 25 mm, aunque un paciente presentó una masa de 20 cm. Hay ocho casos reportados con diagnóstico preoperatorio de apendicitis y un paciente presentó hemorragia digestiva baja 33. Otros casos fueron hallazgos incidentales en procedimientos realizados por otra causa diferente al diagnóstico de apendicitis.
En el caso presentado por los autores, el GIST apendicular fue un hallazgo incidental durante la cirugía de un paciente con diagnóstico clínico de apendicitis, confirmado con marcadores C-Kit, CD 34 y proteína S100, con muy bajo riesgo por su escasa actividad mitótica, por lo que no requirió tratamiento adyuvante.
Conclusión
Se presenta un nuevo caso de GIST apendicular con la revisión de los reportados. Los GIST del apéndice cecal son neoplasias poco frecuentes, con síntomas inespecíficos indiferenciables de la apendicitis aguda o como hallazgo intraoperatorio incidental.
Es difícil hacer su diagnóstico preoperatorio y, por lo general, se logra con el resultado de histopatología e inmunohistoquímica. Los síntomas de apendicitis aguda en personas mayores, de sexo masculino, sin elevación de reactantes, presencia de una masa o engrosamiento del apéndice en las imágenes, son hallazgos que pueden hacer sospechar la presencia de un GIST apendicular.
El tratamiento para la mayoría de los casos es la apendicectomía. En algunos casos, la resección de tejido y órganos adyacentes o la base del ciego, puede ser necesaria para la eliminación completa del tumor y reducir al mínimo el riesgo de recurrencia local.
El pronóstico y el seguimiento se asumen igual que con otros GIST gastrointestinales, con base en los criterios de Fletcher y la localización de la lesión, debido a los escasos reportes de GIST apendicular.
Referencias
1. Nishida T, Hirota S. Biological and clinical review of stromal tumors in the gastrointestinal tract. Histol Histopathol. 2000;15:1293-301. [ Links ]
2. Rubin BP, Heinrich MC, Corless CL. Gastrointestinal stromal tumour. Lancet. 2007;369:1731-41. [ Links ]
3. Worley TA, Abadin SS, Revesz E, Salti GI. Gastrointestinal stromal tumor with hemoperitoneum masquerading as appendicitis. Int Surg. 2010;95:8-11. [ Links ]
4. Tran S, Dingeldein M, Mengshol SC, Kay S, Chin AC. Incidental GIST after appendectomy in a pediatric patient: A first instance and review of pediatric patients with CD117 confirmed GISTs. Pediatr Surg Int. 2014;30:457-66. [ Links ]
5. Corless CL, Fletcher JA, Heinrich MC. Biology of gastrointestinal stromal tumors. J Clin Oncol. 2004;22:3813-25. [ Links ]
6. Tornillo L, Terracciano LM. An update on molecular genetics of gastrointestinal stromal tumours. J Clin Pathol. 2006;59:557-63. [ Links ]
7. Rahimi K, Gologan A, Haliotis T, Lamoureux E, Chetty R. Gastrointestinal stromal tumor with autonomic nerve differentiation and coexistent mantle cell lymphoma involving the appendix. Int J Clin Exp Pathol. 2008;2:608-13. [ Links ]
8. Miettinen M, Lasota J. Gastrointestinal stromal tumors-definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch. 2001;438:1-12. [ Links ]
9. Nishida T, Takahashi T, Miyazaki Y. Gastrointestinal stromal tumor: A bridge between bench and bedside. Gastric Cancer. 2009;12:175-88. [ Links ]
10. Miettinen M, Sobin LH. Gastrointestinal stromal tumors in the appendix: A clinicopathologic and immunohistochemical study of four cases. Am J Surg Pathol. 2001;25:1433-7. [ Links ]
11. Vassos N, Agaimy A, Günther K, Hohenberger W, Schneider-Stock R, Croner RS. A novel complex KIT mutation in a gastrointestinal stromal tumor of the vermiform appendix. Hum Pathol. 2013;44:651-5. [ Links ]
12 Yap WM, Tan HW, Goh SG, Chuah KL. Appendiceal gastrointestinal stromal tumor. Am J Surg Pathol. 2005;29:1545-7. [ Links ]
13. Elazary R, Schlager A, Khalaileh A, Appelbaum L, Bala M, Abu-Gazala M, et al. Malignant appendiceal GIST: Case report and review of the literature. J Gastrointest Cancer. 2010;41:9-12. [ Links ]
14. Miettinen M, Lasota J. Gastrointestinal stromal tumors: Pathology and prognosis at different sites. Semin Diagn Pathol. 2006;23:70-83. [ Links ]
15. Agaimy A, Wünsch PH, Sobin LH, Lasota J, Miettinen M. Occurrence of other malignancies in patients with gastrointestinal stromal tumors. Semin Diagn Pathol. 2006;23:120-9. [ Links ]
16. Burgoyne AM, Somaiah N, Sicklick JK. Gastrointestinal stromal tumors in the setting of multiple tumor syndromes. Curr Opin Oncol. 2014;26:408-14. [ Links ]
17. Kover E, Faluhelyi Z, Bogner B, Kalmar K, Horvath G, Tornoczky T. Dual tumours in the GI tract: Synchronous and metachronous stromal (GIST) and epithelial/neuroendocrine neoplasms. Magy Onkol.2004;48:315-21. [ Links ]
18. Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor. Hum Pathol. 2008;39:1411-9. [ Links ]
19. Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, et al. Diagnosis of gastrointestinal stromal tumors: A consensus approach. Hum Pathol. 2002;33:459-65. [ Links ]
20. Vassos N, Agaimy A, Hohenberger W, Croner RS. Extraabdominal lymph node metastasis in gastrointestinal stromal tumors (GIST). J Gastrointest Surg. 2011;15:1232-6. [ Links ]
21. Joensuu H. Gastrointestinal stromal tumor (GIST). Ann Oncol. 2006;17(Suppl.10):280-6. [ Links ]
22. Miettinen M, Lasota J. Gastrointestinal stromal tumors: Review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med. 2006;130:1466-78. [ Links ]
23. DeMatteo RP, Lewis JJ, Leung D. Two hundred gastrointestinal stromal tumors: Recurrence patterns and prognostic factors for survival. Ann Surg. 2000;231:51-8. [ Links ]
24. Casali PG, Jost L, Reichardt P. Gastrointestinal stromal tumors: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol. 2008;19(Suppl.2):ii35-8. [ Links ]
25. Chacón M, Roca E, Huertas E, Loria FS, Domenechini E. Pathologic complete remission of metastatic gastrointestinal stromal tumor after imatinibmesy late. J Clin Oncol. 2005;23:1580. [ Links ]
26. Casali PG, Blay JY. Consensus Panel of Experts. Gastrointestinal stromal tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2010;21(Suppl.5):v98-102. [ Links ]
27. Láng I, Hitre E, Horváth Z, Godény M. Resection of originally inoperable liver metastases of gastrointestinal stromal tumor after imatinibmesy late therapy. J Clin Oncol. 2003;21:3538. [ Links ]
28. Andtbacka RH, Ng CS, Scaife CL, Cormier JN, Hunt KK, Pisters PW, et al. Surgical resection of gastrointestinal stromal tumors after treatment with imatinib. Ann Surg Oncol. 2007;14:14. [ Links ]
29. Acín-Gándara D, Pereira-Pérez F, Castaño-Pascual A, Durán-Poveda M, Antequera-Pérez A, Miliani-Molina C. Gastrointestinal stromal tumors: Diagnosis and treatment. Cir Cir. 2012;80:44-51. [ Links ]
30. Agaimy A, Wünsch PH, Dirnhofer S, Bihl MP, Terracciano LM, Tornillo L. Microscopic gastrointestinal stromal tumors in esophageal and intestinal surgical resection specimens: A clinicopathologic, immunohistochemical, and molecular study of 19 lesions. Am J Surg Pathol. 2008;32:867-73. [ Links ]
31. Bouassida M, Chtourou MF, Chalbi E, Chebbi F, Hamzaoui L, Sassi S, et al. Appendiceal GIST: Report of an exceptional case and review of the literature. Pan Afr Med J. 2013;15:85. [ Links ]
32. Agaimy A, Pelz AF, Wieacker P, Roessner A, Wünsch PH, Schneider-Stock R. Gastrointestinal stromal tumors of the vermiform appendix: Clinicopathologic, immunohistochemical, and molecular study of 2 cases with literature review. Hum Pathol. 2008;39:1252-7. [ Links ]
33. Kim KJ, Moon W, Park MI, Park SJ, Lee SH, Chun BK. Gastrointestinal stromal tumor of appendix incidentally diagnosed by appendiceal hemorrhage. World J Gastroenterol. 2007;13:3265-7. [ Links ]













