Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Cirugía
versión impresa ISSN 2011-7582
rev. colomb. cir. vol.30 no.3 Bogotá jul./set. 2015
MD, MSc, PhD, cirujano de Cabeza y Cuello, Hospital Pablo Tobón Uribe; profesor asociado, Departamento de Cirugía, Universidad de Antioquia, Medellín, Colombia.
Correspondencia: Alvaro Sanabria, MD, MSc, PhD, FACS, Medellín, Colombia. Correo electrónico: alvarosanabria@gmail.com
Fecha de recibido: 9 de febrero de 2015. Fecha de aprobación: 24 de junio de 2015.
Resumen
La tiroidectomía es la cirugía cervical más frecuente, con poca frecuencia de complicaciones. La frecuencia de lesión definitiva del nervio laríngeo recurrente es menor de 1 %, la de hipoparatiroidismo definitivo es de 1 a 2 % y la de hematoma cervical es de 0,5 %. La frecuencia de la lesión bilateral del nervio laríngeo recurrente que obliga a una traqueostomía, es inferior al 0,2 %. Desde hace más de una década aparecieron reportes del uso de la neuromonitorización intermitente, como una estrategia para disminuir aún más el riesgo de lesión del nervio laríngeo recurrente y del laríngeo superior.
El objetivo de esta revisión es exponer la información disponible en pro o en contra del uso rutinario de la neuromonitorización intermitente en la cirugía de tiroides.
En cinco de las seis revisiones sistemáticas, llegan a la conclusión de que no existen datos que demuestren que las lesiones definitivas del nervio laríngeo recurrente o el laríngeo superior, disminuyan con el uso rutinario de la neuromonitorización. La mayoría de los autores sugieren que los pacientes de alto riesgo de lesión del nervio serían los más beneficiados, pero la definición de alto riesgo es bastante heterogénea e indefinida. El uso del monitor ayuda poco en la toma de decisiones, específicamente cuando se pierde la señal, que es el objetivo con el cual se usa. Tampoco existen datos que demuestren que el uso del neuromonitor disminuya las demandas médico-legales.
Palabras clave: glándula tiroides; tiroidectomía; nervio laríngeo recurrente; conducción nerviosa; monitorización intraoperatorio; factores de riesgo.
Abstract
Thyroidectomy is the most frequent surgical procedure performed on the neck and is associated with a low number of complications. The rate of definitive injury of the recurrent laryngeal nerve is lower than 1%, of definitive hypoparathyroidism is around 1-2%, and of neck hematoma is lower than 0.5%. The incidence of bilateral recurrent laryngeal nerve injury needing tracheostomy is lower than 0.2%. For more than a decade there have appeared reports suggesting that intermittent neuromonitoring is a strategy to decrease even more the risk of laryngeal nerve injuries. This review discusses the available evidence about the effectiveness of intermittent neuromonitoring in thyroidectomy.
Five of six systematic reviews concluded that there is no evidence of a statistically significant decrease in the rate of laryngeal nerves injuries with the routine use of neuromonitoring. Most authors agree that the device will be useful in high risk patients, but definition of high risk is heterogeneous and unclear. Routine use of monitoring offers a minor advantage in decision making during surgery, especially when a loss of signal occurs. Besides, there is no evidence that neuromonitoring decreases the number of medico legal issues.
Key words: thyroid gland; thyroidectomy; recurrent laryngeal nerve; neural conduction; monitoring, intraoperative; risk factors.
Introducción
La tiroidectomía es la cirugía cervical más frecuente. Se estima que en Estados Unidos se practican 35.000 tiroidectomías anuales, mientras que en Alemania se hacen 90.000 1. El dato en Latinoamérica es desconocido. En Colombia no existe un registro del número de tiroidectomías, pero se estima que puede ser de 2.500 por año.
La tiroidectomía es un procedimiento con poca frecuencia de complicaciones. Las estadísticas de los grandes centros con médicos dedicados a la cirugía de cuello, reportan una frecuencia de lesión definitiva del nervio laríngeo recurrente de menos de 1 %, de hipoparatiroidismo definitivo, de 1 a 2 %, y de hematoma cervical, de 0,5 % 2. La frecuencia de lesión bilateral de dicho nervio que obliga a una traqueostomía, es inferior a 0,2 %. No obstante, estos números son mayores cuando se toman las estadísticas de centros no especializados, y la frecuencia de lesión del nervio laríngeo recurrente puede ser de 5 a 15 % y, de hipoparatiroidismo, de 30 % 3. Incluso en estos casos, el número de traqueostomías secundarias a lesión bilateral del nervio, es menor de 1%. Esto se explica porque la gran mayoría de tiroidectomías son practicadas por cirujanos que hacen menos de 10 procedimientos por año y, hoy en día, se ha demostrado que la curva de aprendizaje para mantener al mínimo las complicaciones quirúrgicas es de alrededor de 100 tiroidectomías por año.
De estas complicaciones, la más temida es el hematoma cervical sofocante. Aunque su frecuencia es muy baja, sus consecuencias son trágicas y pueden terminar en la muerte del paciente 4. En segundo lugar se encuentra el hipoparatiroidismo temporal, que puede ocurrir en cerca del 30 % de los pacientes, y suele resultar en síntomas incómodos para el paciente, como parestesias de los miembros y una sensación inminente de muerte. Afortunadamente, sus consecuencias mortales son mínimas y los síntomas son fácilmente tratables con calcio intravenoso 5. Mucho más importante es el hipoparatiroidismo definitivo que, aunque también infrecuente, requiere de tratamiento de por vida con grandes cantidades de calcio y calcitriol, y produce un efecto significativo en la calidad de vida y secuelas sistémicas por el uso a largo plazo de estas dosis suprafisiológicas de calcio. Además, aunque se ha intentado usar hormona paratiroidea exógena, en la práctica clínica no existe curación para dicha complicación.
En tercer lugar se encuentra la lesión temporal del nervio laríngeo recurrente, que produce disfonía posoperatoria importante con la consecuente dificultad en la comunicación en las primeras semanas, pero que suele recuperarse hasta en el 90 % entre 8 y 24 semanas después de la cirugía. Incluso, se estima que hay muchos casos de lesiones que pasan inadvertidas clínicamente, pues en los estudios en los que se ha practicado laringoscopia posoperatoria rutinaria, se reportan frecuencias de parálisis de hasta 15 % 6. En la lesión definitiva, definida como aquella por más de seis a doce meses, según la serie que se consulte, persisten las dificultades de comunicación y se afecta la calidad de vida en un grado importante, pero menor que con el hipoparatiroidismo.
Afortunadamente, existen alternativas quirúrgicas para la corrección de la disfonía posoperatoria (inyección de material directamente en las cuerdas vocales, desplazamiento medial de las cuerdas vocales) que permiten recuperar la voz con el 90 % de su calidad vocal previa 7. La lesión del nervio laríngeo superior, temporal o definitiva, mucho más frecuente que la del nervio laríngeo recurrente, tiene pocas implicaciones clínicas para las personas que no son profesionales de la voz; en estos profesionales, sus consecuencias son desastrosas, pues impide alcanzar los tonos altos. Los tratamientos existentes para esta lesión son poco efectivos.
Desde hace más de una década aparecieron reportes de la neuromonitorización intermitente, como estrategia para disminuir aún más el riesgo de lesión del nervio laríngeo recurrente y del laríngeo superior 8. La neuromonitorización intermitente es una extensión de los primeros sistemas de esta técnica, en los que se insertaba un electrodo en los músculos efectores laríngeos y se estimulaba directamente el nervio en estudio para evaluar su integridad anatómica y fisiológica. Posteriormente, se avanzó con el uso de tubos endotraqueales especialmente diseñados para tomar la señal efectora directamente del movimiento de las cuerdas vocales, los cuales evitan la inserción de electrodos en los músculos laríngeos 9. Algunos defensores de la neuromonitorización sugieren que el uso de esta tecnología debe ser rutinario en todas las tiroidectomías, mientras que otros lo recomiendan para casos de alto riesgo quirúrgico 10,11. Por el contrario, otros cirujanos no recomiendan su uso rutinario y la reservan para casos muy específicos, como en las reintervenciones 12. Como esta tecnología impone un valor extra al procedimiento quirúrgico ya establecido y esto afecta el sistema de salud pues desplaza los recursos de unas actividades a otras –el costo de oportunidad– (por ejemplo, se dejan de practicar otras cirugías u otros procedimientos), es importante determinar si su uso es recomendable en Colombia.
El objetivo de esta revisión es exponer la información disponible en pro o en contra del uso rutinario de la neuromonitorización intermitente en la cirugía de tiroides.
'Evidencia' disponible
En una búsqueda en la base bibliográfica Pubmed de la National Library of Medicine con los términos thyroid and (neuromonitoring OR nerve monitoring), se encontró que, a partir de 1990, el número de publicaciones ha venido aumentando vertiginosamente y, en 2010, se publicaron más de 200 artículos relacionados con el tema (figura 1).
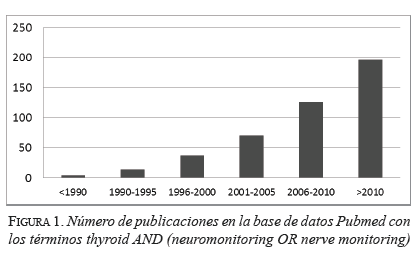
De estos artículos, una búsqueda más específica permitió identificar seis revisiones sistemáticas con metaanálisis 13-17. Higgins, et al., incluyeron 42 estudios con 64.699 nervios en riesgo: siete fueron ensayos clínicos no aleatorios y solo uno fue aleatorio; los demás fueron series de casos 13.
En múltiples comparaciones, los autores no encontraron diferencias estadísticamente significativas en relación con la prevención de una lesión temporal o definitiva del nervio laríngeo recurrente. Zheng, et al., incluyeron 17 estudios (5 ensayos clínicos aleatorios y 12 no aleatorios) con 36.487 nervios en riesgo, sin encontrar diferencias estadísticamente significativas en la frecuencia de una lesión definitiva de dicho nervio 15. Pisanu, et al., incluyeron 20 estudios (3 aleatorios, 7 no aleatorios y 10 observacionales) con 23.512 pacientes y no encontraron diferencias estadísticamente significativas en la incidencia de parálisis del nervio laríngeo recurrente 16. Rulli, et al., incluyeron 8 estudios (dos aleatorios y 6 no aleatorios) con 5.257 nervios en riesgo y encontraron una disminución estadísticamente significativa en la frecuencia de lesiones temporales del nervio laríngeo recurrente, pero no en las definitivas 17. Sanabria, et al,. incluyeron 6 estudios aleatorios con 3.064 nervios en riesgo e identificaron solamente una disminución estadísticamente significativa en la frecuencia de lesión temporal del nervio laríngeo superior, pero no en los resultados relacionados con el nervio laríngeo recurrente 14. Finalmente, Pardal y Ochoa 18 incluyeron 40 estudios (3 ensayos clínicos aleatorios y 12 observacionales) con 30.922 pacientes, y concluyeron que hay una disminución de la frecuencia de lesiones bilaterales.
De estos metaanálisis, 5 combinaban estudios de asignación aleatoria y observacionales, y solo uno, realizado por este autor incluyó únicamente ensayos clínicos de asignación aleatoria, siguiendo las recomendaciones de la Colaboración Cochrane. Se acepta hoy en día que las revisiones sistemáticas que incluyen estudios observacionales adolecen de sesgos importantes que hacen que sus conclusiones sean difíciles de interpretar, por lo que se considera que nuestro metaanálisis es la mejor información disponible a la fecha. No obstante las diferencias metodológicas, 5 de estas 6 revisiones sistemáticas llegan a la misma conclusión global: no existen datos que demuestren que las lesiones definitivas del nervio laríngeo recurrente o del laríngeo superior disminuyan con el uso de la neuromonitorización de rutina y la última revisión adolece de debilidades metodológicas extremas que hacen poco confiables sus resultados. Los efectos son mínimos sobre las lesiones temporales, especialmente de los nervios laríngeos superiores.
Definición de alto riesgo
Es claro que estos estudios abordan poblaciones de bajo riesgo y que, por lo tanto, las conclusiones solo pueden extrapolarse a este tipo de pacientes. La pregunta que surge, entonces, es ¿cuáles son los pacientes que se beneficiarían de esta tecnología? La mayoría de los autores son claros en sugerir que los pacientes en alto riesgo de lesión del nervio serían los más beneficiados 19. Pero la definición de alto riesgo es bastante heterogénea e indefinida, e incluso, se sugiere que alto riesgo de lesión es un concepto equiparable a cirugía difícil. Chiang, et al. 20, definieron como de alto riesgo aquellos pacientes con bocio, reintervención, cáncer, extensión retroesternal o tirotoxicosis; Atallah, et al. 21, los definieron como aquelllos con bocios de más de 70 ml de volumen global, bocios recurrentes, extensión retroesternal, tirotoxicosis o cáncer; Barczinksy, et al. 10, los definieron como aquellos que requieren vaciamiento central, y Hermann, et al. 22, como aquellos con cáncer o que requieren reintervención.
Si se explora un poco cada una de las indicaciones, es difícil determinar con claridad cuáles son los pacientes candidatos. La reintervención parece ser clara, pero no se especifica si es del mismo lado ya operado o del contralateral, pues si el caso es este último, el riesgo de lesión neural de un lado virgen es similar al de un paciente que no ha sido operado nunca y, por lo tanto, no cabría en la definición de alto riesgo.
Si se acepta que el cáncer es un criterio de alto riesgo, es evidente que no pueden caer en la misma definición de riesgo los pacientes que tienen un tumor en estadio I o II (menores de 4 cm, sin extensión extratiroidea) y los que tienen estadios más avanzados, o aquellos sin ganglios centrales que aquellos con ganglios macroscópicamente evidentes. Entonces, incluir a todos los casos de cáncer en un solo grupo no parece una indicación correcta. Incluso, si se aceptan las guías del Instituto Nacional de Cancerología en las cuales se sugiere el vaciamiento central en todos los pacientes con tumores tiroideos mayores de 1 cm, esto implicaría que todos esos pacientes serían de alto riesgo pues serán llevados a vaciamiento ganglionar.
Lo mismo ocurre con la presencia de bocio. Existen bocios de todos los tamaños, unos con extensión retroesternal y otros que crecen hacia la superficie, y todos no pueden caer en la misma categoría de riesgo. Igual reflexión se puede hacer en los casos de hipertiroidismo.
De tal forma que la indicación de alto riesgo que parece tan clara no lo es y, a la fecha, no parece haber consenso en la definición de alto riesgo. Si se examina con detenimiento este punto, es posible pensar que habría un acuerdo mayoritario si los pacientes de alto riesgo se describieran como aquellos que requieren una reintervención del mismo lado que ya ha sido intervenido, incluya o no algún tipo de vaciamiento, aquellos que tengan parálisis unilateral previa y aquellos pacientes en los cuales preoperatoriamente se encuentre evidencia de invasión extratiroidea que ponga en riesgo el nervio. Incluso, es posible pensar que una nueva exploración no implica la búsqueda completa del nervio (lo cual dejaría de ser de alto riesgo) o que, en casos de invasión masiva y parálisis vocal preoperatoria, el riesgo de lesión ya está definido y no tendría ninguna utilidad identificar el nervio para su disección.
La frecuencia de pacientes con un potencial alto riesgo, es baja. Para el cáncer, Bahl, et al. 23, en una serie de 2.090 pacientes y 680 carcinomas de tiroides, encontraron que el tamaño promedio de las lesiones fue de 2,2 cm y el 28 % fueron descubiertas por imaginología o durante el examen histopatológico. Bilimoria, et al. 24, en un análisis de 90.382 pacientes, encontraron que solo el 15 % tenía tumores mayores de 4 cm. Mitchell, et al. 25, en más de 270.000 pacientes con cáncer de tiroides, encontraron que solo el 15 % de los tumores medían más de 4 cm. Vashishta, et al. 26, examinaron 59.478 pacientes y encontrarn 8 % con tirotoxicosis y 7 % con tiroiditis. En los estudios referidos, la frecuencia de lesión del nervio laríngeo recurrente no superó el 2 % y en ninguno de ellos se usaba la neuromonitorización de manera rutinaria.
En relación con el bocio, Barczynski, et al. 27, reportaron 8.132 pacientes con bocio que recurrió en el 10,6 %; Ciuni, et al.,28, reportaron 5,9 % de 2.136 pacientes con bocio recurrente que requirieron cirugía, y Efremidou, et al.,29, reportaron 3,4 % de pacientes operados por recurrencia. Esto indica que entre 3 y 15 % de los pacientes podrían catalogarse como de alto riesgo.
Características operativas del método
Otro punto que puede discutirse se centra en qué tan buena es la tecnología para determinar la lesión del nervio, es decir, cuáles son su sensibilidad y especificidad.
Varios estudios con los cuales se ha evaluado el desempeño de la neuromonitorización, determinaron que su sensibilidad puede estar entre el 25 y el 75 % y, su especificidad, por encima del 93 %. Esto quiere decir que si al final del procedimiento la señal es buena, podemos estar casi seguros (error del 7 %) de que no hay lesión. Pero, por el contrario, si al final la señal es pobre, la posibilidad de que el nervio esté realmente lesionado es baja (error entre 25 y 75 %). La reflexión que se debe hacer es para qué se utiliza el neuromonitor: para que diga que el nervio está sano (muy específico) o para que diga si está lesionado (muy sensible). Si se practica una tiroidectomía de forma rutinaria y la frecuencia de complicaciones está cercana a lo reportado en la literatura científica, lo más probable es que se utilice la tecnología para determinar si las cosas no van como ocurren normalmente (un método muy sensible), donde el método tiene serias deficiencias. Sería difícil pensar en el caso contrario, el de un cirujano a quien la mayoría de las veces le vaya mal y, entonces, utilice el método para asegurarse que en ese caso las cosas van bien (muy específico).
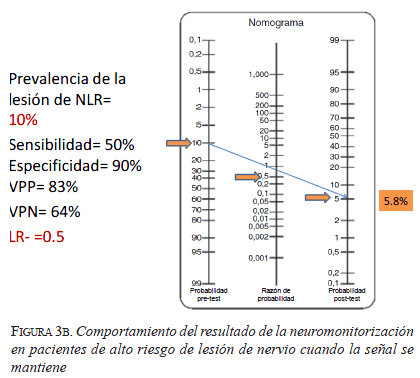
Pero, además de esto, el desempeño de la neuromonitorización parece no modificar de forma importante los resultados durante el acto operatorio. A continuación se muestran algunos ejemplos utilizando el nomograma de Fagan 30, que es una herramienta útil para graficar el efecto de un resultado de sensibilidad y especificidad sobre un determinado hecho. He escogido dos situaciones para facilitar el entendimiento: una de bajo riesgo y otra de alto riesgo.
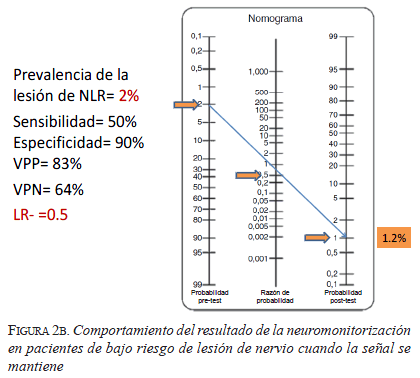
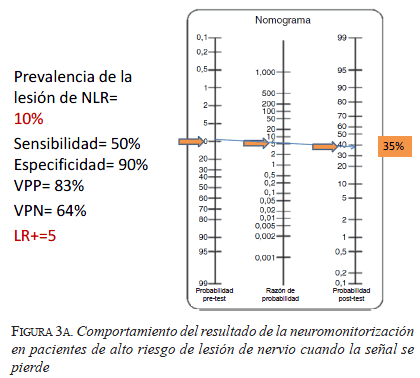
En el caso de bajo riesgo (figura 2), la probabilidad de tener una lesión definitiva del nervio laríngeo recurrente es de 2 %, mientras que en el caso de alto riesgo (figura 3) es de 10 % (de acuerdo con lo reportado en la literatura). Se utiliza una sensibilidad de 50 % y una especificidad de 90 %, también basadas en la información bibliográfica. Con estos datos se calcula una razón de verosimilitud (likelihood ratio) positiva de 5, que quiere decir que cuando hay una pérdida de señal evidenciada con el monitor, la lesión esperada del nervio es cinco veces mayor que si no hubiera pérdida de señal; y una razón de verosimilitud negativa de 0,5, que quiere decir que cuando la señal del monitor es adecuada, la lesión esperada del nervio es de 0,5 veces (se disminuye a la mitad) que cuando no es adecuada.
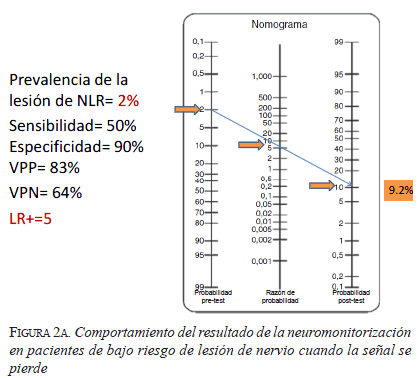
En el primer caso de bajo riesgo (figura 2a), si se espera una lesión en el 2 % de los casos y la señal del monitor se pierde, la probabilidad de que el nervio en verdad tenga un daño es de 9,2 %. Aquí surge la pregunta ¿qué hacer? El grupo de estudio en neuromonitorización 31 refiere que primero deben verificarse todas las causas de pérdida de señal (que haya daño del equipo, que se haya desplazado el tubo endotraqueal, que el sensor del estimulador se haya roto, etc.). Si no se encuentra daño, en publicaciones más recientes sugieren esperar de 15 a 20 minutos y volver a estimular; y si definitivamente la señal no se recupera, se sugiere suspender el procedimiento quirúrgico, practicar una laringoscopia al terminar la cirugía y, si no se confirma la parálisis, reintervenir al paciente en la misma hospitalización.
Respecto a esta recomendación hay varios reparos. La primera es que los dos lados de la tiroidectomía tienen riesgos independientes, esto es, que si la lesión ocurre en un lado, el riesgo de que haya lesión en el otro lado sigue siendo el basal, 2 %. Por lo tanto, suspender la cirugía no parece ser una recomendación válida si se tiene experiencia en cirugía de tiroides. Incluso, en casos de invasión tumoral del nervio en un lado, este se secciona y la cirugía se continúa al otro lado sin mayores inconvenientes.
Los autores que favorecen esta recomendación sugieren que el riesgo de lesión del lado contralateral se aumenta, lo cual carece de todo fundamento lógico. Otros aducen que todo depende del lado que se aborde inicialmente. Si se aborda el lado difícil (el de mayor riesgo) y ocurre un daño, es claro que el otro lado tiene un riesgo menor y probablemente se pueda practicar la disección sin mayor dificultad. Si se aborda el lado de menor riesgo inicialmente y hay lesión, el lado de mayor riesgo implicará una posibilidad de lesión más alta y, entonces, debería abortarse la cirugía. Si esta lógica es clara, lo que se debería recomendar es empezar siempre por el lado de menor riesgo y no la de suspender el procedimiento, para evitar las consecuencias propias de esta decisión, como un segundo acto anestésico y quirúrgico, además de la carga emocional que esto conlleva y los costos para el sistema de salud.
En el segundo caso de bajo riesgo (figura 2b), si la señal del monitor se mantiene, la probabilidad de lesión baja de 2 % a 1,2 %, que es escasamente menor a lo esperado. La discusión en este caso es idéntica a la anterior, ¿de qué sirve usar el monitor si el riesgo del nervio contralateral sigue siendo de 2 %? Además, surge la pregunta de si clínicamente es relevante que el riesgo baje de 2 % a 1,2 %.
En el tercer caso de riesgo alto (figura 3a), si la señal del monitor se pierde, el riesgo de lesión neural pasa de 2 % a 35 %, y vuelve a tomar relevancia la discusión del primer caso acerca de cuál lado intervenir primero.
En el cuarto y último caso de alto riego (figura 3b), si la señal del monitor se mantiene, el riesgo de lesión pasa de 10 % a 5,8 %. ¿Qué hacer en este caso? ¿Es esta una disminución que da tranquilidad? O, por el contrario, como es mayor de 2 %, ¿se debe suspender el procedimiento? Pero incluso es menor de 9 % del primer caso, luego, ¿dónde está el límite para detener un procedimiento?
En un estudio más grande sobre pérdida de señal publicado hasta el momento y que incluyó 290 pacientes, se encontró pérdida de señal en 16 de ellos (5,5 %), pero a pesar de todo, el procedimiento quirúrgico se continuó y solo 1 de estos (6,25 % de todas las pérdidas de señal o 0,003 % de todos los pacientes) finalmente tuvo una lesión definitiva y ninguno presentó lesión bilateral de nervios o necesidad de traqueostomía 32.
En últimas, en todos los casos el panorama es muy incierto y el uso del monitor ayuda poco en la toma de decisiones, específicamente cuando se pierde la señal, que es el objetivo con el cual se usa. Puede esperarse que el uso del monitor simplemente introduzca mayor ruido a la decisión de explorar el lado contrario, sin que cambie la probabilidad de una manera tan radical como para confiar en él.
Costos
Se puede ver con mayor facilidad que el número de pacientes efectivamente protegidos por el uso rutinario de la monitorización neural en la tiroidectomía es muy bajo. Esto se explica porque el riesgo de lesión es muy infrecuente (1 %), porque la sensibilidad del método es muy baja (ofrece poca confianza en su resultado de pérdida de señal) y porque, además, introduce ruido donde no lo había previamente (induce a tomar decisiones de suspensión de la cirugía que, finalmente, eran innecesarias y pone en un riesgo inexistente al nervio contralateral, que no depende de la señal del primer nervio explorado).
Así, de entrada, se espera que su efecto en el costo de un procedimiento sea excesivo. Si a esto se le agrega el valor propio de la tecnología (que puede estar alrededor de COP$ 4'500.000 por paciente) y los costos derivados de su uso (el tiempo de la cirugía se prolonga unos minutos porque hay que explorar el nervio vago para hacer las mediciones de entrada) y de las decisiones derivadas de sus resultados (esperar quince minutos que alarga el tiempo quirúrgico, suspender el 5 % de las cirugías, luego reintervenir este mismo número de pacientes) y esto en relación con lo que se evita (unas semanas de disfonía en un porcentaje de los casos, porque algunas parálisis son silentes; la traqueostomía en un número ínfimo de pacientes), se puede ver que la relación costo-beneficio es desequilibrada.
Un estudio realizado por este autor y presentado en el Congreso Nacional de Endocrinología 33, demuestra que la razón 'incremental' de costo-utilidad es de COP$ 27 millones por cada unidad de utilidad que se gana y la de costo-efectividad 'incremental' es de COP$ 9 millones por cada evento que se evita. Esto es que se debe invertir esa cantidad para disminuir un caso de lesión del nervio laríngeo recurrente. También, más del 60 % de los casos simulados se encuentran en el cuadrante de menor efectividad y mayor costo, lo que hace que el uso de esta tecnología sea oneroso en el medio. Si se compara este valor con lo que cuesta la reparación de una parálisis vocal unilateral, se puede entender que la alternativa de reparación supera con creces la alternativa potencialmente preventiva que se ofrece con el uso del monitor.
Aspectos médico-legales
Algunos autores han sugerido que en la actual situación de amenaza médico-legal en la que se encuentran los médicos, el uso de estos dispositivos puede disminuir los riesgos de perder una demanda. Este argumento no parece tener asidero sólido, cuando ningún estudio ha logrado demostrar que protege de la lesión. Incluso los más acérrimos defensores, siempre suavizan su recomendación con la sentencia de que nada supera una adecuada técnica quirúrgica con la búsqueda sistemática del nervio durante el acto operatorio 34,35. La discusión, incluso, puede dirigirse a si en realidad el uso del dispositivo disminuye las demandas, sobre todo cuando el examen indique que hubo lesión y posoperatoriamente se descubra que no la hubo, lo que pone en nuevo riesgo al paciente producto de una reintervención que era innecesaria o en los casos en que el dispositivo no indique daño y este se manifieste en el posoperatorio. ¿Qué prima en este caso?, ¿el resultado de un método con desempeño imperfecto que dice que el nervio está funcionando o el resultado clínico de un paciente disfónico? Poner parte de la responsabilidad en el resultado que ofrece una determinada tecnología parece demasiado temerario y, en mi opinión, no protege en nada de las acciones legales futuras. El mejor indicador para un paciente de que su cirugía no tendrá complicaciones, está en el estado inicial de la enfermedad y en la demostrada probidad del cirujano, basada en su estadística personal.
Por otro lado, ya se había sugerido previamente que el uso de estos dispositivos podría dar una sensación de falsa seguridad a los cirujanos que tienen poco volumen quirúrgico tiroideo, lo que aumenta el riesgo de lesiones. En un estudio reciente de Chung, et al. 36, que examinaron más de 240.000 tiroidectomías practicadas en los Estados Unidos, se demostró que a medida que el neuromonitor se usa más, la frecuencia de lesiones ha tenido un aumento estadísticamente significativo. De tal forma que el uso del neuromonitor, incluso, puede poner en riesgo de demanda a quien lo usa rutinamente, pues su uso se relaciona con un número mayor de lesiones.
Resultados centrados en el paciente
Finalmente, el uso de la tecnología se centra en la detección intraoperatoria de un patrón de señales eléctricas que indican la integridad neuroconductiva del circuito nervioso que va del nervio vago hasta las cuerdas vocales. Se asume que estas mediciones son relevantes, y que son una buena medida de la ausencia o presencia de parálisis y su correspondiente disfonía. Sin embargo, como otros resultados sucedáneos, en los que se asume que su presencia o ausencia son marcadores efectivos de lo que al paciente le interesa, con la neuromonitorización se asume que el patrón determina las alteraciones vocales.
Este argumento se ve enfrentado a los datos presentados recientemente por la American Academy of Otolaryngology, que demostró que hasta el 25 % de los pacientes tienen alteraciones vocales aun con integridad de los nervios 37. Entonces, ¿qué se le puede decir a un paciente que tiene nervios íntegros y alteraciones de la fonación? ¿No fue bajo la premisa de evitarle las alteraciones vocales que el dispositivo se usó?
Se debe recordar que, durante la cirugía tiroidea, otros factores no relacionados con los nervios también afectan la calidad vocal. La sección de los músculos pretiroideos, la disección extrema del espacio carotídeo o de los pedículos superiores, la manipulación exagerada de los músculos pretiroideos, el tipo de cicatrización del paciente, etc., son factores que pueden alterar la fonación, los cuales no se evitan con el uso del neuromonitor. En algunos estudios se ha sugerido que con el neuromonitor se protege de las lesiones en los casos de variaciones anatómicas de los nervios, como el nervio laríngeo no recurrente 38. Primero, es improbable que un cirujano con gran volumen de cirugías atienda más de algunos pocos casos en su vida (la frecuencia de esta anomalía es menor de 0,5 %). Además, si se siguen al pie de la letra las enseñanzas de los cirujanos clásicos, como Kocher o Cady, donde se exponían los pasos de la técnica quirúrgica para identificar y seguir el nervio hasta su origen, es improbable que un cirujano produzca lesiones, incluso en casos de variaciones como la descrita. Nuevamente, este resultado poco o nada le interesa al paciente. Él simplemente quiere hablar bien, además de no tener hipoparatiroidismo y no sangrar, alteraciones sobre las cuales la neuromonitorización no tiene ningún efecto.
Si estos argumentos están tan claros en la literatura, ¿por qué el uso del dispositivo viene aumentando?
Encontrar la explicación a la conducta humana no es fácil. A pesar de que la corriente de la medicina basada en la evidencia puso de presente la gran cantidad de información que sustenta ciertas decisiones, y que se aplica a la gran mayoría de potenciales pacientes (recordemos que la estadística, ciencia que explica las variables azarosas, entre las que se incluyen todas las biológicas, ya demostró que muy pocos sujetos se salen del promedio), es claro que existe una gran brecha entre lo que se debe hacer (sugerido por los estudios) y lo que en realidad se hace. Esta brecha depende de variables que aborda la psicología, no la epidemiologia clínica, y esto puede explicar la situación en algún grado.
Desde hace décadas, los psicólogos lograron describir conductas que ayudan a entender las decisiones humanas. Entre estas condiciones se encuentra la "disonancia cognitiva" 39, definida como la tensión o desarmonía interna del sistema de ideas, creencias y emociones (cogniciones) que percibe una persona al mantener al mismo tiempo dos pensamientos que están en conflicto, o por un comportamiento que entra en conflicto con sus creencias. Esta disonancia hace que los seres humanos (sin importar su profesión) realicen actos que bajo el ojo crudo de la ciencia son inexplicables. Por ejemplo, que a pesar de existir información a favor o en contra de alguna condición, las personas sean incapaces de adoptar esta información y ponerla en práctica, porque va en contra de sus creencias.
Para el caso particular, si algún cirujano está convencido de que el neuromonitor ofrece ventajas, continuará usándolo aun si las evidencias le enrostran otra realidad. Esta actitud se verá respaldada por otra condición muy conocida en psicología, denominada el "sesgo de confirmación" 40, que consiste en la tendencia a favorecer la información que confirma las propias creencias o hipótesis en desmedro de aquellas que la amenazan, con preferencia de las fuentes que afirman sus posturas ya existentes o la interpretación de las pruebas ambiguas como favorables a su posición previa, la polarización de las actitudes, la perseverancia de creencias incluso cuando se demuestre su falsedad y el "efecto de primacía irracional" que consiste en una mayor confianza en las primeras experiencias tenidas con algún hecho, que a las más recientes.
Asimismo, el efecto del "razonamiento motivado" 41 que consiste en creer lo que queremos creer, no lo que nos digan los hechos, tal como lo describió Esopo en su fábula de la zorra y las uvas, hace más de 26 siglos, y un fenómeno denominado "backfire" 42 (tiro por la culata, en castellano) que se refiere al efecto contraproducente que se produce en las personas al presentar evidencias y argumentos convincentes y racionales, que refutan ideas y opiniones preconcebidas.
El efecto de estas variables en el uso de la neuromonitorización rutinaria se sustenta en un análisis simple. Desde 2011 con la publicación de Higgins, et al. 13, ya se sugería la falta de efectividad de la neuromonitorización rutinaria intermitente y, después de ella, hay un número importante de datos que sustentan esta posición. Luego se esperaría que el número de citaciones de estos trabajos fuera relevante en todos los estudios que abordan el tema. Desde esta fecha, se han publicado 160 artículos sobre el tema, pero solo hay 99 citaciones de los metaanálisis que afirman que la efectividad del método es limitada (61 %). Esto significa que 40 % de los artículos relacionados con el tema, ignoran de manera deliberada los resultados de estos metaanálisis.
Conclusión
A pesar de que la evidencia actual no logra sustentar el uso de la neuromonitorización rutinaria intermitente en la cirugía de tiroides, esta no solo se sigue utilizando, sino que es probable que se utilice aún más, pues razones psicológicas y no científicas impulsan a las personas a tener comportamientos que van en contra de los datos. Es probable que se vea un crecimiento exagerado del uso de estos dispositivos, con los efectos adversos sobre pacientes y el sistema de salud, descritos acá.
Conflictos de interés
Invitado a curso de neuromonitorización por Diseven (distribuidor del dispositivo); patrocinios de asistencia a congresos por Sanofi, Genzyme, Merck, Johnson & Johnson, Medinistros.
Referencias
1. Kahaly GJ, Dietlein M. Cost estimation of thyroid disorders in Germany. Thyroid. 2002;12:909-14. [ Links ]
2. Christou N, Mathonnet M. Complications after total thyroidectomy. J Visc Surg. 2013;150:249-56. [ Links ]
3. Hauch A, Al-Qurayshi Z, Randolph G, Kandil E. Total thyroidectomy is associated with increased risk of complications for low- and high-volume surgeons. Ann Surg Oncol. 2014;21: 3844-52. [ Links ]
4. Weiss A, Lee KC, Brumund KT, Chang DC, Bouvet M. Risk factors for hematoma after thyroidectomy: Results from the nationwide inpatient sample. Surgery. 2014;156:399-404. [ Links ]
5. Puzziello A, Rosato L, Innaro N, Orlando G, Avenia N, Perigli G, Hypocalcemia following thyroid surgery: Incidence and risk factors. A longitudinal multicenter study comprising 2,631 patients. Endocrine. 2014;47:537-42. [ Links ]
6. Jeannon JP, Orabi AA, Bruch GA, Abdalsalam HA, Simo R. Diagnosis of recurrent laryngeal nerve palsy after thyroidectomy: A systematic review. Int J Clin Pract. 2009;63:624-9. [ Links ]
7. Misono S, Merati AL. Evidence-based practice: Evaluation and management of unilateral vocal fold paralysis. Otolaryngol Clin North Am. 2012;45:1083-108. [ Links ]
8. Hvidegaard T, Vase P, Dalsgaard SC, Jorgensen K. Endolaryngeal devices for perioperative identification and functional testing of the recurrent nerve. Otolaryngol Head Neck Surg. 1984;92:292-4. [ Links ]
9. Maloney RW, Murcek BW, Steehler KW, Sibly D, Maloney RE. A new method for intraoperative recurrent laryngeal nerve monitoring. Ear Nose Throat J. 1994;73:30-3. [ Links ]
10. Barczynski M, Konturek A, Cichon S. Randomized clinical trial of visualization versus neuromonitoring of recurrent laryngeal nerves during thyroidectomy. Br J Surg. 2009;96:240-6. [ Links ]
11. Barczynski M, Konturek A, Stopa M, Hubalewska-Dydejczyk A, Nowak W. Intraoperative neuromonitoring of the recurrent laryngeal nerves may improve outcomes of surgery for well-differentiated thyroid cancer. Endokrynologia Polska. 2012;63:166. [ Links ]
12. Prokopakis E, Kaprana A, Velegrakis S, Panagiotaki I, Chatzakis N, Iro H, et al. Intraoperative recurrent laryngeal nerve monitoring in revision thyroidectomy. Eur Arch Otorhinolaryngol. 2013;270:2521-4. [ Links ]
13. Higgins TS, Gupta R, Ketcham AS, Sataloff RT, Wadsworth JT, Sinacori JT. Recurrent laryngeal nerve monitoring versus identification alone on post-thyroidectomy true vocal fold palsy: A meta-analysis. Laryngoscope. 2011;121:1009-17. [ Links ]
14. Sanabria A, Ramírez A, Kowalski LP, Silver CE, Shaha AR, Owen RP, et al. Neuromonitoring in thyroidectomy. A meta-analysis of effectiveness from randomized controlled trials. Eur Arch Otorhinolaryngol. 2013; 270:2175-89 [ Links ]
15. Zheng S, Xu Z, Wei Y, Zeng M, He J. Effect of intraoperative neuromonitoring on recurrent laryngeal nerve palsy rates after thyroid surgery-A meta-analysis. J Formos Med Assoc. 2012;112:463-72. doi: 10.1016/j.jfma.2012.03.003. Epub 2012 Sep 7. [ Links ]
16. Pisanu A, Porceddu G, Podda M, Cois A, Uccheddu A. Systematic review with meta-analysis of studies comparing intraoperative neuromonitoring of recurrent laryngeal nerves versus visualization alone during thyroidectomy. J Surg Res. 2014;188:152-61. [ Links ]
17. Rulli F, Ambrogi V, Dionigi G, Amirhassankhani S, Mineo T, Ottaviani F, et al. Meta-analysis of recurrent laryngeal nerve injury in thyroid surgery with or without intraoperative nerve monitoring. Acta Otorhinolaryngol Ital. 2014;34:223-9. [ Links ]
18. Pardal-Refoyo JL, Ochoa-Sangrador C. Lesión bilateral del nervio laríngeo recurrente en tiroidectomía total con o sin neuromonitorización intraoperatoria. Revisión sistemática y metaanálisis. Acta Otorrinolaringol Esp. 2015; En prensa [ Links ]
19. Dueñas JP, Duque CS. Monitorización intraoperatoria de los nervios laríngeos superior e inferior en cirugía de tiroides y paratiroides. Rev Colomb Cirugía. 2012;27:298-305. [ Links ]
20. Chiang FY, Lu IC, Tsai CJ, Hsiao PJ, Hsu CC, Wu CW. Does extensive dissection of recurrent laryngeal nerve during thyroid operation increase the risk of nerve injury? Evidence from the application of intraoperative neuromonitoring. Otolaryngol Head Neck Surg. 2011;32:499-503. [ Links ]
21. Atallah I, Dupret A, Carpentier AS, Weingertner AS, Volkmar PP, Rodier JF. Role of intraoperative neuromonitoring of the recurrent laryngeal nerve in high-risk thyroid surgery. J Otolaryngol Head Neck Surg. 2009;38:613-8. [ Links ]
22. Hermann M, Hellebart C, Freissmuth M. Neuromonitoring in thyroid surgery: Prospective evaluation of intraoperative electrophysiological responses for the prediction of recurrent laryngeal nerve injury. Ann Surg. 2004;240:9-17. [ Links ]
23. Bahl M, Sosa JA, Nelson RC, Esclamado RM, Choudhury KR, Hoang JK. Trends in incidentally identified thyroid cancers over a decade: A retrospective analysis of 2,090 surgical patients. World J Surg. 2014;38:1312-7. [ Links ]
24. Bilimoria KY, Bentrem DJ, Linn JG, Freel A, Yeh JJ, Stewart AK, et al. Utilization of total thyroidectomy for papillary thyroid cancer in the United States. Surgery. 2007;142:906-13. [ Links ]
25. Mitchell I, Livingston EH, Chang AY, Holt S, Snyder WH 3rd, Lingvay I, et al. Trends in thyroid cancer demographics and surgical therapy in the United States. Surgery. 2007;142:823-8. [ Links ]
26. Vashishta R, Mahalingam-Dhingra A, Lander L, Shin EJ, Shah RK. Thyroidectomy outcomes: A national perspective. Otolaryngol Head Neck Surg. 2012;147:1027-34. [ Links ]
27. Barczynski M, Konturek A, Stopa M, Cichon S, Richter P, Nowak W. Total thyroidectomy for benign thyroid disease: Is it really worthwhile? Ann Surg. 2011;254:724-9. [ Links ]
28. Ciuni R, Biondi A, Di GM, Basile F, Ciuni S. Total thyroidectomy vs. subtotal thyroidectomy for plurinodular goiter. Analysis 1517 cases. Ann Ital Chir. 2010;81:9-12. [ Links ]
29. Efremidou EI, Papageorgiou MS, Liratzopoulos N, Manolas KJ. The efficacy and safety of total thyroidectomy in the management of benign thyroid disease: A review of 932 cases. Can J Surg. 2009;52:39-44. [ Links ]
30. Fagan TJ. Nomogram for Bayes theorem. N Engl J Med. 1975;293:257. [ Links ]
31. Timmermann W, Hamelmann WH, Thomusch O, Sekulla C, Grond S, Neumann HJ, et al. Effectiveness and results of intraoperative neuromonitoring in thyroid surgery. Statement of the interdisciplinary study group on intraoperative neuromonitoring of thyroid surgery. Chirurg. 2004;75:916-22. [ Links ]
32. Sitges-Serra A, Fontane J, Duenas JP, Duque CS, Lorente L, Trillo L, et al. Prospective study on loss of signal on the first side during neuromonitoring of the recurrent laryngeal nerve in total thyroidectomy. Br J Surg. 2013;100:662-6. [ Links ]
33. Sanabria A. Análisis económico de la neuromonitoría rutinaria del nervio laríngeo recurrente en tiroidectomía total. Congreso Nacional de Endocrinologia; 06/2012, 2012; Medellin, Colombia. [ Links ]
34. Angelos P. Recurrent laryngeal nerve monitoring: State of the art, ethical and legal issues. Surg Clin North Am. 2009;89:1157-69. [ Links ]
35. Angelos P. Ethical and medicolegal issues in neuromonitoring during thyroid and parathyroid surgery: A review of the recent literature. Curr Opin Oncol. 2012;24:16-21. [ Links ]
36. Chung TK, Rosenthal EL, Porterfield JR, Carroll WR, Richman J, Hawn MT. Examining national outcomes after thyroidectomy with nerve monitoring. J Am Coll Surg. 2014;219:765-70. [ Links ]
37. Chandrasekhar SS, Randolph GW, Seidman MD, Rosenfeld RM, Angelos P, Barkmeier-Kraemer J, et al. Clinical practice guideline: Improving voice outcomes after thyroid surgery. Otolaryngol Head Neck Surg. 2013;148:S1-37. [ Links ]
38. Chiang FY, Lee KW, Chen HC, Chen HY, Lu IC, Kuo WR, et al. Standardization of intraoperative neuromonitoring of recurrent laryngeal nerve in thyroid operation. World J Surg. 2010;34:223-9. [ Links ]
39. Draycott S, Dabbs A. Cognitive dissonance. 1: An overview of the literature and its integration into theory and practice in clinical psychology. Br J Clin Psychol. 1998;37(Pt 3):341-53. [ Links ]
40. Munro GD, Stansbury JA. The dark side of self-affirmation: Confirmation bias and illusory correlation in response to threatening information. Pers Soc Psychol Bull. 2009;35:1143-53. [ Links ]
41. Miles RW. Fallacious reasoning and complexity as root causes of clinical inertia. J Am Med Dir Assoc. 2007;8:349-54. [ Links ]
42. Cook A, Arndt J, Lieberman JD. Firing back at the backfire effect: The influence of mortality salience and nullification beliefs on reactions to inadmissible evidence. Law Hum Behav. 2004;28:389-410. [ Links ]













