Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582
rev. colomb. cir. vol.31 no.3 Bogotá July/Sept. 2016
1 Médico, cirujano general, gastroenterólogo intervencionista, Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia.
2 Médico, residente de cuarto año de Cirugía General, Universidad El Bosque, Bogotá, D.C., Colombia.
3 Médico internista, gastroenterólogo, hepatólogo, Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia.
4 Médica patóloga, Fundación Santa Fe de Bogotá; profesora, Universidad de Los Andes, Bogotá, D.C., Colombia.
Correspondencia: Luis Felipe Cabrera, MD, Bogotá, D.C., Colombia. Correo electrónico: luis.felipe.cabrera@hotmail.com
Fecha de recibido: 23 de enero de 2016. Fecha de aprobación: 30 de marzo de 2016.
Resumen
A lo largo de la historia, el manejo de los tumores periampulares, malignos o benignos, ha sido la cirugía radical. Sin embargo, la gran complejidad de estos procedimientos, sus complicaciones y su alto índice de mortalidad hicieron impulsar el desarrollo de nuevas técnicas quirúrgicas mínimamente invasivas.
Se presenta el caso clínico de una paciente de 55 años, con hallazgo incidental de un adenoma de la ampolla de Vater en una endoscopia de vías digestivas altas, T1N0M0, manejado con papilectomía endoscópica, sin complicaciones y con márgenes negativos en el estudio histopatológico de la pieza quirúrgica.
La papilectomía endoscópica, fue reportada por primera vez por Ponchon, et al., en 1989. La presentación clínica del adenoma de la ampolla de Vater es asintomática y su diagnóstico es incidental en la endoscopia de vías digestivas altas. El diagnóstico de este tipo de neoplasia se hace teniendo en cuenta la apariencia endoscópica y la histología; por lo tanto, es vital la utilización de un duodenoscopio lateral para poder tener una evaluación completa de la papila. Es importante practicar una ultrasonografía endoscópica biliopancreática, ya que esta determina la profundidad de la lesión y, además, permite descartar adenomegalias locales o regionales. La papilectomía endoscópica es un procedimiento que requiere de manos experimentadas para disminuir el riesgo de complicaciones.
Palabras clave: adenoma; ampolla hepatopancreática; pancreatocolangiografía retrógrada endoscópica; esfinterotomía endoscópica; endosonografía.
Abstract
Introduction: Historically, the management of periampullary tumors, malignant or benign, has been radical surgery, starting with Alessandro Codivilla, who in 1898 described the surgical technique for the performance of pancreaticoduodenectomy. Later, in 1899, William Halsted performed the first transduodenal ampullectomy. The complexity of these procedures, the associated complications and high mortality stimulated the development of novel minimally invasive surgical techniques.
Case report: Fifty five year old female with incidental finding of an adenoma of the ampulla of Vater at endoscopy of the upper digestive tract, T1N0M0, managed by endoscopic papillectomy, without complications; surgical pathology reported negative margins.
Discussion: Endoscopic papillectomy was first reported by Ponchon et al in 1989. The presence of an adenoma of the ampulla of Vater remains asymptomatic and the diagnosis is an incidental finding during upper digestive tract endoscopy. The diagnosis of this neoplasm is made by the endoscopic appearance and histopathology. It is imperative to use a lateral duodenoscope in order to have full assessment of the papilla. It is also important performing pancreatic biliary endosonography, as this determines the depth of the lesion and also rules out local or regional lymphadenopathy. Endoscopic papillectomy is a procedure that requires experienced hands, to avoid complications such as perforation, cholangitis, papillary stenosis, bleeding and pancreatitis, the last two being the most common with an incidence up to 25-30%.
Conclusions: Randomized clinical trials are required to substantiate the benefit of endoscopic papillectomy in malignant pathology, and also there is need to develop management guidelines.
Key words: adenoma; ampulla of Vater; cholangiopancreatography, endoscopic retrograde; sphincterotomy, endoscopic; endosonography.
Introducción
A lo largo de la historia, el manejo de los tumores periampulares, malignos o benignos, ha sido la cirugía radical. Se inició con Alessandro Codivilla en 1898, quien describió la técnica quirúrgica de la pancreatoduodenectomía; posteriormente, en 1899, William Halsted practicó la primera ampulectomía transduodenal y, en 1909, Walther Kausch llevó a cabo la primera resección de un tumor periampular empleando la técnica de la pancreatoduodenectomía, la cual fue perfeccionada por Allen Whipple en 1935. Sin embargo, la gran complejidad del procedimiento, sus complicaciones y su alto índice de mortalidad impulsaron el desarrollo de nuevas técnicas quirúrgicas mínimamente invasivas, indicadas en la enfermedad benigna ampular, como es el caso del adenoma de la ampolla de Vater y la papilectomía endoscópica 1,2.
El adenoma de la ampolla de Vater es una lesión glandular proliferativa, que emerge de la papila duodenal. Su diagnóstico aumentó gracias a la endoscopia de vías digestivas altas indicada por dispepsia y otros síntomas inespecíficos. Se considera premaligna, conformando la asociación de adenoma y carcinoma, ya que en el 90 % de los adenocarcinomas de la ampolla de Vater se identifica tejido adenomatoso en el estudio histológico. Su prevalencia varía entre 0,04 % y 0,12 %. Se asocia con la poliposis adenomatosa familiar hereditaria, en la cual existe un riesgo hasta 124 veces mayor de iniciar con un adenoma de la ampolla de Vater, siendo este la causa de muerte en pacientes después de una colectomía total 3,4.
Caso clínico
Se trata de una mujer de 55 años, con un cuadro clínico de un año de evolución consistente en astenia, adinamia, náuseas sin emesis, epigastralgia y leve distensión abdominal intermitente. La paciente refirió el antecedente de hipotiroidismo manejado con levotiroxina, secundario a la tiroidectomía total por un carcinoma papilar de tiroides.
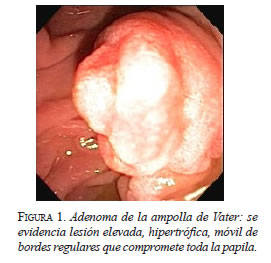
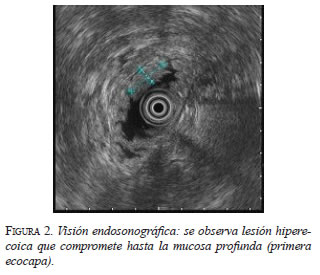
En el examen físico no se encontraron alteraciones. En la endoscopia de vías digestivas altas se encontró gastritis antral difusa y papilitis de Vater (figura 1), y en la colonoscopia total, hemorroides internas de grado I. En las biopsias se observó un adenoma túbulo-velloso de la ampolla de Vater, sin evidencia de displasia de alto grado, por lo cual se practicó una ultrasonografía endoscópica en la que se encontró una lesión hiperecoica de aspecto neoplásico en la papila de Vater, originada en la mucosa superficial y profunda, y que respetaba la muscular propia. No se evidenciaron adenomegalias perilesionales (figura 2). Para descartar metástasis, se practicó una resonancia magnética de abdomen, la cual se encontró dentro de límites normales, lo cual clasificó el adenoma de la ampolla de Vater como T1N0M0.
Con tales hallazgos, se decidió practicar una papilectomía endoscópica, bajo anestesia general, previa firma del consentimiento informado.
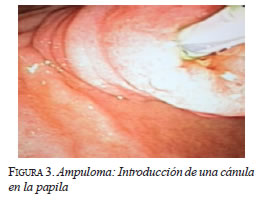
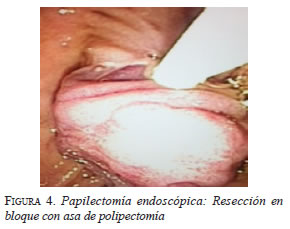
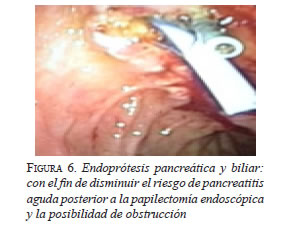
Durante el procedimiento, se evidenció una lesión de 2 por 1,5 cm en la ampolla de Vater, que protruye hacia la luz intestinal. Se procedió a introducir una cánula en la papila (figura 3) y a resecar la ampolla de Vater con el asa de polipectomía, empleando diatermia con corte en 30 (figura 4), hasta extraer la pieza quirúrgica, cuyos bordes de sección estaban libres de infiltración (figura 5). Se introdujo una cánula en el conducto pancreático de Wirsung y se practicó la papilotomía con un papilótomo en asa; se avanzó la guía y se practicó una nueva colangiografía endoscópica retrógrada; se dejó una endoprótesis (stent) biliar de 8,5 F x 10 cm (figura 6). No se presentaron complicaciones durante el procedimiento.
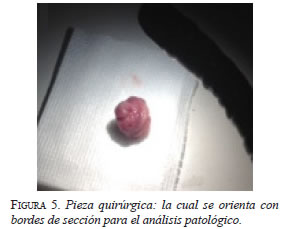
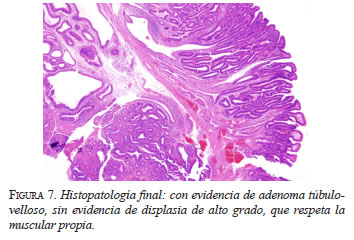
Se procesó en su totalidad un fragmento de tejido de 2 x 2 x 1 cm, en el cual se identificó una lesión polipoide que al estudio microscópico correspondió a un adenoma túbulo-velloso, sin evidencia de displasia de alto grado, que respetaba la muscular propia, con bordes de resección sin cambios adenomatosos (figura 7).
Discusión
Históricamente, el manejo para el adenoma de la ampolla de Vater, siendo una neoplasia benigna, era la pancreatoduodenectomía. Con el cambio del paradigma de la cirugía abierta a la mínimamente invasiva, se desarrolló la papilectomía endoscópica, reportada por primera vez por Ponchon, et al., en 1989 y nombrada así ya que su vía es por endoscopia mientras que la ampulectomía es abierta, con el fin de aclarar la terminología; definitivamente, es una técnica menos mórbida comparada con una ampulectomía transduodenal e, incluso más, con una pancreatoduodenectomía; sin embargo comparada con otros procedimientos endoscópicos, requiere manos más experimentadas 5,6.
La presentación clínica del adenoma de la ampolla de Vater es asintomática y su diagnóstico es por hallazgo incidental en la endoscopia de vías digestivas altas, como sucedió en el presente caso clínico. Algunos pacientes pueden presentar inicialmente pérdida de peso, obstrucción del conducto biliar o pancreático, e ictericia, colangitis o pancreatitis recurrente, pero se debe tener presente que estos signos pueden indicar un proceso invasivo 7,8.
El diagnóstico de este tipo de neoplasia se hace teniendo en cuenta la apariencia endoscópica y la histología. Es vital utilizar un duodenoscopio lateral para poder hacer una evaluación completa de la papila, como se hizo en el presente caso, y determinar características como márgenes regulares, consistencia blanda y ausencia de sangrado espontáneo, que pueden indicar benignidad. La sensibilidad de la biopsia es muchas veces cuestionada por factores como su variación según el examinador, la falta de experiencia del patólogo, o muestras no representativas en las cuales pueden pasar desapercibidos focos de adenocarcinoma.
Morfológicamente, se clasifican en neoplasias papilares no invasivas de tipo pancreatobiliar, neoplasias intraepiteliales planas o adenomas intestinales con los patrones clásicos tubular, túbulo-velloso o velloso, en los cuales la proliferación glandular muestra característicamente cambios displásicos de bajo grado con núcleos ovales, seudoestratificados, predominantemente de localización basal y citoplasmas apicales amfofílicos, como en este caso (figura 7).
El papel más importante del estudio histopatológico es confirmar la ausencia o la presencia de displasia de alto grado, la cual incluye la categoría de "carcinoma in situ" con mayor atipia tanto citológica como arquitectural. Bellizzi, et al., determinaron un diagnóstico de hasta 64 % con la biopsia, comparado con el espécimen resecado, con una sensibilidad variable de 62 % a 85 %. Es importante resaltar que en todos estos pacientes se debe practicar una colonoscopia total para descartar poliposis adenomatosa familiar hereditaria 9,10.
Una vez establecido el diagnóstico, se debe proceder a estadificar el tumor. Para hacerlo se pueden emplear la ecografía abdominal total y la tomografía computarizada (TC) abdominal con contraste; sin embargo, este tipo de imágenes no permiten una adecuada visualización de la ampolla de Vater, por lo cual su función se centra en detectar dilataciones de la vía biliar o pancreática e identificar adenomegalias o metástasis. Es de vital importancia practicar una ultrasonografía endoscópica bilio-pancreática, ya que esta determina la profundidad de la lesión y descarta adenomegalias locales o regionales, empleando ondas con frecuencias de 7,5 a 10 MHz. Se ha informado el uso de ultrasonografía endoscópica intraductal con ondas de frecuencias de 20 a 30 MHz, lo cual aumenta la sensibilidad; sin embargo, no se practica rutinariamente.
La resonancia magnética de abdomen se reserva para pacientes con sospecha de alteraciones en el árbol biliar previamente detectadas en la ecografía abdominal o en la TC abdominal con contraste.
La colangiopancreatografía retrógrada endoscópica permite evaluar si hay extensión de la lesión ampular a la vía biliar o al conducto pancreático, por lo cual se practicó antes de la papilectomía endoscópica en este caso. De esta forma, se pudo completar la estadificación según el TNM, confirmándose que se trataba de un adenoma T1N0M011-13.
Es claro que una de las indicaciones de papilectomía endoscópica es el adenoma de la ampolla de Vater con displasia de bajo grado T1N0M0, menor de 4 a 5 cm, sin signos macroscópicos de neoplasia maligna, como ulceraciones o consistencia sólida, con un compromiso de máximo 1 cm intraductal, en el colédoco y el conducto de Wirsung, como en esta paciente. Otras indicaciones son la poliposis adenomatosa familiar en estadio IV (9 a 12 puntos) según la clasificación de Spigelman (en la cual se consideran el número de pólipos, su tamaño, las características histológicas y el grado de displasia), los tumores neuroendocrinos, la imposibilidad de introducir la cánula en la papila, la colestasis y como método diagnóstico.
No hay duda de que los adenocarcinomas de la ampolla de Vater requieren una cirugía radical, la pancreatoduodenectomía; sin embargo, en aquellos con displasia de alto grado, el tipo de abordaje genera controversia. Yoon, et al., en un estudio retrospectivo de 23 pacientes con displasia de alto grado y adenocarcinoma ampular T1N0M0, no evidenciaron tumor residual en el seguimiento. Seewald, et al., aconsejan el manejo endoscópico si el tumor es extraductal o presenta un crecimiento intraductal menor de 1 cm; sin embargo, Will, et al., en un estudio prospectivo de 58 pacientes, recomiendan la papilectomía endoscópica para los pacientes con adenocarcinoma ampular T1N0M0y alto riesgo quirúrgico debido a múltiples enfermedades concomitantes. Por el contrario, los promotores de la cirugía radical se basan en los focos de adenocarcinoma invasivo y la invasión linfovascular que puede pasar desapercibida14-16.
Al abordar la técnica de la papilectomía endoscópica, es vital tratar tópicos como la inyección de líquido submucoso, la cual se hace con solución salina al 0,9 %, con el fin de evaluar el signo de la elevación, cuya ausencia puede ser indicio de neoplasia maligna; en el presente caso no se empleó pues, como lo reportan Chini, et al., puede distorsionar la anatomía de la ampolla y generar un efecto de domo, lo cual dificulta la resección en bloque. Es importante llevar a cabo una resección en bloque, pues permite reducir el tiempo del procedimiento, disminuye el empleo de electrocauterio y se obtiene un espécimen completo con el cual se puede establecer mejor si los bordes de resección están libres en el estudio histopatológico.
La resección en segmentos se recomienda para lesiones mayores de 2 cm o cuando hay tejido remanente después de una resección en bloque. En el presente caso se utilizó diatermia de corte puro, pues aunque no hay un estándar, consideramos que presenta menor disipación en el tejido y se puede disminuir el riesgo de estenosis posterior a la papilectomía. Se omitió el uso de argón y coagulación sobre el lecho quirúrgico después de la resección, cuyo objeto es eliminar células neoplásicas residuales, pues no ha presentado beneficios ya que no permite una adecuada recuperación del epitelio, como lo demostraron Catalano, et al., en el seguimiento de 103 casos.
Se practicó esfinterotomía endoscópica, ya que disminuye el riesgo de estenosis posoperatoria y permite descomprimir la vía biliar. Se recomienda la colocación de una endoprótesis (stent) pancreática por protocolo para evitar la pancreatitis posoperatoria; en este caso, se colocó una endoprótesis biliar, pues se ha demostrado que evita la obstrucción de la vía biliar por hemobilia posoperatoria. Los bordes de sección en el espécimen quirúrgico se marcaron para orientar al patólogo al establecer la radicalidad de la resección16-19.
Entre las complicaciones de la papilectomía endoscópica se encuentran la perforación, la colangitis, la estenosis de la papila, el sangrado y la pancreatitis; las dos últimas son las más frecuentes, con una incidencia hasta de 25 a 30 %. Es de resaltar que no se presentó ninguna complicación en el presente caso y el sangrado se controló inmediatamente con la inyección de adrenalina diluida, como está recomendado20-22.
El seguimiento se debe hacer con un control a las cuatro semanas, con el fin de retirar las endoprótesis y tomar biopsias; después, cada seis meses durante un año, y luego, cada año durante dos años, siempre haciendo hincapié en la importancia de una adecuada vista lateral. En pacientes con tumores mayores de 1,5 centímetros que tenían inicialmente fosfatasa alcalina mayor de 120 mg/dl y displasia de alto grado, se deben hacer controles cada tres meses23.
Conclusiones
Es muy importante que todos los médicos especialistas que manejen enfermedades del sistema gastrointestinal, tengan claro que el manejo actual del adenoma de la ampolla de Vater, como condición premaligna (T1N0M0), es netamente endoscópico, lo cual permite ofrecerle al paciente un tratamiento curativo y con las menores complicaciones posibles, teniendo en cuenta que debe ser realizado por un endoscopista experto y en un centro médico quirúrgico que cuente con la tecnología necesaria. Es indispensable promocionar los centros de referencia en los cuales se puede practicar este procedimiento y, así, concentrar los casos y disminuir la morbilidad de esta cirugía endoscópica.
Además, hay que actualizarse constantemente sobre los avances casi diarios en dispositivos endoscópicos y nuevas tecnologías de estadificación, los cuales permitirán ampliar las indicaciones para la papilectomía endoscópica. Sin embargo, se requieren estudios clínicos aleatorizados que fundamenten su beneficio en la enfermedad maligna y, por último, crear la necesidad de desarrollar unas guías de manejo definitivas.
Referencias
1. Will U, Muller A, Fueldner F, Wanzar I, Meyer F. Endoscopic papillectomy: Data of a prospective observational study. World J Gastroenterol. 2013;19:4316-24. [ Links ]
2. Ponchon T, Berger F, Chavaillon A, Bory R, Lambert R. Contribution of endoscopy to diagnosis and treatment of tumors of the ampulla of Vater. Cancer. 1989;64:161-7. [ Links ]
3. Bassan M, Bourke M. Endoscopic ampullectomy: A practical guide. J Interv Gastroenterol. 2012;2:23-30. [ Links ]
4. Draganov P, Chini P. Diagnosis and management of ampullary adenoma: The expanding role of endoscopy. World J Gastrointest Endosc. 2011;3:241-7. [ Links ]
5. Bustamante J, Ramia JM, Quiñones JE, Veguillas P, Sabater C, García-Parreño J. Transduodenal ampullectomy as treatment of ampulla of Vater adenoma. Cir Esp. 2010;87:178-92. [ Links ]
6. Ahn D, Ryu JK, Kim J, Yoon WJ, Lee SH, Jim YT, et al. Endoscopic papillectomy for benign ampullary neoplasms: How can treatment outcome be predicted? Gut and Liver. 2013;7:239-45. [ Links ]
7. Yoon SM, Kim MH, Kim MJ, Jang SJ, Lee TY, Kwon S, et al. Focal early stage cancer in ampullary adenoma: Surgery or endoscopic papillectomy? Gastrointest Endosc. 2007;66:701-7. [ Links ]
8. Seewald S, Omar S, Soehendra N. Endoscopic resection of tumors of the ampulla of Vater: How far up and how deep down can we go? Gastrointest Endosc. 2006;63:789-91. [ Links ]
9. Kim JH, Kim JH, Han JH, Yoo BM, Kim MW, Kim WH. Is endoscopic papillectomy safe for ampullary adenomas with high-grade dysplasia? Ann Surg Oncol. 2009;16:2547-54. [ Links ]
10. Will U, Bosseckert H, Meyer F. Correlation of endoscopic ultrasonography (EUS) for differential diagnostics between inflammatory and neoplastic lesions of the papilla of Vater and the peripapillary region with results of histologic investigation. Ultraschall Med. 2008;29:275-80. [ Links ]
11. Bohnacker S, Soehendra N, Maguchi H, Chung JB, Howell DA. Endoscopic resection of benign tumors of the papilla of Vater. Endoscopy. 2006;38:521-5. [ Links ]
12. Stolte M, Pscherer C. Adenoma-carcinoma sequence in the papilla of Vater. Scand J Gastroenterol.1996;31:376-82. [ Links ]
13. Catalano MF, Linder JD, Chak A, Sivak MV, Raijman I, Geenen JE, et al. Endoscopic management of adenoma of the major duodenal papilla. Gastrointest Endosc. 2004;59:225-32. [ Links ]
14. Bellizzi AM, Kahaleh M, Stelow EB. The assessment of specimens procured by endoscopic ampullectomy. Am J Clin Pathol. 2009;132:506-13. [ Links ]
15. WHO Classification of Tumours of the Digestive System. Bosman F, Carneiro F, Hruban R, Thiese N (editors). Fourth edition. Lyon, France: IARC Press; 2010. p. 10-50. [ Links ]
16. Castaño R, Ruiz M, Sanín E, Granados FE, García LH, Núñez E. Experiencia local en la resección endoscópica de la papila. Rev Col Gastroenterol. 2007;22:173-89. [ Links ]
17. Choi JJ, Kim MH, Kim GD, Kim JK, Park JT, Oh DR, et al. Papillary stenosis and cholangitis caused by endoscopic mucosal resection of ampullary adenoma. Korean J Gastrointest Endosc. 2003;27:249-53. [ Links ]
18. Saurin JC, Chavaillon A, Napoleon B, Descos F, Bory R, Berger F, et al. Long-term follow-up of patients with endoscopic treatment of sporadic adenomas of the papilla of Vater. Endoscopy. 2003;35:402-6. [ Links ]
19. Ito K, Fujita N, Noda Y, Kobayashi G, Kimura K, Horaguchi J, et al. Modes of spread in early ampullary cancer in terms of establishing proper indications for endoscopic papillectomy. Dig Endosc. 2004;16:224-8. [ Links ]
20. Charton JP, Deinert K, Schumacher B, Neuhaus H. Endoscopic resection for neoplastic diseases of the papilla of Vater. J Hepatobiliary Pancreat Surg. 2004;11:245-51. [ Links ]
21. Ardengh JC, Kemp R, Lima-Filho ÉR, Dos Santos JS. Endoscopic papillectomy: The limits of the indication, technique and results. World J Gastrointest Endosc. 2015;7:987-94. [ Links ]
22. Fujita N, Noda Y, Kobayashi G, Kimura K, Ito K. Endoscopic papillectomy: Is there room for this procedure in clinical practice? Dig Endosc. 2003;15:253-5. [ Links ]
23. Cheng CL, Sherman S, Fogel EL, Mchenry L, Waltkins JL, Fukushima T, et al. Endoscopic snare papillectomy for tumors of the duodenal papillae. Gastrointest Endosc. 2004;60:757-64. [ Links ]













