Introducción
La esofagectomía continúa siendo la piedra angular en el tratamiento del cáncer de esófago, pese a una tasa elevada de complicaciones letales que varían del 26 al 64 % y una mortalidad nada despreciable en centros de bajo y alto volumen (5,6 a 21,8 0/o)1.
La cirugía mínimamente invasiva ha incrementado su aplicación con el tiempo, no solo por sus resultados estéticos, sino también por sus ventajas claramente conocidas, entre las que figuran menor tasa de infecciones, recuperación temprana y reincorporación rápida a las actividades diarias, con resultados oncológicos aparentemente similares. La esofagectomía no ha sido la excepción, y a partir de su primera implementación en el año 1992, ha ganado fuerza. En 2003, se reportaron series de casos con disminución significativa de la mortalidad (7,7 %)1-3. Dados los resultados prometedores y la amplia gama de técnicas disponibles, el objetivo de este artículo es mostrar algunas de las técnicas utilizadas alrededor del mundo, así como sus claves y trucos para aprovechar su potencial.
Esofagectomía mínimamente invasiva
Clasificación
Aunque la terminología no es estándar en todos los lugares del mundo, ya que requieren múltiples abordajes, las esofagectomías mínimamente invasivas se pueden clasificar en dos grandes grupos1,2:
Esofagectomía híbrida mínimamente invasiva: hace referencia a los procedimientos con abordaje convencional y vídeo-asistido (toracotomía más movilización gástrica la-paroscopia o toracoscopia más laparotomía).
Esofagectomía mínimamente invasiva completa: se refiere al abordaje mediante to-racoscopia y laparoscopia; estos tipos de procedimientos pueden requerir incisiones utilitarias pero conservan su esencia de mínima invasión.
Linfadenectomía
Al ser el esófago un órgano que cruza a través de tres compartimentos, a primera vista representa complejidad durante un procedimiento quirúrgico. Los diferentes tipos de procedimientos deben conservar los principios técnicos y oncológicos de la cirugía abierta con una linfadenectomía adecuada, pero este tópico aún es debatible dado que depende del tipo histológico y estadio tumoral, entre otros, y aunque una disección ganglionar minuciosa podría aumentar la sobrevida de los pacientes, también puede incrementar la tasa de morbilidad (lesiones del nervio laríngeo recurrentes, fugas anastomóticas y complicaciones pulmonares) 4-6.
La estandarización de la linfadenectomía es compleja debido a sus patrones de metástasis ganglionar variables, pero según su localización en el mediastino se clasifica en: estándar, cuando la disección se limita al mediastino (especialmente por debajo de la tráquea); extendida, cuando se extiende a nivel paratraqueal derecho y al nervio laríngeo recurrente ipsilateral; y total o completa, cuando se extiende a nivel paratraqueal bilateral, nervios laríngeos recurrentes y subaórtica.
La linfadenectomía que se extiende a nivel cervical bilateral, mediastinal y abdomen superior, se conoce como de tres campos; para tumores localizados por encima o a nivel de la carina se recomienda una disección linfática de dos a tres campos, al igual que en pacientes con ade-nocarcinomas por debajo de la carina, puesto que en el 10 al 25 % de los casos, puede haber compromiso nodal supracarinal4,5.
El número de ganglios disecados también es tema de controversia. Para el American Joint Committee on Cancer, AJCC, su sigla en inglés, deben valorarse mínimo 10 ganglios, mientras que las guías holandesas recomiendan un mínimo de quince ganglios, en tanto que las guías alemanas (S3) afirman que el número adecuado son 20 ganglios. Por otro lado, Rizk et al. encuentran diferencias entre el estadio tumoral, así que para pacientes con lesiones T1 recomiendan un mínimo de 10 ganglios, para aquellos con lesiones T2 al menos 20 ganglios y para las lesiones T3 y T4, 30 ganglios4,5,7.
Adicionalmente, la neoadyuvancia modifica el número y la distribución de los ganglios; en cuanto a reportes de patología de ganglios con fibrosis o estériles, se encuentran algunos estudios como el de Talsma et al. en el que no se halló diferencia en la supervivencia y el número de ganglios resecados, hecho que cuestiona su utilidad en pacientes con quimio- y radioterapia4,8.
Curva de aprendizaje
El número de procedimientos representa un factor importante en la cirugía esofágica. Osugi et al. reportan reducción del tiempo quirúrgico, sangrado, complicaciones pulmonares e incremento en los ganglios disecados después de 34 casos, mientras que Guo et al. establecen que 30 procedimientos son necesarios y se logra una reducción aún más significativa en morbilidad al completar los 60 casos. Por otro lado, Ramage et al. observaron una reducción de complicaciones relacionadas con el tubo gástrico después de los 50 casos1,9-11.
Preparación prequirúrgica
Además de una monitorización adecuada, el catéter venoso central y línea arteria, constituyen el equipo básico para este procedimiento. El tratamiento del dolor posoperatorio es una prioridad, de modo que es vital el uso de analgesia epidural antes del procedimiento. La intubación selectiva con tubo sencillo o tubo de doble luz, permite el colapso pulmonar apropiado y facilita la buena visualización durante el tiempo torácico12,13.
Esofagectomía híbrida (esofagectomía transtorácica y ascenso gástrico laparoscópico)
Tiempo quirúrgico abdominal
Posición del paciente. Posición de litotomía con piernas en estribos, formando ángulo de 20 a 30° con las rodillas. El cirujano se ubica entre las piernas justo frente al monitor. El primero y el segundo ayudantes estarán al lado derecho e izquierdo del paciente12,13 (figura 1).
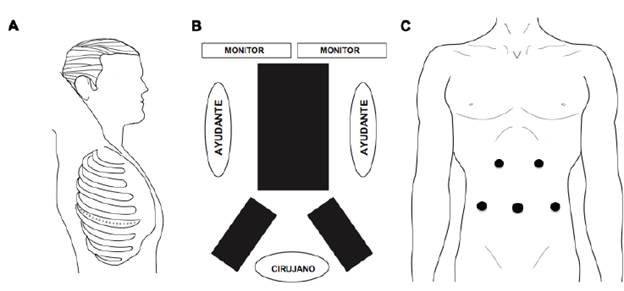
Figura 1 Esofagectomía híbrida: A. Tiempo quirúrgico torácico: paciente en decúbito lateral izquierdo, incisión de toracotomía postero-lateral derecha en el quinto espacio intercostal. B. Tiempo quirúrgico abdominal: paciente en decúbito supino y piernas abiertas en estribos. C. Tiempo quirúrgico abdominal: posición de los trocares.
Posición de los trocares. Generalmente se usan cinco trocares.
Trocar umbilical de 10 mm, comúnmente a 16 cm por debajo del apéndice xifoides (para uso de cámara); esta localización varía de acuerdo con el tamaño del paciente.
Trocar de 10 mm en línea medio-clavicular derecha (al mismo nivel del primer trocar). Se usa para sutura mecánica en el momento del corte de los vasos y para insertar la sutura en caso de hacerse una piloroplastia o yeyunostomía.
Trocar de 5 o 10 mm en la línea medio-clavicular izquierda (al mismo nivel de los dos anteriores). Se usa para insertar el separador hepático y durante piloroplastia.
Trocar de 5 mm en margen costal izquierdo a 6 cm de la línea media, formando un ángulo de 120° con la cámara.
Trocar de 5 mm en margen costal derecho; la misma posición del anterior. Los dos últimos trocares permiten la disección del hiato y mediastino posterior.
Pasos durante el tiempo quirúrgico abdominal
Disección y corte del ligamento gastrohepático hasta encontrar el pilar derecho; se continúa con disección del ligamento freno-esofágico hasta el pilar izquierdo (identificación del nervio vago anterior), y luego con disección roma y separación de los pilares del esófago (identificación y linfadenectomía del mediastino posterior y descarte de infiltración tumoral sobre la aorta).
Disección y corte de vasos gástricos cortos que se dividen iniciando en un punto medio a lo largo de la curvatura mayor. Se conserva la arcada proveniente de los vasos gastroepiploicos derechos, que serán la irrigación final del tubo gástrico. Al completar la disección del esófago distal se puede localizar un dren de Penrose alrededor de este para facilitar su movilización y manipulación (este se empuja y se abandona en el mediastino posterior para eventualmente ser recuperado en el tiempo torácico).
Disección de la vena coronaria y la arteria gástrica izquierda en bloque hasta su base; se corta con endosutura vascular. Liberación gástrica hasta el píloro (a este nivel se preservan las arterias gastroepiploica y gástrica derecha).
Liberación de adherencias de la pared posterior del estómago con el objetivo de conseguir la mayor movilización posible.
Cierre abdominal bajo visión directa y verificación de hemostasia.
Tiempo quirúrgico torácico
Posición del paciente. Paciente en decúbito lateral izquierdo (rollo axilar para extender los espacios intercostales). Brazo derecho extendido y suspendido para evitar lesiones de nervios, y rollos laterales y fijación de la cadera para minimizar movimiento del paciente (las piernas deben estar cómodas, en posición anatómica y sin que hagan contacto con zonas de presión) (figura 1).
Incisión. Toracotomía postero-lateral en el quinto espacio intercostal. Para mejor visualización, se reseca un segmento de costilla de 1,5 cm.
Pasos durante el tiempo quirúrgico torácico
División del ligamento pulmonar inferior (identificación del dren de Penrose abandonado en el tiempo abdominal). Disección del esófago en sentido caudal hasta la vena ácigos.
Disección y ligadura de la vena ácigos con endosutura vascular.
Se completa disección en sentido distal y proximal, teniendo cuidado de ligar el conducto torácico (localizado en el mediastino posterior a la derecha de la vena ácigos).
Movilización gástrica al tórax mediante tracción cuidadosa para no desgarrarlo o girarlo.
Pinzamiento del esófago con pinza de Satinsky, 3 cm por encima de la vena ácigos para que no se separe la mucosa de la capa muscular y se corta el esófago.
Construcción del tubo gástrico mediante sutura mecánica (refuerzo con seda 3-0, puntos separados).
Anastomosis esofagogástrica intratorácica latero-lateral con endosutura mecánica (permite angulación) y cierre en dos planos (tomar el esófago en sentido transversal para evitar desgarros).
Avance de sonda de nutrición enteral si no se realizó yeyunostomía y/o sonda nasogástrica para descompresión del tubo gástrico (a libre drenaje).
Cierre del tórax, no antes sin dejar dos tubos de toracostomía (anterior y posterior) para el drenaje adecuado de la cavidad verificando la expansión pulmonar correcta a través del orificio en el segmento costal resecado.
Esofagectomía mínimamente invasiva completa (toracoscopia en decúbito lateral izquierdo y ascenso gástrico laparoscópico, técnica con incisiones utilitarias de minito-racotomía y minilaparotomía)
El orden del procedimiento depende de la localización y extensión del tumor determinando previamente la necesidad de una esofagectomía de tres (McKeown) o dos abordajes (Lewis-Tanner). En el primero de los casos la disección torácica del esófago precede a la fase abdominal y cervical, mientras que con el uso de dos abordajes la movilización gástrica se hace en primera instancia14,15.
Tiempo quirúrgico torácico
Posición del paciente. Es la misma del procedimiento mencionado anteriormente. El cirujano se ubica en la parte posterior del paciente, el primer ayudante frente al cirujano para separación y manejo de la succión y el segundo ayudante a la derecha del cirujano para manejo de la cámara (figura 2).
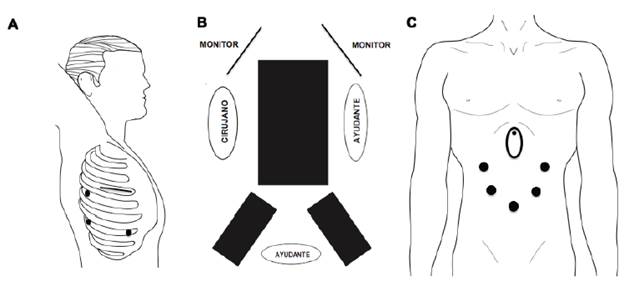
Figura 2 Esofagectomía mínimamente invasiva completa (minitoracotomía y minilaparotomía): A. Tiempo quirúrgico torácico: paciente en decúbito lateral izquierdo, incisión de minitoracotomía en el cuarto espacio intercostal y posición de los trocares. B. Tiempo quirúrgico abdominal: paciente en decúbito supino y piernas abiertas. C. Tiempo quirúrgico abdominal: posición de los trocares.
Posición de los trocares y minitoracotomía
10. Incisión de minitoracotomía de 5 cm en el cuarto espacio intercostal con el límite posterior de la incisión en la línea axilar media e inserción de separador de silicona de tipo Alexis). Inserción de trocares bajo visión directa. Este puerto permite el uso de separador y succión simultánea por parte del ayudante y la disección del esófago en su porción superior.
11. Trocar de 5 mm en el quinto espacio en la línea axilar posterior.
12. Trocar de 10 mm en el séptimo espacio intercostal en la línea axilar posterior.
13. Trocar de 10 mm en el séptimo espacio intercostal en la línea axilar media.
Pasos durante el tiempo quirúrgico torácico
División del ligamento pulmonar inferior hasta la raíz de la vena pulmonar inferior extendiéndose lateralmente a la pared posterior del pericardio.
Identificación del bronquio fuente derecho y vaciamiento ganglionar a este nivel (paquete ganglionar infracarinal hasta exponer el bronquio fuente izquierdo). Esta zona es muy vascularizada, de modo que se recomienda empaquetar con una gasa para hacer control de la hemostasia.
Identificación, disección y ligadura distal del conducto torácico con Hemolock®; disección y resección del mismo en sentido cefálico hasta unirlo con la disección esofágica.
Disección de la pleura en la cara anterior de la vena ácigos y ligadura de la vena ácigos con endosutura vascular.
Completar la disección a lo largo del esófago, cuidando de ligar los vasos provenientes de la aorta hacia este.
Los límites de la linfadenectomía son:
Inferior: crura diafragmática
Anterior: pericardio
Derecha: bronquio fuente derecho
Apical: bifurcación de la tráquea
Posterior: aorta descendente
7. Disección ganglionar superior: requiere la identificación del nervio laríngeo recurrente y la remoción del tejido graso inferior a la arteria subclavia.
8. Vaciamiento ganglionar en su porción derecha, teniendo en cuenta como reparos la vena cava superior y la tráquea en la cara anterior.
Tiempo quirúrgico abdominal Posición del paciente. Paciente en decúbito supino con las piernas abiertas. El cirujano se ubica a la derecha del paciente. El primero y el segundo ayudantes estarán al lado izquierdo y entre las piernas del paciente (figura 2).
Posición de los trocares
Trocar subumbilical de 10 mm para uso de cámara.
Puerto epigástrico justo por debajo del apéndice xifoides para ubicar separador hepático de tipo Nathanson.
Trocar de 5 mm justo debajo del margen costal derecho ligeramente medial a la línea axilar anterior.
Trocar de 5 mm entre el puerto anterior y el puerto umbilical a un puño de distancia.
Inserción de dos trocares de 5 mm en la misma posición en el lado izquierdo.
Pasos durante el tiempo quirúrgico abdominal
Separación del epiplón mayor de la curvatura mayor del estómago conservando la arcada proveniente de la arteria gastroepiploica derecha; se debe cuidar de conservar suficiente epiplón mayor en caso de que se quiera envolver el tubo gástrico en este, a nivel del tórax.
Disección y corte de vasos gástricos cortos hasta el hiato esofágico.
División del ligamento gastrohepático e identificación de la arteria gástrica izquierda.
Disección de la arteria gástrica izquierda y vena coronaria, con ligadura individual desde su origen con Hem-o-lock®, previa identificación del tronco celíaco. En este punto se hace disección meticulosa de los ganglios; este tejido es arrastrado hacia el hiato hasta encontrarse con la disección mediastinal.
Disección del mediastino posterior a nivel del hiato esofágico hasta encontrarse con la disección del pilar izquierdo del diafragma.
Disección y corte del nervio vago anterior y posterior y localización de un dren de Pen-rose alrededor del esófago para movilización (generalmente la maniobra de Kocher no es necesaria para una movilización apropiada).
En caso de esofagectomía de tres abordajes en este momento o de manera simultánea se realiza la incisión de cervicotomía donde se divide el esófago y se fija el muñón distal a un tubo de tórax (se usa por su flexibilidad y menor riesgo de causar daño).
Retiro del separador hepático y conversión de esta incisión en una mini-laparotomía de 5 cm a nivel de la línea media donde se localiza un separador de silicona.
Exteriorización del esófago y el estómago a través de esta incisión, conservando parte del tubo de tórax a nivel cervical para tracción y movilización del tubo gástrico más adelante.
Construcción del tubo gástrico con endosutura mecánica que permite su angulación, cuidando de mantener un diámetro de 3,5 cm aproximadamente y conservando la mayor cantidad de fondo gástrico (no dejar un antro redundante ya que puede influir en el vaciamiento gástrico). Este momento se usa para evaluar la irrigación correcta del tubo gástrico (cuando se cuenta con la tecnología adecuada -angiografía por fluorescencia asistida por láser).
Realización de piloroplastia de Heineke-Mikulicz utilizando una sutura de monofilamento absorbible en dos planos.
Fijación del tubo gástrico en dos puntos para evitar la rotación al tubo de tórax y movilización a través del mediastino, posterior al cual se recubre con una bolsa plástica para permitir un mejor deslizamiento y proteger la vasculatura.
Anastomosis cervical o torácica de acuerdo con el procedimiento.
Anastomosis cervical
Sutura manual en un solo plano término-terminal con dos suturas absorbibles monofilamento atadas en los extremos. Reparación del esófago con cuatro polos. El primer punto pasa desde el interior del estómago hacia el exterior y desde el exterior del esófago hacia su lumen. Se realiza primero la cara posterior y al final la cara anterior, dejando las grapas en la cara anterior para invaginarla14,15.
Anastomosis torácica
La sutura mecánica circular es más fácil de utilizar cuando se realiza la anastomosis a este nivel. Se hace anastomosis con un dispositivo transoral (de tipo OrVil®) a través de la incisión utilitaria término-lateral y se cierra el muñón distal del tubo gástrico con una sutura mecánica lineal14,15.
Esofagectomía mínimamente invasiva completa (toracoscopia en prono y ascenso gástrico laparoscópico)
Al igual que el procedimiento anterior el orden depende de la localización y extensión del tumor (de acuerdo con McKeown, primero el tiempo torácico, y según Lewis-Tanner primero el tiempo abdominal) 16 (figura 3).
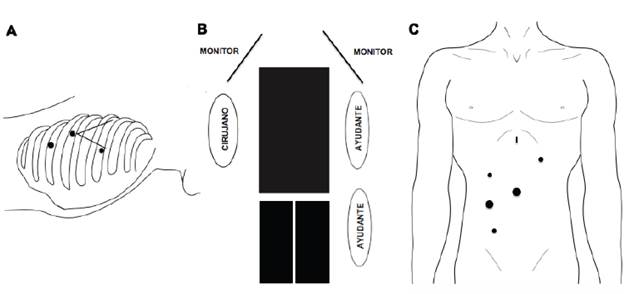
Figura 3 Esofagectomía mínimamente invasiva completa (toracoscopia en prono y ascenso gástrico laparoscópico): A. Tiempo quirúrgico torácico: paciente en prono y posición de los trocares. B. Tiempo quirúrgico abdominal: paciente en decúbito supino y piernas abiertas. C. Tiempo quirúrgico abdominal: posición de los trocares.
Tiempo quirúrgico torácico
Posición del paciente. Paciente en posición decúbito prono con brazos extendidos en posición cómoda para evitar lesiones adicionales. Se utilizan tres o cuatro trocares de acuerdo con la dificultad del procedimiento en caso de realizar una sutura intratorácica con sutura mecánica lineal; en ocasiones, cuando es necesario apoyar el colapso pulmonar completo, se usa una presión de 8 mm Hg en el neumotórax.
Posición de los trocares
Trocar de 10 mm para la cámara justo por debajo del ángulo inferior de la escápula.
Trocar de 10 mm en el octavo espacio intercostal, un poco por debajo del ángulo inferior de la escápula en sentido medial.
Trocar de 10 mm en el quinto espacio intercostal, línea axilar media, sobre el borde interno de la escápula.
En caso de ser necesario un cuarto trocar, se ubica uno de 5 mm en el cuarto espacio intercostal.
Pasos durante el tiempo quirúrgico torácico
Movilización del esófago distal dividiendo el ligamento pulmonar inferior.
Disección de la pleura al nivel de la vena ácigos y ligadura de la misma con endosutura vascular.
Disección del borde derecho de la aorta para localizar el conducto torácico y seccionarlo entre clips. En este momento se hace hemos-tasia de los vasos provenientes de la aorta con el instrumento de energía disponible a fin de evitar el sangrado.
La linfadenectomía depende de la localización y el tamaño del tumor, entre otras. Se tiene cuidado de incorporar los ganglios periesofágicos en la disección y adicionalmente se realiza vaciamiento ganglionar del bronquio fuente derecho e izquierdo y tráqueo-bronquiales bilaterales.
En caso de que el procedimiento requiera anastomosis intratorácica se asciende el tubo gástrico a través del hiato cuidando la línea de grapado, la cual se mantiene a la derecha para prevenir la rotación del conducto.
Luego de realizar la anastomosis, la cual se describirá más adelante, se hace una incisión de minitoracotomía (extendiendo el orificio del trocar caudal) por la cual se extrae la pieza.
Uso de dos drenajes, uno sobre la anastomosis y otro a nivel pulmonar, de 14 y 27 Fr, exteriorizados a través de las heridas de los trocares.
Tiempo quirúrgico abdominal Posición del paciente. Paciente en posición supina con piernas cerradas; el cirujano se ubica a la derecha del paciente y los ayudantes del lado izquierdo (figura 3).
Posición de los trocares
Trocar de 10 mm a nivel de la línea media, 10 cm por debajo de la apófisis xifoides.
Trocar de 5 mm en hipocondrio izquierdo.
Trocares de 10 y 5 mm en flanco derecho.
Incisión para la inserción de separador hepático a nivel subxifoideo.
Puede ser necesaria la inserción de un trocar adicional en la fosa ilíaca derecha al momento de realizar la yeyunostomía.
Pasos durante el tiempo quirúrgico abdominal
Movilización del esófago inferior; permite evaluar con prontitud la resecabilidad en los tumores de la unión esofagogástrica. Se hace la apertura de la membrana frenoesofágica, así como el ligamento gastrohepático.
Identificación de la arcada gastroepiploica con disección y corte a un nivel medio del epiplón mayor.
Disección de vasos cortos, disección en bloque de la vena coronaria y de la arteria gástrica izquierda arrastrando el tejido circundante en sentido cefálico y corte con sutura mecánica vascular.
Confección del tubo gástrico con endosutura mecánica; a nivel proximal no se corta por completo el estómago, de manera que sirva de "puente" para el ascenso del tubo a la cavidad torácica.
Linfadenectomía abdominal rutinaria, resecando ganglios linfáticos a lo largo del borde suprapancreático y el tronco celíaco (grupos 8a, 9 y lip), así como el tejido restante en la raíz de la arteria gástrica izquierda (grupo 7).
No se hace piloroplastia de rutina.
Yeyunostomía laparoscópica: se usa un set de introducción que consta de aguja de 14 G, alambre guía, dilatador, catéter peel away y sonda de alimentación K30. Se agrega un trocar de 5 mm en la fosa ilíaca derecha para ser utilizado como mano derecha del cirujano, permitiendo una correcta triangulación.
Marcación del lugar en la pared abdominal a nivel del flanco izquierdo, sutura de asa delgada seleccionada a la pared abdominal con sutura absorbible a manera de jareta. Una vez se asegura el asa a la pared abdominal, se inserta una aguja 14 G y se avanza el alambre guía (técnica de Seldinger); con precaución se insufla el intestino antes de progresar el alambre guía y se avanza la sonda sobre la guía. Finalmente, se completa la jareta y se ajusta para sellar la punción intestinal y prevenir fugas.
Se adicionan puntos de sutura distales al asa y la pared para prevenir su rotación. Para terminar se fija la sonda a la piel con el fin de evitar su movilización.
Anastomosis con sutura mecánica lineal Se completa la división del "puente" (la conexión restante) entre el conducto y la pieza. Se hace una pequeña gastrotomía en la cara anterior del conducto, lo más lejos posible de la línea de grapas (a 5 o 6 cm de la parte superior del conducto), y a través de esta y a nivel del muñón esofágico se introduce la endosutura mecánica de 45 mm para la confección de la anastomosis. Se avanza una sonda nasogástrica al tubo gástrico para descompresión y se realizan dos planos de suturas continua para el cierre final. Como refuerzo adicional se envuelve la anastomosis en parte del epiplón el cual se fija con puntos separados.
Anastomosis con sutura mecánica circular Se realiza una anastomosis con un dispositivo transoral a través de la incisión utilitaria término-lateral y se cierra el muñón distal del tubo gástrico con una sutura mecánica lineal. En este caso se retira el trocar ubicado en el octavo espacio intercostal y se prolonga dicha incisión 3 cm aproximadamente con un separador de silicona. Se corta el esófago proximal y se introduce el dispositivo transoral y al igual que se hizo en el procedimiento descrito anteriormente, se realiza la anastomosis y el cierre del muñón gástrico.
Esofagectomía mínimamente invasiva completa (toracoscopia en decúbito lateral izquierdo y ascenso gástrico laparoscópico)
La elección del tipo de abordaje depende de muchos factores; el principal es la localización del tumor, que define la extensión de la resección.
Tiempo quirúrgico abdominal Posición del paciente. Paciente en decúbito supino con piernas abiertas. El cirujano se ubica en medio de las piernas del paciente. El primero y segundo ayudantes estarán al lado derecho e izquierdo (figura 4).
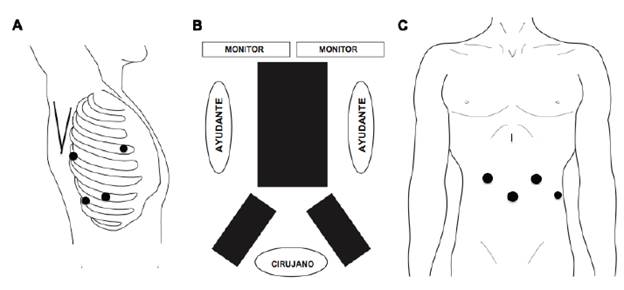
Figura 4 Esofagectomía mínimamente invasiva completa: A. Tiempo quirúrgico torácico: paciente en decúbito lateral izquierdo y posición de los trocares. B. Tiempo quirúrgico abdominal: paciente en decúbito supino y piernas abiertas. C. Tiempo quirúrgico abdominal: posición de los trocares.
Posición de los trocares
Trocar de i0 mm supraumbilical para uso de la cámara.
Dos trocares de 10 mm, i a 2 cm en sentido cefálico al de la óptica de forma bilateral, a no menos de 8 cm entre sí.
Uso de un separador de Nathanson a nivel epigástrico para la separación del hígado.
Trocar de 5 mm en la línea axilar anterior izquierda, al mismo nivel que la cámara para retracción.
Pasos durante el tiempo quirúrgico abdominal
Evaluación de la cavidad abdominal para determinar resecabilidad
Apertura de la pars flaccida y condensación para evaluar compromiso del pilar derecho.
Sección de la membrana frenoesofágica estableciendo plano de disección hacia el mediastino posterior.
Sección de vasos gástricos cortos permitiendo la identificación adecuada del plano con el páncreas; en este punto se descartan adeno-patías en el grupo 10 para definir necesidad de vaciamiento a este nivel.
La disección de la unión esofagogástrica no es muy extensa pues el ingreso a la cavidad pleural ocasionaría la pérdida de neumoperitoneo y/o neumotórax con la limitación subsecuente de la visualización abdominal y el compromiso hemodinámico asociado.
Sección del ligamento gastrocólico teniendo precaución de preservar la arcada gastroepiploica derecha.
Liberación de adherencias gastropancreáticas usuales y disección, mediante maniobra de Kocher que asegure la movilidad del futuro conducto.
Sección del pedículo gástrico derecho e izquierdo y vaciamiento de los grupos 7, 8a, 9, IIp y IId.
Construcción del tubo gástrico por medio de sutura mecánica lineal cortante de forma sucesiva verificando margen adecuado respecto al compromiso subcardial; usualmente primero sutura vascular, luego verde y posteriormente azul para lograr menor sangrado y aproximación adecuada de la sutura.
Fijación de dicho tubo con 2 puntos de PDS al extremo más distal del espécimen quirúrgico aún fijo al esófago.
Disección del esófago distal incluyendo el tejido linfograso periesofágico asegurando su completa liberación del hiato esofágico. Revisión de hemostasia.
Evacuación del neumoperitoneo y cierre de puertos de forma convencional.
Tiempo quirúrgico torácico
Posición del paciente. Paciente en decúbito lateral izquierdo, igual a los procedimientos mencionados anteriormente. El cirujano se ubica en la parte posterior del paciente. El primer ayudante frente al cirujano para separación y manejo de la succión y el segundo ayudante a la derecha del cirujano para manejo de la cámara (figura 4).
Posición de los trocares
Trocar de i0 mm en línea axilar media, séptimo u octavo espacio intercostal
Trocar de 10 mm posterior a la línea axilar posterior en el octavo o noveno espacio intercostal.
Para la separación del pulmón sobre la línea axilar anterior en el cuarto o quinto espacio intercostal se introduce una pinza atraumática o un separador de abanico, si está disponible, para la retracción pulmonar.
Trocar de 5 mm caudal a la punta de la escápula para tracción.
Pasos durante el tiempo quirúrgico torácico
Identificación el tendón central del hemidiafragma derecho y colocación de punto con seda i para realizar tracción del mismo por exteriorización de dicha sutura a través del aspecto más inferior de la pared torácica bajo visión directa a fin de no ingresar a la cavidad abdominal.
Identificación y sección del ligamento pulmonar inferior hasta unirla con la disección periesofágica realizada previamente en el tiempo abdominal.
Sección cuidadosa de la pleura mediastinal hasta lograr colocación de hiladillo asegurando resección de ganglios periesofágicos.
Disección en sentido proximal identificando la vena ácigos la cual se diseca y secciona con sutura mecánica vascular.
Determinación del sitio de sección esofágica asegurando margen sano. Sección esofágica con endosutura lineal cortante azul de 60 mm.
Ampliación de puerto inferior, colocación de separador de silicona a través del cual se extrae la pieza quirúrgica y verificación de ascenso y orientación adecuados del tubo gástrico.
Paso del dispositivo transoral, el cual se recupera a nivel esofágico; gastrotomía en el aspecto más proximal del tubo para introducir sutura mecánica circular de 25mm.
Anastomosis esofagogástrica con cierre posterior de gastrostomía con sutura mecánica lineal azul de 60 mm.
Revisión de hemostasia e inserción de tubos de toracostomía a drenaje cerrado.
En caso de planear una esofagectomía total se realiza el primer tiempo a través de toracoscopia, de la forma antes anotada, y se libera el esófago hasta el estrecho torácico y distal hasta visualizar el aspecto derecho del hiato diafragmático; luego se cambia a posición en decúbito supino y se procede a la disección descrita en el abordaje previo.
Ejecución de cervicotomía longitudinal usual sobre el borde anterior del esternoclei-domastoideo identificando el esófago. Extracción de la pieza quirúrgica por dicha incisión con posterior esofagogastrostomía con sutura lineal cortante laterolateral descrita por Orringer. Por último, se avanza sonda de alimentación enteral y se cierra de forma convencional previa colocación de drenaje de silicona el cual se fija a la piel.
Evaluación intraoperatoria del conducto gástrico
Las fugas de la anastomosis esofagogástrica representan una complicación determinante en este procedimiento reportada entre el 3,8 y 11,7 % de los pacientes. En nuestro medio se pueden presentar hasta en un 30 % de los pacientes y comúnmente se asocian a mala perfusión del tubo gástrico. La perfusión del conducto generalmente se evalúa de manera subjetiva por el cirujano, basándose en la presencia de sangrado en el muñón gástrico, la vitalidad del tejido y, por supuesto, la palpación del pulso de la arcada proveniente de la arteria gastroepiploica derecha17,18.
Cuando la tecnología está al alcance de la mano se pueden utilizar herramientas como la fluorescencia con verde de indocianina, que consiste en la administración endovenosa de este colorante y la evaluación del conducto, mediante la aplicación de una luz infrarroja que induce a la fluorescencia de los tejidos. Aunque este tipo de tecnología aún se encuentra a prueba, estudios iniciales reportados por Zehetner et al. han demostrado que podrían disminuir la tasa de fugas anastomóticas después de esofagectomía cuando la anastomosis se realiza en un lugar con mejor perfusión (2 vs. 45%)17,18 (figura 5).
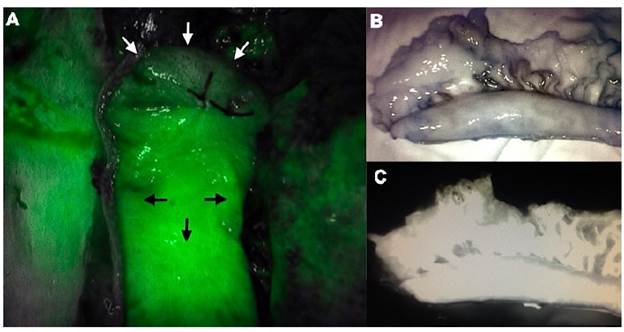
Figura 5 Evaluación intraoperatoria del conducto gástrico. Fluorescencia con verde de indocianina: A. Las flechas blancas señalan la porción distal del tubo gástrico con pobre perfusión y las flechas negras señalan la porción proximal del tubo gástrico con adecuada perfusión. B y C. Perfusión adecuada del conducto gástrico.
Bordes de sección (margen de resección)
Múltiples factores se asocian a los resultados oncológicos entre ellos los márgenes de sección. En general se prefieren márgenes de sección proxi-males alrededor de los 10 cm y distales 5 cm19,20.
La distancia puede depender de la técnica utilizada pero los bordes libres de tumor deben ser una prioridad en la cirugía. Por su parte, Barbour et al. definen como adecuado un borde proximal in situ de aproximadamente 5 cm, Marriette et al. no encontraron infiltración tumoral cuando el borde proximal excedía los 7 cm, mientras que Miller et al. consideran un margen seguro de 12 cm. Adicionalmente, Tam et al. reportan una tasa de 20 % de recurrencia con márgenes menores de 5 cm, de 8 % con márgenes de entre 5 y 10 cm y de 0 % con márgenes mayores de 10 cm19,20.
Por otro lado, el margen distal representa menores dificultades. Di Musto y Orringer mostraron que con márgenes de 4 a 6 cm se consigue una tasa de márgenes microscópicamente negativos en un 98 % de los casos. Así mismo, el margen circunferencial puede afectar la sobrevida de los pacientes indicando un promedio de 12 meses en grupos con margen circunferencial comprometido19,20.
Piloroplastia
El uso o no de piloroplastia continúa siendo otro de los temas en discusión. La esofagectomía resulta en una inevitable lesión vagal con dismotilidad y denervación pilórica que genera alteraciones en el vaciamiento gástrico y se asocia a síntomas como plenitud, náuseas y vómito con posible riesgo de aspiración. En contraparte, la piloroplastia es un área potencial de fugas, con incremento del tiempo operatorio y predisposición al reflujo biliar. A pesar de los pro y los contra, aún no existe una diferencia significativa clara, pero se reportan menos fugas anastomó-ticas, complicaciones pulmonares y reducción de la estasis gástrica cuando se emplea drenaje pilórico después de la esofagectomía21,22.
Cuidados posoperatorios
Al finalizar el procedimiento, el paciente es llevado a la unidad de cuidados intensivos para monitorización; se procura la extubación po-soperatoria inmediata temprana; el catéter peridural desempeña un papel importante dado que permite el control acertado del dolor. Se promueve la movilización temprana y el retiro de sondas, así como el inicio de la nutrición enteral y la ingesta rápida (previa realización de estudios contrastados -opcional-). Los tubos de tórax son una queja frecuente de los pacientes debido al dolor que producen y la limitación de la movilidad. Estos pueden ser removidos si no se sospechan fugas con drenajes de hasta 200 ml23,24.
En caso de sospechar fugas anastomóticas, se practican estudios radiológicos con contraste y tomografía axial computarizada, para evaluar su tamaño, así como pruebas de laboratorio que alerten sobre la presencia de signos de reacción inflamatoria sistémica23,24.
Los programas ERAS (Enhanced Recovery After Surgery), ampliamente descritos en múltiples procedimientos, son actividades encaminadas a disminuir la estancia hospitalaria así como la morbimortalidad. Inician en el preoperatorio (consejería, carga de carbohidratos, ayuno mínimo, nutrición preoperatoria, entrenamiento de músculos inspiratorios y optimización de hemoglobina), intraoperatoria (analgesia preventiva, cirugía de mínima invasión y fluido-terapia adecuada) y postoperatoria (nutrición temprana, retiro rápido de sondas y tubos, analgesia, profilaxis antitrombótica y movilización), actividades que buscan mejorar la evolución de pacientes y obtener resultados tempranos prometedores aun en espera de resultados conclusivos23,24.
Conclusiones
La esofagectomía mínimamente invasiva es un procedimiento técnicamente difícil, que requiere entrenamiento, habilidad y experiencia, asociado a un cuidado pre- y posoperatorio preciso. Las múltiples variaciones en el procedimiento así como la mezcla de procedimientos abiertos con procedimientos vídeo-asistidos hacen de esta una técnica con mayor aceptación, factible y segura, con resultados oncológicos adecuados si se implementa de manera correcta.
La técnica quirúrgica debe elegirse con base en la preferencia del cirujano, sus fortalezas y habilidades.














