Introducción
La diabetes mellitus de tipo 2 es el principal reto de salud pública que enfrentamos actualmente, constituye la primera causa de discapacidad y es o está asociada con las principales causas de muerte en nuestro país. En la Ciudad de México, se reportó que más del 79 % de los pacientes diabéticos no tienen cifras óptimas de HbA1c (<6,5 %), mientras que el 47 % presentan descontrol importante (HbA1c >9 %) 1.
La cirugía es el mejor tratamiento, en términos de disminución de la hemoglobina glucosilada (HbA1c), control de la glucemia, inducción de la remisión y prevención del desarrollo de complicaciones microvasculares 2. Tanto la cirugía bariátrica como la metabólica favorecen la mejoría en 89,2 % de los pacientes y, hasta en 64,7 %, se logra la remisión de la enfermedad 2, tanto en pacientes con obesidad mórbida como en aquéllos con un índice de masa corporal (IMC) menor de 35 kg/m23 e incluso, en pacientes con sobrepeso (IMC <30 kg/m2).
En México, de acuerdo con la guía de práctica clínica para el tratamiento quirúrgico de la diabetes mellitus de tipo 2 en adultos con IMC de 30 a 34,9 kg/m2, se consideran como candidatos a manejo quirúrgico aquellos pacientes con una HbA1c mayor de 8 % mientras que otros autores incluyen a los pacientes diabéticos con difícil control, aun con un IMC menor de 30 kg/m. Ambos consideran apropiadas las técnicas quirúrgicas bariátricas restrictivas y las bariátricas mixtas (malabsortivos/restrictivos).
Aunque muchos autores equiparan los términos ‘bariátrico’ y ‘metabólico’, existen diferencias sustantivas entre estos procedimientos. Una cirugía bariátrica está enfocada en la pérdida ponderal y, para concretar su objetivo, restringe la ingestión (banda gástrica ajustable y balón intragástrico), de la gastrectomía en manga (Sleeve Gastrectomy, SG) o de procedimientos aún considerados como mixtos: derivación gástrica en Y de Roux por laparoscopia (Laparoscopic Roux-en-Y Gastric Bypass, miniderivación gástrica (Mini-Gastric Bypass), duodeno-ileostomía con una anastomosis (Single Anastomosis Duodeno-Ileal; Distal Loop Duodeno-Ileostomy), derivación biliopancreática y duodeno-yeyunostomía (DJOS), etc.
Aunque los procedimientos bariátricos restrictivos pueden disminuir los factores de riesgo cardiometabólico, el control de enfermedades como la diabetes mellitus de tipo 2 es marginal; hay reportes de hasta 3 % de remisión completa prolongada en pacientes sometidos a banda gástrica ajustable y entre 0 a 3% en aquellos sometidos a gastrectomía en manga. La cirugía metabólica, por otro lado, propone el restablecimiento de la cinética de las enterohormonas sin utilizar restricción, prótesis, ni estenosis, o favorecer la malabsorción 4, razones por las cuales está indicada para la diabetes mellitus de tipo 2 de difícil control, en pacientes sin obesidad.
En México, la derivación gástrica en Y de Roux por laparoscopia ha demostrado ser una opción segura y efectiva para mejorar los perfiles metabólicos en pacientes diabéticos no obesos, con un índice de remisión completa de 47,4 % mientras que 36,8 % lograron remisión parcial con un índice de 13 % de complicaciones 5. Entre las complicaciones más frecuentes se encuentran: colecistolitiasis (13 a 36 %), hipoglucemia después de la derivación (1 a 13,3 %) 6, oclusión intestinal (4,4 %), sangrado digestivo alto, disminución de la densidad ósea y complicaciones nutricionales 7.
Debido a que el intestino delgado es el principal sitio de absorción de ciertos nutrientes, la exclusión segmentaria lograda con la derivación gástrica en Y de Roux por laparoscopia, la derivación biliopancreática, la duodeno-ileostomía con una anastomosis, la duodeno-yeyunostomía y otros procedimientos, favorecen las deficiencias de micronutrientes, vitaminas A, C, D, K, tiamina, ácido fólico, hierro, selenio, cinc y cobre.
Por lo tanto, habitualmente se requieren suplementos de vitamina B12 (1.200 µg), carbonato de calcio (1.000 mg), vitamina D3 (1.000 U) y sulfato ferroso (300 mg), los cuales deben reajustarse según las concentraciones séricas. Otras grandes desventajas de la derivación gástrica en Y de Roux por laparoscopia son el costo y la necesidad de contar con personal específicamente entrenado para este procedimiento, además de una infraestructura que no es habitual en los hospitales de segundo nivel de atención, por lo que es viable la opción de considerar otros procedimientos.
La bipartición del tránsito intestinal es la cirugía metabólica más sencilla de practicar con la que se logra obtener los cambios necesarios para favorecer la secreción de incretinas 8, aumentar la exposición del epitelio intestinal a ácidos biliares y, además, modificar la microbiota sin favorecer la malabsorción. Aunque el concepto no es nuevo, nuestro conocimiento al respecto se ha profundizado para lograr que estos procedimientos puedan ser más seguros y cada vez menos invasivos 9.
El objetivo del presente trabajo fue ofrecer una actualización sobre los mecanismos involucrados en la remisión de la diabetes mellitus de tipo 2 posterior a la cirugía metabólica 9.
Mecanismos responsables de la remisión de diabetes mediante cirugía metabólica
La restricción calórica y la pérdida ponderal son dos resultados comunes a las intervenciones bariátricas restrictivas, malabsortivas y mixtas. Sin embargo, se ha demostrado que el control metabólico favorecido por la cirugía restrictiva no es la estrategia ideal para mantener la remisión de la diabetes mellitus de tipo 2 10.
Durante la última década, se ha establecido que los factores más importantes para favorecer dicha remisión son los cambios neurohumorales que afectan la regulación de la energía, el apetito, la homeostasis de la glucosa; los cambios inducidos en la microbiota 11 , y los cambios en el metabolismo de los ácidos biliares y sus interacciones con el receptor X farsenoid (FXR) además del cambio en los patrones de dieta y ejercicio.
Dieta
Es innegable que los pacientes sometidos a un procedimiento quirúrgico modifican más frecuentemente sus hábitos dietéticos que quienes no lo hacen. Además de la ingestión calórica total, las concentraciones de macronutrientes y el contenido de glucosa o fructuosa son determinantes en la historia natural de la diabetes durante el posoperatorio, ya que la hiperglucemia sostenida disminuye la secreción de insulina. Se ha comprobado la importancia de la dieta, pues una con mayor contenido de grasas y proteínas favorece la remisión completa de la diabetes hasta en 42 a 100 % de los pacientes 12.
Por otro lado, la sobrealimentación favorece la proliferación del epitelio intestinal, con aumento de la absorción más temprana de los nutrientes. Además, acentúa el estrés sobre el retículo endoplásmico, lo cual favorece un estado proinflamatorio, la resistencia a la insulina y la disminución en la producción de insulina, incluyendo la disfunción y apoptosis de las células beta y agravando la glucotoxicidad, efectos estos últimos que son atenuados por agonistas del receptor del péptido similar al glucagón de tipo 1 (Glucagon-Like Peptide-1, GLP-1) 13. La falla en el control de la saciedad, las interacciones sociales (hedonismo, gratificación inmediata, sedentarismo, etc.) y el gran contenido calórico de los alimentos, entre otros factores, favorecen la sobrealimentación. De ahí, que el tratamiento integral de estos pacientes sea una condición indispensable para el éxito del procedimiento 14.
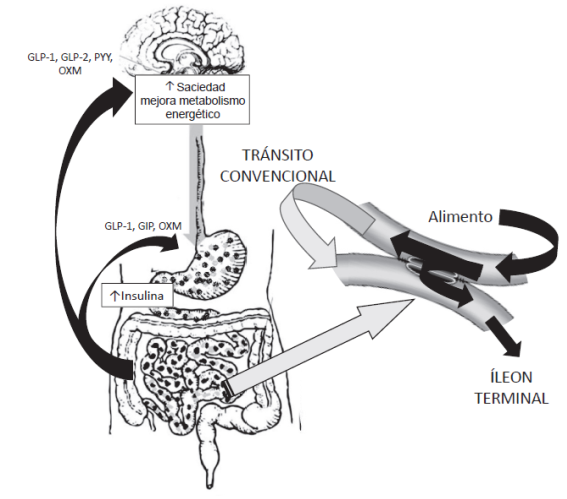
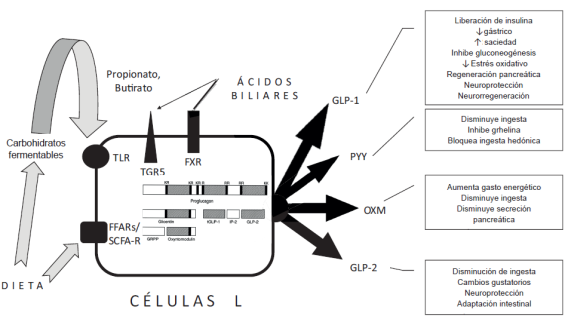
La dieta interactúa con el paciente y su microbiota, modificando su conformación y la producción de butiratos, propionatos, productos de fermentación de los carbohidratos (prebióticos) y ácidos grasos libres; estos interactúan por medio de los receptores TGR5, FFARs/SCFA-R, TLR y TR de las células L del intestino distal, para favorecer la producción de incretinas, como el péptido GLP-1 y el péptido YY, modificando el patrón alimentario, la saciedad, la secreción de insulina y la supervivencia o regeneración pancreáticas.
Las verduras contienen sustancias llamadas tilacoides localizadas preferentemente en los cloroplastos que, de forma independiente, favorecen la secreción del péptido y la promoción de la saciedad. Otro factor importante asociado con el consumo de verduras es su contenido de inulina y otros carbohidratos fermentables que ayudan a modelar la microbiota, y la concentración de butiratos y propionatos.
Incretinas, decretinas y diabetes como mala adaptación intestinal
Las incretinas son hormonas secretadas por el epitelio intestinal que favorecen la secreción de insulina como reacción a la ingestión de alimentos y a la exposición a los ácidos biliares, y como resultado de las interacciones con el microbiota intestinal. El péptido GLP-1 es una incretina producida por las células L localizadas en el íleon terminal y el colon proximal, a partir de la proteólisis del preproglucagón; tiene una vida media de dos minutos, aproximadamente, ya que es ‘inactivada’ por la peptidasa dipeptidil 4 (Dipeptidyl peptidase-4, DPP-4) (7-36) 15,16,17.
La forma primaria, el GLP-1 (7-36), controla la liberación de insulina dependiente de la glucosa y optimiza la función de las células beta, además de inhibir la secreción de glucagón, retrasar el vaciamiento gástrico y favorecer la saciedad. Al ser metabolizada, se transforma en GLP-1 (9-36) reestableciendo la motilidad antral bloqueada por GLP-1 (7-36), mientras que la GLP-1 (28-36) 18,19,20 inhibe la producción hepática de glucosa y el estrés oxidativo en el hepatocito y la GLP-1 (32-36) modula el metabolismo de glucosa en todo el organismo.
La disminución de la concentración del péptido GLP-1 está involucrada en la fisiopatología de diversas enfermedades consideradas propias del estilo de vida occidental. El tratamiento con análogos de esta incretina mejora el control de diabetes mellitus de tipo 2, la hipertensión arterial, la remodelación miocárdica, la dislipidemia, la obesidad, la albuminuria, la esteatohepatitis, etc. La cirugía metabólica y la bariátrica mixta aumentan las concentraciones de incretina GLP-1 al favorecer el contacto temprano del íleon terminal con los nutrientes, lo cual mejora las condiciones metabólicas de los pacientes, para después disminuir las concentraciones de insulina y péptido C debido a la disminución de la glucosa.
El péptido GLP-1 promueve la proliferación de las células beta, la sensibilidad a la insulina, la cardioprotección, mejora la función cardiaca, favorece la neuroprotección y la neuroproliferación, y mejora la función cognitiva 21,22,23,24,25,26.
Al parecer, esta incretina contribuye a los mecanismos de saciedad, al valor hedónico de la ingestión de alimentos de alto contenido de grasas y carbohidratos, así como la motivación para la ingestión por medio de vías dopaminérgicas en el centro de recompensa.
El péptido insulinotrópico dependiente de glucosa, (Glucose-dependent Insulinotropic Peptide, GIP), otra incretina secretada por las células K del duodeno y del yeyuno, mejora la secreción de insulina y promueve la proliferación de las células beta pancreáticas.
La oxintomodulina es cosecretada con los péptidos GLP-1 y PYY, disminuye la ingestión de alimentos, el vaciamiento gástrico y la secreción pancreática exocrina por medio de la activación del receptor de glucagón, el del GLP-1 o el de ambos, y aumenta el gasto energético basal.
El polipéptido YY es otra enterohormona secretada por las células L (1-36), en cuyo metabolismo interviene la dipeptidasa DPP-4 (3-36). Actúa principalmente en el hipotálamo, disminuyendo la ingestión de alimentos, y además, la secreción gástrica, la pancreática y la intestinal. Inhibe a la hormona ghrelina y al neuropéptido Y en el núcleo arcuato por medio del receptor Y2, con la activación de las células POMC (proopiomelanocortina). Su liberación puede aumentarse por la ingestión de prebióticos como la inulina, ya que los productos de fermentación de los carbohidratos pueden aumentar su expresión y las interacciones en el hipotálamo.
El bloqueo del polipéptido YY, del GLP-1 y de la secreción de insulina mediante la administración de octreótido, incrementa la recompensa asociada con la ingestión de alimentos, además de las reacciones anticipatorias y la ingestión hedónica.
Otros sitios de expresión de los péptidos GLP-1, PYY y GIP, y de las hormonas neurotensina y ghrelina, son las células enteroendocrinas secretoras de colecistocinina (Cholecystokinin, CCK) 27.
Las alteraciones en la cinética de las incretinas que producen una reacción tardía y disminuida son un factor inicial en la fisiopatología de la obesidad y la diabetes mellitus de tipo 2. Reestablecer la secreción apropiada, como se logra al estimular de forma temprana al íleon distal con procedimientos como la derivación gástrica en Y de Roux por laparoscopia, la duodeno-yeyunostomía, la duodeno-ileostomía de asa distal, la interposición ileal y la bipartición del tránsito intestinal, es una condición sine qua non para favorecer y mantener la remisión de la diabetes mellitus de tipo 2.
Diabetes mellitus de tipo 2 como mala adaptación Intestinal
Las características anatomo-funcionales del intestino delgado no han podido adaptarse a los cambios que se han presentado en las condiciones dietéticas a partir de la revolución neolítica y que se han acentuado en los últimos 50 años.
Se ha podido relacionar a la mayor longitud intestinal con procesos patológicos como obesidad, diabetes y dislipidemias. La longitud del intestino proveniente de individuos sanos seleccionados para trasplante es de aproximadamente 356 cm, mientras que, en los pacientes con obesidad y dislipidemia es de 500 cm y, en los diabéticos, de hasta 760 cm en promedio. Sin embargo, algunos autores han asociado la longitud intestinal in vivo, medida por enteroscopia, con la estatura y así con el peso y con el IMC. Se han encontrado longitudes intestinales de 261 a 755 cm, utilizando distintos métodos de medición 28,29.
Se ha descrito que el número y el recambio de las células L, productoras de los péptidos GLP-1, PYY y OXM en el íleon terminal, es igual en pacientes sanos y en aquellos con diabetes. Por lo tanto, no puede descartarse la posibilidad de que la longitud intestinal, junto con la composición del microbiota y la cinética de los ácidos biliares, sea un factor que contribuye al desarrollo de una cinética inapropiada de las incretinas y al desarrollo consecuente de obesidad y diabetes 29.
Decretinas
Las decretinas son enterohormonas producidas en el intestino anterior (duodeno, yeyuno proximal) que disminuyen la secreción de insulina y bloquean los mecanismos de saciedad. Aún existe mucha controversia acerca del papel de las decretinas. Por ejemplo, algunos autores han demostrado que la neuromedina U, un neuropéptido expresado en el sistema nervioso central, favorece la disminución de la ingestión de alimentos y del peso corporal al actuar sobre los receptores 2 (NmUR2) 30, mientras que los receptores 1 (NmRU1), expresados en el tejido pancreático, inhiben la secreción de insulina y los mecanismos de saciedad 30,31. Inclusive, se ha sugerido que la neuromedina U puede influir en el comportamiento alimentario al favorecer el rechazo de alimentos con alto contenido calórico y preferir dietas más balanceadas.
La importancia de las decretinas se deriva del estudio de Rubino, en el que se demostró mejoría significativa en la secreción de insulina en ratas GK sometidas a exclusión duodenal quirúrgica, sin impactar de forma importante en la secreción de GLP-1 pero sí en la de GIP 32,33. Sin embargo, en humanos se ha comprobado que la exclusión de un segmento de intestino anterior mediante el EndoBarrier puede favorecer la pérdida ponderal pero no resulta en diferencias significativas en cuanto a la hemoglobina glucosilada y la glucosa en ayuno. De la misma manera, con la derivación duodeno-yeyunal se demostró una remisión completa de diabetes mellitus de tipo 2 en solo el 10 % de los pacientes que se sometieron al procedimiento 34,35,36, lo que apoyaría el hecho de que, si existe un efecto clínico, este es marginal y pudiera deberse a otros factores; así lo sugiere un estudio de exclusión duodenal en el modelo en ratón, en el cual se demostró un aumento significativo de la concentración de GLP-1, mejoría en la sensibilidad a la insulina, aumento de la concentración de ácidos biliares, y cambios de la microbiota a expensas de firmicutes y proteobacterias 37.
La ghrelina y la galanina son otras dos enterohormonas que pueden favorecer la supresión de las células beta. La primera es una hormona orexígenica secretada por las células X/A del antro y el fondo gástrico como reacción al ayuno con el fin de proteger de la hipoglucemia que este induce. Actúa en el núcleo arcuato y el área tegmental ventral del hipotálamo por medio de aferencias del vago y secreción directa 38. La galanina, por su lado, se expresada en las neuronas y en el intestino, y suprime la secreción de insulina mediada por la glucosa.
En el modelo en ratones, existe evidencia que sugiere que la diabetes favorece un aumento de hasta 100 % en el peso húmedo del intestino a expensas de la hiperplasia en el intestino proximal, sitio responsable de la secreción de decretinas.
Considerando lo anterior, la relación entre diabetes y longitud intestinal puede ser bidireccional. Los individuos con una mayor longitud intestinal presentarían una alteración de la cinética de las incretinas por un estímulo tardío, lo cual favorecería la sobrealimentación, la hiperglucemia y la glucotoxicidad contra las células beta. La sobrealimentación favorecería la hiperplasia intestinal, al igual que la diabetes mellitus, agravando la hiperglucemia por aumento del efecto de la decretina y disminución del efecto de la incretina.
De forma similar, la ingestión de alimentos muy procesados y de ‘fácil digestión’, favorecería la absorción en el intestino proximal y la secreción de insulina; al ser absorbidos en este sitio, el estímulo distal sería menor.
Ácidos biliares
Los ácidos biliares son esteroides sintetizados en el hígado a partir del colesterol, conjugados con taurina o glicina para aumentar la hidrosolubilidad. Existen dos vías metabólicas (la clásica y la alterna) iniciadas por la 7 alfa hidroxilasa y la esterol-27 hidroxilasa, respectivamente. La vía clásica produce ácido cólico y ácido quenodesoxicólico, mientras que la vía alterna produce ácido cólico, principalmente. Los ácidos biliares se secretan en la bilis y se excretan como reacción a la ingestión de alimentos para facilitar la digestión de las grasas.
Además de las funciones digestivas de las secreciones hepatobiliares, los ácidos biliares poseen efectos endocrinos y ayudan en la regulación de la glucosa y el metabolismo de lípidos 38.
Las cirugías metabólicas aumentan las concentraciones de ácidos biliares circulantes y activan al receptor farsenoide X (FXR) y al TGR5. Favoreciendo la secreción de los péptidos GLP-1 y PYY 39.
El receptor farsenoide X también se expresa en las células beta y estimula la secreción de insulina. Existe evidencia que sugiere que también disminuye la gluconeogénesis hepática y la glucogénesis. Otra actividad mediada por la activación del FXR, es la secreción de factor de crecimiento de fibroblastos 19, el mismo que reduce la expresión de 7 alfa-hidroxilasa para inhibir la síntesis de ácidos biliares en el hígado.
Las interacciones de los ácidos biliares son de primordial importancia en la secreción del GLP-1, como se pudo comprobar al someter a ratas, a las que se les practicó una derivación duodeno-yeyunal, a un bloqueo de la exposición de los ácidos biliares al epitelio. Además, la derivación duodeno-yeyunal favorece un decremento en el estado proinflamatorio por medio de la activación del sistema JNK en el hígado y el tejido adiposo 40. Con esto se mejora la esteatosis hepática por medio de la secreción del GLP-1, favorecida principalmente por los ácidos biliares.
El TGR5 es un receptor asociado con la proteína G y expresado en el tejido adiposo, el músculo esquelético y las células L. Los ácidos biliares favorecen la secreción de GLP-1 por medio del TGR5 en las células L.
Se ha comprobado que la derivación de la vesícula biliar al íleon terminal promueve efectos metabólicos similares a los obtenidos después de la derivación gástrica en Y de Roux por laparoscopia, incluyendo mejoría del peso corporal, de la tolerancia a la glucosa y de la esteatosis hepática. Asimismo, se ha visto que la derivación biliar al intestino favorece modificaciones benéficas en el microbiota 41.
Microbiota
La anatomía intestinal y los patrones dietéticos modelan el microbiota, la cual se ha asociado con la patogenia de obesidad, síndrome metabólico, diabetes, esteato-hepatitis y otras enfermedades 42,43,44. Los firmicutes y las bacterioidetes dominan la población bacteriana del intestino de los humanos sanos, mientras que, en pacientes con obesidad, los firmicutes disminuyen y las Metanobrevibacterias, que son capaces de extraer más calorías de la dieta, aumentan, favoreciendo fallas en su manejo 45. Las bacterias productoras de butiratos y propionatos se encuentran disminuidas en pacientes con diabetes mellitus de tipo 2.
Al transferir el microbiota de pacientes sometidos a cirugía metabólica al modelo en ratones se ha demostrado que puede contribuir a mejorar el fenotipo metabólico en los roedores 46. Tanto la derivación gástrica en Y de Roux por laparoscopia como la gastrectomía en manga favorecen cambios en la conformación del microbiota, aumentando el número de Gammaproteobacterias, Bacteroides, Akkermansia, Verrucomicrobiales y Escherichia, sin embargo, en el caso de la la segunda, estos cambios son temporales 47,48,49,50.
Las interacciones entre microbiota y huésped son complejas y, al parecer, multilaterales. En un estudio en ratones sometidos a dietas altas en grasas, se logró identificar alteraciones exploratorias, cognitivas y de comportamiento estereotípico, comparados con aquellos ratones con microbiota modelada al consumir dieta de control. Los cambios en el microbiota fueron evidentes con alteraciones en las diversidades alfa y beta, además de la distribución taxonómica asociada con marcadores de disrupción de la membrana intestinal, endotoxemia y mayor expresión de TLR2, TLR4 e Iba1 por parte de los linfocitos, lo cual repercute en un mayor estado de neuroinflamación y alteración de la homeostasis cerebrovascular (figura 1) 51,52,53.
Regeneración pancreática
La falla celular beta es una de las características comunes en las etapas avanzadas de la diabetes mellitus de tipo 2. El estrés del retículo endoplásmico y el estrés oxidativo crónico favorecen el agotamiento de las células beta y su consecuente disfunción y muerte. Se ha propuesto que la glucotoxicidad puede silenciar genes de las células beta, como los que codifican para Pdx1, Nkx6.1, MafA y Pax6, favoreciendo su ‘desdiferenciación’ a otras líneas celulares (Ngn3+) 54. Este evento puede ser revertido mediante cambios dietéticos, incluyendo el ayuno.
Hasta hace unos años, se consideraba que la masa celular beta no era capaz de reestablecerse. Sin embargo, existe evidencia de que la regeneración pancreática es posible por medio de varios mecanismos. Los mecanismos observados son:
a) inhibición de la apoptosis y regeneración de las células beta restantes,
b) neogénesis a partir de células progenitoras ductales, y
c) transdiferenciación de células alfa o delta a células beta.
Entre los efectores de este proceso, se encuentran el glucagón y el péptido GLP-1 55.
Un mecanismo, distinto al mediado por el GLP-1 y otras enterohormonas, es el aumento de la expresión de los productos de los genes REG después de la modificación anatómica. Estos productos favorecen la regeneración pancreática, específicamente Reg3 gamma, que se ha asociado con las concentraciones de insulina y péptido C en pacientes que reaccionaron favorablemente a la derivación gástrica en Y de Roux por laparoscopia 56,57.
La cirugía metabólica, mediante el aumento del GLP-1, mejora el control de la glucemia aun en pacientes con péptido C negativo, en quienes se supondría la ausencia de células B funcionales, independientemente de su etiología (diabetes mellitus de tipo 2, DM1, LADA). Esto sugiere la existencia de un efecto clínicamente significativo de esta regeneración y le otorga mayor relevancia a la actividad de los productos de metabolismo del GLP-1 58.
Bipartición del tránsito intestinal
El concepto de bipartición de tránsito intestinal ha evolucionado a partir de la necesidad de estimular la secreción de incretinas por parte del intestino distal, sin resecar ni excluir segmentos de intestino delgado, como ocurre en las entero-omentectomías adaptativas descritas por Santoro, la derivación gástrica en Y de Roux por laparoscopia, la derivación biliopancreática, la duodeno-yeyunostomía, la duodeno-ileostomía con una anastomosis, etc 59-60.
Actualmente, la bipartición del tránsito intestinal puede ser alta o baja. La alta está representada por una gastro-ileostomía látero-terminal a 180-250 cm proximales a la válvula ileocecal, con entero-entero anastomosis término-lateral a 80 cm proximales a la válvula en conformación de Y 61, en conformación de omega 62 o mediante una duodeno-ileostomía látero-lateral 63.
La bipartición del tránsito intestinal baja se logra mediante una anastomosis yeyuno-ileal, látero-lateral, en un sitio calculado de acuerdo con la longitud intestinal total del paciente, considerando 1/3 de yeyuno y 2/3 de íleon, cuya suma no debe ser menor de 2,5 m ni de 33 % de la longitud intestinal total 64,65.
Lo anterior se debe a que se ha estimado que una longitud de menos de 200 cm de intestino funcional puede resultar en un síndrome de intestino corto, al igual que un segmento menor de 35 cm de yeyuno (con anastomosis yeyuno-ileal), menos de 60 cm con anastomosis yeyuno-cólica y menor de 150 cm con yeyunostomía terminal 66.
En otras palabras, un paciente con un yeyuno-íleon de 7 metros podría tener la anastomosis a 100 cm del ángulo de Treitz y a 200 cm de la válvula ileocecal; de esta manera, aun con un paso exclusivamente transanastomótico, la longitud mínima de tránsito sería de 300 cm, lo que constituye el 42,8 % de la longitud total del intestino, lo cual evita la posibilidad del síndrome de intestino corto 67,68,69.
En el modelo en ratones, se ha establecido que la distancia más apropiada para la derivación es entre 50 a 60% de la longitud total del yeyuno-ileon, ya que, si es menor, no existirán los efectos en la regulación de la glucosa y, si es mayor, aparecerán con mayor frecuencia efectos adversos como la diarrea 70.
Con el fin de favorecer un tránsito similar a través de la anastomosis, la longitud de esta debería ser similar al diámetro de las asas intestinales. Lo anterior, con el fin de evitar las complicaciones que se evidenciaron con la derivación yeyuno-ileal descrita por Stockeld, en 1991 71,72. En esa cirugía se hacía una anastomosis látero-lateral de 9 cm, a 20 cm del ángulo de Treitz, con el asa ileal localizada a 25 cm de la válvula ileocecal. Al hacer una anastomosis de, por lo menos, dos veces el diámetro del asa aferente, la presión transanastomótica favorecería un paso preferencial, logrando disminuir en forma importante el flujo por el resto del intestino con la sobrepoblación bacteriana asociada, además de malnutrición y hepatopatía, como lo reportó en su momento Stockeld (figura 2) 73,74,75.
La bipartición del tránsito intestinal es una modificación de la derivación intestinal reversible e hipofuncionante de Lazzarotto e Souza (BIRHLS). Después de calcular la superficie de absorción intestinal, utilizando fórmulas no validadas, Lazzarotto e Souza sometió a 1.200 pacientes a una anastomosis yeyuno-ileal látero-lateral, considerando no dejar menos de 90 cm de íleon terminal para evitar complicaciones nutricionales. En su serie, reportó una pérdida ponderal de 42,7 % y complicaciones como diarrea, náuseas en 9 %, anemia en 0,6 %, hipoalbuminemia en 0,83 % y una extraordinariamente baja tasa de revisión para un procedimiento que se utilizó con fines bariátricos (0,24 %) 76.
No fue sino hasta 10 años después de la publicación del trabajo de Lazzarotto e Souza, que los angloparlantes han vuelto a considerar este tipo de cirugía. Duan, et al., demostraron que la bipartición del tránsito intestinal mediante una anastomosis látero-lateral, produce mejoría en la homeostasis de la glucosa y en la sensibilidad a la insulina, así como aumento considerable en las concentraciones de GLP-1 y ácidos biliares totales, al compararla con el modelo de derivación intestinal y yeyunectomía 77. La yeyunectomía es el componente principal en las entero-omentectomías adaptativas propuestas por Sergio Santoro, procedimientos considerados como readaptaciones intestinales a las condiciones ambientales, que favorecen una mayor secreción de enterohormonas por parte del íleon terminal, como fuera publicado en humanos en 2008 y retomado en el modelo en ratones años después con el fin de reforzar la teoría de la estimulación del intestino distal 78-79.
La GLP-2 se secreta en relación equimolar con la incretina GLP-1, e inhibe el hambre a nivel del núcleo arcuato hipotalámico, además de reducir la producción hepática de glucosa y aumentar la sensibilidad a la insulina 80.
Una potencial desventaja con la yeyunectomía física, es que se sabe que la GLP-2 es una de las enterohormonas asociadas con los procesos readaptativos intestinales y que la readaptación entérica a la resección del intestino delgado está en relación con la magnitud de la resección 81, por lo que una anastomosis látero-lateral podría implicar menos readaptación en comparación con la yeyunectomía, si existieran mecanismos paracrinos que regularan la actividad de la GLP-2.
La bipartición del tránsito intestinal puede hacerse mediante cirugía convencional, laparoscópica o, inclusive, mediante procedimientos totalmente endoscópicos asistidos por magnetos.
La derivación yeyunal parcial o bipartición de tránsito intestinal yeyuno-ileal asistida con magnetos, mantiene los principios fisiológicos de la bipartición del tránsito intestinal, y se logra sin la necesidad de cirugía 82. Sin embargo, entre sus desventajas hay dos principales. La primera es la imposibilidad de cerrar la brecha mesentérica, lo que expone a los pacientes al riesgo de complicaciones por hernia interna. La segunda radica en la diferencia con los procedimientos abiertos y los laparoscópicos, en los cuales el sitio de la anastomosis se determina tomando en cuenta la longitud intestinal total, mientras que, en el procedimiento endoscópico, se desconoce dicha longitud y, además, se limita según las características del endoscopio utilizado, con el consecuente riesgo de desarrollar síndrome de sobrepoblación bacteriana, diarrea, malabsorción y otros.
Durante el primer estudio realizado con este sistema endoscópico, se utilizó asistencia laparoscópica para identificar el sitio de la anastomosis a 50-100 cm del ángulo de Treitz y a 50-100 cm de la válvula ileocecal. Los pacientes pudieron reanudar sus actividades diarias al segundo día, en promedio. Al cabo de 12 meses, habían presentado una pérdida de 40 % del peso excedente (14,6 % del peso total), así como una disminución de 1,8 % de HbA1c (7,8 + 2,4% a 5,9 + 0,5 %).
Entre los efectos adversos en la primera serie de pacientes intervenidos con imanes, se presentaron dolor abdominal (90 %), diarrea leve (50 %) y moderada (50 %), deficiencia de vitamina B (40 %), y deficiencia de vitamina D (20 %) y de hierro en (40 %). Sin embargo, la diarrea fue resuelta mediante cambios en la composición de la dieta, limitando la ingestión de carbohidratos, con loperamida o con ambas cosas 83. Actualmente, se está llevando a cabo el primer estudio aleatorizado para verificar la utilidad del procedimiento (NTC03130244).
La experiencia previa con la bipartición del tránsito intestinal quirúrgica sugiere una reducción en los niveles de HbA1c de más del 2 % en 53,3 % de los pacientes, mientras que el 73,3 % presentarán una disminución mayor de 1,5 % y pérdida ponderal de 12 %, aproximadamente. Los parámetros funcionales de las células beta mejoran, así como las concentraciones de la GLP-1. Las tasas de remisión completa de diabetes mellitus de tipo 2 se han reportado en 57 a 59%.
Al modificar la cinética de las incretinas, la GLP-1 y la GLP-2 contribuyen a la pérdida ponderal mediante su actividad en el vaciamiento gástrico, así como en la activación del sistema de la proopiomelanocortina. La bipartición del tránsito intestinal puede favorecer una pérdida mayor de 10 % del peso inicial en 66,7 % de los pacientes.
Los efectos metabólicos incluyen mejoría en el perfil de riesgo cardiovascular, disminución de la hipertensión arterial sistémica y mejoría en los parámetros de función renal; sin embargo, también se ha documentado disminución de los niveles de vitamina B12.
Los efectos adversos más frecuentemente reportados fueron diarrea (46,7%), flatulencia (26,7%) y dolor (33,3%).
La bipartición del tránsito intestinal no favorece asas ciegas. Sin embargo, de acuerdo con la longitud intestinal en continuidad, pueden existir deficiencias de micronutrientes y macronutrientes, como hierro, cinc, vitamina B o vitamina D, así como de calcio y albúmina. Otro riesgo es la disbiosis, con la generación de diarrea y meteorismo con flatulencia 84.
En cuanto a la seguridad del procedimiento, es claramente superior a otras intervenciones bariátricas que presentan tasas de complicación de hasta 10,5 % y mortalidad menor de 0,5 %; además, es fácilmente reversible.
La remisión de la diabetes mellitus de tipo 2 lograda por procedimientos quirúrgicos, depende de complejas interacciones entre el microbiota, los ácidos biliares y el epitelio intestinal, más que de procesos malabsortivos o restrictivos. La bipartición de tránsito intestinal es una opción quirúrgica basada en los principios fisiológicos responsables en la remisión de diabetes, y es la más sencilla y segura para el manejo de la diabetes mellitus 84.