Introducción
La palabra acalasia es un neologismo de origen griego, acuñado por el médico inglés Sir Edwin Cooper en 1913, y significa: sin calidad de relajación. La acalasia es una enfermedad que se manifiesta clínicamente por disfagia para sólidos y para líquidos, regurgitación esofágica, dolor retroesternal, tos, broncoaspiración, neumonía, acidez estomacal y pérdida de peso. Su fisiopatología corresponde a la ausencia de peristalsis esofágica e insuficiente relajación del esfínter esofágico inferior 1,2. Estas anormalidades motoras se deben a la pérdida de las neuronas mientéricas, que coordinan la peristalsis esofágica y la relajación del esfínter esofágico inferior 3.
Fue descrita por primera vez por Sir Thomas Willis 4 en 1674 y, aunque actualmente se considera idiopática, se han comenzado a considerar posibles causas autoinmunitarias, debido al hallazgo de anticuerpos circulantes contra el plexo mientérico. En otros estudios se menciona una posible predisposición genética, por su correlación con enfermedades como la neoplasia endocrina múltiple de tipo 2 (Multiple Endocrine Neoplasia type 2, MEN2) y el síndrome de Allgrove; también, se han implicado como probables causas las infecciones por virus herpes y por herpes zóster 2.
Su incidencia anual oscila entre 0,3 y 1,63 por 100.000 personas en adultos 5,6, con una prevalencia de 10 en 100.000 habitantes al año. Afecta por igual a cualquier sexo, y el grupo etario de 30 a 60 años es el más afectado 7,8.
Diagnóstico
En cualquier paciente que consulte por disfagia, se debe descartar inicialmente reflujo gastroesofágico, obstrucción mecánica y procesos inflamatorios o neoplásicos. Posteriormente, se debe estudiar la motilidad esofágica por la posibilidad de acalasia 9.
La endoscopia de vías digestivas altas permite descartar enfermedad erosiva por reflujo gastroesofágico, anomalías estructurales y cáncer de esófago. No obstante, un resultado normal no descarta la existencia de acalasia, ya que la endoscopia de vías digestivas altas puede ser normal hasta en el 40 % de los pacientes con acalasia 10,11.
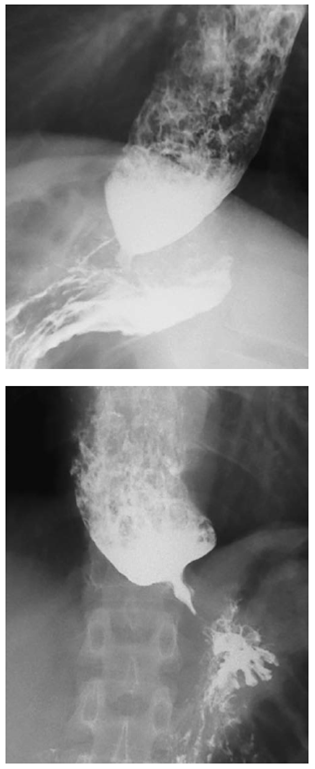
El esofagograma puede mostrar el clásico aspecto de ‘pico de pájaro’, dilatación esofágica y ausencia de peristalsis 12 (figura 1).
La manometría esofágica de alta resolución es un estudio que se basa en el análisis de la presión integrada de relajación (Integrated Relaxation Pressure, IRP), la presión integral contráctil distal (Distal Contractile Integral Pressure, DCI) y la latencia distal. Mediante procesos algorítmicos, estas mediciones permiten determinar alteraciones de la motilidad esofágica 13. Actualmente, se considera la prueba estándar para establecer el diagnóstico de acalasia 8.
Según la clasificación de Chicago, versión 3.0, se describen cuatro grandes grupos de anormalidades motoras esofágicas: acalasia, obstrucción de la salida en la unión esófago-gástrica, alteraciones mayores, y alteraciones menores 14.
Con la introducción de la manometría de alta resolución en la década de 1990, el diagnóstico de acalasia se ha subdividido en tres subtipos, que se caracterizan por falla de la relajación del esfínter esofágico inferior, pero poseen diferentes patrones de contracción esofágica. La acalasia de tipo I -anteriormente, clásica- presenta 100 % de degluciones fallidas. La acalasia de tipo II, o acalasia con compresión esofágica, presenta presurización panesofágica, al menos, en el 30 % de las degluciones. La acalasia de tipo III, o espástica, presenta contracciones prematuras -o espásticas-en el esófago distal, al menos, en el 30 % de las degluciones 15,16.
Tratamiento
Con base en la clasificación de Chicago, algunos autores han sugerido que la acalasia de tipo I responde mejor al tratamiento con la miotomía de Heller, con tasas de mejoría del 56 al 85 %; la de tipo II, que es la más común, presenta las tasas de mejoría más altas (85 a 95 %) con cualquier tratamiento, y la de tipo III, que es la menos frecuente, presenta las tasas de mejoría más bajas (29 a 69 %) 17,18,19. El tratamiento de la acalasia se enfoca en lograr la disminución de la presión del esfínter esofágico inferior, mediante tratamientos farmacológicos, endoscópicos o quirúrgicos 20,21.
Tratamientos farmacológicos
Se han empleado medicamentos, como los nitratos, los bloqueadores de canales de calcio y, más recientemente, los inhibidores de la 5-fosfodiesterasa. Sin embargo, no hay estudios de seguimiento a largo plazo y su uso ha sido previo a la subclasificación de los tipos de acalasia. Aunque los medicamentos relajantes del músculo liso pueden proporcionar algún beneficio sintomático, no son tratamientos duraderos, a menudo se asocian con efectos secundarios intolerables, y no detienen la progresión de la dilatación esofágica ni la retención de alimentos 13.
La toxina botulínica se ha empleado desde 1994 y consiste en la inyección endoscópica de Botox™ en el esfínter esofágico inferior, lo que inhibe la liberación de acetilcolina de las terminaciones nerviosas y baja el tono del esfínter. La mejoría de la sintomatología es de hasta 78,7 % al mes del tratamiento, pero baja hasta 40,6 % a los 12 meses. Aunque el procedimiento es simple y casi sin ningún riesgo de complicación, su repetición es menos eficaz y se han informado casos de morbilidad e, incluso, de mortalidad a causa de mediastinitis. Actualmente, sigue siendo una alternativa en pacientes ancianos, en aquellos no aptos para otro tipo de tratamientos y en casos de acalasia de tipo III después de un tratamiento quirúrgico fallido 22,23,24.
Dilatación neumática
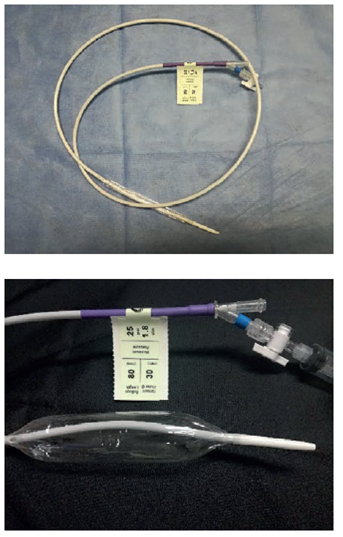
La dilatación neumática se practica con un balón dilatador cilíndrico de 30, 35 o 40 mm (figura 2), que se ubica a nivel del esfínter esofágico inferior mediante fluoroscopia y se infla mediante un manómetro manual. Actualmente, el más usado en los Estados Unidos es un balón de polietileno con marcadores radioopacos en su interior (Rigiflex™). Recientemente, se ha empezado a utilizar un dilatador hidráulico de 30 mm, conjuntamente con la tecnología FLIP (Functional Lumen Imaging Probe), con la cual no se requiere la fluoroscopia 13.
Con esta técnica se logra una mejoría de la disfagia hasta en el 85 % de los casos, pero tiene poco efecto sobre el dolor retroesternal. Hasta 25 % de los pacientes requiere sesiones adicionales en forma temprana y su eficacia disminuye con el paso de los años; la tasa de éxito es de tan solo el 60 % a los tres años. Se puede observar reflujo hasta en 33 % de los pacientes, por lo que la dilatación neumática no se recomienda en pacientes menores de 40 años y, en aquellos que no mejoran con una sola dilatación neumática, se recomienda el tratamiento quirúrgico. La principal complicación informada es la perforación esofágica, hasta en 8 % de los casos 25.
En algunos estudios europeos multicéntricos, se ha comparado la miotomía de Heller con la dilatación neumática y se ha encontrado hasta 90 % de efectividad, sin una diferencia significativa entre ellos. Se debe tener en cuenta que estos estudios fueron anteriores a la subclasificación de la acalasia 26,27. En otro estudio europeo, la efectividad de la dilatación neumática en el tratamiento de la acalasia de tipo II fue del 100 % y, debido a su menor costo y riesgo de perforación, los autores la recomiendan como el tratamiento de elección en estos casos 28.
Miotomía de Heller
Fue descrita por Ernest Heller en 1913, y consiste en practicar una miotomía anterior mediante una incisión longitudinal de 7 cm en el esfínter esofágico inferior, que se extienda 2 cm en el cardias gástrico y 5 cm en el esófago. Este procedimiento debe ir acompañado de una cirugía antirreflujo, siendo la de tipo Dor la más recomendada 13. En 1991 se describió la miotomía laparoscópica de Heller 29, en uso desde hace más de dos décadas y considerada actualmente como el tratamiento estándar para la acalasia 24,30.
Algunos estudios muestran resultados similares en cuanto a la mejoría de la disfagia, cuando se compara la técnica laparoscópica con la toracoscópica, pero informan una menor incidencia de reflujo después de la primera. La vía toracoscópica tiene, además, la desventaja de ser técnicamente más dispendiosa y requerir un tubo a tórax en el periodo posperatorio, por lo cual los pacientes presentan mayor sensación de malestar y dolor 25.
Mucha de la ‘evidencia’ actual respalda el uso de la miotomía laparoscópica de Heller, pero aún continúa el debate apoyando el uso de la dilatación neumática. En un estudio aleatorizado, multicéntrico y prospectivo (European Acalasia Trial), se comparó la dilatación neumática con la cardiomiotomía laparoscópica de Heller con fundoplicatura de Dor, con un seguimiento de dos años. Se encontró que todos los tipos de acalasia mejoraban de manera similar con estos dos procedimientos, pero hubo mejores resultados a largo plazo para los pacientes con acalasia de tipo III tratados con la cardiomiotomía laparoscópica de Heller 14,26.
Miotomía endoscópica peroral
Uno de los principales pioneros en el desarrollo de esta técnica (Per-Oral Endoscopic Myotomy, POEM) fue Ortega, que publicó su trabajo de miotomía endoscópica submucosa en 1980, la cual no fue aceptada universalmente debido a la preocupación de un alto riesgo de perforación 31. Pasricha publicó un trabajo en el 2007, en el que describió la realización de un túnel submucoso esofágico en cerdos, contribución de gran importancia también 32.
El paradigma del tratamiento quirúrgico para la acalasia cambió cuando Inoue practicó en el año 2008 la primera miotomía endoscópica en un ser humano, y posteriormente, en 2010, publicó la primera serie de 17 pacientes con acalasia tratados mediante miotomía endoscópica peroral, la cual demostró buenos resultados y sin complicaciones graves. Durante el seguimiento (media de 5 meses), se necesitó tratamiento o medicación adicional (inhibidores de la bomba de protones) en un solo paciente, que desarrolló esofagitis por reflujo 33.
Esta técnica ha sido aceptada rápidamente en la mayor parte del mundo y se considera una alternativa segura y efectiva para el tratamiento de la acalasia. Los pacientes son operados bajo anestesia general. Deben tener una dieta líquida clara durante las 48 horas antes del procedimiento y ayuno de 12 horas antes del mismo. Algunos autores recomiendan una profilaxis preoperatoria con fluconazol durante siete días. Se debe suspender la administración de clopidogrel o de ácido acetilsalicílico durante 5 y 7 días, respectivamente, antes del procedimiento 34. El uso de dióxido de carbono (CO2) es obligatorio, para disminuir el riesgo de eventos adversos asociados con la fuga de gas.
La técnica comprende cuatro pasos específicos: mucosotomía, que se debe practicar entre 12 y 14 cm por encima de la unión gastroesofágica; ‘tunelización’ (sic), la cual debe extenderse 2 a 3 cm dentro del cardias gástrico por debajo de la unión gastroesofágica; miotomía, que debe iniciar a 2 cm después de la mucosotomía y terminar en el sitio distal de la ‘tunelización’, y cierre de la mucosotomía, con la técnica tradicional mediante clips 35.
En una revisión sistemática de 2016 que incluyó 1.122 pacientes, los efectos secundarios menores fueron capno-neumoperitoneo (30,6 %), capno-neumotórax (11,0 %) y enfisema subcutáneo (36,1 %), y los mayores fueron fístula del mediastino (0,3 %) y sangrado (1,1 %). Solo hubo un caso de muerte (0,09 %) 36.
El análisis conjunto de tres estudios comparativos entre la cardiomiotomía laparoscópica de Heller y la miotomía endoscópica peroral, mostró resultados similares en cuanto a efectos secundarios, tasa de perforación y tiempo quirúrgico, y una tendencia no significativa estadísticamente hacia una reducción del tiempo de hospitalización en el grupo sometido a miotomía endoscópica peroral. Considerando que este último es un tratamiento seguro y efectivo para la acalasia, que mejora subjetiva y objetivamente los síntomas relacionados con ella, se necesita adelantar futuros estudios comparativos y aleatorizados, para determinar cuál es el tratamiento más efectivo a largo plazo 37,38,39.
Nuevas perspectivas y futuros tratamientos
En la última década, se ha fortalecido la hipótesis de las causas inmunológicas para explicar la fisiopatología de la acalasia. Por esta razón, se ha considerado teóricamente razonable usar medicamentos inmunomoduladores en las primeras etapas de la enfermedad 6. Se conocen tres informes de casos, en los que se administraron corticosteroides (prednisolona, metilprednisolona o beclometasona) solos o en combinación con otros inmunosupresores (metotrexato, azatioprina o ciclofosfamida), y se logró la recuperación completa de la peristalsis, corroborada por manometría de alta resolución 2. Sin embargo, hasta el momento, no existe ‘evidencia’ definitiva que apoye el uso de esta terapia y son indispensables los estudios futuros.
En algunos estudios recientes, se ha demostrado que las células madre con potencial neurogénico pueden ser implantadas, sobrevivir y migrar con éxito dentro del intestino agangliónico. Existe información preliminar de la recuperación funcional en enfermedades gastrointestinales de tipo agangliónico, mediante el tratamiento con células madre, incluida la acalasia 6,40. Este hallazgo abre una ventana a futuras investigaciones, que determinen la predisposición genética o la detección temprana de la acalasia 41,42,43.
En aquellos pacientes con acalasia de reciente aparición, se han usado tratamientos antivirales que, se cree, logran eliminar el elemento antigénico y, por lo tanto, controlar la reacción inmunológica 2,44.
Conclusión
La acalasia es todavía una enfermedad idiopática, en la que se han estudiado diversas causas, incluso, las genéticas, las inmunológicas y las virales. Aunque todavía existe un importante desconocimiento de su fisiopatología, se sabe que se debe a una pérdida de la peristalsis esofágica y a una relajación inadecuada del esfínter esofágico inferior.
El diagnóstico se sospecha por los síntomas del paciente, entre los cuales la disfagia es el más importante, y se confirma mediante endoscopia de las vías digestivas altas, esofagograma y manometría de alta resolución.
El tratamiento sigue siendo paliativo y puede estar orientado según el subtipo de acalasia, de acuerdo con la clasificación de Chicago. Los mejores resultados se obtienen mediante la dilatación neumática, la cardiomiotomía laparoscópica de Heller y, más recientemente, la miotomía endoscópica peroral. No obstante, aún faltan estudios prospectivos aleatorizados con seguimiento a largo plazo que determinen cuál es la mejor técnica.