Introducción
El mesotelioma es una neoplasia que se origina en las células mesoteliales de la pleura y el peritoneo 1,2, aunque también se han descrito casos de mesotelioma pericárdico 3. Se divide en tres tipos histológicos: mesotelioma maligno, mesotelioma quístico y mesotelioma papilar bien diferenciado 2, y representa del 15 al 25 % de todos los mesoteliomas 4,5, excepto en una serie de casos de China, en la cual esta neoplasia correspondió al 68 % 6.
Históricamente, la supervivencia de los pacientes con mesotelioma peritoneal maligno sin tratamiento es menor de 12 meses y se considera una neoplasia resistente a la quimioterapia. La citorreducción quirúrgica más quimioterapia regional, la hipertérmica intraperitoneal (Hyperthermic Intraperitoneal Chemotherapy, HIPEC) o la intraperitoneal posquirúrgica temprana (Early Post-operative Intraperitoneal Chemotherapy, EPIC), se asocia con mejor supervivencia a largo plazo 4,7.
Se presenta un caso de mesotelioma peritoneal maligno tratado con cirugía citorreductora más quimioterapia hipertérmica intraperitoneal en el Instituto Nacional de Cancerología con una supervivencia de un año libre de enfermedad.
Descripción del caso
Se trata de un hombre de 61 años de edad, albañil de profesión, con antecedentes ocupacionales de exposición al asbesto durante 20 años, que fue operado de apendicitis aguda en una clínica de Bogotá. Durante la cirugía, se encontró una tumoración en la capa serosa del apéndice, cuyo reporte de histopatología informó una proliferación mesotelial atípica sugestiva de mesotelioma.
El paciente no tenía antecedentes patológicos ni quirúrgicos relevantes y, en la revisión por sistemas, refirió dolor abdominal difuso de siete meses de evolución.
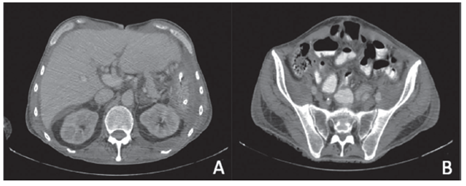
En la primera consulta en el Instituto Nacional de Cancerología, el paciente se encontraba en regulares condiciones generales, con desnutrición leve y aumento del perímetro abdominal por ascitis. En la tomografía computarizada (TC) de abdomen con contraste que le había sido tomada, se apreciaba ascitis, alteración de la densidad de la grasa mesentérica y realce difuso del peritoneo.
En la revisión de las láminas de histología en el Instituto se pudo demostrar expresión de las citoqueratinas (CK) CK5/6 y CK7, el factor de transcripción WT1 y la proteína calretinina, con un marcador de proliferación Ki-67 del 10 %, además, la CK20 y el antígeno carcinoembrionario fueron negativos. Esto confirmaba el diagnóstico de mesotelioma peritoneal maligno de tipo epitelioide (figura 1).
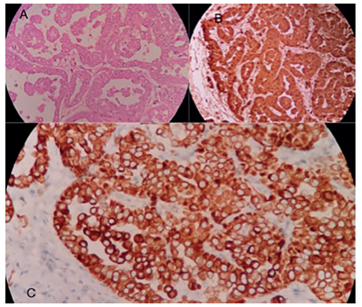
Figura 1. A. Compromiso por células mesoteliales atípicas en grupos que forman trabéculas e infiltran la grasa con un patrón irregular. Hematoxilina y eosina, 10X. B. Las células tumorales son positivas para calretitina. Inmunohistoquímica, 10X. C. También, son positivas para las citoqueratinas 5 y 6, la citoqueratina 7, el factor WT1 y el marcador endotelial linfático D2-40?. Inmunohistoquímica, 10X.
Con los estudios de extensión, se descartó enfermedad extraperitoneal y se calculó un índice de carcinomatosis peritoneal (Peritoneal Cancer Index, PCI) de 15 mediante la TC (figura 2) y de 21 por laparoscopia.
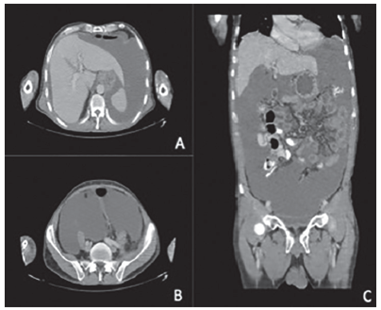
Figura 2. Tomografía computarizada prequirúrgica de abdomen y pelvis: A) corte axial del hemiabdomen superior; B) corte axial del hemiabdomen inferior, y C) corte coronal. En todos los cortes se aprecia gran cantidad de líquido ascítico y engrosamiento peritoneal.
El caso se presentó en la junta institucional de malignidad peritoneal, en la cual se avaló la conducta de practicar una cirugía citorreductora más quimioterapia hipertérmica intraperitoneal.
El abordaje quirúrgico se hizo a través de una incisión xifopúbica con disección extraperitoneal, para facilitar la peritonectomía parietal de los cuatro cuadrantes, incluyendo las cicatrices quirúrgicas previas y el muñón umbilical (figura 3).
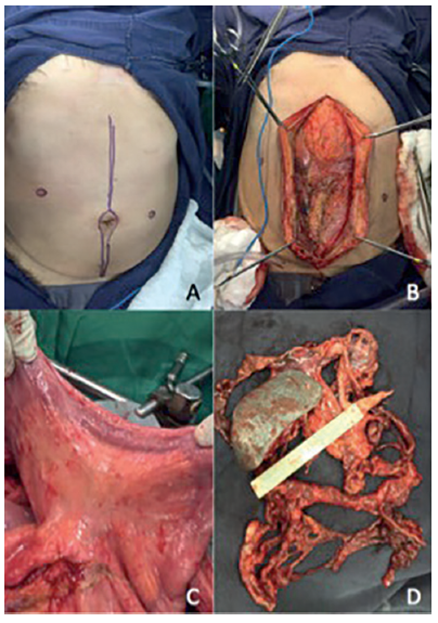
Figura 3. Aspectos técnicos del procedimiento quirúrgico. A) Planeación de la incisión en la línea media con resección de las cicatrices previas. B) Infiltración generalizada de la cavidad por mesotelioma peritoneal. C) Compromiso del mesenterio del intestino delgado. D) Pieza quirúrgica tras la resección del bazo y del peritoneo parietal de los cuatro cuadrantes del abdomen incluyendo cúpulas diafragmáticas y pelvis.
Se drenaron tres litros de líquido ascítico, y se practicaron los siguientes procedimientos: peritonectomía de ambas cúpulas diafragmáticas; escisión de múltiples implantes de la cápsula hepática en los segmentos VII y VIII; esplenectomía; omentectomía radical; resección radical del peritoneo pélvico, y resección anterior del recto, con un puntaje de citorreducción de 0 (CC-0: sin enfermedad macroscópica residual). Se calculó un índice de carcinomatosis peritoneal de 27 y, con técnica cerrada, se practicó la quimioterapia hipertérmica intraperitoneal con 50 mg/m2 de cisplatino y 15 mg/m2 de doxorrubicina a 42 0C durante 60 minutos.
El paciente requirió empaquetamiento abdominal por sangrado hepático y no se hizo la anastomosis colorrectal por la condición del paciente en el transoperatorio. El tiempo quirúrgico fue de 13 horas. Se practicaron una colostomía de tipo Hartman y tres lavados peritoneales terapéuticos, los días siguientes a la cirugía.
El paciente requirió manejo en la unidad de cuidados intensivos durante 20 días y se le dio egreso 30 días después de la cirugía. La histopatología quirúrgica confirmó el compromiso de todos los órganos resecados por mesotelioma peritoneal maligno y, al completar el primer año de seguimiento clínico, los estudios de imágenes no habían evidenciado recaída de la enfermedad (figura 4).
Discusión
La incidencia global anual del mesotelioma peritoneal maligno oscila entre 0,7 y 1,2 casos por cada millón de habitantes 1,7. En múltiples estudios se han proyectado los picos de su incidencia: en Australia, será entre 2015 y 2025, en Italia, entre 2011 y 2015, y en Gran Bretaña, entre 2012 y 2024 8,9. La edad del diagnóstico oscila entre los 40 y los 67 años 1,4 y la relación de la incidencia entre hombres y mujeres es cercana a uno 10,11, aunque en algunas series hay predominio del sexo masculino 1,7 y, en otras, predomina el sexo femenino 6.
Los factores de riesgo son la exposición al asbesto y a la radiación ionizante, con un riesgo del 10 % durante la vida de desarrollar mesotelioma y un periodo de latencia de 30 a 40 años para el caso de la exposición al asbesto. Las tasas de exposición al asbesto varían entre 33 y 90 % en los pacientes con mesotelioma peritoneal maligno 5,7,12,13,14,15, y se cree que las células mesoteliales y los macrófagos expuestos al asbesto generan radicales libres de oxígeno y de nitrógeno que alteran la estructura del ADN y, además, liberan citocinas y factores de crecimiento que inducen inflamación y transformación maligna 10,16.
En un estudio se contaron las fibras de asbesto por gramo de tejido peritoneal y se encontró que solo el 55 % de los mesoteliomas peritoneales malignos tenía un número de fibras por encima del rango normal (0 a 20), en comparación con el 83 % de los mesoteliomas pleurales malignos; no obstante, en promedio, el número de fibras de asbesto por gramo de tejido fue mayor en los pacientes con compromiso peritoneal (127.000 Vs. 15.900) 5.
Algunos pacientes tiene supervivencias prolongadas y otros presentan una rápida progresión de la enfermedad, lo cual se ha atribuido a la heterogeneidad de la biología tumoral 4. Los mesoteliomas se diagnostican de forma tardía por los síntomas inespecíficos, entre los que se encuentran dolor abdominal vago, aumento del perímetro abdominal por la ascitis, pérdida de peso, fiebre, diarrea y vómito 14,15.
La TC abdominal con contraste es el estudio imagenológico de elección para los pacientes con mesotelioma peritoneal maligno, y sus principales signos son: ascitis (69 %), engrosamiento peritoneal (59 %), masa abdominal (37 %) y engrosamiento mesentérico (27 %). Algunos son factores pronósticos negativos, como el acortamiento mesentérico y la enfermedad periportal. La resonancia magnética puede tener ventajas en la evaluación de los pacientes con ascitis y la tomografía por emisión de positrones (PET-CT), aunque no está indicada de rutina, evalúa con mayor precisión el compromiso ganglionar y es útil en el seguimiento de los pacientes 7,17.
El diagnóstico se basa en la confirmación histológica del mesotelioma peritoneal maligno, y se puede obtener mediante una biopsia guiada con tomografía o por laparoscopia. Los subtipos histológicos de esta neoplasia son: epitelioide (75 a 90 %), sarcomatoide y bifásico 18. La inmunohistoquímica es esencial para el diagnóstico definitivo y, aunque no existe un marcador único específico de mesotelioma, se deben tener, al menos, dos marcadores positivos entre citoqueratinas 5 y 6, calretinina, WT-1, HBME-1 y vimentina; además, debe ser negativa para antígeno carcinoembrionario, Ber-Ep4, LeuM1 y Bg8 4,7.
Los marcadores tumorales como CA-125, CA 19-9, CA 15.3, fibulina 3 y mesotelina, se pueden valorar para favorecer el diagnóstico o para hacer el seguimiento de los pacientes. La fibulina y la mesotelina son muy específicos para la enfermedad, pero su utilidad clínica es aún desconocida 17.
En estudios pequeños, se ha encontrado asociación con mutaciones somáticas y germinales del gen supresor tumoral BPA1 en 61 a 85 % de los pacientes con mesotelioma peritoneal maligno 19. En 5 a 15 % de los casos, se encuentran mutaciones en los genes DDX3X y SETD2, en el 21 %, en el gen NF2 y, en el 33 %, en el gen CDKN2A. Estos hallazgos sugieren que la alteración de la transcripción es un mecanismo clave en la tumorogénesis mesotelial. Además, mediante la inmunofluorescencia (Fluorescent in situ Hybridization, FISH) y la inmunohistoquímica, se puede diferenciar el mesotelioma peritoneal maligno de su forma benigna y del compromiso secundario por otros tumores 19.
Usualmente, el mesotelioma peritoneal maligno queda confinado al peritoneo; el compromiso ganglionar (5 a 10 %) y el compromiso extraperitoneal (3 a 5 %) son raros 20 y, en algunos casos, se ha descrito infiltración del hígado, del colon, del pulmón y del hueso 7.
El índice de carcinomatosis peritoneal tiene valor pronóstico y es útil para la valoración prequirúrgica del tumor en el abdomen, con un puntaje de 0 a 39 según la extensión de la enfermedad 4. Este índice (PCI) se ha utilizado como un sustiuto del sistema de estadificación TNM; el tumor primario se clasifica como T1, con un PCI entre 1 y 10; como T2, con un PCI entre 11 y 20; como T3, con un PCI entre 21 y 30, y como T4, con un PCI mayor de 30; la N y la M codifican la presencia o la ausencia de metástasis ganglionares o peritoneales, respectivamente.
Con base en este sistema, la supervivencia a cinco años es de 87 % en caso de tumores en el estadio I (T1N0M0); de 53 %, en el estadio II (T2N0M0 o T3N0M0), y de 29 %, en el estadio III, ya sean T4, N1 o M14.
Actualmente, la radioterapia no tiene un papel definido en el tratamiento del mesotelioma peritoneal maligno. Se considera un tumor resistente a la quimioterapia, la cual permite una tasa de mejoría del 25 % 7; no obstante, cuando esta se usa como adyuvante, se ha asociado con un aumento de la supervivencia global y de la supervivencia libre de enfermedad 21.
El tratamiento sistémico de elección es pemetrexed más cisplatino, el cual se utiliza como tratamiento primario en los pacientes con mesotelioma peritoneal maligno irresecable o con un tumor cuya histología sea sarcomatoide o bifásica, los cuales no se benefician del tratamiento quirúrgico 22,23.
Actualmente, no existen terapias moleculares para el mesotelioma peritoneal maligno y las investigaciones en este sentido se han orientado hacia la enfermedad pleural 10.
La citorreducción quirúrgica más quimioterapia intraperitoneal perioperatoria, ya sea hipertérmica intraperitoneal o intraperitoneal posquirúrgica temprana, es el tratamiento de primera línea en los pacientes con mesotelioma peritoneal maligno de tipo epitelioide 17, y aumenta la supervivencia desde 6 meses, en pacientes que no reciben ningún tratamiento, hasta 34 a 92 meses, en pacientes sometidos a cirugía 4,7,11,15,17. Los objetivos de este tratamiento combinado son la resección completa de la enfermedad macroscópica y la administración de quimioterapia intraperitoneal hipertérmica a altas dosis para tratar la enfermedad micrometastásica.
En un metanálisis de 20 publicaciones con 1.047 pacientes con mesotelioma peritoneal maligno sometidos a citorreducción más quimioterapia intraperitoneal perioperatoria, reportaron una supervivencia a cinco años de 42 % y una mortalidad perioperatoria entre 0 y 5 %. El porcentaje de pacientes que obtuvieron citorreducción completa (CC-0) o casi completa (CC-1: ganglios residuales <2,5 mm), estuvo entre 46 y 93 % 12.
En el estudio multicéntrico retrospectivo más grande de Estados Unidos y Europa, que incluyó 29 centros y 401 pacientes, el promedio de la supervivencia fue de 53 meses, el 47 % de los pacientes estaban vivos a los cinco años, y los factores pronósticos favorables fueron el tipo histológico epiteloide, la ausencia de compromiso ganglionar, la citorreducción completa o casi completa (CCR-0 o CCR-1) y la quimioterapia hipertérmica intraperitoneal 24.
En otro estudio multicéntrico los resultados fueron similares: supervivencia media de 38 meses y 41 % de los pacientes vivos a los cinco años; además, identificaron como factores de mejor pronóstico el uso de cisplatino en la quimioterapia hipertérmica intraperitoneal y la edad menor de 60 años 25.
En un estudio sobre citorreducción quirúrgica seguida de quimioterapia intraperitoneal hipertérmica, se compararon los resultados de la peritonectomía parietal selectiva con los de la completa; la supervivencia a cinco años fue de 64 % con peritonectomía parietal completa y, de 40 %, con la selectiva, sin diferencias en la morbimortalidad 26. No obstante, faltan más estudios para establecer qué tipo de peritonectomía ofrece los mejores resultados.
Después de la citorreducción y antes de la reconstrucción intestinal, se debe preparar el abdomen y la pelvis para la quimioterapia hipertérmica intraperitoneal. Para dicha quimioterapia, se usa un agente basado en el platino, como el cisplatino, si la función renal es adecuada; aunque se han utilizado combinaciones de cisplatino o carboplatino con doxorrubicina, mitomicina, pemetrexed o ifosfamida, no existen estudios prospectivos al respecto y se debe usar el esquema con el que los cirujanos estén familiarizados 11,17.
En un estudio publicado en el 2017, se incluyeron pacientes tratados con citorreducción quirúrgica y se dividieron en tres grupos: uno solo con quimioterapia hipertérmica intraperitoneal, otro con quimiotrapia intraperitoneal posquirúrgica temprana, y otro con quimioterapia hipertérmica intraperitoneal más quimioterapia normotérmica intraperitoneal (Normothermic Intraperitoneal Chemotherapy, NIPEC) adyuvante a largo plazo durante seis meses; se encontró que la supervivencia a cinco años en el primer grupo fue de 44 %, en el segundo grupo, de 52 %, y en el tercer grupo, de 75 % 27. Este estudio sugiere que estos pacientes podrían beneficiarse de un tratamiento a largo plazo con quimioterapia normotérmica intraperitoneal como tratamiento adyuvante.
En aquellos pacientes con mesotelioma peritoneal maligno recurrente, también se puede considerar la citorreducción quirúrgica más quimioterapia hipertérmica intraperitoneal, con una supervivencia entre 21,8 y 80 meses después de la segunda citorreducción y una morbimortalidad similar a la de la primera 7,11,28,29.
Algunos estudios sugieren que la duración de la exposición al asbesto mayor de 20 años 14, un Ki-67 mayor o igual a 25 % 30, trombocitosis prequirúrgica 31,32, albúmina menor de 3,5 g/dl y la relación entre neutrófilos y linfocitos mayor o igual a 3 13, se asocian con un peor pronóstico, aun después de una adecuada citorreducción quirúrgica más quimioterapia hipertérmica intraperitoneal.
La citorreducción completa (CC-0) y la casi completa (CC-1), se asocian con mejor supervivencia libre de enfermedad, en comparación con la CC-2 (ganglios residuales entre 2,5 mm y 2,5 cm) o la CC-3 (ganglios residuales >2,5 cm) 27,33.
En Colombia, se reportaron los primeros casos de cirugía citorreductora más quimioterapia hipertérmica intraperitoneal para el tratamiento del pseudomixoma peritoneal, en el 2009 34. En el 2012, se reportó una serie de 24 pacientes con diversas enfermedades, pero ninguno con mesotelioma peritoneal maligno 35. En el 2017, se reportaron dos pacientes con pseudomixoma peritoneal tratados con una segunda citorreducción 36. En el presente trabajo, reportamos el primer caso de mesotelioma peritoneal maligno tratado con este tipo de tratamiento en Colombia.
Conclusiones
La supervivencia global y la supervivencia libre de enfermedad de los pacientes con mesotelioma peritoneal maligno, mejoraron con la cirugía; en todo el mundo, la mayoría de los pacientes con esta enfermedad solo reciben tratamiento paliativo o quimioterapia sistémica. Solo dos de cada tres pacientes en Estados Unidos, reciben el tratamiento apropiado 11 y, aunque en Colombia no tenemos estas cifras, se sabe que el panorama es aún más desalentador. Se necesitan más esfuerzos para garantizarle a estos pacientes el acceso a un tratamiento apropiado.
Se presenta el primer paciente con diagnóstico de mesotelioma peritoneal maligno tratado con cirugía citorreductora más quimioterapia hipertérmica intraperitoneal en Colombia, quien ha presentado una buena evolución y no tiene signos de recaída después de 12 meses.