Introducción
Las infecciones intraabdominales generalmente son secundarias a la perforación o a la inflamación de la pared intestinal, a partir de la flora gastrointestinal habitual. Clínicamente, las infecciones intraabdominales se dividen en no complicadas -el proceso infeccioso se limita al órgano o tejido de origen- y complicadas, cuando la infección se extiende y afecta el peritoneo y produce peritonitis generalizada o procesos localizados como abscesos, con cuadros clínicos que pueden ir desde fiebre, anorexia y dolor, a sepsis y falla orgánica múltiple, choque séptico y muerte. Por tanto, la elección adecuada del tratamiento antimicrobiano se convierte en uno de los puntos primordiales del abordaje de las infecciones intraabdominales 1,2,3. Las enfermedades primarias que conducen a peritonitis varían según la región geográfica y la edad del paciente.
En los Estados Unidos e Israel, la apendicitis aguda es responsable de 82 % y 92 % de los casos, respectivamente 4,5, mientras que, en África, es más frecuente la perforación intestinal secundaria a fiebre tifoidea, ascaridiasis, trauma o invaginación y, luego, la apendicitis aguda, siendo de suma importancia en esta región la enterocolitis necrosante 6. La mortalidad atribuible a la peritonitis en los países desarrollados es del 0,06 % 7; en África, varía entre el 0,9 y el 2 %, lo que refleja, básicamente, las diferencias en el acceso a los servicios quirúrgicos y a las unidades de cuidado crítico 8.
Las infecciones intraabdominales raramente son el resultado de un solo agente microbiano, y no es fácil el aislamiento de todos los microorganismos involucrados con los métodos rutinarios de laboratorio. Aunque pueden predecirse los microorganismos causantes de las infecciones intraabdominales adquiridas en la comunidad con base en la microbiota, su tasa de resistencia difiere según la zona geográfica, las comorbilidades y la exposición previa a antimicrobianos 9,10,11.
Desde el punto de vista clínico y terapéutico, vale la pena destacar exclusivamente dos condiciones de la enfermedad apendicular: la apendicitis no perforada y la perforada; esta última se caracteriza por el hallazgo de perforación en la exploración quirúrgica o en el reporte de histopatología 9. La apendicitis perforada -cirugía contaminada- requiere tratamiento adicional con antibióticos hasta la resolución del cuadro clínico, lo que se asocia con mayor estancia hospitalaria, a diferencia de las apendicitis no complicadas o no perforadas, en las cuales solo se usan los antimicrobianos como profilaxis y, por ende, se suspenden luego del procedimiento quirúrgico 12,13.
La mayoría de los reportes en la literatura mencionan que la flora encontrada en los aislamientos de líquido abdominal es mixta. Se destacan microorganismos como: Escherichia coli, Streptococcus milleri, Pseudomonas aeruginosa y Enterococcus spp.; entre los anaerobios, Bacteroides fragilis es el más frecuentemente aislado. Sin embargo, ni los microorganismos ni su resistencia a los antibióticos se consideran para indicar el manejo profiláctico o terapéutico de las infecciones intraabdominales, por el desconocimiento de la prevalencia y de la resistencia de los microorganismos a nivel local 14.
Varios autores han reportado tasas de resistencia a la amoxicilina-clavulanato mayores de 40 % en los aislamientos de líquido peritoneal, factor que, sumado a la falta de cobertura para microorganismos como P. aeruginosa, tercer bacteria en frecuencia, hace necesario replantear la utilidad de los esquemas empíricos profilácticos y de los esquemas terapéuticos utilizados en la apendicitis aguda y rescata la importancia de hacer los cultivos de líquido peritoneal, los cuales han sido abandonados en favor de abordajes rutinarios en estas circunstancias 15,16.
Se ha descrito que, al menos, el 35,3 % de los niños sometidos a apendicectomía tienen cultivos positivos y, aunque muchos estudios reportan preferencias por el tratamiento profiláctico empírico de amplio espectro sobre el basado en la toma de cultivos del líquido peritoneal, esta decisión ignora las ventajas de los esquemas reducidos y ajustados, con menor impacto en la microbiota y en el riesgo de diarrea asociada a Clostridium difficile como infección emergente en los pacientes pediátricos 17,18,19,20.
Entre los factores más asociados a las infecciones del sitio operatorio, está la duración de los síntomas preoperatorios (≥6 horas), la perforación visceral, la técnica quirúrgica empleada y la elección del esquema antibiótico 21,22,23. La introducción de nuevos antibióticos, el incremento de las tasas locales de resistencia a los antimicrobianos, la frecuencia de uso de los esquemas profilácticos y terapéuticos basados en la monoterapia o los tratamientos combinados para las infecciones intraabdominales en la población pediátrica, requieren el conocimiento de la epidemiología local con el fin de optimizar el uso de la terapia antimicrobiana 24,25.
Son escasos en la literatura médica los datos locales sobre sensibilidad y resistencia a los antibióticos en la población pediátrica sometida a procedimientos quirúrgicos, en comparación con los reportados en la población adulta 26,27. Los estudios de prevalencia en portadores nasofaríngeos reportan Staphylococcus aureus como el principal microorganismo aislado en el personal de salud de los hospitales pediátricos (43,1 % en el personal de enfermería y 23,5 % en los médicos) con resistencia a los betalactámicos 28. En el 2012, los hospitales pediátricos chilenos reportaron diferentes patrones de sensibilidad in vitro de E. coli en hemocultivos, relacionados con antibióticos de uso frecuente como la ampicilina (31,9 %), la gentamicina (89,9 %), la cefalotina (48,3 %) y la cefotaxima (88,6 %). La menor sensibilidad in vitro para Klebsiella pneumoniae se presentó con la cefotaxima (62,6 %), para P. aeruginosa, con el imipenem (72,9 %), y para Acinetobacter baumannii, con ampicilina-sulbactam (67,6 %) 29.
El propósito del estudio fue analizar la frecuencia y la sensibilidad microbiológica de los cultivos practicados a las muestras de la cavidad abdominal tomadas por sospecha de infecciones intraabdominales, en niños que requirieron manejo quirúrgico en la Clínica Universitaria Colombia y Clínica Reina Sofía de Bogotá, Colombia.
Materiales y métodos
Se llevó a cabo un estudio prospectivo de cohorte con muestreo consecutivo 30. Se recolectó la información demográfica, los datos clínicos y los reportes de laboratorio de las historias clínicas y de las notas quirúrgicas de los niños entre un mes y 16 años de edad sometidos a cirugía con sospecha diagnóstica de abdomen agudo y con hallazgos operatorios de infección en la cavidad abdominal.
Los cirujanos pediatras tomaron muestras del líquido peritoneal para hacer los cultivos y antibiograma. La recolección de la información se hizo durante 12 meses de forma sistemática, de septiembre de 2015 a septiembre de 2016.
Toma del cultivo
En los niños con evidencia de infección en la cavidad abdominal durante la exploración quirúrgica, se tomó por aspiración una muestra del líquido durante el acto quirúrgico y se envió en jeringa estéril con capuchón sin retirar la aguja, idealmente, previa inoculación de la muestra en la botella de hemocultivos para anaerobios. Se inoculó la muestra en cantidad de 5 a 10 ml (volumen mínimo de 5 ml) en esta botella de hemocultivo (relación 1:10 ml). En el Laboratorio de Microbiología, se inoculó la muestra de líquido peritoneal en agar sangre al 5 %, MacConkey y caldo de enriquecimiento de tioglicolato, y se incubó por 48 horas en atmósfera aerobia, con lectura diaria de las cajas de agar. Se identificaron todos los microorganismos y su sensibilidad, mediante el método automatizado de Vitek 2C™ (BioMerieux).
Análisis estadístico
Se trabajó con el universo de los datos y las unidades de observación se recolectaron de forma consecutiva, previa validación y cumplimiento de los criterios de inclusión.
Se estimaron las medidas de frecuencia y de tendencia central para las variables continuas, y se evaluó la función de distribución de normalidad de las variables de interés mediante los gráficos P-P y Q-Q, y la prueba de Shapiro-Wilk. Las variables categóricas se analizaron mediante las pruebas no paramétricas de ji al cuadrado y exacta de Fisher. La comparación de las medias para muestras independientes se llevó a cabo con la prueba de la suma de rangos de Wilcoxon. Los valores de p para el contraste de hipótesis se consideraron estadísticamente significativos cuando p era mayor de 0,05. Los datos se analizaron con el software licenciado Stata™, versión15.0.
Resultados
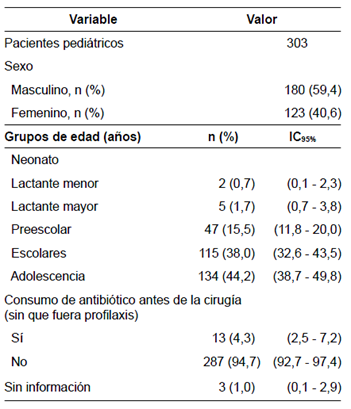
Se analizó la información de 303 pacientes pediátricos con sospecha de abdomen agudo durante el periodo de estudio, es decir, de septiembre de 2015 a septiembre de 2016, de los cuales 298 (98,3 %) presentaron hallazgos sugestivos de infección intraabdominal.
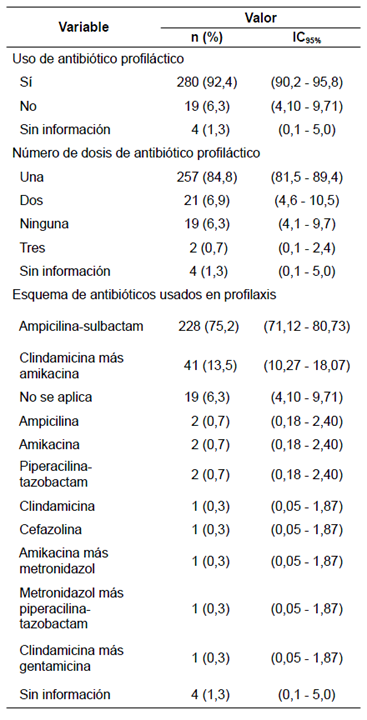
La mayoría (59 %) de los pacientes eran del sexo masculino y los grupos más representados (82 %) fueron los escolares y los adolescentes. El 94 % no manifestaron antecedentes de consumo de antibióticos antes de la cirugía (≤48 horas), mientras que el 4,3 % restante tenía antecedentes de alguna enfermedad respiratoria que justificaba el manejo antibiótico previo (amigdalitis e infección respiratoria aguda, entre otras) (tabla 1). El 93 % recibió profilaxis con antibióticos antes del procedimiento quirúrgico y en el 6 % no fue formulada desde urgencias por tratarse de una urgencia vital. El esquema antibiótico más utilizado (75 %) fue ampicilina-sulbactam, seguido de clindamicina-amikacina y, en menos casos, se utilizaron otros tratamientos combinados, como metronidazol-amikacina, u otros poco convencionales como, por ejemplo, monoterapias (amikacina o ampicilina o clindamicina o cefazolina) o asociaciones como metronidazol-piperacilina-tazobactam (tabla 2).
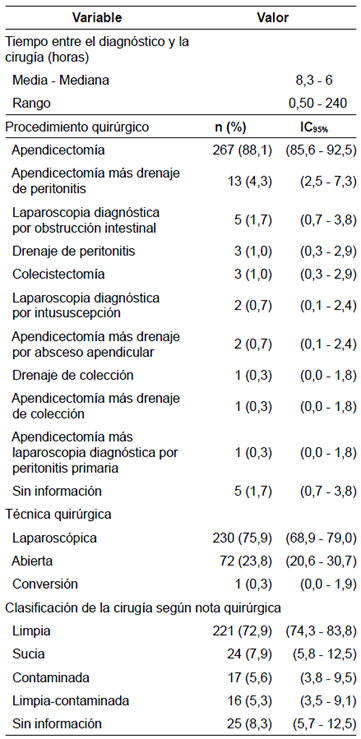
El tiempo medio entre el diagnóstico clínico y el inicio de la cirugía fue de seis horas; sin embargo, fue de 240 horas en un paciente con abdomen agudo secundario a un absceso intraabdominal manejado inicialmente con antibióticos parenterales y drenaje guiado por radiología intervencionista, pero que requirió cirugía abierta por el deterioro clínico.
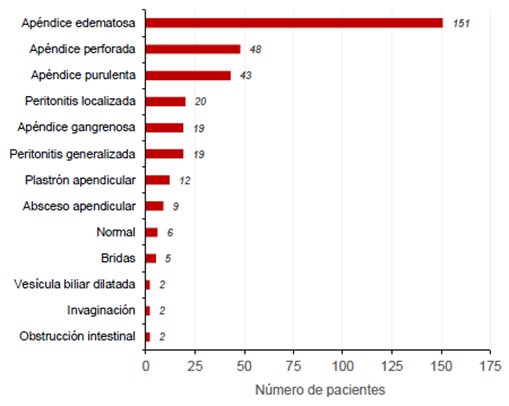
De los pacientes con diagnóstico de abdomen agudo, el 95,3 % correspondió a apendicectomía y, los procedimientos restantes, a drenaje de colecciones, laparoscopia diagnóstica por obstrucción intestinal, intususcepción y colecistectomía, entre otros. La técnica más utilizada (75 %) fue la laparoscópica y solo un caso requirió conversión de la técnica a laparotomía 31. El 72 % de los cirujanos clasificó los procedimientos como cirugía limpia (tabla 3). Entre las descripciones quirúrgicas, se evidenció gran variabilidad en el reporte de los hallazgos del procedimiento descrito por los médicos tratantes (figura 1).
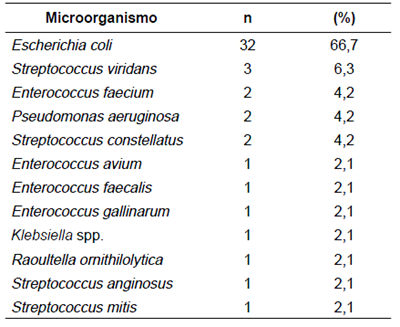
De 285 pacientes con apendicectomía, el 83 % correspondió a apéndices no perforadas, de las cuales únicamente se tomaron seis cultivos que representaban el 2,5 % de las no perforadas con seis aislamientos de E. coli. De 48 pacientes con diagnóstico de apendicitis perforada, se tomaron 24 (50 %) cultivos, todos positivos, de los cuales 12 fueron tomados de pacientes con apendicitis clasificadas como gangrenosas; un cultivo correspondió a un apéndice que no se había clasificado como tal en la historia clínica y otros dos cultivos procedieron de pacientes sometidos a laparotomía por obstrucción intestinal, con un total de 33 (10,9 %) tomas de cultivo de pacientes operados por sospecha de infección intraabdominal . Los cultivos analizados revelaron que el microorganismo aislado más frecuentemente fue E. coli (66%); sin embargo, es importante destacar que el 54 % de los aislamientos fueron polimicrobianos, con predominio (75 %) de los microorganismos Gram negativos (tabla 4). En el 2,7 % de los microorganismos Gram negativos, se identificaron mecanismos de producción de betalactamasas de espectro extendido (positivos para BLEE).
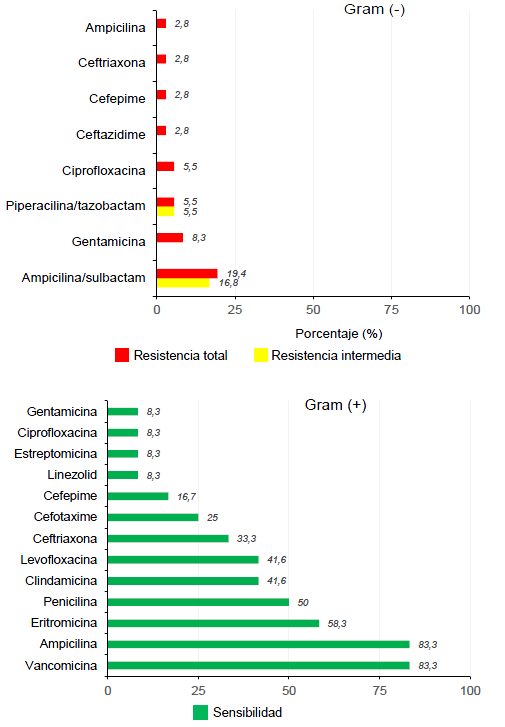
Por otra parte, en el Laboratorio de Microbiología, se procesaron los cultivos para la búsqueda de anaerobios en las muestras de 14 pacientes con apendicitis perforada y se logró identificar microorganismos como Clostridium spp. y Prevotella spp. En los antibiogramas, todos (100 %) los gérmenes Gram negativos resultaron ser sensibles a la amikacina, el 97,2 %, al meropenem, y el 94,4 %, a la ciprofloxacina, el cefepime y el ceftazidime (figura 2). Los mayores porcentajes de resistencia para en los Gram negativos -incluidos E. coli, Klebsiella spp. y Pseudomonas spp.- se registraron con ampicilina-sulbactam (37 %), seguido por la gentamicina (8,33 %). En el caso de antibióticos con cobertura para los microorganismos Gram positivos, los mayores porcentajes (83 %) de sensibilidad reportados correspondieron a la vancomicina y la ampicilina, y el 58 %, a la eritromicina (figura 3).
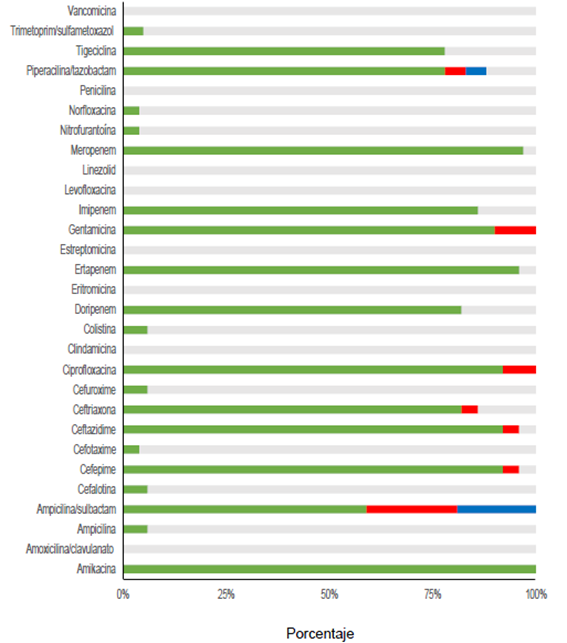
Figura 2. Perfil de sensibilidad y resistencia en cultivos realizados en niños con infección intraabdominal.
Discusión
Esta investigación corresponde al primer trabajo conjunto entre cirujanos e infectólogos pediatras interesados en caracterizar la flora bacteriana y el perfil de sensibilidad a los antibióticos en los pacientes pediátricos sometidos a cirugía por abdomen agudo y sospecha de infección intraabdominal 32. La apendicitis aguda fue causa del 90 % de las infecciones intraabdominales en la edad pediátrica, y el germen más prevalente (66 %) fue E. coli, seguido en menor grado por otros aerobios Gram positivos y P. aeruginosa; esto es similar a lo reportado en otros estudios en los cuales también reportan a E. coli como el principal agente patógeno, seguido de Klebsiella spp., Acinetobacter spp. y P. aeruginosa9,33,34.
Dado el papel primordial en nuestro medio de E. coli en la apendicitis perforada y como causa principal de peritonitis secundaria, el perfil de resistencia de este agente patógeno juega un papel fundamental, tanto en el tratamiento antimicrobiano profiláctico, como en la terapéutica seleccionada. Los datos demostraron resistencia intermedia en 16 % y, total, en 19 % de los cultivos de E. coli ante la ampicilina-sulbactam, lo cual convierte este esquema antibiótico en una opción poco adecuada para la profilaxis y para el manejo terapéutico en presencia de infecciones intraabdominales, dado que puede incrementar el riesgo de infección posoperatoria 35,36,37. A pesar del aumento de la prevalencia de gérmenes Gram negativos positivos para BLEE reportada a nivel mundial, en el presente estudio, la proporción de gérmenes positivos para BLEE fue baja (2,7 %), cifras que se pueden explicar por la implementación del programa racional de optimización de los antibióticos que orienta el uso empírico y la duración de los esquemas antimicrobianos de menor espectro, guardando opciones como el carbapenem o la piperacilina-tazobactam solo para infecciones intraabdominales complicadas 38.
A pesar del bajo porcentaje de muestras procesadas para anaerobios, los resultados refuerzan la conducta de la cobertura empírica que ahorra un recurso económico al no procesar estas muestras en condiciones anaerobias, ya sea por su pobre resultado o por la dificultad de que las muestras sean enviadas en condiciones óptimas de anaerobiosis desde las salas de cirugía 33. Por otra parte, la clasificación de la apendicitis aguda como perforada o no perforada con base en los hallazgos quirúrgicos, debería ser uno de los objetivos próximos por considerar, tanto por los cirujanos pediatras como por los patólogos, reevaluando la clasificación actual de apéndice edematosa, gangrenosa o purulenta, ya que esta es la base con la cual se toman decisiones de manejo antimicrobiano, pronóstico y seguimiento del paciente 39.
Dentro de la unificación de conceptos por parte del equipo quirúrgico, es de suma importancia establecer la adecuada clasificación de la herida y la intervención practicada a cada paciente, resaltando que tanto el manejo antibiótico como la asociación con la infección del sitio operatorio difieren según la situación clínica y el hallazgo o la ausencia de perforación apendicular 40,41,42.
En muchas de las instituciones de salud del país, la elección del antibiótico para la infección intraabdominal depende de la decisión del cirujano o de la disponibilidad de los antimicrobianos; sin embargo, la recomendación de profilaxis o terapéutica debe ser guiada por datos objetivos, tanto de resistencia como de epidemiología local, lo cual favorecerá resultados más costo-efectivos para el paciente y para la institución.
La participación de los cirujanos pediatras en un programa racional de optimización de uso de los antibióticos, mejora la atención de los niños que consultan a los servicios de urgencias con una afección quirúrgica abdominal aguda 43,44. Los cultivos rutinarios resultan ser de gran valor en la detección de los cambios epidemiológicos y de los patrones de resistencia a los antimicrobianos asociados con la peritonitis, lo que permite el ajuste subsecuente del tratamiento, según los patrones de sensibilidad y la evolución clínica.
Los esquemas antimicrobianos varían en cada institución, pero, en general, deben tener cobertura adecuada frente a enterobacterias y Bacteroides spp., y ser iniciado lo más pronto posible después del diagnóstico de infección intraabdominal, especialmente, en presencia de sepsis o choque séptico.
Según la Infectious Diseases Society of America (IDSA), entre los esquemas de tratamiento antibiótico más recomendados para los pacientes pediátricos con infecciones intraabdominales complicadas, se incluyen los esquemas basados en una de las siguientes opciones: un aminoglucósido, un carbapenem (imipenem, meropenem o ertapenem), un β-lactámico o un inhibidor de betalactamasas (piperacilina-tazobactam o ticarcilina-clavulanato), o una cefalosporina de generación avanzada (cefotaxime, ceftriaxona, ceftazidima o cefepima) con metronidazol, dejando el uso de clindamicina sujeto a las tasas de resistencia de B. fragilis. Sin embargo, no se discute el impacto sobre la flora microbiana ni la opción de tener tratamientos dirigidos con un menor impacto ecológico, que sean eficaces y con cobertura adecuada para la flora implicada, y que contribuyan igualmente a un menor número de complicaciones infecciosas posoperatorias 44,45.
En conclusión, el conocimiento de la resistencia y de la epidemiología nos permite tratar los pacientes con infección intraabdominal no complicada con esquemas antimicrobianos de espectro limitado, disminuyendo la toxicidad y los efectos colaterales sin repercusión en el éxito terapéutico, lo cual hace de esta terapia antimicrobiana dirigida una opción costo-beneficiosa que, al igual que en otras publicaciones, no conlleva un aumento de las complicaciones posoperatorias cuando se compara con un esquema de mayor espectro.