Introducción
El síndrome de Budd-Chiari consiste en la oclusión de la circulación de salida venosa del hígado, desde las sinusoides hepáticas hasta la unión de la vena cava inferior con la aurícula derecha. En el hemisferio occidental, se comprometen las venas hepáticas y, en Asia, se ocluye la vena cava inferior, con obstrucción de las venas hepáticas o sin ella. Esta entidad es rara.
El síndrome de Budd-Chiari se considera una entidad de mal pronóstico si no se trata tempranamente, la cual progresa a cirrosis en un periodo menor de dos años. El tratamiento quirúrgico ha sido el más usado, pero con alta mortalidad y morbilidad; los métodos endovasculares han tomado preponderancia por su efectividad y baja morbimortalidad 1,2.
Se presenta el caso de un hombre joven con obstrucción de la vena cava y las venas hepáticas.
Presentación del caso
Se trata de un paciente de sexo masculino de 50 años de edad, que consultó por cuadro clínico de un año de evolución, con edema de miembros inferiores, distensión abdominal y disnea, el cual se exacerbó en el último mes asociado a ictericia, y con empeoramiento del edema de las extremidades inferiores. No tenía antecedentes médicos ni quirúrgicos de relevancia.
En el examen físico, se encontró un paciente de sexo masculino sin alteraciones neurológicas, con distensión abdominal, hepatomegalia, onda ascítica positiva, várices escrotales (figura 1) y edema de grado II, con fóvea, en los miembros inferiores.
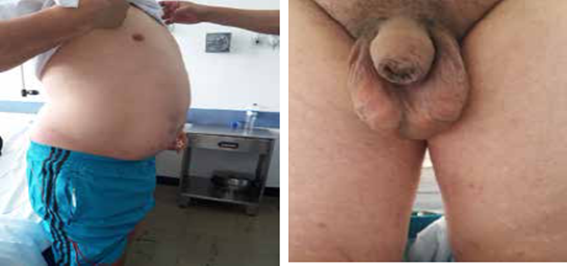
Figura 1. Aumento del perímetro abdominal por la ascitis y várices escrotales secundarias a la circulación colateral.
En los exámenes de laboratorio se informó: bilirrubina total de 1,7 mg/dl (directa de 0,99 mg/dl e indirecta de 0,71 mg/dl); albúmina de 4,22 g/dl, tiempo parcial de tromboplastina de 50,7 segundos; tiempo de protrombina de 12,4 segundos, e INR (índice normalizado internacional) de 1.
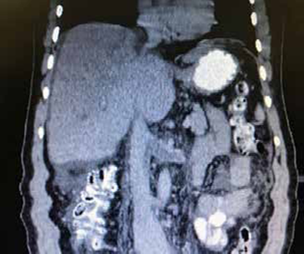
En la endoscopia de vías digestivas altas se observaron várices esofágicas de grado I-II y el ecocardiograma transtorácico fue normal. En la ecografía abdominal, se encontró abundante líquido ascítico libre, hipertrofia del lóbulo caudado, trombosis de las venas hepáticas y un sistema venoso portal normal. La tomografía computarizada abdominal demostró trombosis de la vena cava inferior, las venas hepáticas y la vena renal izquierda (figura 2).
Discusión
En resumen, se trata de un paciente masculino sin antecedentes de importancia que cursaba con un cuadro clínico de ascitis de larga data con trombosis de la vena cava y las venas hepáticas, de clase A según la clasificación de Child-Pugh, que tenía obstrucción indicativa de síndrome de Budd-Chiari, por lo cual se decidió un tratamiento endovascular con angioplastia percutánea y trombectomía venosa bajo anestesia general.
Procedimiento
Bajo anestesia general, con monitorización con línea venosa y pulsioxímetro, se hicieron una punción en la vena femoral común derecha con un introductor 6 French y una punción yugular interna derecha con introductor 5 French (Cordis™ - Johnson & Johnson).
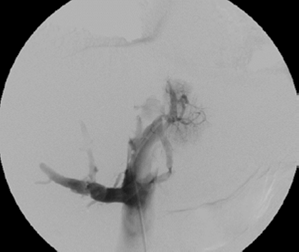
Se practicó una cavografía y se encontró trombosis de la vena cava inferior, desde la vena renal izquierda; la vena cava superior era normal (figura 3). Se procedió a cambiar el introductor femoral por un 8 French (Cordis™ - Johnson & Johnson) y se practicó una trombectomía venosa percutánea con el sistema de tromboaspiración de penumbra (Penumbra Medical Systems, Inc.), extrayendo moderada cantidad de coágulos subagudos.
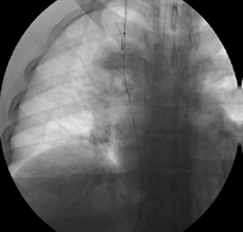
Se procedió a practicar la cavografía de control con oclusión fija en la vena cava inferior perihepática con una guía de 0,035 pulgadas hidrofílica más un catéter multipropósito (Cordis™ - Johnson & Johnson), logrando pasar a la aurícula derecha; se recuperó esta guía por la vía yugular interna con un snare o recuperador de cuerpo extraño (Merit Medical Corp.) y se extrajo por el cuello para poder tener una guía transyugular (figura 4).
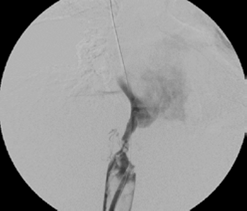
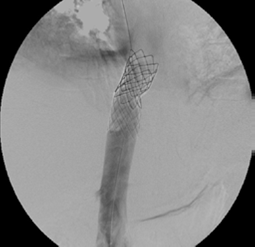
Se procedió a realizar angioplastias secuenciales con balones de 10, 12 y 14 mm de diámetro (Boston Sci. Corp.), logrando repermeabilizar la vena cava, pero con una estenosis residual del 60 % (figura 5). Se continuó colocando dos endoprótesis (stents) de Palmaz con balón montado de 24 mm de diámetro (Cordis™ - Johnson & Johnson). La vena cava se recanalizó de manera completa y las venas suprahepáticas eran permeables (figura 6).
El procedimiento se llevó a cabo sin complicaciones y su duración fue de una hora. El paciente se extubó y se sometió a monitorización en la unidad de cuidados intensivos. Se trasladó a sala general al siguiente día y se dio de alta al cuarto día posoperatorio, con anticoagulación plena y antiagregación dual. El edema y la ascitis desaparecieron a las 24 horas del procedimiento.
En los controles del tercer y sexto mes de seguimiento, el paciente se encontró asintomático, sin edemas ni ascitis y con pruebas de función hepática normales.
Discusión
Este síndrome fue descrito por George Budd, el médico internista británico que, en 1845, presentó tres casos de trombosis venosa hepática por abscesos hepáticos con flebitis secundaria y describió los tres signos clásicos: ascitis, dolor abdominal y hepatomegalia. El médico patólogo austriaco, Hans Chiari, fue el primero en describir los hallazgos patológicos del hígado producidos por esta enfermedad, denominándola endoflebitis obliterante de las venas hepáticas.
En el consenso entre el grupo europeo de estudio de enfermedades vasculares y la Asociación Americana de Enfermedades Vasculares Hepáticas, se definió el síndrome de Budd-Chiari como una obstrucción del flujo de salida venoso hepático, desde las vénulas hepáticas más pequeñas hasta la unión de la vena cava inferior con la aurícula derecha; se excluyen de esta definición las enfermedades venooclusivas sinusoidales, secundarias a obstrucción de los sinusoides hepáticos o venas centrales hepáticas causada por tóxicos o por trastornos cardiacos 3.
Esta entidad es muy rara, su incidencia es de 0,2 a 1 por 100.000 y su prevalencia es de 2 por un millón de habitantes, sin predilección según el sexo, y la edad promedio de presentación son los 45 años. Generalmente, produce un cuadro clínico agudo consistente en dolor abdominal y aumento del perímetro abdominal, debido a ascitis y hepatomegalia; en los casos crónicos, los síntomas se relacionan con hipertensión portal. En el 15 % de los casos se asocia con trombosis portal, lo que conlleva un peor pronóstico. El sitio más común del síndrome de Budd-Chiari, es en la ribera del río Amarillo (Huang He) en China 4,5.
El síndrome de Budd-Chiari se clasifica en primario o secundario, según la causa de la obstrucción.
En el síndrome de Budd-Chiari primario, la obstrucción se debe a membranas congénitas anómalas o a trombos que se desarrollan de manera espontánea dentro de las venas hepáticas y la vena cava. La presencia de membranas congénitas se considera una malformación vascular de tipo troncular, según la clasificación de la International Society for the Study of Vascular Anomalies3,4. En los casos de trombosis espontánea, se asocia con trastornos de la coagulación o enfermedades raras, como hemoglobinuria paroxística nocturna, síndrome de Behçet, neoplasia mieloproliferativa, hiperhomocisteinemia, mutaciones del factor V de Leiden, mutaciones del gen G20210A de la protrombina, deficiencia de proteína C y S, policitemia vera, uso de anticonceptivos orales, trombocitopenia esencial o mielofibrosis idiopática.
La obstrucción de carácter membranoso se presenta típicamente en Asia, y la obstrucción por causas hematológicas es más frecuente en el hemisferio occidental 5,6. Wang, et al., clasifican la obstrucción primaria de tipo membranoso, en tres tipos: A, obstrucción membranosa en la vena cava inferior alta, con venas hepáticas permeables (típica de Asia); B, obstrucción difusa de la vena cava inferior con venas hepáticas permeables (típica de Asia), y C, obstrucción de las venas hepáticas y de la vena cava (típica de occidente) 7,8.
Las diferencias anatómicas y de presentación entre oriente y occidente, apuntan a factores ambientales y genéticos no muy conocidos en la actualidad; por ejemplo, la mutación del factor V de Leiden se ve en el 90 % de casos de síndrome de Budd-Chiari en occidente.
En Asia, las endoprótesis se colocan por vía percutánea, ya sea por la vena cava o transhepática, y poco se usa la derivación yugular transparietohepática (Transjugular Intrahepatic Portosystemic Shunt, TIPS); es diferente en Estados Unidos, donde esta derivación se utiliza como primera opción. Los mejores resultados se observan en Asia, pero la información entre los dos hemisferios no se puede comparar efectivamente siempre, y se debe evaluar el paciente de manera muy precisa 9,10. En el presente caso, la obstrucción era solo de la vena cava, lo cual correspondía a un caso típico de Asia y no del hemisferio occidental.
En el síndrome de Budd-Chiari secundario, hay un factor extrínseco de compresión sobre las estructuras venosas, como tumores o abscesos; se asocia con obstrucción venosa hepática y de la vena cava inferior.
Fisiopatología. La obstrucción de una o más venas hepáticas incrementa la presión sinusoidal y disminuye su flujo; la obstrucción de una sola vena no es clínicamente aparente, se deben ocluir dos o más venas para que la enfermedad se manifieste. Esta obstrucción genera cambios hemodinámicos, como dilatación sinusoidal y extravasación de líquido intersticial que se exuda por la cápsula hepática y genera ascitis. La presión portal se incrementa y la perfusión del hígado por vía portal disminuye. La combinación de estos cambios genera hipoxia hepática y daño tisular; en el 70% de casos, se encuentra necrosis centrolobulillar, la necrosis hepática fulminante es rara y en muchos pacientes las manifestaciones clínicas son crónicas 11,12.
Presentación clínica. Los pacientes pueden presentar un cuadro clínico agudo de dolor abdominal y ascitis de causa desconocida que, si no se trata tempranamente, va a generar fibrosis hepática y daño irreversible de la función hepática. Por lo tanto, es muy importante sospechar esta entidad, especialmente en pacientes jóvenes sin ningún antecedente relevante, como en el presente caso, pues se ha visto que, después de pocas semanas de obstrucción, se desarrolla fibrosis centrolobulillar. Después de meses de evolución, se encuentra regeneración nodular periportal y evoluciona a cirrosis 13,14.
Los pacientes pueden ser asintomáticos o sintomáticos. El primer grupo representa del 15 al 20 % de casos; los pacientes presentan la obstrucción, pero están compensados por el desarrollo espontáneo de venas colaterales extrahepáticas y portosistémicas. Estos vasos colaterales son vías de drenaje diferentes a los que se producen en la hipertensión portal, encontrándose su origen en las venas lumbares ascendentes, el plexo vertebral, la vena ácigos o la hemiácigos. Estos pacientes se podrían tratar con anticoagulación plena de por vida, pero se debe estar muy atento a cualquier signo de disfunción hepática, la cual indicaría la intervención quirúrgica 14,15.
Los pacientes sintomáticos presentan dolor abdominal, ascitis, ictericia, hepatomegalia, edema de miembros inferiores, encefalopatía y sangrado gastrointestinal. Según la localización de la obstrucción, esta se clasifica en tres tipos: obstrucción pura de las venas hepáticas, obstrucción de la vena cava inferior y una forma combinada de las dos anteriores. La obstrucción de la vena cava o la forma mixta son típicas de Asia, mientras que la obstrucción pura de las venas hepáticas es propia de los países occidentales 16.
Desde el punto de vista clínico, hay tres presentaciones: aguda o subaguda, crónica y fulminante. En la forma aguda o subaguda, hay una evolución rápida del dolor abdominal, la ictericia y el aumento del perímetro abdominal, en un periodo menor de dos semanas. En la forma crónica, la más común, la ascitis es progresiva, no se presenta ictericia y el 50 % de casos cursan con falla renal. En la tercera forma, la falla hepática es aguda y fulminante; en estos casos, se recomienda el trasplante hepático con o sin derivación yugular transparietohepática o sin ella17,18.
Imágenes diagnósticas. La ultrasonografía con Doppler a color es la imagen de elección, con una sensibilidad del 85 %. Los hallazgos patológicos más frecuentes son: ausencia de flujo en las venas hepáticas, circulación colateral intrahepática, extrahepática y subcapsular, membranas dentro de la luz de la vena cava, y flujo turbulento, invertido y lento dentro de las venas hepáticas y la vena cava.
La tomografía computadorizada con contraste solo evidencia la trombosis hepática en el 50 % de los casos; la angiorresonancia muestra la obstrucción de los vasos hepáticos con mayor exactitud y ayuda a descartar otros diagnósticos diferenciales. En 60 a 80 % de los casos, se observan nódulos hepáticos benignos múltiples menores de 4 cm, dados por anormalidades en la perfusión hepática. Es común encontrar también hipertrofia del lóbulo caudado, lo que se explica porque este lóbulo tiene drenaje independiente y diferente al del resto del hígado 18,19.
Los métodos diagnósticos invasivos, como la venografia hepática y la cavografía, son los procedimientos de referencia para la evaluación anatómica de las venas hepáticas, la medición de presiones y evidenciar trombosis, y son una vía de acceso terapéutico para los procedimientos endovasculares. En casos de difícil diagnóstico, se recomienda la biopsia hepática, especialmente, para diferenciar el síndrome de Budd-Chiari de las enfermedades venooclusivas, en las cuales se presenta una obstrucción no trombótica de las vénulas hepáticas con edema subendotelial, producida por tóxicos que lesionan la pared del sinusoide hepático; estos cambios se asocian con el trasplante de médula ósea 20,21,22.
Tratamiento. Dado que se pueden presentar obstrucciones en diferentes localizaciones anatómicas y en forma aguda o crónica, es muy importante analizar cada caso en particular y definir las mejores opciones terapéuticas. La cirugía por medio de derivaciones cavo-auriculares o meso-cava, han sido el tratamiento convencional para estas oclusiones, pero se acompañan de gran mortalidad (50 %) y morbilidad posquirúrgica. El tratamiento médico con anticoagulación no es el adecuado y se debe complementar siempre con un procedimiento de nueva perfusión de los vasos ocluidos, ya sea quirúrgica o endovascular; la anticoagulación sola tiene una mortalidad del 80 % en un periodo de dos años. Los objetivos del tratamiento en el síndrome de Budd-Chiari son disminuir la congestión hepática y la ascitis, y evitar el deterioro hepático 23,24,25.
Los métodos endovasculares han cobrado preponderancia y se consideran la primera línea de tratamiento intervencionista en la actualidad. El objetivo del procedimiento endovascular es repermeabilizar la cava y recuperar el flujo en las venas hepáticas; al hacer esto, se obtiene una supervivencia a cinco años de más del 90 % 26,27.
Furuil, et al., hicieron los primeros reportes de tratamientos endovasculares con buenos resultados en la década de los 90 27. En un estudio de Han, et al., se demostró que la recanalización por vía endovascular de los vasos ocluidos en los pacientes con síndrome de Budd-Chiari, logra una permeabilidad del 95 % a un año, del 77 % a cinco años y del 58 % a diez años, con una permeabilidad secundaria del 97 % a un año, del 90 % a cinco años y del 86 % a diez años 28.
La trombólisis y la trombectomía localizada son útiles en los casos de menos de dos semanas de evolución de obstrucción, sumadas a angioplastias con balón y endoprótesis. En el presente caso, se utilizó el sistema de tromboaspiración penumbra, que se usa para la extracción de coágulos frescos en la circulación venosa, con el objetivo de disminuir el riesgo de embolia pulmonar durante el procedimiento y extraer, así, la mayor cantidad de trombos frescos, como aspirar los coágulos de la vena renal izquierda y, después, colocar la endoprótesis en la vena cava inferior. En menos del 3 % de los procedimientos endovasculares, se presentan complicaciones como encefalopatía hepática, sangrado intrabdominal o hemobilia, y la mortalidad es de menos del 1 % 29,30.
En el presente caso, no se presentó ninguna complicación y el paciente obtuvo mejoría inmediata de sus signos y síntomas.