Introducción
La cirugía continúa siendo la única modalidad terapéutica con potencial intención curativa en el tratamiento del adenocarcinoma gástrico (ACG) 1. A pesar de los últimos avances en genética y biología molecular, que han permitido un mejor entendimiento de la carcinogénesis de esta enfermedad, y del desarrollo de tratamientos neoadyuvantes y adyuvantes, los dos principales factores predictores biológicos del comportamiento de la enfermedad continúan siendo el grado de penetración del tumor a través de la pared y el estadio ganglionar, expresados en la clasificación TNM, aún vigente 1,2.
Basados en el análisis histológico, el ACG se ha clasificado tradicionalmente en diferenciado e indiferenciado. Este último tipo histológico se ha considerado como un factor de riesgo independiente para la presencia de metástasis ganglionares (MG) 1,3. En los tumores intramucosos, las MG se presentan entre el 4,2 - 6,0 % y su frecuencia va aumentando hasta el 40 - 60 % en los tumores más avanzados, asociado con otros factores pronósticos, como el tamaño tumoral, la infiltración linfovascular y la ulceración 4,5.
En Colombia, debido a la ausencia de programas de tamización a gran escala para ACG, la mayoría de los diagnósticos se hacen en etapas avanzadas que exigen un gran esfuerzo terapéutico, en el que la gastrectomía con linfadenectomía continúa siendo el tratamiento quirúrgico estándar para el adenocarcinoma gástrico indiferenciado (ACGI) 1,6. El objetivo de este estudio fue analizar, de forma prospectiva y por un periodo de dos años, a los pacientes con ACGI y su correlación con la presencia de MG, para determinar las implicaciones terapéuticas subsecuentes.
Métodos
Estudio prospectivo de una serie de casos de pacientes con ACG que fueron atendidos en la Unidad de Cirugía Oncológica del Hospital Militar Central, en Bogotá D.C., Colombia, entre enero de 2018 y enero de 2020, y se les practicó gastrectomía total con linfadenectomía, según los criterios establecidos por la Japanese Research Society for Gastric Cancer, considerados a nivel mundial actualmente como el patrón de oro para el manejo quirúrgico 7. Se incluyeron pacientes mayores de 18 años, sin cirugías gástricas previas, con diagnóstico histológico confirmado de adenocarcinoma gástrico. El ACGI se basó en los criterios histológicos establecidos por Brothers y posteriormente modificados por Nakamura 3,8,9.
La recolección de datos y el análisis estadístico se realizó con el sistema SPSS; se aplicó la prueba de Chi cuadrado y se consideró una p significativa al valor inferior a 0,05.
Resultados
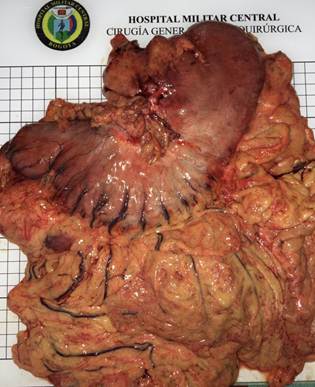
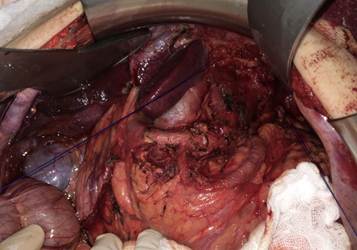
En el periodo de estudio se recolectaron en la base de datos 113 pacientes con adenocarcinoma gástrico que fueron llevados a gastrectomía total (Figura 1), disección ganglionar DII y reconstrucción esofagoyeyunal terminolateral con técnica de Orr + Y de Roux (Figura 2). Se excluyeron del estudio 72 pacientes (63,7 %) con diagnóstico histológico de adenocarcinoma gástrico bien o moderadamente diferenciados. Fueron clasificados histológicamente como adenocarcinoma indiferenciado e incluidos en el estudio 41 pacientes (36,3 %) (Figura 3). La edad promedio de este grupo fue de 56 años, con un rango entre 28 a 92 años. Correspondieron a hombres 30 casos (73 %) y a mujeres 11 (27 %). En relación con el grado de penetración del tumor a través de la pared gástrica, se encontraron los siguientes resultados: T1=1; T2=5; T3=27 y T4=8. Es decir que el 85 % de los pacientes con ACGI (n=35) presentaban tumores localmente avanzados (Tabla1).
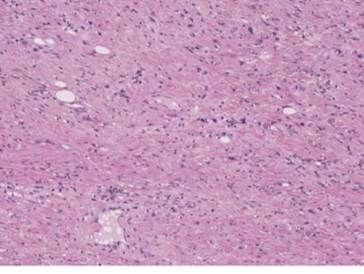
Figura 3. Adenocarcinoma gástrico indiferenciado con intensa desmoplasia. Hematoxilina & eosina. 10x.
Tabla 1. Pacientes con adenocarcinoma gástrico indiferenciado, estadio tumoral T, total de ganglios linfáticos resecados y total de ganglios linfáticos metastásicos (n=41).
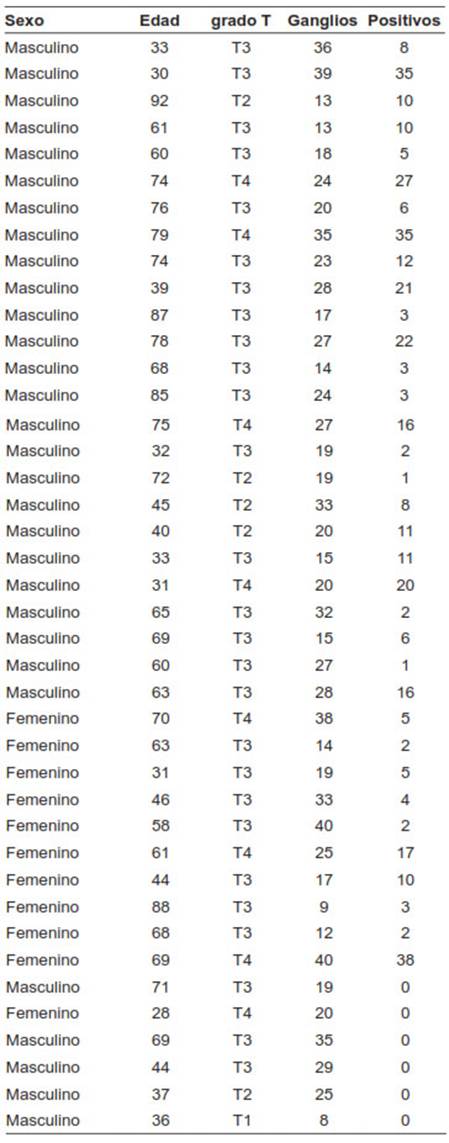
El total de ganglios linfáticos analizados fue de 969, con un rango entre 8-40 y un promedio de ganglios linfáticos analizados por espécimen de 24. De los pacientes con ACGI, 85 % (n=35) tuvieron metástasis ganglionares, con 382 ganglios positivos en total, con un rango entre 1 - 38 y un promedio de 10,9 ganglios linfáticos positivos por espécimen. De los seis pacientes con ACGI que no presentaron metástasis ganglionar, uno tenía una lesión T1, otro una lesión T2 y cuatro no tenían invasión linfovascular.
Discusión
Brothers y posteriormente Nakamura dieron a conocer e hicieron global el concepto del grado de diferenciación histológica del adenocarcinoma gástrico como un factor histológico de importancia relevante, que puede predecir cómo será el comportamiento a futuro del tumor y su correlación con la presencia de metástasis ganglionares, las cuales siguen siendo el principal factor predictor de supervivencia global y de libre de enfermedad en los análisis univariados y multivariados para ACG 3,8,9,10.
Fenotípicamente, el ACGI tiene particularidades clínicas diferenciales. Generalmente son lesiones proximales, de comportamiento difuso y ulceradas, asociadas a tumores con células en anillo de sello y muy alta tasa de metástasis ganglionares 11,12. Estudios de biología molecular han podido correlacionar diferentes factores pronósticos adversos relacionados con tumores indiferenciados gástricos, por ejemplo, la baja expresión de las proteínas P27kip1 y P21cip1, que son ciclinas dependientes de las quinasas directamente relacionadas al funcionamiento del gen p53, que se identifica en la progresión de la carcinogénesis con una disminución progresiva de una mucosa gástrica normal a una gastritis superficial crónica y su progresión a lesiones precancerosas o invasivas avanzadas, sugiriendo que la perdida de la expresión de la proteína P21 está estrechamente relacionada con la perdida de la diferenciación histológica del tumor, incrementando su potencial de invasión tumoral, favoreciendo la presencia de enfermedad metastásica ganglionar y a distancia 13,14.
En el tratamiento del cáncer gástrico temprano mediante mucosectomía o resección endoscópica segmentaria, la identificación de un ACGI en la patología es crucial para la selección del tratamiento a realizar. En lesiones tumorales que solo afectan la mucosa, las metástasis ganglionares se han encontrado entre el 4,2 - 6 % y se incrementan al 11 - 23,8 % en las lesiones que penetran la submucosa y que están acompañadas de factores adversos como un tamaño mayor a 2 cm, infiltración linfovascular presente y ulceración. Sin embargo, aún en los tumores tempranos bien diferenciados, las metástasis ganglionares se pueden presentar entre el 0,4 - 1,8 %, lo que permite concluir que el proceso de diseminación metastásica ganglionar no es dependiente de un solo factor pronóstico 15,16,17,18.
En este estudio, el 36,3 % de los ACG tratados quirúrgicamente correspondieron a ACGI, datos muy similares a otras series Latinoamericanas. Como consecuencia de un diagnostico tardío, el 85 % (n=35) de los pacientes correspondieron a etapas avanzadas T3 - T4, con lesiones prominentes y con una muy alta proporción de metástasis ganglionares, las cuales se presentaron en el 85 % de los ACGI. Con la excepción de un paciente en el que se reportó un total de ocho ganglios linfáticos analizados, el estudio patológico ganglionar se consideró como satisfactorio, con un promedio de 24 ganglios linfáticos estudiados por espécimen, cumpliendo el estándar de calidad mínimo permisible de 16 ganglios evaluados, lo cual refleja una buena técnica quirúrgica de la linfadenectomía DII, así como una confiable técnica de análisis patológico 19,20.
Esta serie confirma que las metástasis ganglionares son un fenómeno muy frecuente y esperado en los ACGI avanzados. Estos hallazgos tienen implicaciones terapéuticas, considerando que en el tratamiento de este tipo de lesiones tumorales la cirugía a realizar debe incluir por lo menos una linfadenectomía DII para favorecer un mejor control locorregional y se debe optar por terapias sistémicas complementarias para tener la posibilidad de una mejor supervivencia libre de enfermedad 20.
Conclusiones
El adenocarcinoma gástrico indiferenciado es un tumor con características fenotípicas distintivas, que en etapas avanzadas con lesiones T3 - T4 tiene una alta tasa de metástasis ganglionares, en hasta el 85 % de los casos, lo que indica la necesidad de tratamientos quirúrgicos radicales, incluyendo linfadenectomía D II y de terapias sistémicas complementarias adicionales.