Introducción
El acretismo placentario se entiende como un proceso de inserción anormal de la placenta, secundario a un antecedente quirúrgico en el útero, que con lleva a un error de decidualización en el área cicatricial y permite la profundización anormal del trofoblasto, con sangrado masivo, que ponen en riesgo la vida de la madre y el producto de la gestación 1,2.
La incidencia de acretismo placentario es de 14,4 por cada 10.000 partos, siendo mayor en mujeres con placenta previa. Esta incidencia ha aumentado de manera paralela con el incremento de las cesáreas, de 1 en 30.000 partos en 1960 y a 1 en 533 partos en 2020, lo que corresponde a un incremento de 60 veces en cinco décadas 3.
La placenta percreta es la presentación más compleja y peligrosa de las tres formas de acretismo placentario: increta, acreta o percreta. Se ha asociado a sangrado masivo al momento de la cesárea o histerectomía, requiriendo múltiples transfusiones y estancia prolongada en cuidados intensivos, con complicaciones severas dadas por lesiones ureterales o viscerales, además de mortalidad perinatal 1.
La literatura tiene datos limitados del tratamiento ideal de esta enfermedad, por lo que debemos tener un enfoque organizado, con el fin de disminuir el sangrado y las complicaciones asociadas. El objetivo de este artículo fue dar a conocer el protocolo institucional del manejo de la placenta percreta en el Hospital Universitario Clínica San Rafael, Bogotá, D.C., Colombia, como un procedimiento varias horas después de la cesárea, con embolización de arterias placentarias de forma selectiva, previo a la práctica de la histerectomía, y presentar los resultados en las pacientes atendidas.
Métodos
Descripción del protocolo
Posterior al diagnóstico de placenta percreta, se realizó junta medico quirúrgica entre ginecología y cirugía vascular, individualizando a cada paciente según los hallazgos en la imagen ultrasonográfica.
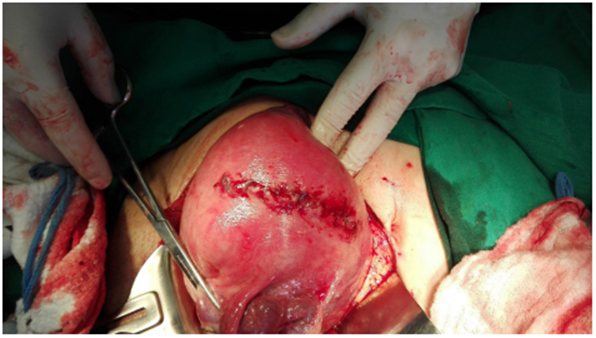
Se explico a la paciente y su familia el procedimiento, sus riesgos y complicaciones, y luego de ello se programó la cesárea, la cual se realizó por vía fúndica mediante laparotomía mediana (figura 1), se extrajo el recién nacido y se procedió a la histerorrafia dejando la placenta in situ. A continuación, se practicó control de hemograma diario, pruebas de coagulación y observación clínica estricta, que se registró sin complicaciones.
A las 48 a 72 horas se programó para embolización placentaria ultra-selectiva, por parte del mismo cirujano vascular, ocluyendo de manera selectiva y bilateral todas las arterias anómalas dependientes de la arteria hipogástrica. Entre 48 a 72 horas después se hizo la histerectomía abdominal total, por la misma incisión utilizada para la cesárea, con anestesia general. El procedimiento quirúrgico de cesárea e histerectomía fue realizado por el mismo ginecólogo. Dependiendo del volumen de sangrado intraoperatorio y estado hemodinámico de la paciente se trasladó a habitación convencional o unidad de cuidado intermedio. Durante este periodo se administró antibiótico de amplio espectro (piperacilina/ tazobactam) y anticoagulación profiláctica.
Descripción de la embolización
El objetivo de la embolización es generar trombosis en el espacio intervelloso, disminuir el riesgo de sangrado y aumentar el proceso de resorción placentaria. Los procedimientos se realizaron en sala de hemodinamia, a través de la arteria femoral común (punción única), bajo anestesia local, con anticoagulación plena con 5000 unidades de Heparina y reversión al final con sulfato de protamina.
A través de un introductor 5 french (Cordis - Johnson & Johnson medical) se accedió a la aorta abdominal con una guía hidrofílica Aquatrak (Cordis-Johnson & Johnson medical), de 0,035 x 260 centímetros. Se realizó primero un aortograma abdominal con un catéter pigtail (Cordis - Johnson & Johnson medical) para evaluar la aorta abdominal, arterias iliacas comunes externas e hipogástricas, con el objetivo de determinar las ramas placentarias anómalas.
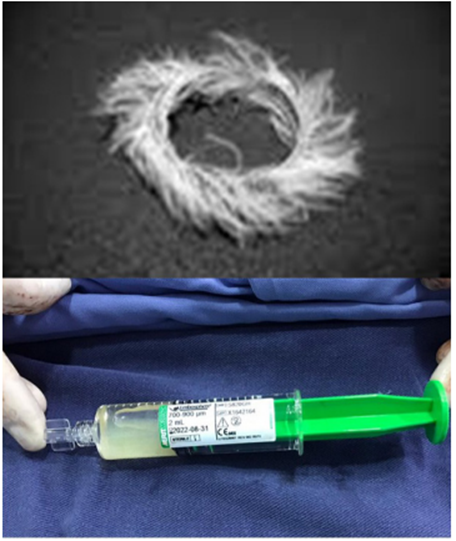
Posteriormente se canalizaron las arterias hipogástricas y de manera ultra-selectiva las ramas viscerales placentarias con un catéter cobra o Simmons 1 (Cordis - Johnson & Johnson medical). Se realizan varias inyecciones en DSA (Digital Substraction Angiography) y con fase venosa tardía, y luego de escoger las arterias objetivos, se procedió a canalización con microguía y microcatéter Direction (Boston Scientific, Massachusetts). En primera instancia se realizó embolización con micropartículas (Contour, Boston Scientific, Massachusetts) y microesferas (Embosphere, Merrit Medical Systems Inc.) de 500 a 700 micras, con el objetivo de ir a los vasos más distales y posteriormente se complementaba con microcoils de platino Interlock, de 4 a 6 mm de diámetro por 40 cm de longitud (Boston Scientific, Massachusetts). Se efectúo compresión manual después del retiro del introductor y vendaje, con reposo en cama por 12 horas (figura 2).
Resultados
En el Hospital Universitario Clínica San Rafael, Bogotá, D.C., Colombia, se evaluaron cinco pacientes con placenta percreta diagnosticada por ecografía en control prenatal, que se llevaron a cesárea e histerectomía programada según protocolo institucional.
Las pacientes tenían una edad promedio de 34,5 años (rango 26 - 41 años) y paridad promedio de 3,8 embarazos (rango 2 - 7 embarazos). Los factores de riesgo identificados para placenta percreta, fueron cesárea previa en 2 y placenta previa en 3 pacientes. No se utilizó metotrexato en ninguno de los casos, y se canalizó solo en un caso los uréteres de manera prequirúrgica.
El promedio de sangrado intraoperatorio fue de 1160 ml (rango 600 - 1500 ml). El promedio de unidades de glóbulos rojos transfundidas durante la histerectomía fue de 2 unidades (rango 0 - 4). Tres pacientes requirieron traslado a la unidad de cuidados intensivos y 2 se trasladaron a habitación convencional. El promedio de espera entre la cesárea y la embolización fue de 4,8 días (mínimo 3 días - máximo de 8 días) y el promedio de espera entre la embolización y la histerectomía fue de 2,6 días (mínimo 2 días - máximo 5 días)
No existió mortalidad materno fetal ni perinatal a 30 días. No se presentaron complicaciones (lesiones ureterales, viscerales ni sangrado masivo) durante la cesárea o la histerectomía, tampoco se presentaron complicaciones (sangrado, coagulación intravascular diseminada, sepsis, eventos tromboembólicos venosos) durante los periodos de espera entre cesárea y embolización o embolización e histerectomía; no se generaron complicaciones por la embolización (complicaciones del acceso vascular, procedimiento no exitoso, embolización a otros órganos, síndrome postembolización).
Discusión
El acretismo placentario se debe a ausencia o deficiencia de la capa de Nitabuch, que es una capa de fibrina que se ubica entre la decidua basal y el corion frondoso, debido a una falla en la reconstitución del endometrio/decidua basal, especialmente después de la reparación de un procedimiento quirúrgico, como es la cesárea. En la medida que las cesáreas sigan aumentando a nivel mundial, la frecuencia de esta patología será mayor 4.
El sangrado genital durante el embarazo es la principal causa de mortalidad en las mujeres gestantes, elevando la morbimortalidad materna (59 %) y la mortalidad perinatal (9 %) 5. Puede presentar varias complicaciones que incluyen la necesidad de transfusión sanguínea masiva, infecciones, ruptura uterina y lesiones de vías urinarias y digestivas 6.
El principal factor de riesgo es el antecedente quirúrgico en el útero (cesárea, miomectomía, legrados uterinos, metroplastias, embolización uterina para miomatosis), pero también se ha asociado con edad avanzada, multiparidad o antecedente de placenta previa 7.
El acretismo placentario se clasifica según la invasión trofoblástica, como: placenta acreta, la cual se adhiere a miometrio (75 % de los casos), placenta increta, la cual penetra miometrio (15 % de los casos) y placenta percreta, que es aquella que traspasa el miometrio hacia la serosa u órganos adyacentes (5 % de los casos) 8. Este trabajo incluyó únicamente las pacientes con placenta percreta, debido a su mayor riesgo de complicaciones.
La identificación de esta anormalidad es posible mediante métodos de imagen, entre ellos la ecografía y la resonancia magnética. Los hallazgos ecográficos que se pueden evidenciar son desaparición o irregularidad de área hipoecoica retro-placentaria, grosor miometrial retro-placentario inferior a 1 mm, múltiples dilataciones vasculares, lagunas placentarias (aspecto de queso suizo) y áreas hipervascularizadas en el Doppler color, que se caracterizan porque el flujo es turbulento con pico de velocidad sistólica > 15 cm/segundo, presencia de tejido placentario o vasos en la interfase entre la serosa uterina y la vejiga urinaria. La presencia de lagunas placentarias múltiples e irregulares es el signo que aisladamente presenta una sensibilidad elevada (93 %) 9.
La resonancia magnética, por otro lado, se indica en casos específicos durante el segundo y tercer trimestre de gestación, para descartar compromiso de otro órgano, como vejiga 10, pero en esta investigación ninguna de las pacientes requirió de este estudio.
Asimismo, los hallazgos intraoperatorios de acretismo más comunes son la distorsión, deformación o levantamiento del segmento uterino inferior (aspecto de medusa), tejido placentario invadiendo la serosa vesical y uterina, e hipervascularización masiva del segmento inferior, como se aprecia en la figura 3 11.
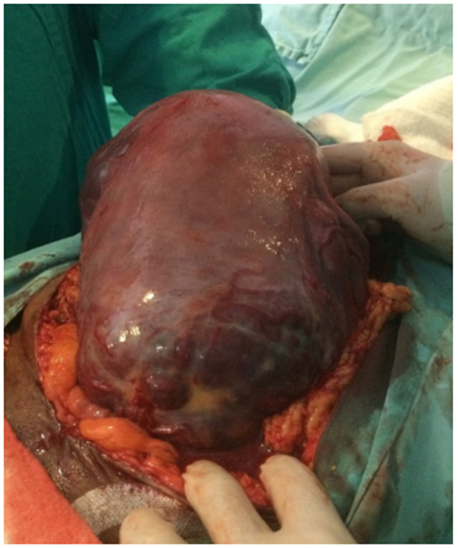
Figura 3. Aspecto macroscópico de los vasos sanguíneos fuera de la serosa uterina, típico de placenta percreta.
En cuanto al tratamiento aceptado, se describen la cesárea y la histerectomía obstétrica total en el mismo tiempo quirúrgico; sin embargo, está asociada a sangrados masivos (entre 3 a 5 litros), complicaciones severas (lesión ureteral en 17 % de casos), mayor mortalidad (7 %), estancias en cuidados intensivos y hospitalización prolongadas 12,13. Es por ello que el surgimiento de nuevas técnicas de abordaje, como la embolización de arterias placentarias, constituyen alternativas para un manejo más seguro del acretismo placentario, que en este protocolo se basó en la disminución del sangrado, permitiendo y estimulando la involución de la placenta con los tiempos de espera y la oclusión endovascular de los vasos anómalos placentarios.
A pesar de que algunos estudios muestran alto riesgo de complicaciones al dejar placenta in situ 14,15, en esta investigación no se demostró ninguna complicación y se logró que la placenta involucionara adecuadamente. Clausen et al. 16, en un metaanálisis de casos publicados para el 2014, encontraron que las mujeres sometidas a embolización sangraban en promedio de 1,25 litros y las que no, entre 2 a 4 litros; además observaron que las pacientes embolizadas requerían transfusión solo en el 28 % de los casos versus el 90 % en las no embolizadas. En este estudio se corroboró que los volúmenes son mucho menores en las pacientes sometidas a embolización, encontrando que el volumen promedio de sangrado fue de 1160 ml y se requirió en promedio la transfusión de 2 unidades de glóbulos rojos por paciente.
Dentro del manejo médico, se ha utilizado el Metotrexate para disminuir el crecimiento trofoblástico, sin embargo, su uso fue innecesario en estas pacientes, además de que puede aumentar la incidencia de complicaciones (sepsis, sangrados tardíos, inmunosupresión) 17. Otra opción de manejo es la ligadura de arterias hipogástricas, que fue descrita desde 1960 para el control de diferentes situaciones hemorrágicas en la pelvis, pero es poco recomendada dada sus complicaciones (claudicación glútea, lesión de vena iliaca, lesión de uréter, ligadura de arteria iliaca externa) y poca efectividad (falla para controlar el sangrado en más del 50 % de casos), además de que impide a los cirujanos vasculares realizar procedimientos endovasculares de control de sangrado 18,19.
El uso de técnicas mínimamente invasivas endovasculares ha revolucionado el tratamiento de muchas enfermedades, logrando controlar sangrados que antes eran imposibles de tratar. Específicamente para el acretismo placentario, se ha usado la canalización de las arterias aorta, iliacas comunes e hipogástricas, con balones que, al ser inflados, ocluyen el flujo sanguíneo, pero se han descrito malos resultados y complicaciones graves (embolismo, disección y ruptura iliaca) 19.
Es por ello que la embolización uterina como control de sangrado ginecológico se describió por primera vez en 1979 por Brown y Heaston, con efectividad de más del 90 % 20, y el uso de embolizaciones selectivas para acretismo placentario fue reportado por primera vez en 1992 por el grupo de Bakri y Linjawi 21, demostrando ser la clave para el control del sangrado, llegando a vasos de menos de 5 milímetros de diámetro, ocluyéndolos de manera ultra-selectiva, sin sacrificar vasos normales o tejidos adyacentes sanos.
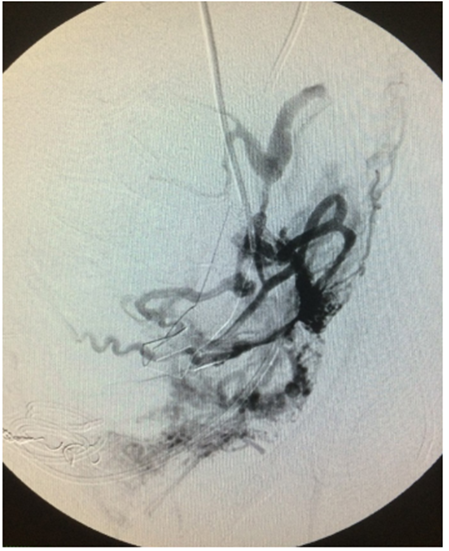
La imagen angiográfica debe hacerse con sustracción digital en fase arterial temprana y tardía, para poder observar las ramas arteriales anómalas en sacacorchos pseudotumorales 22 (figura 4).
En los casos de acretismo placentario, no solamente la embolización de las ramas uterinas controla el sangrado. Es muy importante evaluar la participación de otras arterias como pudendas, epigástricas, ováricas, sacras y obturatriz 23. Clásicamente, el principal material de embolización utilizado ha sido el Gelfoam (gelatina de piel porcina purificada), pero ocurre reabsorción del material en 4 a 6 semanas, por lo que el uso de agentes más efectivos como las micropartículas y microesferas de polivinilo alcohol (500 a 900 micras), asociada a coils de platino o líquidos embolizantes (como el onyx o glue), permiten una oclusión permanente y segura del vaso elegido24(figura 5).
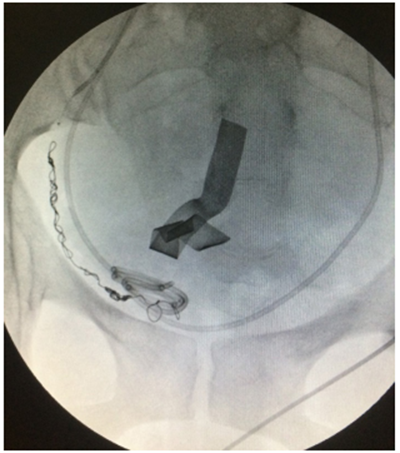
El éxito en general de la embolización, que se refiere a la oclusión completa de los vasos elegidos (figura 6), oscila entre el 85 y 95 % 10, y en este trabajo fue del 100 %. La embolización ha demostrado en diferentes estudios disminuir estancias hospitalarias, incluidas las de cuidado intensivo, necesitando únicamente en un 25 % de casos este recurso 25.
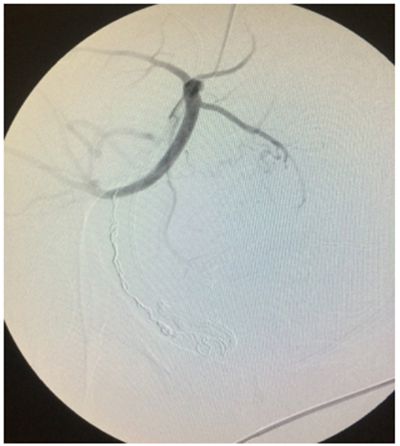
Figura 6. Resultado exitoso con oclusión completa de las ramas elegidas, preservando las arterias glútea y vesical.
La incidencia de complicaciones secundarias a la embolización, oscila entre el 6 y el 9 % 26, asociadas al acceso vascular femoral (fistulas, pseudoaneurismas, hematomas postpunción) o a la embolización de sitios no indicados con necrosis de estructuras vecinas. Esta última se puede presentar en pacientes con antecedentes de radioterapia abdominal, neoplasias pélvicas o enfermedad oclusiva arterial severa. Otras complicaciones son el síndrome postembolización, abscesos, isquemia de miembros inferiores, o claudicación glútea 27. En este trabajo no se tuvo ninguna complicación asociada al procedimiento endovascular.
Considerando esta patología como problema de salud pública, debido a su notable aumento en las últimas décadas y su mortalidad, es fundamental tener un protocolo de manejo institucional. Asimismo, es necesario realizar un adecuado control prenatal para la prevención y el diagnóstico temprano del acretismo placentario y, cuando se confirme, direccionar a las pacientes a centros con experiencia en el manejo endovascular, disponibilidad de banco de sangre, cuidado intensivo y demás recursos para el manejo de esta desafiante enfermedad.